My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nefrología (Madrid)
On-line version ISSN 1989-2284Print version ISSN 0211-6995
Nefrología (Madr.) vol.32 n.1 Cantabria 2012
Utilidad del ácido úrico como marcador de mortalidad global en una cohorte de ancianos
Serum uric acid as a marker of all-cause mortality in an elderly patient cohort
Manuel Heras, María J. Fernández-Reyes, Rosa Sánchez, Álvaro Molina, Astrid Rodríguez, Fernando Álvarez-Ude
Servicio de Nefrología. Hospital General de Segovia.
Dirección para correspondencia
RESUMEN
Introducción: Existe evidencia creciente del papel del ácido úrico (AU) como factor de riesgo cardiovascular y renal. En este trabajo analizamos la asociación entre niveles basales de AU y mortalidad global en una cohorte de ancianos seguidos prospectivamente durante 5 años.
Pacientes y métodos: 80 pacientes clínicamente estables; mediana de edad, 83 años (rango 69-97); 31,3% varones; 35% diabéticos; 83% hipertensos; reclutados aleatoriamente en consultas de Geriatría y Nefrología entre enero y abril de 2006 y seguidos durante 5 años. Medimos basalmente AU y creatinina en plasma y estimamos filtrado glomerular (FG) con fórmula MDRD abreviada. Asimismo, en los pacientes de Nefrología se midió la proteinuria mediante la recogida de orina de 24 horas, y en los vistos en Geriatría se estimó a partir del cociente proteínas (mg/dl)/creatinina (mg/dl) en primera orina de la mañana. Registramos edad, género, comorbilidad basal (Índice de Charlson), patologías cardiovasculares individualizadas, tratamientos y mortalidad. Estadística: SPSS15.0.
Resultados: El AU basal presentaba una distribución normal y su mediana era de 5,85 mg/dl. No encontramos diferencias significativas en los niveles de AU según género, antecedentes de diabetes méllitus, hipertensión arterial, uso de diuréticos, cardiopatía isquémica, arteriopatía periférica o ictus. Los pacientes con antecedentes de insuficiencia cardíaca tenían AU significativamente mayor (7,00 ± 1,74 vs. 5,90 ± 1,71; p = 0,031). 41 pacientes (15 varones y 26 mujeres) fallecieron: 15 por deterioro en el estado general; 8 por infecciones; 4 por ictus; 4 por tumores; 3 por causas cardiovasculares; 2 por complicaciones de fracturas y 5 por causas desconocidas. Los pacientes con AU superior a la mediana tenían un FG significativamente menor y una mortalidad a los 5 años más elevada. En el análisis de Cox para mortalidad global (variables independientes: edad, género, Charlson, antecedentes de insuficiencia cardíaca, AU, creatinina, proteinuria y filtrado glomerular-MDRD) sólo los niveles de AU (riesgo relativo: 1,35; 1,17-1,56, p = 0,000) se asociaban de forma independiente a la mortalidad.
Conclusiones: en nuestro estudio, los niveles de AU se muestran como factor de riesgo independiente de mortalidad en ancianos.
Palabras clave: Ácido úrico. Mortalidad. Filtrado glomerular. Enfermedad renal crónica. Ancianos.
ABSTRACT
Introduction: There is growing evidence of the role of serum uric acid (SUA) as a risk factor for cardiovascular and renal disease. We analysed the association between baseline SUA and overall mortality in a cohort of elderly patients followed prospectively for 5 years.
Patients and Methods: Eighty clinically stable patients, median age 83 years (range 69-97), 31.3% men, 35% diabetics, 83% hypertensives were randomly recruited at Geriatrics and Nephrology visits between January and April 2006 and followed for 5 years. We measured baseline SUA and serum creatinine and estimated glomerular filtration rate (GFR) with MDRD abbreviated. In Nephrology Department patients, we measured proteinuria in 24-hour urine and in Geriatrics department patients we measured proteinuria (mg/dl)/creatinine (mg/dl) in urine (first morning urine). Predictive variables were: baseline SUA and plasma creatinine; estimated GFR (abbreviated MDRD formula); and we recorded age, gender, baseline comorbidity (Charlson index), individualised cardiovascular treatment and mortality. Statistical analysis: SPSS15.0.
Results: baseline SUA was normally distributed and its median was 5.85mg/dl. We found no significant differences in levels of SUA by gender, history of diabetes mellitus, hypertension, diuretic drug use, heart disease, peripheral arterial disease or stroke. Patients with a history of heart failure had significantly higher SUA (7.00±1.74 vs 5.90±1.71, P=.031). Some 41 deaths occurred during follow-up (15 men and 26 women): 15 due to general deterioration, 8 due to infections, 4 due to stroke, 4 due to tumours, 3 due to cardiovascular disease, 2 due to complications of fractures and 5 due to unknown causes. Patients with SUA higher than the median had significantly lower GFR and higher mortality at 5 years. In the Cox analysis for overall mortality [independent variables: age, gender, Charlson Index, history of heart failure, SUA, creatinine, proteinuria and GFR (MDRD)] only SUA levels (HR: 1.35; 1.17-1.56 P=.000) were independently associated with mortality.
Conclusions: In our study, levels of SUA are an independent risk factor for mortality in elderly patients.
Key words: Serum uric acid. Mortality. Glomerular filtration rate. Chronic kidney disease. Elderly.
Introducción
El ácido úrico (AU), un producto de desecho del metabolismo de las purinas, es degradado por la enzima urato oxidasa (uricasa) a alantoina, la cual seelimina libremente por la orina. Una consecuencia de la ausencia de la uricasa en la especie humana es la aparición de niveles de AU más elevados en los humanos que en otras especies: incluso pueden llegar a alcanzar concentraciones plasmáticas de AU cincuenta veces más elevadas que en otros mamíferos. Este hecho, lejos de ser una desventaja, se postula como un avance evolutivo relacionado con la capacidad protectora del AU frente al daño oxidativo de los radicales libres1,2.
La hiperuricemia generalmente se define por unos niveles de AU > 6,5 o 7 mg/dl en varones y > 6 mg/dl en mujeres3.
Aunque los estudios epidemiológicos recientes se han centrado en la gota, mostrando un incremento en su prevalencia, particularmente en personas de edad avanzada, se infiere que la incidencia de hiperuricemia también ha aumentado en este mismo período4.
Además de su papel en la aparición de reumatismo y gota, desde hace tiempo se ha postulado como posible determinante de la aparición de hipertensión arterial (HTA), diabetes mellitus y enfermedad renal crónica (ERC)2,5.
En los últimos años existe una evidencia creciente de la relación entre los niveles elevados de AU en sangre y la patología renal y cardiovascular, siendo la lesión endotelial el mecanismo patogénico propuesto2,6.
En estudios epidemiológicos prospectivos, se ha evidenciado la asociación entre los niveles basales de AU y la incidencia de ERC (aumentando el riesgo a medida que aumentan los niveles de AU)7,8.
Respecto a la comorbilidad cardiovascular, en algunos estudios se encuentra una asociación del AU con un mayor riesgo de infartos coronarios y accidentes cerebrovasculares de origen isquémico; sin embargo, otros estudios no confirman estos resultados en el análisis multivariante2.
Por otra parte, algunos estudios han mostrado que los niveles de AU se comportan como un factor de riesgo de mortalidad, tanto cardiovascular como global9.
En este trabajo analizamos el papel del AU como marcador de mortalidad global en una cohorte de pacientes ancianos seguidos durante un período de 5 años. Además, estudiamos la asociación entre los niveles basales de AU y los antecedentes cardiovasculares, el uso de diuréticos y la función renal (FR).
Pacientes y métodos
Pacientes
El presente estudio se ha realizado analizando la evolución a los 5 años de la cohorte de pacientes incluidos en el estudio de ancianos con ERC10,11,12 en el Hospital General de Segovia. Los pacientes fueron reclutados aleatoriamente en el momento en que acudían a las consultas de Geriatría y Nefrología General en el período enero-abril del año 2006. Los pacientes se encontraban en un período de estabilidad clínica cuando fueron seleccionados y fueron seguidos de forma prospectiva durante 5 años (revaluación entre enero-abril de 2011). Estos pacientes tenían una edad media de 82,4 ± 6 años (rango 69-97) en el período basal de reclutamiento. De ellos, un 68,8% eran mujeres; 82,5% tenían antecedentes previos de HTA, 35% eran diabéticos, 19,5% tenían antecedentes de insuficiencia cardíaca (IC) y 15% de cardiopatía isquémica (CI); 68,4% estaban recibiendo terapia con diuréticos.
Determinaciones analíticas
La analítica basal se realizó una semana antes de acudir los pacientes a sus consultas programadas de Geriatría y Nefrología. Se determinaron, según el procedimiento habitual del Laboratorio de nuestro Hospital, creatinina, AU, albúmina, colesterol y triglicéridos en sangre venosa; también se analizó creatinina y proteinuria en orina de 24 horas (consulta de Nefrología) o en primera orina de la mañana (consulta de Geriatría).
Métodos
Estudio observacional prospectivo. El filtrado glomerular (FG) se estimó con la formula MDRD abreviada13. Según la mediana de AU basal, establecimos dos grupos de estudio: grupo 1 de 40 pacientes con AU < 5,85 mg/dl, y grupo 2 de 40 pacientes con AU > 5,85 mg/dl. Estudiamos también la posible asociación entre los niveles elevados de AU (P75) y las características sociodemográficas, la FR y la mortalidad.
Al cabo de cinco años analizamos la mortalidad en función de los grupos de estudio.
Estadística
La estadística se realiza con el programa SPSS 15.0. Los datos se expresan como media y desviación estándar o mediana y percentiles. La comparación de medias se hace con t de student y la comparación de proporciones con Chi-2. Para analizar el efecto simultáneo de varias variables sobre la mortalidad usamos un análisis de Cox.
Resultados
El AU presentaba una distribución normal. Los niveles medios de AU basal fueron 6,11 ± 1,7 mg/dl (rango 2,8-11) y su mediana fue de 5,85 mg/dl (P25 = 4,90 mg/dl, P75 = 7,07 mg/dl). Respecto al empleo de diuréticos: un 42,6% utilizaban diuréticos del asa, un 29,5% empleaban tiazidas, y los ahorradores de potasio eran los menos prescritos con una frecuencia de 11,5%. En la tabla 1 se muestra la asociación entre los niveles de AU y el género, los antecedentes cardiovasculares y el empleo de diuréticos. Los pacientes con antecedentes de IC tenían niveles de AU significativamente mayores (7,00 ± 1,74 vs. 5,90 ± 1,71 mg/dl, p = 0,031).
Tabla 1. Niveles de ácido úrico (mg/dl) basal según género, antecedentes
cardiovasculares y empleo de diuréticos 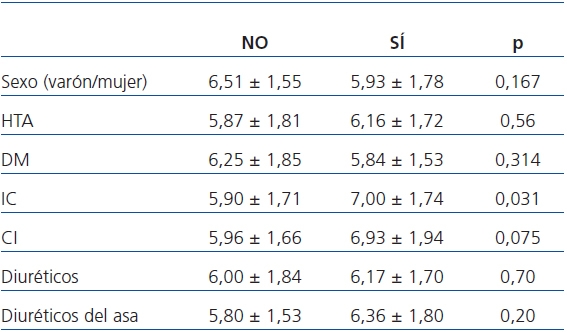
CI: cardiopatía isquémica; DM: diabetes mellitus; HTA: hipertensión arterial; IC: insuficiencia cardíaca.
En la tabla 2 se muestra la comparación de las características sociodemográficas, los parámetros de FR, la comorbilidad y la mortalidad a los 5 años según la mediana de AU. Los pacientes con AU superior a la mediana tenían un FG significativamente menor y una mortalidad a los 5 años más elevada.
Tabla 2. Comparación de variables según la mediana de ácido úrico (5,85 mg/dl) 
AU: ácido úrico; m: mujer; MDRD: Modification of Diet in Renal Disease;v: varón.
Veinte pacientes tenían un AU > del P75 (7,07 mg/dl). En la tabla 3 se comparan las variables según dicho percentil.
Tabla 3. Comparación de variables según P75 de ácido úrico (7,07 mg/dl) 
AU: ácido úrico; m: mujer; MDRD: Modification of Diet in Renal Disease;v: varón.
No se registraron pérdidas de pacientes durante el seguimiento que no se debieran a fallecimiento.
Globalmente, en el seguimiento a los 5 años, 41 pacientes fallecieron: 15 por deterioro del estado general; 8 por infecciones; 4 por ictus; 4 por tumores; 3 por causas cardiovasculares; 2 por complicaciones de fracturas y 5 por causa desconocida. En el análisis multivariante de Cox, la única variable predictora de mortalidad global tras corregir para edad, género, Charlson, antecedentes de IC, uso de diurético, y creatinina, presencia de proteinuria y FG-MDRD, fue los niveles de AU (mg/dl) (riesgo relativo 1,35;1,17-1,56; p = 0,000). En la figura 1 y la figura 2 se muestran las curvas de Kaplan-Meier de mortalidad según la mediana de AU y P75. En ambas se comprueba una mortalidad significativamente superior en pacientes con AU mayor de P50 y P75.

Figura 1. Curva de Kaplan-Meier de mortalidad según la mediana de ácido úrico (P50)

Figura 2. Curva de Kaplan-Meier de mortalidad según el P75 de ácido úrico
Discusión
La mortalidad global en el grupo de pacientes con niveles de AU superior a la mediana fue significativamente más elevada. Además, si analizamos los pacientes con niveles de AU > P75 (7,07 mg/dl), su mortalidad se incrementaba aún más, alcanzando un 80%, resultados que van en consonancia con otros estudios recientes9.
En esta cohorte de pacientes longevos, la causa de mortalidad más frecuente fue el deterioro progresivo, en lugar de las enfermedades cardiovasculares, y se encontró que los niveles de AU basal fueron los únicos predictores de mortalidad en el análisis de Cox.
La hiperuricemia se ha relacionado con diversas enfermedades en humanos4. La gota es una enfermedad que afecta predominantemente a los varones, con un incremento de su prevalencia en ambos sexos a medida que aumenta la edad. En nuestro estudio también los varones tenían niveles superiores de AU, si bien estas diferencias no fueron significativas, lo que posiblemente se explica por el hecho de tratarse de mujeres posmenopáusicas en las que ha cesado la actividad estrogénica14.
La ERC se ha asociado con la hiperuricemia2. En estudios experimentales en ratas con hiperuricemia, la lesión renal consiste en arteriolopatía aferente, fibrosis leve del túbulo intersticial, hipertrofia glomerular y/o glomeruloesclerosis15. En nuestro trabajo también encontramos que los ancianos con mayores niveles de AU tenían significativamente peor grado de FR. Esta asociación posiblemente es válida en ambas direcciones; es decir, los niveles elevados de AU se pueden explicar por isquemia renal y reducción de la FR, y/o el descenso del FG en pacientes con niveles más elevados de AU se debe a un efecto tóxico directo de éste.
Los diuréticos, ampliamente utilizados para tratar la HTA con el beneficio adicional de prevenir los episodios de IC16, incrementan el AU por la estimulación de la reabsorción de sodio y urato en el túbulo proximal3. Por otra parte, la elevación de AU también se ha observado en estados que cursan con hipoxia (enfermedad pulmonar obstructiva, IC congestiva)17,18. Leyva et al. estudian por primera vez las concentraciones de AU en pacientes con IC crónica y encuentran una relación inversa entre los niveles de AU y la oxigenación, sugiriendo que el daño en el metabolismo oxidativo podría jugar un papel en la patogénesis de la IC19. En el estudio SHEP los diuréticos mostraban reducir la mortalidad cardiovascular en los ancianos; sin embargo, en un reciente subanálisis se encontró que la cardioprotección fue menor en aquellos pacientes que tenían niveles elevados de AU20.
En nuestro trabajo encontramos que los niveles de AU eran similares entre aquellos que recibían diuréticos y los que no. Por otra parte, los ancianos con antecedentes previos de IC, que en general precisarían dosis más altas de diuréticos, tenían niveles significativamente mayores de AU, por lo que cabe pensar que el incremento en los niveles de AU en ancianos con antecedentes de IC está traduciendo más el efecto de una isquemia a nivel local que el incremento asociado a los diuréticos. Igualmente, los pacientes con antecedentes previos de CI tienen mayores niveles de AU, si bien en este caso no se alcanza significación estadística, posiblemente por el menor número de pacientes que presentaban esta patología.
Por último, la isquemia determina un incremento de la xantina oxidasa que conduce a un aumento en los niveles de AU3. El tratamiento con inhibidores de la xantina oxidasa como el alopurinol ha demostrado disminución de las complicaciones cardiovasculares después de by pass coronario y en pacientes con miocardiopatía dilatada21. Recientemente Goicoechea et al. encuentran que en pacientes con insuficiencia renal crónica el tratamiento con alopurinol reducía la caída de FR22.
Con los datos de nuestro estudio no podemos afirmar que exista una relación causal entre los niveles de AU elevados y la mortalidad. Un paso adelante en nuestro estudio habría sido confirmar si la reducción de los niveles de AU con alopurinol o más recientemente febuxostat23(nuevo inhibidor de la xantina oxidasa) podría contribuir a reducir la mortalidad en estos pacientes.
Un importante factor pronóstico de morbimortalidad es la presencia de proteinuria24,25;en efecto, en nuestro estudio de seguimiento de la FR en ancianos, a los 36 meses la presencia de proteinuria se mostraba como un factor independiente de mortalidad12, lo que no ocurre en este análisis a los cinco años tanto si la proteinuria se incluía en el modelo como variable cualitativa (sí/no) como si se hacía con su valor numérico. Posiblemente esto se explica por la escasez de la proteinuria en la muestra basal y por el hecho de que los pacientes con proteinuria más elevada fallecieron en los primeros años de seguimiento.
En conclusión, con nuestros datos, el AU se muestra como un factor de riesgo independiente de mortalidad global.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Oda M, Satta Y, Takenaka O, Takahata N. Loss of urate oxidase activity in hominoids and its evolutionary implications. Mol Biol Evol 2002;19(5):640-653. [ Links ]
2. Minguela JI, Hernando A, Gallardo I, Martínez I, García P, Muñoz RI, et al. La hiperuricemia como factor de riesgo cardiovascular y renal. Dial Transp 2011;32(2):57-61. [ Links ]
3. Johnson RJ, Kang D-H, Feig D, Kivlighn S, Kanellis J, Watanabe S, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease. Hypertension 2003;41:1183-90. [ Links ]
4. So A, Thorens B. Uric Acid transport and disease. J Clin Invest 2010;120(6):1791-9. [ Links ]
5. Perlstein TS, Gumieniak O, Williams GH, Sparrow D, Vokonas PS, Gaziano M, et al. Uric acid and the development of hypertension: the normative aging study. Hypertension 2006;48(6):1031-6. [ Links ]
6. Waring WS, Webb DJ, Maxwell SRJ. Effect of local hyperuricemia on endothelial function in the human forearm vascular bed. Br J Clin Pharmacol 2000;49:511. [ Links ]
7. Obermayr RP, Temml C, Gutjahr G, Knechtelsdorfer M, Oberbauer R, Klauser-Braun R. Elevated uric acid increase the risk for kidney disease. J Am Soc Nephrol 2008;19:2407-13. [ Links ]
8. Ben-Dov IZ, Kark JD. Serum uric acid is a GFR-independent long-term predictor of acute and chronic renal insufficiency: the Jerusalem Lipid Research Clinic cohort study. Nephrol Dial Transplant 2011;26(8):2558-66. [ Links ]
9. Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, et al. Uric acid and long term outcomes in CKD. Am J Kidney Dis 2009;53(5):796-803. [ Links ]
10. Heras M, Guerrero MT, Fernández-Reyes MJ, Sánchez R, Muñoz A, Macías MC, et al. Las manifestaciones analíticas asociadas a la insuficiencia renal crónica: ¿a partir de qué grado de filtrado glomerular las detectamos en ancianos? Rev Esp Geriatr Gerontol 2009;44(3):143-45. [ Links ]
11. Heras M, Fernández-Reyes MJ, Guerrero MT, Sánchez R, Muñoz A, Macias MC, et al. Ancianos con enfermedad renal crónica: ¿qué ocurre a los 24 meses de seguimiento? Nefrología 2009;4:343-9. [ Links ]
12. Heras M, Fernández-Reyes MJ, Guerrero MT, Sánchez R, Molina A, Rodríguez A, et al. Seguimiento durante 36 meses de la función renal en el anciano. Dial Transp 2011;32(3):97-101. [ Links ]
13. Levey AS, Greene T, Kusek JW, Beck GJ. Simplified equation to predict glomerular filtration rate from serum creatinine. J Am Soc Nephrol 2000;11:828(A). [ Links ]
14. Galvan AQ, Natali A, Baldi S, Frascerra S, Sanna G, Ciociaro D, et al. Effect of insulin on uric acid excretion in humans. Am J Physiol 1995;268:E1-E5. [ Links ]
15. Nakagawa T, Mazzali M, Kang DH, Kanellis J, Watanabe S, Sánchez-Lozada LG, et al. Hyperuricemia causes glomerular hypertrophy in the rat. Am J Nephrol 2003;23:2-7. [ Links ]
16. Heras M, Fernández-Reyes MJ, Sánchez R, Guerrero MT, Prado F, Alvarez-Ude F. Repercusión sobre la función renal de los fármacos antihipertensivos utilizados en ancianos con hipertensión arterial esencial. Hipertensión 2008;25(5):1947-7. [ Links ]
17. Elsayed N, Nakashima J, Postlethwait E. Measurement of uric acid as a marker of oxigen tension in the lung. Arch Biochem Biophys 1993;302:228-32. [ Links ]
18. Woolliscroft JO, Colfer H, Fox IH. Hyperuricemia in acute illness: a poor prognostic sign. Am J Med 1982;72:58-62. [ Links ]
19. Leyva F, Anker S, Swan JW, Godsland IF, Wingrove CS, Chua TP, et al. Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure. Eur Heart J 1997;18:858-65. [ Links ]
20. Franse LV, Pahor M, Di Bari M, Shorr RI, Wan JY, Somes G, et al. Serum uric acid, diuretic treatment and risk of cardiovascular events in the Systolic Hypertension in the Elderly Program. J Hypertens 2000;18:1149-54. [ Links ]
21. Tabayashi K, Suzuki Y, Nagamine S, Ito Y, Sekino Y, Mohri H. A clinical trial of allopurinol (Zyloric) for myocardial protection. J Thorac Cardiovasc Surg 1991;101:713-18. [ Links ]
22. Goicoechea M, García de Vinuesa S, Verdalles V, Ruiz-Caro C, Ampuero J, Rincón A, et al. Effect of allopurinol in chronic kidney disease progression and cardiovascular risk. Clin J Am Soc Nephrol 2010;5:1388-93. [ Links ]
23. Bruce SP. Febuxostat: a selective xanthine oxidase inhibitor for the treatment of hyperuricemia and gout. Ann Pharmacother 2006;40:2187-94. [ Links ]
24. García de Vinuesa S. Factores de progresión de la enfermedad renal crónica. Prevención secundaria. Nefrología 2008;S3:17-21. [ Links ]
25. Agrawal V, Marinescu V, Agarwal M, Mc Cullough. Cardiovascular implications of proteinuria: an indicator of chronic kidney disease. Nat Rev Cardiol 2009;6(4):301-11. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel Heras
Servicio de Nefrología,
Hospital General de Segovia.
40002 Segovia
mherasb@saludcastillayleon.es
manuhebe@hotmail.com
Enviado a Revisar: 21 Jun. 2011
Aceptado el: 1 Nov. 2011














