Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.33 no.3 Cantabria 2013
https://dx.doi.org/10.3265/Nefrologia.pre2013.Jan.11439
Neumonitis intersticial como reacción adversa a inhibidores de mTOR
Interstitial pneumonitis as an adverse reaction to mTOR inhibitors
Gloria Molas-Ferrer, Dolors Soy-Muner, Helena Anglada-Martínez, Gisela Riu-Viladoms, Anna Estefanell-Tejero y Josep Ribas-Sala
Servicio de Farmacia Hospitalaria. Hospital Clínic de Barcelona
Dirección para correspondencia
RESUMEN
Introducción: Los inhibidores de mTOR (del inglés mammalian target of rapamycin), sirolimus y everolimus, utilizados como tratamiento inmunosupresor en el trasplante de órganos sólidos, pueden producir efectos adversos graves, como la neumonitis intersticial.
Incidencia y presentación clínica: La incidencia de neumonitis intersticial se ha estimado entre el 4 % y el 11 %, aunque podría ser mayor. La mayoría de los casos publicados se ha producido en pacientes trasplantados renales en tratamiento con sirolimus. La presentación clínica es heterogénea, lo que dificulta el diagnóstico. Se acostumbra a observar alteraciones en la tomografía axial computarizada torácica, como opacidades en vidrio deslustrado. La fisiopatología es poco conocida. Sin embargo, se ha observado una mayor incidencia en pacientes con función renal alterada y en pacientes que habían recibido inhibidores de calcineurina previamente. La relación entre aparición de neumonitis y concentraciones plasmáticas de inhibidores de mTOR no está bien definida.
Tratamiento: La suspensión del fármaco y la administración de dosis altas de corticoides parecen ser efectivos. Otras alternativas terapéuticas, aunque más discutidas, son la reducción de la dosis del inhibidor de mTOR y el cambio de sirolimus a everolimus.
Conclusión: Se debe sospechar de neumonitis iatrogénica en pacientes trasplantados en tratamiento con inhibidores de mTOR y con síntomas respiratorios. Faltan datos concluyentes en cuanto a estrategias de tratamiento. Parece que everolimus podría ser mejor tolerado que sirolimus.
Palabras clave: Enfermedad pulmonar intersticial, Inhibidores de mTOR, Neumonitis, Sirolimus, Everolimus, Trasplante de órganos.
ABSTRACT
Introduction: mTOR (mammalian target of rapamycin) inhibitors sirolimus and everolimus, used as immunosuppressants in solid organ transplantation, may cause severe adverse effects, such as interstitial pneumonitis.
Incidence and clinical presentation: The estimated incidence of interstitial pneumonitis is 4-11% although it may be higher. Most reported cases have occurred in renal transplant recipients treated with sirolimus. Clinical presentation is heterogeneous, which makes diagnosis difficult. Abnormalities, such as ground glass opacities, are often found in computerised axial tomography scans of the chest. Physiopathology is not well-known. However, patients with abnormal renal function and those with previous calcineurin inhibitor treatment display a higher incidence. The relationship between pneumonitis and mTOR inhibitor plasma concentrations is not well defined.
Treatment: Drug discontinuation and administration of high doses of corticosteroids seems to be an effective treatment. mTOR inhibitor dose reduction and replacing sirolimus with everolimus are other alternatives, but they are still under discussion.
Conclusion: Iatrogenic pneumonitis must be suspected when a transplant recipient being treated with mTOR inhibitors presents respiratory symptoms. There is lack of conclusive data on treatment strategies. It appears that everolimus may be tolerated better than sirolimus.
Key words: Interstitial lung disease, mTOR inhibitors, Pneumonitis, Sirolimus, Everolimus, Organ transplantation.
Introducción
Los inhibidores de mTOR (del inglés mammalian target of rapamycin), sirolimus (rapamicina) y everolimus, actúan inhibiendo la proliferación de linfocitos T y B. Se propusieron como una alternativa más segura en el tratamiento inmunosupresor de los trasplantes de órganos sólidos, comparados con los ya ampliamente utilizados inhibidores de calcineurina: tacrolimus y ciclosporina. Sin embargo, en la práctica clínica se ha comprobado que los inhibidores de mTOR no están exentos de toxicidad1. Durante su introducción en el mercado se destacó la ausencia de nefrotoxicidad como su principal ventaja frente a los inhibidores de calcineurina, pero estudios posteriores en pacientes con trasplante renal han puesto en duda esta afirmación2,3.
La farmacocinética de sirolimus y everolimus es muy parecida en cuanto a metabolismo y excreción. Ambos se metabolizan por el CYP3A4 a metabolitos inactivos, que se eliminan fundamentalmente por las heces, con una mínima excreción por vía renal. Los parámetros farmacocinéticos, que se alteran en caso de insuficiencia hepática, no se ven afectados por la presencia de insuficiencia renal. Los dos fármacos también son sustratos de la glicoproteína P, implicada en procesos de eliminación. La semivida de eliminación es de alrededor de 30 horas para everolimus y aproximadamente del doble para sirolimus. Son fármacos que se distribuyen ampliamente por el organismo, como indica su elevado volumen de distribución4,5. Recientemente, se ha introducido en el mercado un nuevo inhibidor de mTOR, temsirolimus, indicado en el carcinoma de células renales avanzado.
Se ha demostrado que los inhibidores de mTOR estimulan la producción de algunas citocinas proinflamatorias en monocitos y macrófagos y promueven la proliferación de células T memoria. Este hecho indica que poseen ciertos efectos proinflamatorios, que podrían ser la causa de algunos de sus efectos adversos, como la neumonitis, que es la inflamación del tejido pulmonar2. En la tabla 1 se muestran los principales estudios sobre neumonitis en pacientes en tratamiento con inhibidores de mTOR6-10.
Tabla 1. Principales estudios sobre neumonitis en pacientes en tratamiento con inhibidores de mTOR 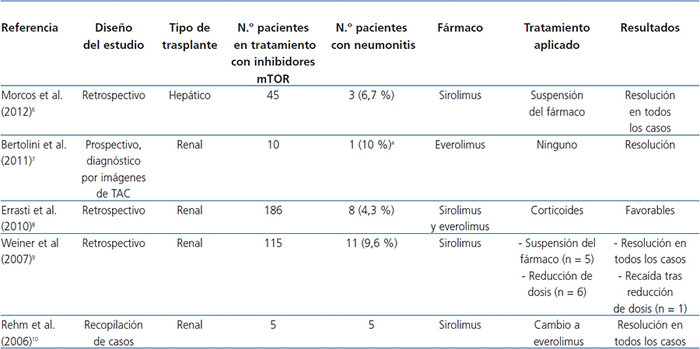
aDiagnóstico radiológico.
TAC: tomografía axial computarizada.
Incidencia
Se han publicado numerosos casos de neumonitis por inhibidores de mTOR desde su comercialización, la mayoría asociados al tratamiento con sirolimus, aunque también se han descrito con everolimus y temsirolimus3,11. La incidencia de este efecto adverso se ha estimado entre 4-11 %6,8,9. Sin embargo, la introducción reciente de este grupo de fármacos, concretamente everolimus y temsirolimus, como tratamiento antineoplásico aporta más casuística y sugiere que probablemente la incidencia sea mayor. Dado que los pacientes oncológicos se someten a tomografía axial computarizada (TAC) de forma periódica, se han podido observar alteraciones pulmonares sugestivas de neumonitis en pacientes no sintomáticos. La incidencia global de neumonitis por inhibidores de mTOR en este tipo de pacientes, sintomáticos o no, parece que se eleva por encima del 20 %11,12. En cuanto a la mortalidad asociada a la neumonitis por sirolimus y everolimus, se estima en alrededor de un 5 %2.
La gran mayoría de los casos descritos son en pacientes trasplantados renales, ya que es en este tipo de trasplante en el que primero se administraron inhibidores de mTOR. Sin embargo, también se han publicado casos de neumonitis en pacientes con trasplante de hígado o corazón, que presentaban características similares6,13,14.
Presentación clínica
La neumonitis causada por inhibidores de mTOR presenta una clínica heterogénea, pudiendo debutar con fiebre, fatiga, tos y disnea, signos y síntomas inespecíficos que no facilitan el diagnóstico. Puede aparecer tanto al inicio como tras varios años de tratamiento. En muchos casos la radiografía de tórax no presenta alteraciones y solo en la TAC se detectan anormalidades. Los hallazgos más frecuentes en la TAC son opacidades en vidrio deslustrado, aunque también se han observado infiltrados periféricos sobreañadidos o un patrón de bronquiolitis obliterante con neumonía organizativa. En algunos casos, se observaron también signos de fibrosis pulmonar. El diagnóstico es difícil y acostumbra a realizarse por exclusión de otras causas, como infecciones, enfermedades autoinmunes o toxicidad por otros productos8,9,15,16. La mejoría clínica al suspender el fármaco puede confirmar el diagnóstico8.
La fisiopatología de la neumonitis asociada a inhibidores de mTOR es poco conocida. Se han propuesto mecanismos de toxicidad directa por los fármacos, de toxicidad inmunológica o de una combinación de ambos mecanismos. En biopsias pulmonares de pacientes afectados se ha observado alveolitis linfocítica, lo cual favorece la hipótesis de toxicidad mediada por sistema inmune. Sin embargo, la rápida respuesta a la suspensión del fármaco favorece la hipótesis de toxicidad directa2,15-17.
Curiosamente, se ha observado que los pacientes que inician la inmunosupresión postrasplante directamente con inhibidores de mTOR presentan una incidencia menor de neumonitis que los que inician tratamiento con inhibidores de calcineurina y posteriormente cambian a sirolimus o everolimus. El motivo de esta menor incidencia no se conoce, pero algunos autores indican que podría deberse a diferencias en la función renal, puesto que se ha observado una mayor incidencia de neumonitis en pacientes con función renal alterada9,18. En ocasiones la razón para cambiar de inhibidores de calcineurina a inhibidores de mTOR es la nefrotoxicidad debida a los primeros. Por lo tanto, cuando cambian a tratamiento con inhibidores de mTOR, los pacientes presentan una función renal más deteriorada. Esta hipótesis es poco plausible, ya que sirolimus y everolimus se metabolizan por el CYP3A4 y su excreción renal es muy minoritaria4,5. Sin embargo, no se pueden descartar otros mecanismos por los cuales la función renal modifique la tolerancia a los inhibidores de mTOR y se discute si algún metabolito de eliminación renal podría ser el causante del cuadro clínico.
Se ha investigado también la posible relación entre la aparición de neumonitis y las concentraciones plasmáticas del fármaco. En los estudios de eficacia de sirolimus publicados hasta la fecha, se han utilizado diferentes concentraciones terapéuticas objetivo. Mientras algunos autores han empleado concentraciones predosis de 5-10 ng/ml, otros optan por 10-15 ng/ml o mayores, dependiendo de si los tratamientos eran en combinación con inhibidores de calcineurina o no y del período postrasplante19. En el estudio de Weiner et al., aunque en la mayoría de los casos de neumonitis las concentraciones de sirolimus eran superiores a ambos márgenes terapéuticos (media de 16,7 ng/ml), también se observaron casos con concentraciones menores a 10 ng/ml. Por lo que concentraciones plasmáticas dentro de los márgenes terapéuticos no permiten descartar la neumonitis causada por inhibidores de mTOR9,15.
Tratamiento
La primera medida que se ha de tomar ante un posible caso de neumonitis por inhibidores de mTOR es la suspensión del fármaco implicado en el proceso. Esto supone la resolución completa de los síntomas, en muchas ocasiones8,9,20,21. También se aconseja la administración de dosis altas de corticoides, aunque no se ha establecido una dosis recomendada. Hay que tener en cuenta que la mayoría de estos pacientes ya son tratados de base con corticoides en dosis bajas para evitar el rechazo del injerto. Sin embargo, en algunas series de casos, los pacientes han presentado evolución favorable sin haber recibido corticoides9. Por ello, algunos autores sugieren administrar corticoides solo en los casos más graves8.
Asimismo, se han descrito casos en los que la reducción de la dosis del inhibidor de mTOR ha sido suficiente para la resolución de la neumonitis3. Como alternativa a la suspensión de sirolimus, también se ha propuesto el cambio a everolimus, que ha tenido buen resultado en varios casos. Everolimus es un fármaco más hidrófilo que sirolimus, por lo que es más fácilmente eliminable del organismo y menos susceptible de causar reacciones de hipersensibilidad10,22. Parece que presenta una menor incidencia de neumonitis respecto a sirolimus3, aunque algunos estudios no han encontrado diferencias1.
Conclusión
Ante un paciente trasplantado de órgano sólido en tratamiento con inhibidores de mTOR y con clínica respiratoria, tras descartar una posible infección y otras causas, es conveniente sospechar de neumonitis iatrogénica, para iniciar lo más precozmente posible un tratamiento adecuado: suspensión o cambio de tratamiento inmunosupresor y/o corticoterapia.
Teniendo en cuenta que la neumonitis por inhibidores de mTOR es más frecuente en pacientes que presentan insuficiencia renal y que se han descrito casos en los que la reducción de dosis produce una resolución de las manifestaciones clínicas, se podría creer que esta toxicidad es dependiente de las concentraciones del fármaco en el organismo. Sin embargo, pacientes con concentraciones plasmáticas dentro del margen terapéutico han presentado esta complicación. Siguen sin conocerse los detalles de la fisiopatología de esta enfermedad, pero, tratándose de fármacos con volumen de distribución elevado, una posibilidad sería la acumulación específica del inhibidor de mTOR o de sus metabolitos en el parénquima pulmonar. Esto podría explicar la presencia de concentraciones séricas dentro del intervalo terapéutico en pacientes afectos de neumonitis.
Los inhibidores de mTOR, aun presentando un mismo mecanismo de acción, parece que difieren en el perfil de efectos adversos, siendo mayor la tolerancia a everolimus. Sin embargo, aún faltan datos que confirmen este hecho.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Sánchez-Fructuoso AI, Ruiz JC, Pérez-Flores I, Gómez Alamillo C, Calvo Romero N, Arias M. Comparative analysis of adverse events requiring suspension of mTOR inhibitors: everolimus versus sirolimus. Transplant Proc 2010;42(8):3050-2. [ Links ]
2. Cravedi P, Ruggenenti P, Remuzzi G. Sirolimus for calcineurin inhibitors in organ transplantation: contra. Kidney Int 2010;78(11):1068-74. [ Links ]
3. Alexandru S, Ortiz A, Baldovi S, Milicua JM, Ruiz-Escribano E, Egido J, et al. Severe everolimus-associated pneumonitis in a renal transplant recipient. Nephrol Dial Transplant 2008;23(10):3353-5. [ Links ]
4. Product information: Rapamune, sirolimus. Wyeth-Ayerst Laboratories. Philadelphia, PA; 1999. [ Links ]
5. Product information: Zortress oral tablets, everolimus oral tablets. Novartis Pharma Stein AG. Stein, Switzerland; 2010. [ Links ]
6. Morcos A, Nair S, Keane MP, McElvaney NG, McCormick PA. Interstitial pneumonitis is a frequent complication in liver transplant recipients treated with sirolimus. Ir J Med Sci 2012;181(2):231-5. [ Links ]
7. Bertolini L, Vaglio A, Bignardi L, Buzio C, De Filippo M, Palmisano A, et al. Subclinical interstitial lung abnormalities in stable renal allograft recipients in the era of modern immunosuppression. Transplant Proc 2011;43(7):2617-23. [ Links ]
8. Errasti P, Izquierdo D, Martín P, Errasti M, Slon F, Romero A, et al. Pneumonitis associated with mammalian target of rapamycin inhibitors in renal transplant recipients: a single-center experience. Transplant Proc 2010;42(8):3053-4. [ Links ]
9. Weiner SM, Sellin L, Vonend O, Schenker P, Buchner NJ, Flecken M, et al. Pneumonitis associated with sirolimus: clinical characteristics, risk factors and outcome-a single-centre experience and review of the literature. Nephrol Dial Transplant 2007;22(12):3631-7. [ Links ]
10. Rehm B, Keller F, Mayer J, Stracke S. Resolution of sirolimus-induced pneumonitis after conversion to everolimus. Transplant Proc 2006;38(3):711-3. [ Links ]
11. Duran I, Siu LL, Oza AM, Chung TB, Sturgeon J, Townsley CA, et al. Characterisation of the lung toxicity of the cell cycle inhibitor temsirolimus. Eur J Cancer 2006;42(12):1875-80. [ Links ]
12. White DA, Schwartz LH, Dimitrijevic S, Scala LD, Hayes W, Gross SH. Characterization of pneumonitis in patients with advanced non-small cell lung cancer treated with everolimus (RAD001). J Thorac Oncol 2009;4(11):1357-63. [ Links ]
13. David S, Kumpers P, Shin H, Haller H, Fliser D. Everolimus-associated interstitial pneumonitis in a patient with a heart transplant. Nephrol Dial Transplant 2007;22(11):3363-4. [ Links ]
14. Marín-Gómez LM, Cordero-Matía E, Gómez-Bravo MA, Bernal-Bellido C. Neumonitis asociada a everolimus en un receptor de trasplante hepático. Med Clin (Barc) 2010;135(9):431-2. [ Links ]
15. Martínez M, González Roncero FM, López M, Toro J, Valdivia MA, Pereira P, et al. Neumonitis intersticial asociada al uso de sirolimus en un trasplantado renal: un caso clínico. Nefrologia 2004;24 Suppl 3:7-10. [ Links ]
16. Filippone EJ, Carson JM, Beckford RA, Jaffe BC, Newman E, Awsare BK, et al. Sirolimus-induced pneumonitis complicated by pentamidine-induced phospholipidosis in a renal transplant recipient: a case report. Transplant Proc 2011;43(7):2792-7. [ Links ]
17. Singh U, Gupta A, Jasuja S. Sirolimus-induced pneumonitis. Indian J Nephrol 2009;19(2):80-1. [ Links ]
18. Sola E, López V, Gutiérrez C, Cabello M, Burgos D, Molina MG, et al. Late conversion to mammalian target of rapamycin inhibitor/proliferation signal inhibitors in kidney transplant patients: clinical experience in the last 5 years. Transplant Proc 2010;42(8):2859-60. [ Links ]
19. Patel SJ, Elliott EN, Knight RJ, Gaber LW, Gaber AO. Considerations in sirolimus use in the early and late post-transplant periods. Expert Opin Drug Saf 2009;8(4):421-34. [ Links ]
20. Davaus Gasparetto T, Marchiori E, Menezes P, Zanetti G. Pulmonary toxicity associated with sirolimus following kidney transplantation: computed tomography findings. Nefrologia 2010;30(2):259-60. [ Links ]
21. Losada González GP, Gómez Marqués G, Martínez Mateu JG, Munar Vila MA, Uriol Rivera M. Neumonitis intersticial por everolimus. Nefrologia 2010;30(4):479-80. [ Links ]
22. Calle L, Tejada C, Lancho C, Mazuecos A. Neumonitis por sirolimus: resolución tras conversión a everolimus. Nefrologia 2009;29(5):490-1. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Gloria Molas-Ferrer
Servicio de Farmacia Hospitalaria
Hospital Clínic de Barcelona, Villarroel 170
08036 Barcelona
gmolas@clinic.ub.es
gloriamolas@gmail.com
Enviado a Revisar: 12 Mar. 2012
Aceptado el: 28 Ene. 2013














