Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nefrología (Madrid)
versión On-line ISSN 1989-2284versión impresa ISSN 0211-6995
Nefrología (Madr.) vol.33 no.4 Cantabria 2013
https://dx.doi.org/10.3265/Nefrologia.pre2013.Jan.11806
REVISIONES CORTAS
Evolución natural de la función renal en el anciano: análisis de factores de mal pronóstico asociados a la enfermedad renal crónica
Natural progression of renal function in the elderly: analysis of poor prognosis factors associated with chronic kidney disease
Manuel Heras1, Pedro García-Cosmes2, María J. Fernández-Reyes1, Rosa Sánchez1
1Servicio de Nefrología. Hospital General de Segovia.
2Servicio de Nefrología. Hospital Universitario de Salamanca.
Dirección para correspondencia
RESUMEN
En los últimos años se ha generado un debate sobre el rango de función renal normal y el ritmo de progresión de la enfermedad renal en el anciano. En esta revisión analizamos, basándonos en los resultados del estudio Ancianos con enfermedad renal crónica del Hospital General de Segovia, los factores de mal pronóstico asociados a esta enfermedad: proteinuria, episodios de fracaso renal agudo y de insuficiencia cardíaca, y el papel del ácido úrico. Los ancianos con enfermedad renal crónica que presenten estos factores de mal pronóstico serían los que se podrían beneficiar del seguimiento por Nefrología.
Palabras clave: Función renal, Ancianos, Proteinuria, Fracaso renal agudo, Insuficiencia cardíaca, Ácido úrico.
ABSTRACT
In the last few years a debate has emerged on the range of normal renal function and the rate at which renal disease progresses in the elderly. In this review we analysed, on the basis of the results of the study Ancianos con enfermedad renal crónica del Hospital General de Segovia (Elderly people with chronic kidney disease of the Hospital General de Segovia), the poor prognosis factors associated with this disease: proteinuria, episodes of acute renal failure and heart failure, and the role of uric acid. Elderly people with chronic kidney disease who present these poor prognosis factors may benefit from follow-up by Nephrology.
Key words: Renal function, Elderly people, Proteinuria, Acute renal failure, Heart failure, Uric acid.
Introducción
Se ha demostrado, en experimentación animal y en humanos, que el filtrado glomerular (FG) y el flujo plasmático renal efectivo experimentan un descenso con la edad en ausencia de enfermedad renal1-5. El estudio de Baltimore demostró un descenso en el FG (estimado por aclaramiento de creatinina) por término medio de 0,75 ml/min/año, aunque una tercera parte de los participantes mantuvieron estable el aclaramiento de creatinina6. Fliser et al. valoraron la reserva funcional renal comparando 15 personas sanas normotensas, con una mediana de edad de 26 años (rango 23 a 32), frente a 10 personas de edad avanzada, con una mediana de edad de 70 años (rango de 61 a 82), y encontraron que el FG, estimado por aclaramiento de inulina (Cin), era significativamente más bajo en las personas de más edad respecto al grupo más joven (Cin: 102 frente a 122 ml/min), si bien los niveles de FG estimado por Cin en las personas de más edad se mantenían en rango normal4. Posteriormente, otro trabajo que incluía a 68 ancianos, comprobó también que el FG en pacientes ancianos estaba solo discretamente reducido respecto a un grupo control de jóvenes y, además, que esa reducción del FG se vinculaba estrechamente a la existencia de enfermedades asociadas, como hipertensión arterial (HTA) o insuficiencia cardíaca (IC)5.
Los hallazgos de estos estudios demuestran que ancianos sanos no experimentan un serio deterioro de la función renal4-6, y cuestionan el dogma del descenso inexorable de la función renal en el anciano7.
Por otra parte, las Guías KDOQI establecen una definición/clasificación de la enfermedad renal crónica (ERC), con cinco estadios basados en el grado de FG y/o en la presencia de manifestaciones de daño renal (hematuria, proteinuria, alteración en pruebas de imagen). Las Guías consideran también que los diferentes estadios de la ERC son válidos para las personas de todas las edades8. Existe, sin embargo, un gran debate acerca de cuál es el rango de función renal normal en el anciano, y si el FG disminuido en el anciano obedece a un proceso fisiológico de envejecimiento o, por el contrario, sería debido a enfermedad renal intrínseca.
En nuestro estudio, Ancianos con enfermedad renal crónica del Hospital General de Segovia, describimos la evolución natural de la función renal en dos grupos de pacientes seguidos durante un período de cinco años9: en este estudio se encuentra un lento descenso de la función renal con el tiempo, por término medio de 0,52 ml/min/año (figura 1). En un primer grupo (pacientes con creatinina sérica ≤ 1,1 mg/dl y sin proteinuria), el descenso medio fue de 0,67 ml/min; ninguno de estos pacientes progresó a nefropatía terminal (NT). En un segundo grupo de pacientes, con creatinina sérica > 1,1 mg/dl, el descenso medio fue de 0,26 ml/min/año; solo dos pacientes progresaron a NT, aunque en ningún caso se realizó tratamiento renal sustitutivo (TRS). El menor descenso de FG en personas que tenían peor función renal basal tal vez se pueda explicar porque la mayoría de los pacientes del segundo grupo fallecieron antes de que la enfermedad renal progresara a un estadio terminal (figura 2). Los resultados de nuestro estudio van en consonancia con otros estudios previos donde se constata que el riesgo de fallecer de estos pacientes es mayor que el de progresar a la NT10. En el estudio de Eriksen e Ingebretsen, el 31% de los pacientes fallecieron, frente al 2% que inició TRS11.

Figura 1. Descenso de filtrado glomerular en los supervivientes del estudio
Ancianos con enfermedad renal crónica a los 5 años
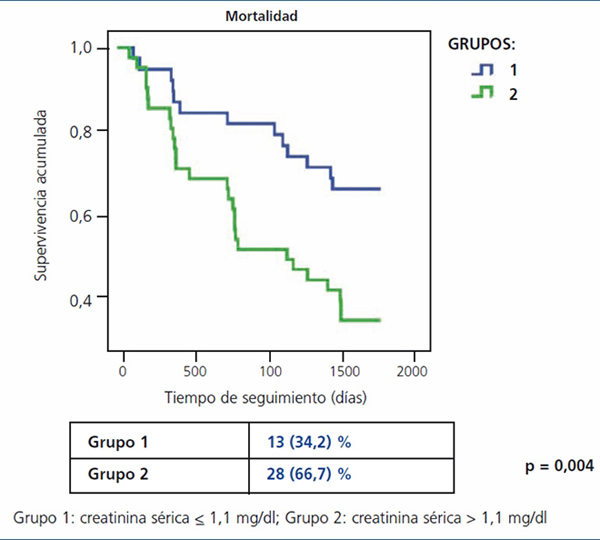
Figura 2. Evolución de la mortalidad a los 5 años del estudio Ancianos con enfermedad
renal crónica considerando grupos de función renal basal
Respecto al control de la presión arterial, es conocido que la reducción de las cifras de presión arterial se asocia con un enlentecimiento en el daño renal. En nuestro trabajo, la mayoría de los ancianos estudiados presentaban unas cifras de presión arterial < 140/90 mmHg, lo que nos permitiría especular con el hecho de que su control podría haber influido en la evolución de la función renal que presentamos con nuestros ancianos9.
En esta revisión analizamos los factores que podrían estar implicados en un peor pronóstico de la ERC en ancianos basándonos en los resultados obtenidos de nuestro estudio: proteinuria, episodios de fracaso renal agudo (FRA), episodios de IC y ácido úrico (AU).
Proteinuria: valor pronóstico en la evolución de la función renal y en la mortalidad en los ancianos
La presencia de proteinuria es un signo primordial de daño renal12. Numerosos estudios previos han demostrado que la proteinuria es un factor de riesgo muy importante de disfunción renal y de mortalidad cardiovascular13,14. Un reciente metaanálisis, que analiza nueve cohortes de población general y ocho cohortes con pacientes de alto riesgo, con inclusión de más de un millón de personas, encuentra que un FG disminuido unido a la presencia de albuminuria se asocia con un riesgo elevado de desarrollar NT, con independencia de otros factores de riesgo tradicionales de enfermedad cardiovascular15.
En nuestro estudio, en el corte basal los pacientes del primer grupo no presentaban proteinuria, y solo el 13% de los pacientes del segundo grupo tenían proteinuria mayor de 0,5 g/día; comprobamos que los pacientes con proteinuria fueron los que incrementaron de forma significativa las cifras de creatinina sérica a los tres años (figura 3) respecto a los pacientes sin proteinuria16. Como consecuencia práctica, este grupo de pacientes serían los que se beneficiarían más de cuidados específicos nefrológicos.

Figura 3. Impacto de la proteinuria sobre la evolución de la creatinina sérica a los tres años
Una de las limitaciones de la clasificación KDOQI radica precisamente en que la proteinuria se tiene en cuenta para definir los estadios más leves (estadios 1 y 2) y, sin embargo, en los estadios más avanzados (3-5), es suficiente tener un FG estimado (FGe) inferior a 60 ml/min para definirlos, con independencia de que presenten o no proteinuria. Así, es posible que la función renal de pacientes con ERC en estadio 1 pero con proteinuria progrese antes a NT que requiera diálisis que otros pacientes en estadio 3 pero sin proteinuria. En nuestro estudio, encontramos pacientes con creatinina sérica en rango normal sin proteinuria con un FG disminuido, que podrían ser etiquetados de ERC en estadio 3 simplemente por tener FG inferior a 60 ml/min y, sin embargo, ninguno de estos pacientes progresó a NT en el tiempo de seguimiento.
En nuestro estudio, la existencia de proteinuria también mostró ser un factor de riesgo independiente de mortalidad, como se recoge en el análisis de Cox efectuado en el seguimiento a los tres años (riesgo relativo [RR]: 2,12, p = 0,03)16.
Nuestros resultados son superponibles a los comunicados en el estudio de Hemmelgarn et al., en el cual se analizó una cohorte de 920985 adultos, con una mortalidad de un 3% a los 35 meses de media de seguimiento; los autores concluyeron que el riesgo de muerte, de sufrir infarto de miocardio o de progresión a insuficiencia renal terminal asociado con un determinado nivel de FGe se incrementaba de forma independiente en los pacientes con mayores niveles de proteinuria17.
Episodios de fracaso renal agudo
El FRA es una pérdida brusca de la función renal que se traduce en el acúmulo de productos de desecho (incremento en niveles de creatinina sérica) y disregulación en el equilibrio hidroelectrolítico18. En los ancianos, la presencia de determinadas comorbilidades, la polifarmacia, y el hecho de que determinados procedimientos diagnósticos y terapéuticos invasivos (medicamentos, contrastes e intervenciones quirúrgicas) se practiquen con más frecuencia en este grupo poblacional han contribuido a aumentar la incidencia del FRA19-21. De hecho, se sugiere que la epidemia real en nefrología es el FRA, en lugar de la ERC21,22.
La edad mayor de 65 años es un factor de riesgo de no recuperación de la función renal tras sufrir un episodio de FRA e incluso de progresión a ERC avanzada21. Un metaanálisis revela que el 31% de las personas de edad avanzada no recuperaron la función renal tras un episodio de FRA, en comparación con un 26% en pacientes más jóvenes23.
Diversos estudios ponen en evidencia que el hecho de sufrir un FRA, la severidad de este (necesidad de diálisis) y su frecuencia (más de un episodio) se relacionan con laprogresión a la cronicidad de la enfermedad renal24-27. Otros estudios demuestran que tanto la severidad como la duración del FRA son factores relacionados con la mortalidad28,29. En un estudio específico llevado a cabo en ancianos, Ishani et al. observan que los pacientes con episodios de FRA, particularmente si ya presentaban daño renal crónico, tienen más riesgo de desarrollar NT que aquellos pacientes que no han sufrido episodios de FRA. Los autores sugieren que el FRA puede acelerar la progresión de la enfermedad renal. En este estudio también se demuestra un riesgo de mortalidad absoluta a los dos años de un 29% en los ancianos con FRA respecto a los que no lo padecieron30.
Otro estudio reciente demuestra que incluso episodios de FRA reversibles con rápida recuperación de la función renal o pacientes que presentan modestos incrementos de creatinina sérica se asocian a un mayor riesgo para desarrollar ERC (RR: 1,91) y de mortalidad (RR: 1,50)31.
Con los datos de nuestro estudio, aproximadamente una cuarta parte de los pacientes que continúan con vida a los 36 meses de su reclutamiento presentaron algún episodio de FRA durante algún período en el que estuvieron hospitalizados. Aun siendo reversibles -de etiología funcional y sin precisar terapia con diálisis-, los pacientes con FRA presentaron un mayor descenso de la función renal en el tiempo (figura 4); un 25% de estos pacientes fallecieron durante el episodio, confirmando la elevada morbimortalidad asociada a este síndrome32. Según estos datos, los ancianos que hubieran presentado algún episodio de FRA serían un subgrupo de pacientes que se beneficiarían de seguimiento ulterior en consultas de nefrología.
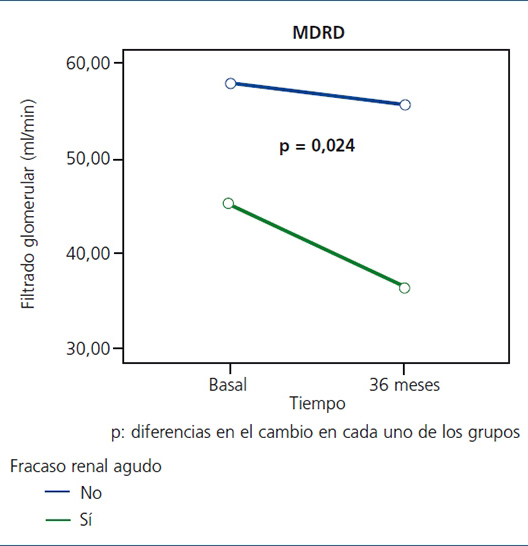
Figura 4. Impacto del fracaso renal agudo en la evolución de la función renal a los 36 meses
Episodios de insuficiencia cardíaca
En la literatura se describe la IC como la causa de hospitalización más habitual en los pacientes de más de 65 años33. En España, se estima una prevalencia de IC en torno a un 7-8% en la población general de 45 o más años (con una media de edad de 64 años), y el 1% del total de las tasas de hospitalización corresponden a episodios de IC descompensada (con una media de edad más elevada)34. Entre los mecanismos etiopatogénicos involucrados en la aparición de la IC en pacientes ancianos, se pueden mencionar, por una parte, los cambios asociados al proceso de envejecimiento (incremento progresivo de la masa de ventrículo izquierdo, pérdida de la elasticidad aórtica, incremento en el contenido de colágeno en el corazón normal)35,36 y, por otra parte, la asociación con patologías como la HTA, la cardiopatía isquémica (CI) y la patología valvular cardíaca34.
En nuestro estudio, los pacientes con antecedentes de IC en el período basal también tenían una peor función renal37. Además, la IC fue el principal evento cardiovascular en el curso del seguimiento, por encima de la CI y el accidente cerebrovascular. Un 20% de ellos presentaron algún episodio de IC que se podría explicar por ser una población muy envejecida y porque, además, la HTA fue una patología con alta prevalencia (superior al 80%). Al analizar la presencia de IC por grupos, aunque las diferencias no alcanzaron significación estadística (bien por el número limitado de pacientes analizados o por el período de tiempo estudiado), los pacientes del grupo 2 sufrieron más episodios de IC9.
Ácido úrico
El AU es un producto de desecho del metabolismo de las purinas38. La hiperuricemia, definida por niveles de AU > 6,5 o 7 mg/dl en varones y > 6 mg/dl en mujeres, esun hallazgo que puede encontrarse cuando la función renal se deteriora39,40. En estudios observacionales, se considera el nivel de AU como factor de riesgo independiente para desarrollar ERC41,42 y, como se ha demostrado recientemente, de FRA43,44. En un estudio específico en población anciana china, donde se estudian 1182 personas de ≥ 65 años, se encuentra que un alto porcentaje tenía hiperuricemia; además, se demuestra una asociación entre hiperuricemia y otros factores de riesgo cardiovascular45.
Existe un gran debate en relación con el papel que juega el AU tanto en el inicio como en la progresión de la enfermedad renal. Un estudio de corte transversal es incapaz de determinar qué evento ocurre primero, si la elevación de AU o la enfermedad renal40. Sin embargo, en algunos estudios de seguimiento longitudinal se muestra que el AU es un factor de riesgo para el desarrollo de ERC con el paso el tiempo46,47. En este sentido, otros estudios también evidencian que el tratamiento de la hiperuricemia con alopurinol disminuye el riesgo de progresión de la enfermedad renal48 o mejora la disfunción endotelial49.
También se ha demostrado que los niveles de AU se comportan como un factor de riesgo de mortalidad, tanto cardiovascular como global50,51. En nuestro estudio Ancianos con enfermedad renal crónica del Hospital General de Segovia, el AU se muestra como un factor de riesgo independiente tanto para el desarrollo de FRA (RR: 2,65, p = 0,027)32 como de mortalidad global (RR: 1,35, p = 0,000)52. En la figura 5 se muestran las curvas de Kaplan-Meier de mortalidad según los percentiles de AU: los pacientes con mayores niveles de AU, a su vez, tenían también peor grado de función renal basal52.
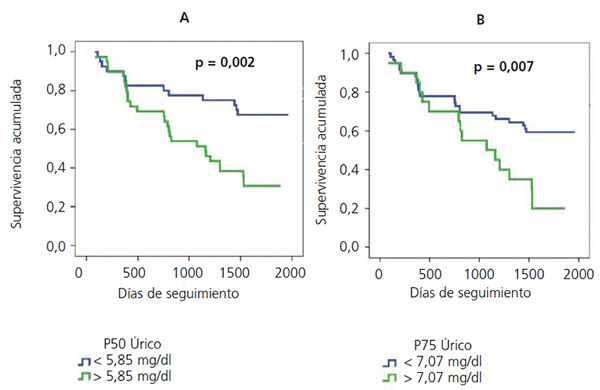
Figura 5. Curva de Kaplan-Meier de mortalidad según P50 (A) o P75 (B) de ácido úrico
En conclusión, los ancianos con ERC que presenten factores de mal pronóstico, como proteinuria, antecedentes de fracaso renal agudo o IC e hiperuricemia, serían un subgrupo de pacientes que se beneficiarían de seguimiento en las consultas de Nefrología.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias bibliográficas
1. Goldstein RS, Tarloff JB, Hook JB. Age-related nephropathy in laboratory rats. FASEB J 1988;2:2241-51. [ Links ]
2. Anderson S, Brenner BM. Effects of aging on the renal glomerulus. Am J Med 1986;80:435-42. [ Links ]
3. Kaysen GA, Myers BD. The aging kidney. Clin Geriatr Med 1985;1:207-22. [ Links ]
4. Fliser D, Zeier M, Nowack R, Ritz E. Renal functional reserve in healthy elderly subjects. J Am Soc Nephrol 1993;3:1371-7. [ Links ]
5. Fliser D, Franek E, Joest M, Block S, Mutschler E, Ritz E. Renal function in the elderly: impact of hypertension and cardiac function. Kidney Int 1997;51:1196-204. [ Links ]
6. Lindeman RD, Tobin J, Shock NW. Longitudinal studies on the rate of decline in renal function with age. J Am Geriatr Soc 1985;33:278-85. [ Links ]
7. Fliser D, Franek E, Ritz E. Renal function in the elderly-is the dogma of an inexorable decline of renal function correct? Nephrol Dial Transplant 1997;12:1553-5. [ Links ]
8. National Kidney Foundation: K/DOQI Clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002;39:S1-S266. [ Links ]
9. Heras M, Fernández-Reyes MJ, Sánchez R, Guerrero MT, Molina A, MA Rodríguez, et al. Ancianos con enfermedad renal crónica: ¿qué ocurre a los cinco años de seguimiento? Nefrologia 2012;32:300-5. [ Links ]
10. Keith D, Nichols GA, Gullion C, Brown JB, Smith DH. Longitudinal follow-up and outcome among a population with chronic kidney disease in a large managed care organization. Arch Intern Med 2004;164:659-63. [ Links ]
11. Eriksen BO, Ingebretsen OC. The progression of chronic kidney disease: a 10-year population-based study of the effects of gender and age. Kidney Int 2006;69:375-82. [ Links ]
12. García de Vinuesa S. Factores de progresión de la enfermedad renal crónica. Prevención secundaria. Nefrologia 2008;S3:17-21. [ Links ]
13. Peterson JC, Adler S, Burkart JM, Greene T, Hebert LA, Hunsicker LG, et al. Blood pressure control, proteinuria, and the progression of renal disease: the Modification of Diet In Renal Disease Study. Ann Intern Med 1995;123:754-62. [ Links ]
14. Gerstein HC, Mann JF, Yi Q, Zinman B, Dinneen SF, Hoogwerf B, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001;286:421-6. [ Links ]
15. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int 2011;80:93-104. [ Links ]
16. Heras M, Fernández-Reyes MJ, Guerrero MT, Sánchez R, Molina A, Rodríguez A, et al. Seguimiento durante 36 meses de la función renal en el anciano. Dial Transpl 2011;32:97-101. [ Links ]
17. Hemmelgarn BR, Manns BJ, Lloyd A, James MT, Klarenbach S, Jindal KK, et al. Relation between kidney function, proteinuria and adverse outcomes. JAMA 2010;303:423-9. [ Links ]
18. Abdel-Kader K, Palevsky P. Acute kidney injury in the elderly. Clin Geriatr Med 2009;25:331-58. [ Links ]
19. Rosner MH. The pathogenesis of susceptibility to acute kidney injury in the elderly. Curr Aging Sci 2009;2:158-64. [ Links ]
20. Yilmaz R, Erden Y. Acute kidney injury in the elderly population. Int Urol Nephrol 2010;42:259-71. [ Links ]
21. Anderson S, Eldadah B, Halter JB, Hazzard WR, Himmelfard J, McFarland Horne, et al. Acute kidney injury in older adults. J Am Soc Nephrol 2011;22:28-38. [ Links ]
22. Hsu CY. Where is the epidemic kidney disease? J Am Soc Nephrol 2010;21:1607-11. [ Links ]
23. Schmitt R, Coca S, Kanbay M, Tinetti ME, Cantley LG, Parikh CR. Recovery of kidney function after acute kidney injury in the elderly: A systematic review and meta-analysis. Am J Kidney Dis 2008;52:262-71. [ Links ]
24. Lo LJ, Go AS, Chertow GM, McCulloch CE, Fan D, Ordonez JD, et al. Dialysis-requiring acute renal failure increases the risk of progressive chronic kidney disease. Kidney Int 2009;76:893-9. [ Links ]
25. Chawla LS, Amdur RL, Amodeo S, Kimmel PL, Palant CE. The severity of acute kidney injury predicts progression to chronic kidney disease. Kidney Int 2011;79:1361-9. [ Links ]
26. Ishani A, Nelson D, Clothier B, Schult T, Nugent S, Greer N, et al. The magnitude of acute serum creatinine increase after cardiac surgery and the risk of chronic kidney disease, progression of kidney disease, and death. Arch intern Med 2011;171:226-33. [ Links ]
27. Thakar CV, Christianson A, Himmelfarb J, Leonard AC. Acute kidney injury episodes and chronic kidney disease risk in diabetes mellitus. Clin J Am Soc Nephrol 2011;6:2567-72. [ Links ]
28. Coca SG, King JT, Rosenthal RA, Perkal MF, Parikh CR. The duration of postoperative acute kidney injury is an additional parameter predicing long-term survival in diabetic veterans. Kidney Int 2010;78:926-33. [ Links ]
29. Brown JR, Kramer RS, Coca SG, Parikh CR. Duration of acute kidney injury impacts long-term survival after cardiac surgery. Ann Thorac Surg 2010;90:1142-8. [ Links ]
30. Ishani A, Xue JL, Himmelfarb J, Eggers PW, Kimmel PL, Molitoris BA, et al. Acute kidney injury increases risk of ESRD among elderly. J Am Soc Nephrol 2009;20:223-8. [ Links ]
31. Bucaloiu ID, Kirchner HL, Norfolk ER, Hartle JE, Perkins RM. Increased risk of death and novo chronic kidney disease following reversible acute kidney injury. Kidney Int 2012;81:477-85. [ Links ]
32. Heras M, Fernández-Reyes MJ, Guerrero MT, Sánchez R, Muñoz A, Molina A, et al. Factores predictores de fracaso renal agudo en ancianos con enfermedad renal crónica. Nefrologia 2012;32:819-23. [ Links ]
33. Biernacka A, Frangogiannis NG. Aging and cardiac fibrosis. Aging Dis 2011;2:158-73. [ Links ]
34. Chivite D, Formiga F, Pujol R. La insuficiencia cardiaca en el paciente anciano. Rev Clin Esp 2011;211:26-35. [ Links ]
35. Olivetti G, Melissari M, Capasso JM, Anversa P. Cardiomyopathy of the aging human Heart. Myocite loss and reactive cellular hypertrophy. Circ Res 1991;68:1560-8. [ Links ]
36. Gazoti Debessa CR, Mesiano Maifrino LB, Rodrigues de Souza R. Age related changes of the collagen network of the human heart. Mech Ageing Dev 2001;122:1049-58. [ Links ]
37. Heras M, Fernández-Reyes MJ, Sánchez R, Guerrero MT. Función renal en el anciano y su asociación con la comorbilidad. Nefrologia 2009;29:84-5. [ Links ]
38. Minguela JI, Hernando A, Gallardo I, Martínez I, García P, Muñoz RI, et al. La hiperuricemia como factor de riesgo cardiovascular y renal. Dial Transplant 2011;32:57-61. [ Links ]
39. Johnson RJ, Kang D-H, Feig D, Kivlighn S, Kanellis J, Watanabe S, et al. Is there a pathogenetic role for uric acid in hypertension and cardiovascular and renal disease. Hypertension 2003;41:1183-90. [ Links ]
40. Nashar K, Fried LF. Hyperuricemia and the progresión of chronic kidney disease: is uric acid a marker or an independent risk factor? Adv Chronic Kidney Dis 2012;19:386-91. [ Links ]
41. Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DN, Levey AS. Uric acid and incident kidney disease in the community. J Am Soc Nephrol 2008;19:1204-11. [ Links ]
42. Obermayr RP, Temml C, Gutjahr G, Knechtelsdorfer M, Oberbauer R, Klauser-Braun R. Elevated uric acid increases the risk for kidney disease. J Am Soc Nephrol 2008;19:2407-13. [ Links ]
43. Lapsia V, Johnson RJ, Dass B, Shimada M, Kambhampati G, Ejaz NI, et al. Elevated uric acid increases the risk for acute kidney injury. Am J Med2012;125:302.e9-17. [ Links ]
44. Ejaz AA, Kambhampati G, Ejaz NI, Dass B, Lapsia V, Arif AA, et al. Post-operative serum uric acid and acude kidney injury. J Nephrol 2012;25:497-505. [ Links ]
45. Chiou WK, Huang DH, Wang MH, Lee YJ, Lin JD. Significance and association of serum uric acid (UA) levels with components of metabolic syndrome (MS) in the elderly. Arch Gerontol Geriatr 2012;55:724-8. [ Links ]
46. Zoppini G, Targher G, Chonchol M, Ortalda V, Abaterusso C, Pichiri I, et al. Serum uric acid levels and incident chronic kidney disease in patients with type 2 diabetes and preserved kidney function. Diabetes Care 2012;35:99-104. [ Links ]
47. Zhang L, Wang F, Wang X, Liu L, Wang H. The association between plasma uric acid and renal function decline in a Chinese population-based cohort. Nephrol Dial Transplant 2012;27:1836-9. [ Links ]
48. Goicoechea M, García de Vinuesa S, Verdalles V, Ruiz-Caro C, Ampuero J, Rincón A, et al. Effect of allopurinol in chronic kidney disease progression and cardiovascular risk. Clin J Am Soc Nephrol 2010;5:1388-93. [ Links ]
49. Yelken B, Caliskan Y, Gorgulu N, Altun I, Yilmaz A, Yazici H, et al. Reduction of uric acid levels with allopurinol improves endotelial function in patients with chronic kidney disease. Clin Nephrol 2012;77:275-82. [ Links ]
50. Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, et al. Uric acid and long term outcomes in CKD. Am J Kidney Dis 2009;53:796-803. [ Links ]
51. Kuo CF, See LC, Yu KH, Chou IJ, Chiou MJ, Luo SF. Significance of serum uric acid levels on the risk of all cause and cardiovascular mortality. Rheumatology (Oxford) 2013;52(1):127-34. [ Links ]
52. Heras M, Fernández-Reyes MJ, Sánchez R, Molina A, Rodríguez A, Álvarez-Ude F. Utilidad del ácido úrico como marcador de mortalidad global en una cohorte de ancianos. Nefrologia 2012;32:67-72. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel Heras,
Servicio de Nefrología,
Hospital General de Segovia,
40002 Segovia
mherasb@saludcastillayleon.es
manuhebe@hotmail.com
Enviado a Revisar: 7 Nov. 2012
Aceptado el: 27 Ene. 2013














