My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nefrología (Madrid)
On-line version ISSN 1989-2284Print version ISSN 0211-6995
Nefrología (Madr.) vol.34 n.3 Cantabria 2014
https://dx.doi.org/10.3265/Nefrologia.pre2014.Feb.12464
ARTÍCULOS ESPECIALES
Documento de la Sociedad Española de Nefrología sobre las guías KDIGO para la evaluación y el tratamiento de la enfermedad renal crónica
Spanish Society of Nephrology document on KDIGO guidelines for the assessment and treatment of chronic kidney disease
Manuel Gorostidi1*, Rafael Santamaría2*, Roberto Alcázar3, Gema Fernández-Fresnedo4*, Josep M. Galcerán5, Marián Goicoechea6, Anna Oliveras7*, José Portolés8*, Esther Rubio8, Julián Segura9*, Pedro Aranda10*, Ángel L.M. de Francisco4*, M. Dolores del Pino11, Francisco Fernández-Vega1, José L. Górriz12*, José Luño6, Rafael Marín13, Isabel Martínez14, Alberto Martínez-Castelao15, Luis M. Orte16, Carlos Quereda16*, José C. Rodríguez-Pérez17*, Mariano Rodríguez2*, Luis M. Ruilope9*
1Hospital Universitario Central de Asturias. Oviedo.
2Hospital Universitario Reina Sofía. Córdoba.
3Hospital Universitario Infanta Leonor. Madrid
4Hospital Universitario Marqués de Valdecilla. Santander, Cantabria
5Fundació Althaia. Manresa, Barcelona
6Hospital General Universitario Gregorio Marañón. Madrid
7Hospital Universitari del Mar. Barcelona
8Hospital Universitario Puerta de Hierro. Madrid
9Hospital Universitario 12 de Octubre. Madrid
10Hospital Universitario Carlos Haya. Málaga
11Hospital Universitario Torrecárdenas. Almería
12Hospital Universitario Dr. Peset. Valencia
13Centro Médico de Asturias. Oviedo
14Hospital de Galdakao. Bilbao, Vizcaya
15Hospital Universitari de Bellvitge. L'Hospitalet de Llobregat, Barcelona
16Hospital Universitario Ramón y Cajal. Madrid
17Hospital Universitario Dr. Negrín. Las Palmas de Gran Canaria
*Red de Investigación Renal (REDinREN)
Dirección para correspondencia
RESUMEN
Las nuevas guías internacionales del consorcio KDIGO (Kidney Disease: Improving Global Outcomes) sobre la enfermedad renal crónica (ERC) y sobre el manejo de la presión arterial (PA) en pacientes con ERC constituyen la actualización de las correspondientes guías KDOQI (Kidney Disease Outcomes Quality Initiative) de 2002 y 2004. El objetivo de estos documentos es ofrecer una guía actualizada para el diagnóstico, la evaluación, el manejo y el tratamiento del paciente con ERC. La primera guía conserva la definición de ERC de 2002, pero ofrece una clasificación pronóstica mejorada. Además, se revalúan los conceptos sobre el pronóstico de la ERC, y se establecen recomendaciones para el manejo de los pacientes y sobre los criterios de derivación al especialista en nefrología. La segunda guía conserva el objetivo de una PA < 130/80 mmHg para pacientes con ERC que curse con una albuminuria elevada (cociente albúmina/creatinina en muestra aislada de orina entre 30 y 300 mg/g) o proteinuria (cociente albúmina/creatinina en muestra aislada de orina > 300 mg/g), pero recomienda el objetivo menos estricto de PA < 140/90 mmHg para pacientes con albuminuria normal. El desarrollo de las guías siguió un proceso predeterminado de revisión y evaluación de las evidencias disponibles. Las recomendaciones sobre el manejo y el tratamiento están basadas en la revisión sistemática de los estudios relevantes. El sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) se utilizó para evaluar la calidad de la evidencia y emitir el grado de recomendación. También se discuten las áreas de incertidumbre de los distintos aspectos tratados.
Palabras clave: Albuminuria, Enfermedad renal crónica, Clasificación, Filtrado glomerular, Guía de práctica clínica, Hipertensión arterial, KDIGO, Proteinuria, Recomendaciones basadas en la evidencia, Revisión sistemática.
ABSTRACT
The new Kidney Disease: Improving Global Outcomes (KDIGO) international guidelines on chronic kidney disease (CKD) and the management of blood pressure (BP) in CKD patients are an update of the corresponding 2002 and 2004 KDOQI (Kidney Disease Outcomes Quality Initiative) guidelines. The documents aim to provide updated guidelines on the assessment, management and treatment of patients with CKD. The first guidelines retain the 2002 definition of CKD but present an improved prognosis classification. Furthermore, concepts about prognosis of CKD, recommendations for management of patients, and criteria for referral to the nephrologist have been updated. The second guideline retains the <130/80mmHg-goal for management of BP in patients with CKD presenting increased albuminuria or proteinuria (albumin-to-creatinine ratio 30-300 mg/g, and >300 mg/g, respectively) but recommends a less-strict goal of <140/90mmHg in patients with normoalbuminuria. The development of the guidelines followed a predetermined process in which the evidence available was reviewed and assessed. Recommendations on management and treatment are based on the systematic review of relevant studies. The GRADE system (Grading of Recommendations Assessment, Development and Evaluation) was used to assess the quality of evidence and issue the grade of recommendation. Areas of uncertainty are also discussed for the different aspects addressed.
Key Words: Albuminuria, Chronic kidney disease, Classification, Glomerular filtration rate, Clinical practice guidelines, High blood pressure, KDIGO, Proteinuria, Evidence-based recommendations, Systematic review, Blood pressure.
Introducción
La visión epidemiológica de la enfermedad renal crónica (ERC) ha experimentado un cambio significativo en los últimos veinte años. Restringida inicialmente a patologías de incidencia relativamente baja, como las enfermedades glomerulares o las nefropatías hereditarias, y a un ámbito especializado de atención (Nefrología), la ERC predominante en la actualidad afecta a un porcentaje importante de la población y está relacionada con fenómenos o enfermedades de alta prevalencia, como el envejecimiento, la hipertensión arterial (HTA), la diabetes o la enfermedad cardiovascular. La ERC forma parte, frecuentemente, del contexto de comorbilidad que padecen enfermos seguidos por múltiples especialidades médicas, particularmente por Atención Primaria, Medicina Interna, Cardiología, Geriatría, Endocrinología y cualquier otra especialidad médica o quirúrgica que trate pacientes en riesgo de desarrollar ERC, sobre todo aquellos de edad avanzada. Los pacientes con ERC avanzada incluidos en programas de tratamiento renal sustitutivo mediante diálisis y trasplante se consideran la parte visible del iceberg que constituye el gran problema de salud pública que es la ERC en la población.
En los últimos diez años las sociedades científicas de nefrología han desarrollado una enorme actividad de información e investigación acerca de la ERC. En 2002 la National Kidney Foundation norteamericana publicó las guías K/DOQI (Kidney Disease Outcome Quality Initiative)1,2, en las que se estableció la definición actual de la ERC, la clasificación en grados y los métodos básicos de evaluación, como son la estimación de la función renal mediante ecuaciones para el cálculo del filtrado glomerular (FG) basadas en la determinación de la creatinina sérica y la evaluación de la albuminuria mediante la determinación del cociente albúmina/creatinina en una muestra aislada de orina. En 2004 se publicaron las primeras guías K/DOQI sobre el manejo de la HTA en los pacientes con ERC3. En las primeras guías de la Sociedad Española de Nefrología (S.E.N.) editadas con posterioridad a estas fechas ya se adoptó la clasificación K/DOQI de la ERC4,5. En 2003 se fundó la organización Kidney Disease Improving Global Outcomes (KDIGO) como grupo de expertos internacional e independiente, con participación española, para el desarrollo de iniciativas para la prevención y manejo de la ERC (http://www.kdigo.org/). En 2005 se publicó la primera guía KDIGO sobre la definición y clasificación de la ERC, que ratificó el enfoque de las guías K/DOQI de 20026. En 2008 la S.E.N. y la Sociedad Española de Medicina de Familia y Comunitaria (semFYC) elaboraron el Documento de Consenso S.E.N.-semFYC sobre la ERC, que estableció las bases de la prevención y el manejo conjunto de la enfermedad renal entre Atención Primaria y Nefrología7. La S.E.N. ha desarrollado un amplísimo programa de actividades de formación e investigación sobre la ERC8, uno de cuyos principales exponentes es el estudio EPIRCE (Estudio Epidemiológico de la Insuficiencia Renal en España), en el que se observó que la prevalencia de ERC en población general es del 9,16%9. En paralelo, las principales guías internacionales y nacionales sobre el manejo del paciente hipertenso incorporaron esta sistemática de diagnóstico de la ERC e incluyeron la disminución de la función renal y la albuminuria entre las variables principales de riesgo cardiovascular10,11. Por último, en los últimos meses se ha publicado un documento de consenso sobre la ERC de diez sociedades científicas españolas promovido por la S.E.N.12. En este contexto se publican en diciembre de 2012 y enero de 2013 unas nuevas guías KDIGO sobre la evaluación y tratamiento de la ERC y sobre el tratamiento antihipertensivo en pacientes con esta enfermedad13,14, disponibles de forma libre en su versión completa en http://www.kdigo.org. El objetivo del presente artículo fue elaborar un documento breve y práctico con las aportaciones más importante de estas dos últimas guías KDIGO.
Metodología
Las recomendaciones sobre el manejo y el tratamiento de la ERC expresadas en las citadas guías KDIGO se basaron en la revisión sistemática de los estudios relevantes por grupos de trabajo de expertos internacionales en nefrología y un equipo de expertos en medicina basada en la evidencia. Los manuscritos resultantes fueron objeto de una revisión pública. Las personas que llevaron a cabo esta revisión figuran en los correspondientes anexos de las guías. El sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) se utilizó para evaluar la calidad o nivel de la evidencia y emitir el grado de recomendación (GR). En el anexo 1 se exponen las definiciones del sistema GRADE utilizadas por el grupo KDIGO.
Anexo 1. Sistema GRADE 
GRADE: Grading of Recommendations Assessment, Development and Evaluation.
El presente documento de divulgación de las citadas guías KDIGO se elaboró con la siguiente metodología. Un comité de redacción elaboró resúmenes por áreas temáticas de los distintos capítulos de las guías. Los resúmenes fueron compilados por los editores especiales y el manuscrito resultante fue sometido a la revisión por parte de un comité de expertos designados por la S.E.N. Tras recoger las aportaciones de los expertos, se elaboró un documento definitivo que fue sometido a la aprobación por parte de todos los autores. En el anexo 2 figura la distribución de los autores en los distintos grupos de trabajo.
Anexo 2. Grupo de trabajo para la elaboración del presente documento 
Este documento resume las aportaciones de las citadas guías KDIGO referentes a pacientes en edad adulta con ERC en estadios previos al tratamiento renal sustitutivo, con excepción hecha en el manejo de la HTA del paciente portador de trasplante renal. Además, el documento pretende ofrecer una visión integradora de estas y otras guías para la práctica clínica diaria. El nivel de evidencia y el GR se expresan con las formas «se recomienda» para la recomendación de nivel 1 (la mayoría de los pacientes deberían recibir la acción recomendada) y «se sugiere» para la recomendación de nivel 2 (muchos pacientes deberían recibir la acción recomendada, aunque un porcentaje significativo de casos puede ser objeto de otra aproximación). Los autores del presente documento destacan el escaso número actual de evidencias grado A y de recomendaciones de nivel 1 en las guías KDIGO, considerando que son numerosos los aspectos sobre la ERC sometidos a debate. Los GR y el correspondiente nivel de evidencia de las principales recomendaciones se exponen entre paréntesis.
Definición de la enfermedad renal crónica
La ERC se define como la presencia de alteraciones en la estructura o función renal durante al menos tres meses y con implicaciones para la salud (GR, sin grado). Esta definición no cambia con respecto a la previa1,2,6,7, salvo por el añadido «con implicaciones para la salud», que refleja el concepto de que pueden existir determinadas alteraciones renales estructurales o funcionales que no conlleven consecuencias pronósticas (por ejemplo, un quiste renal simple). Los criterios diagnósticos de ERC serán los denominados marcadores de daño renal (kidney damage) o la reducción del FG por debajo de 60ml/min/1,73m2 (tabla 1). La duración mayor de tres meses de alguna de estas alteraciones podrá constatarse de forma prospectiva o bien inferirse de registros previos.
Tabla 1. Criterios diagnósticos de la enfermedad renal crónica 
Grado de recomendación: sin grado.
ERC: enfermedad renal crónica; FG: filtrado glomerular.
Categorías o grados de enfermedad renal crónica
Tras la confirmación diagnóstica, la ERC se clasificará según las categorías de FG y albuminuria y según la etiología (GR 1B). La causa de la ERC se establecerá según la presencia o ausencia de una enfermedad sistémica con potencial afectación renal o mediante las alteraciones anatomopatológicas observadas o presuntas (GR, sin grado). Los grados de FG (G1 a G5) y de albuminuria (A1 a A3) se exponen en la tabla 2 (GR, sin grado).
Tabla 2. Clasificación en grados de la enfermedad renal crónica 
Grado de recomendación: aunque la división en tramos del FG y de la albuminuria es una recomendación sin grado, la recomendación
de clasificar la ERC en grados de FG y albuminuria se considera de nivel 1B.
A/C: albúmina/creatinina; ERC: enfermedad renal crónica; FG: filtrado glomerular.
aLa causa se establecerá según la presencia o ausencia de una enfermedad sistémica o según un diagnóstico
anatomopatológico observado o presunto.bFG, filtrado glomerular, en ml/min/1,73 m2.cLa albuminuria en la
tabla se expresa como cociente albúmina/creatinina en mg/g en muestra aislada de orina como determinación más
recomendada; las equivalencias en mg/mmol son A1 < 3, A2 3-30 y A3 > 30, y en albuminuria en orina de 24 horas son
A1 < 30, A2 30-300 y A3 > 300 mg/24 horas.dEsta categoría incluye el síndrome nefrótico en el que la albuminuria suele ser > 2200
mg/g (> 220 mg/mmol o > 2200 mg/24 horas).
Con respecto a la clasificación previa de la ERC1,2,6,7, se conserva como definitorio el umbral de FG de 60ml/min/1,73m2, y el grado 3 se subdivide en G3a y G3b, según el FG esté entre 59 y 45 o entre 44 y 30ml/min/1,73m2, respectivamente. Además, se deberá categorizar la albuminuria en cualquier grado de FG. También se recomienda sustituir el término «microalbuminuria» por el de albuminuria moderadamente elevada. Se clasificará la albuminuria como A1, A2 o A3, según el cociente albúmina/creatinina en una muestra aislada de orina sea <30, 30-300 o >300mg/g, respectivamente (o según los valores correspondientes de excreción urinaria de albúmina expuestos en la tabla 2).
La reafirmación de considerar un FG <60ml/min/1,73m2 como definitorio de ERC ha sido objeto de debate, particularmente en sujetos de edad avanzada, dada la reducción del FG asociada a la edad. Este límite se basa en los resultados del metaanálisis del CKD Prognosis Consortium15-17. Este estudio demostró la asociación de un FG <60ml/min/1,73m2 con los riesgos de mortalidad total, de mortalidad cardiovascular, de progresión de la ERC, de llegada a ERC grado 5 y de fracaso renal agudo tanto en población general como en grupos de riesgo cardiovascular elevado. Además, el riesgo de nefrotoxicidad por fármacos y de complicaciones metabólicas y endocrinológicas aumenta exponencialmente con un FG <60ml/min/1,73m2.
Estratificación del riesgo
Las variables determinantes del riesgo de complicaciones de la ERC son la causa de esta, el grado de FG, el grado de albuminuria y otros factores de riesgo o comorbilidades. Al expresar el diagnóstico de ERC en un paciente concreto, se deberán explicitar la etiología y los grados de FG y albuminuria, por ejemplo: ERC G3a A3 probablemente secundaria a nefropatía diabética para un paciente diabético con FG entre 45 y 59ml/min/1,73m2 y una albuminuria >300mg/g. Esta sistemática permite la clasificación pronóstica del paciente con ERC en situaciones de riesgo moderado, alto o muy alto con respecto al riesgo basal o de referencia de sujetos sin criterios analíticos de ERC (FG >60ml/min/1,73m2 y albuminuria <30mg/g). En la figura 1 se expone la tabla de estratificación del riesgo de la ERC según las categorías de FG y albuminuria (GR, sin grado).
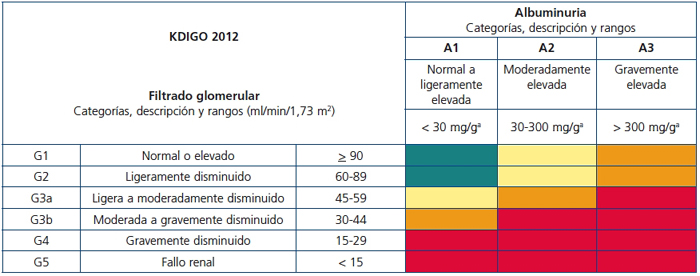
Figura 1. Pronóstico de la enfermedad renal crónica según las categorías de filtrado glomerular y de albuminuria.
Riesgo de complicaciones específicas de la enfermedad renal, riesgo de progresión y riesgo cardiovascular:
verde, riesgo de referencia, no hay enfermedad renal si no existen otros marcadores
definitorios; amarillo, riesgo moderado; naranja, riesgo alto; rojo, riesgo muy alto.
KDIGO: Kidney Disease: Improving Global Outcomes.
aLa albuminuria se expresa como cociente albúmina/creatinina.
Evaluación de la enfermedad renal crónica
Los objetivos básicos de la aproximación al paciente con ERC son la evaluación de la cronicidad, de la causa, del FG y de la albuminuria. La cronicidad se verificará de forma retrospectiva, revisando la historia previa, o bien de forma prospectiva cuando no existan determinaciones analíticas previas. La causa se determinará según la presencia o ausencia de una enfermedad sistémica con potencial afectación renal o mediante las alteraciones anatomopatológicas observadas o presuntas. Además, se evaluarán la historia familiar de la enfermedad, la toma mantenida de fármacos nefrotóxicos, los factores medioambientales, como el contacto con metales como el plomo o el mercurio, y las pruebas de imagen.
La evaluación del FG se llevará a cabo mediante la determinación de la creatinina sérica y una fórmula para estimar el FG (GR 1A). La determinación de la creatinina sérica se realizará mediante una prueba específica con trazabilidad adecuada a los estándares internacionales de referencia y con la mínima desviación respecto al método de referencia de espectrometría de masas por dilución isotópica. Esta recomendación no varía con respecto a la de documentos previos1,7,18. Las nuevas guías recomiendan el cambio de la ecuación para estimar el FG a la fórmula CKD-EPI (CKD Epidemiology Collaboration) de 200919 (GR 1B). La estimación del FG mediante fórmulas basadas en la creatinina sérica puede tener menos exactitud en determinadas circunstancias, como en individuos que siguen dietas especiales (vegetariana estricta o hiperproteica), con alteraciones importantes en la masa muscular (amputaciones, enfermedades con pérdida de masa muscular), con índices de masa corporal extremos (<19kg/m2 o >35kg/m2) o en el embarazo. En estas circunstancias y en determinadas situaciones en las que sea preciso optimizar la valoración del FG (por ejemplo, evaluación de potenciales donantes de riñón, casos con FG estimado entre 45 y 59ml/min/1,73m2 sin otros marcadores de daño renal o pacientes que necesiten tratamientos de toxicidad renal elevada), se sugiere la determinación de la cistatina C y del FG estimado por una ecuación basada en la cistatina C (preferiblemente CKD EPI cistatina) o una evaluación del aclaramiento de creatinina previa recogida de orina de un período de tiempo determinado. Además, en situaciones de retención hidrosalina grave (cirrosis con descompensación hidrópica, insuficiencia cardíaca congestiva, hipotiroidismo avanzado), al igual que en cualquier situación grave con inestabilidad hemodinámica, no es apropiado estimar el FG mediante una ecuación basada en la creatinina sérica.
La albuminuria se evaluará inicialmente en una muestra aislada de orina de primera hora de la mañana mediante la determinación del cociente albúmina/creatinina (GR 2B). En caso de grados avanzados de albuminuria, el cociente proteínas/creatinina ofrece una mejor aproximación a la proteinuria, si bien esta determinación no se lleva a cabo de forma rutinaria en nuestro medio. Se contempla también la utilización de las clásicas tiras reactivas como método de despistaje. El hallazgo de un cociente albúmina/creatinina ≥30mg/g se confirmará en una segunda muestra. La cuantificación de la excreción urinaria de albúmina o de proteínas en un determinado período de tiempo, por ejemplo, la clásica determinación en orina de 24 horas, se reservará para casos especiales en los que se considere necesaria una estimación más precisa. El término clásico de microalbuminuria debería ser abandonado (GR, sin grado), expresando la albuminuria en los citados grados A1, A2 o A3. En todo caso, la albuminuria deberá considerarse como tal en ausencia de factores que puedan aumentarla circunstancialmente, como infecciones urinarias, ejercicio físico, fiebre o insuficiencia cardíaca.
Progresión de la enfermedad renal crónica
La progresión y la evolución de la ERC es muy variable entre los sujetos que la padecen. Al no disponer de evidencias suficientes para definir e identificar a aquellos que van a tener una progresión rápida, la recomendación es evaluar simultánea y sistemáticamente el FG estimado y la albuminuria. Tanto la reducción del FG como el grado de albuminuria condicionan el pronóstico, ejerciendo, además, un efecto sinérgico (figura 1)15-17.
La progresión de la ERC se define por un descenso sostenido del FG >5ml/min/1,73m2 al año o por el cambio de categoría (de G1 a G2, de G2 a G3a, de G3a a G3b, de G3b a G4 o de G4 a G5), siempre que este se acompañe de una pérdida de FG ≥5ml/min/1,73m2 (GR, sin grado). Pequeñas fluctuaciones del FG no indican necesariamente progresión. Cuando se detecten los citados criterios de progresión, habrá que descartar factores potencialmente reversibles de agudización (progresión frente a agudización), como uropatía obstructiva, depleción de volumen, situaciones de inestabilidad hemodinámica o uso de antiinflamatorios no esteroideos, inhibidores de la ciclooxigenasa 2, antibióticos nefrotóxicos, contrastes radiológicos o fármacos bloqueantes del sistema renina-angiotensina (SRA) en determinadas condiciones hemodinámicas. En caso de progresión, se procurará identificar factores de progresión como etiología de la ERC, edad, sexo, raza, tabaco, obesidad, HTA, hiperglucemia, dislipemia, enfermedad cardiovascular previa y exposición a agentes nefrotóxicos, y se tratarán aquellos modificables20,21. Los pacientes con ERC progresiva sufren también un mayor riesgo cardiovascular, por lo que serán subsidiarios de las medidas de prevención apropiadas.
La periodicidad de la monitorización del paciente con ERC también es objeto de recomendación. En este sentido, la frecuencia de las revisiones también se basa en la tabla de estratificación del riesgo (figura 1). En términos generales, los pacientes de riesgo bajo se revisarán con periodicidad anual, los pacientes de riesgo moderado con periodicidad semestral, y los pacientes de riesgo alto y muy alto se deberán revisar tres, cuatro o más veces al año. Esta pauta será válida para el paciente estable. La repetición periódica de los parámetros de función renal servirá, además, para optimizar la evaluación de la progresión de la enfermedad.
Prevención de la progresión y manejo de las complicaciones de la enfermedad renal crónica
Las complicaciones más frecuentes de la ERC y su prevalencia según los grados de FG se exponen en la tabla 322,23. El denominado manejo integral del paciente de riesgo cardiorrenal constituye la base de la prevención de la progresión de la ERC. Aunque pueden establecerse matices diferenciales entre las medidas de prevención de la progresión de la ERC y las medidas de prevención cardiovascular, las bases para una prevención global serán las modificaciones dietéticas y del estilo de vida, el control de la HTA, el bloqueo del SRA y el control metabólico, fundamentalmente glucémico y lipídico.
Tabla 3. Prevalencia de las complicaciones habituales de la enfermedad
renal crónica según los grados del filtrado glomerulara 
Referencias: Levin et al.22 e Inker et al.23.
HTA: hipertensión arterial.
aDatos en porcentaje.bDefinida como presión arterial sistólica ≥140 mmHg, presión arterial diastólica ≥90
mmHg o uso de medicación antihipertensiva.cDefinida como niveles de hemoglobina <12 g/dl en mujeres
y <13,5 g/dl en varones.dDefinido como paratohormona intacta ≥70 pg/ml (≥7,4 pmol/l).eDefinida como
fósforo sérico ≥4,5 mg/dl (≥1,5 mmol/l).fDefinido como niveles séricos <15 ng/ml (<37 nmol/l).
gDefinida como bicarbonato sérico <21 mEq/l.hDefinida como albúmina sérica <3,5 g/dl.
Recomendaciones generales para el manejo de la hipertensión arterial
El control adecuado de la presión arterial (PA) constituye la base de la prevención cardiovascular, renal y global en el paciente con ERC. El objetivo de control será una PA <140/90mmHg en pacientes con cociente albúmina/creatinina <30mg/g, sean o no diabéticos (GR 1B), y una PA <130/80mmHg en pacientes con cociente albúmina/creatinina ≥30mg/g, tanto en no diabéticos como en diabéticos (GR 2D). El objetivo previo de una PA <130/80mmHg para todos los pacientes con ERC, con independencia del nivel de albuminuria o proteinuria, era una recomendación basada sobre todo en datos observacionales. Sin embargo, datos recientes han cuestionado que este objetivo sea beneficioso para pacientes con ERC y albuminuria <30mg/g24,25, por lo que se propone que los objetivos recomendados para el paciente hipertenso en general se apliquen a los pacientes con ERC con albuminuria normal. Respecto a los casos con albuminuria elevada o proteinuria, la sugerencia de un objetivo de PA <130/80mmHg se reconoce como recomendación de expertos. El objetivo de control de la PA en el paciente con ERC continúa siendo objeto de debate26. De hecho, tres guías recientes recomiendan un control de la PA <140/90mmHg para el paciente hipertenso en general, incluidos los casos con ERC27-29.
El alcance de estos objetivos se basará en un abordaje individualizado que incluirá medidas no farmacológicas (cambios de estilo de vida) y tratamiento farmacológico. La introducción de cambios del estilo de vida puede reducir las cifras de PA de forma sencilla, económica y efectiva, y suele acompañarse de otros efectos beneficiosos30,31. Respecto al tratamiento farmacológico, la elección de los fármacos que se han de utilizar debe ser individualizada en función de la edad, la tolerancia y las comorbilidades de los pacientes. Los fármacos bloqueantes del SRA, inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de los receptores de la angiotensina II (ARA II), constituirán la base del tratamiento antihipertensivo farmacológico en pacientes tanto no diabéticos como diabéticos con cociente albúmina/creatinina ≥30mg/g. La utilización prioritaria de este tipo de fármaco en pacientes con cociente albúmina/creatinina entre 30 y 300mg/g es una sugerencia (GR 2D), mientras que en pacientes con cociente albúmina/creatinina >300mg/g, o proteinuria equivalente (>500mg/24 horas), es una recomendación (GR 1B). Independientemente de la elección del tipo de fármaco para la primera línea de tratamiento, la mayoría de los pacientes necesitarán más de un fármaco antihipertensivo para el control adecuado de la HTA. Respecto al denominado bloqueo dual con IECA y ARA II, no existe evidencia suficiente para recomendar esta combinación para prevenir la progresión de la ERC, pero sí de posibles efectos adversos como deterioro agudo de función renal o hiperpotasemia. En la tabla 4 se exponen los aspectos fundamentales sobre el manejo de la HTA en el paciente con ERC. No entra dentro de los objetivos de estas guías la revisión exhaustiva de las indicaciones preferenciales, la dosificación, los efectos adversos y las contraindicaciones de los distintos tipos de fármacos antihipertensivos. No obstante, en la tabla 5 se resumen algunos de los aspectos básicos de cada grupo de fármacos antihipertensivos.
Tabla 4. Aspectos fundamentales sobre el manejo de la hipertensión arterial en la enfermedad renal crónica 
ARA II: antagonistas de los receptores de la angiotensina II; ERC: enfermedad renal crónica; GR: grado
de recomendación; IECA: inhibidores de la enzima de conversión de la angiotensina; PA: presión arterial.
Tabla 5. Indicaciones, beneficios adicionales, precauciones y uso combinado de los distintos
grupos de fármacos antihipertensivos en el paciente con enfermedad renal crónica 
AINE: antiinflamatorios no esteroideos; ARA II: antagonistas de los receptores de la angiotensina II;
COX2: ciclooxigenasa 2; DHP: dihidropiridinas; ERC: enfermedad renal crónica; HTA: hipertensión arterial;
IAM: infarto agudo de miocardio; IECA: inhibidores de la enzima de
conversión de la angiotensina; SRA: sistema renina-angiotensina.
Manejo de la hipertensión arterial en el paciente de edad avanzada
A pesar de la elevada prevalencia de HTA y ERC en individuos de edad ≥65 años y, sobre todo, en individuos de edad muy avanzada (edad ≥80 años), existen pocas evidencias para el desarrollo de recomendaciones sobre su manejo32. El tratamiento antihipertensivo en este tipo de pacientes será particularmente escalonado y con vigilancia de posibles efectos adversos tales como trastornos electrolíticos, agudización de la insuficiencia renal o hipotensión ortostática (GR, sin grado). La búsqueda de un control estricto de la PA y el uso de fármacos bloqueantes del SRA, claves del manejo del paciente adulto con ERC, pueden no ocasionar el mismo beneficio en el paciente muy anciano e, incluso, ser causa de efectos deletéreos33. En estos no existe evidencia para establecer recomendaciones, por lo que su manejo será particularmente individualizado34.
Manejo de la hipertensión arterial en el paciente con trasplante renal
La HTA en el paciente trasplantado es un factor de riesgo cardiovascular y de deterioro de la función del injerto35. Se sugiere que los pacientes trasplantados renales con PA >130/80mmHg sean tratados con el objetivo de mantener una PA <130/80mmHg, independientemente del nivel de excreción urinaria de albúmina (GR 2D). La elección del tipo de fármaco antihipertensivo debe tener en cuenta el tiempo postrasplante, la presencia o ausencia de una albuminuria elevada, el uso de anticalcineurínicos y la presencia de otras comorbilidades. En trasplante de menos de dos años de evolución, los antagonistas del calcio podrían tener un efecto beneficioso añadido al de placebo o al de los bloqueantes del SRA36, siendo preferibles los calcioantagonistas dihidropiridínicos. Durante los primeros meses postrasplante los bloqueantes del SRA podrían presentar un efecto deletéreo en la recuperación de la función renal. Sin embargo, posteriormente este tipo de fármacos podría ser de elección, sobre todo en casos con excreción urinaria de albúmina o proteínas aumentada.
Riesgo cardiovascular en la enfermedad renal crónica
Los pacientes con ERC, particularmente aquellos con grados 3a a 5, presentan un riesgo cardiovascular más elevado al que correspondería a la acumulación de factores clásicos como HTA o diabetes, por lo que deben ser considerados como pacientes de riesgo cardiovascular alto (GR 1A). El aumento en la albuminuria incrementa el riesgo de forma independiente del FG37. El riesgo de sufrir una complicación cardiovascular mayor aumenta desde un 43% en la ERC grado 3a hasta >300% en grados 4-5 con respecto a individuos sin ERC38. De hecho, los pacientes con ERC presentan más riesgo de muerte cardiovascular que de llegar a necesitar tratamiento renal sustitutivo mediante diálisis o trasplante renal39. Por estos motivos se recomienda considerar a cualquier sujeto con un FG estimado <60ml/min/1,73m2 como un paciente de riesgo cardiovascular alto. Los pacientes con ERC deben ser objeto de un plan integral y sistematizado de reducción del riesgo cardiovascular que debe incluir la abstención de fumar, ejercicio, control del peso, control del perfil lipídico, control óptimo de la diabetes, control óptimo de la PA, corrección de la anemia, control del metabolismo fosfo-cálcico y antiagregación plaquetaria en prevención secundaria. Se aconseja también que el paciente con ERC y un episodio coronario agudo reciba el mismo nivel de intervención diagnóstica y terapéutica que aquel sin ERC (GR 1A). Respecto al tratamiento del paciente con ERC e insuficiencia cardíaca, se sugiere un nivel de intervención similar al del paciente sin ERC (GR 2A), si bien cualquier aumento de tratamiento o cualquier deterioro clínico deberá llevar emparejado un control más estricto de la función renal y del potasio sérico. Algunas determinaciones diagnósticas como la de troponinas o la de BNP/NT-proBNP (péptido natriurético atrial tipo B/N-terminal-proBNP) se interpretarán con cautela en los pacientes con ERC, particularmente con un FG estimado <60ml/min/1,73m2, debido a que los valores de referencia estándar pueden no tener la misma significación que en el paciente sin ERC.
Control nutricional y metabólico
El control de la obesidad constituye un objetivo principal en el tratamiento del paciente con ERC, tanto como medida de prevención cardiovascular y global como para frenar la progresión de la insuficiencia renal (GR 1D).
Se recomendará una reducción en el consumo de sal a niveles de entre 4 y 6g diarios, salvo contraindicación (GR 1C).
Un aporte elevado dietético de proteínas en el paciente con ERC conlleva acumulación de toxinas urémicas, pero su ingesta insuficiente puede llevar a malnutrición. Se sugiere reducir la ingesta proteica a 0,8g/kg/día en pacientes adultos con FG estimado <30 ml/min/1,73m2 (ERC grados 4-5) sin evidencia ni riesgo de malnutrición (GR 2C).
En pacientes diabéticos se recomienda un objetivo de hemoglobina glucosilada (HbA1C) <7% (GR 1A), salvo en casos frágiles con riesgo de hipoglucemias o con comorbilidades importantes que reduzcan la expectativa de vida, en los que el objetivo será una HbA1C entre 7,5% y 8% (GR 2C). En pacientes muy ancianos y frágiles puede considerarse un objetivo de HbA1C más laxo de <8,5%40.
Respecto al tratamiento de la hiperuricemia, se estima que no hay evidencia suficiente que avale o rechace el uso de fármacos hipouricemiantes para frenar la progresión de la ERC. Sin embargo, está indicado que en los pacientes con ERC e hiperuricemia sintomática (gota o litiasis de ácido úrico) se consigan niveles de ácido úrico por debajo de 7mg/dl. Para conseguir dicho objetivo recibirán tratamiento con inhibidores de la xantino-oxidasa con dosis ajustadas a la función renal. La reducción del ácido úrico por debajo de 7mg/dl podría disminuir el riesgo cardiovascular y frenar la progresión de la ERC en pacientes con hiperuricemia asintomática. A pesar de que hay datos en la literatura que avalan este hecho, no existen estudios de intervención con tamaño muestral suficiente para recomendar el uso de fármacos hipouricemiantes con este objetivo41.
Los pacientes con grados avanzados de ERC pueden necesitar varios consejos dietéticos específicos simultáneos (sal, hidratos de carbono, proteínas, potasio, fósforo), que serán objeto de una atención individualizada y especializada (GR 1B).
Anemia
La anemia contribuye de forma importante en la sintomatología y la calidad de vida del paciente y tiene un impacto determinante en el pronóstico de la ERC. La determinación de la hemoglobina sérica se llevará a cabo al menos con periodicidad anual en pacientes con grados 3a y 3b, y al menos semestralmente con FG estimado <30ml/min/1,73m2. Los tratamientos y los objetivos terapéuticos detallados se tratan en la guía correspondiente42, si bien los aspectos fundamentales incluyen: 1) descartar causas secundarias, fundamentalmente déficit de hierro, 2) suplementar farmacológicamente hierro en caso de déficit, y 3) emplear agentes estimuladores de la eritropoyesis con una hemoglobina objetivo que no supere los 11,5g/dl. El tratamiento con agentes eritropoyéticos no se recomienda en casos con enfermedad maligna activa. Los estudios básicos para la evaluación de una anemia en el paciente con ERC incluirán un hemograma completo y la determinación de reticulocitos, ferritina sérica, índice de saturación de la transferrina, vitamina B12 y folato. El primer paso en el tratamiento de la anemia asociada a ERC será el aporte farmacológico de hierro en caso de un índice de saturación de la transferrina ≤30% y una ferritina sérica ≤500ng/ml. El tratamiento con agentes estimuladores de la eritropoyesis se valorará con niveles de hemoglobina <10g/dl42. Los GR y niveles de evidencia correspondientes a estas consideraciones sobre la anemia en la ERC se exponen en la correspondiente guía KDIGO42.
Alteraciones del metabolismo óseo-mineral
Las alteraciones en el metabolismo óseo-mineral pueden comenzar en los grados iniciales de la ERC y aumentan a medida que la enfermedad empeora (tabla 3). Estos cambios se agrupan bajo la denominación de alteraciones del metabolismo óseo-mineral e incluyen la osteodistrofia renal y las calcificaciones extraesqueléticas (vasculares) relacionadas. La osteodistrofia renal incluye a su vez la osteítis fibrosa (hiperparatiroidismo), la osteomalacia y la enfermedad ósea adinámica. La actual guía KDIGO remite a las recomendaciones de la guía específica previa43, también expresadas en la correspondiente guía de la S.E.N.44. Se aconseja evaluar al menos una vez al año los niveles de calcio, fósforo, fosfatasa alcalina, paratohormona intacta (PTHi) y vitamina D (25 OH D3) séricos en pacientes con FG estimado <45 ml/min/1,73m2 (grados 3b a 5). En pacientes con estos grados de ERC se sugiere mantener la concentración de fósforo en el rango normal. Se reconoce la ausencia de evidencia acerca del nivel óptimo de PTHi en estos pacientes, por lo que en caso de detectar una PTHi elevada se sugiere evaluar la posibilidad de hiperfosfatemia, hipocalcemia y déficit de vitamina D. En la tabla 6 se exponen los valores de estos parámetros recomendados en la guía de la S.E.N. para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con ERC no en diálisis44. Respecto a la indicación de determinar la densidad mineral ósea y a la utilización de bifosfonatos, se sugiere no indicar la densitometría ósea de forma rutinaria en pacientes con FG estimado <45ml/min/1,73m2 y evitar la citada prescripción en pacientes con FG estimado <30ml/min/1,73m2. Los GR y los niveles de evidencia correspondientes a estas consideraciones sobre las alteraciones del metabolismo óseo-mineral en la ERC se exponen en la correspondiente guía KDIGO43.
Tabla 6. Valores recomendados en la guía de la Sociedad Española de Nefrología para el manejo de las
alteraciones del metabolismo óseo-mineral en los pacientes con enfermedad renal crónica no en diálisis 
Referencia: Torregrosa44.
ERC: enfermedad renal crónica; PTHi: paratohormona intacta.
Acidosis
Al igual que para otras complicaciones citadas, la prevalencia y gravedad de la acidosis aumenta a medida que empeora la ERC (tabla 3). Se sugiere el tratamiento con suplementos orales de bicarbonato en pacientes con concentraciones de bicarbonato <22mEq/l, si no hay contraindicación.
Otros aspectos de seguridad en el paciente con enfermedad renal
Los pacientes con ERC son vulnerables a determinadas situaciones muy frecuentes en la atención sanitaria y, por tanto, deben ser objeto de las medidas preventivas apropiadas.
Riesgo de deterioro agudo de la función renal
El deterioro de la función renal ensombrece el pronóstico de cualquier patología aguda o crónica. Se recomienda considerar que todos los pacientes con ERC son una población de riesgo de fracaso renal agudo (GR 1A). Esta consideración será tenida en cuenta especialmente en casos de enfermedad intercurrente y, sobre todo, ante cualquier hospitalización o cualquier procedimiento diagnóstico o terapéutico.
Uso de medicamentos en pacientes con enfermedad renal
Las principales recomendaciones con respecto al uso de medicamentos en el paciente con ERC son: 1) utilizar el FG para la dosificación de los fármacos (GR 1A); 2) suspender temporalmente tratamientos potencialmente nefrotóxicos o de excreción preferentemente renal en pacientes con FG estimado <60ml/min/1,73m2 en circunstancias de enfermedad intercurrente grave, dado el riesgo de deterioro agudo de la función; los fármacos que se han de tener en cuenta en esta recomendación son, fundamentalmente, IECA, ARA II, antialdosterónicos, diuréticos, antiinflamatorios no esteroideos, metformina, litio y digoxina (GR 1C); 3) no emplear hierbas medicinales; 4) no utilizar metformina en pacientes con FG <45ml/min/1,73m2; y 5) monitorización de la función renal, los electrolitos y los niveles de fármacos en pacientes que reciben fármacos potencialmente nefrotóxicos, fundamentalmente antibióticos aminoglucósidos, litio, anticalcineurínicos y digoxina.
Uso de contrastes radiológicos
En pacientes con FG <60ml/min/1,73m2 que vayan a recibir un contraste yodado, se recomienda evitar agentes de osmolaridad alta, utilizar la mínima dosis posible del radiocontraste, suspender previamente los fármacos potencialmente nefrotóxicos, particularmente metformina, administrar la hidratación adecuada con solución salina antes, durante y después del procedimiento, y monitorizar el FG 48-96 horas después de este (GR 1, A a C según cada recomendación concreta). El uso de N-acetilcisteína o ácido ascórbico como profilaxis de la nefropatía por contrastes yodados no ha demostrado un beneficio consistente, por lo que no se ha incluido como recomendación en las guías KDIGO. Sin embargo, las guías sobre fracaso renal agudo de la S.E.N. recomiendan la profilaxis con N-acetilcisteína previa a la administración del contraste yodado y le asignan un nivel de evidencia B45.
Con respecto a la utilización de contrastes basados en gadolinio, se recomienda evitar su uso en pacientes con FG estimado <15ml/min/1,73m2 (GR 1B), salvo ausencia de alternativa. En pacientes con FG estimado <30ml/min/1,73m2 se aconseja evitar el uso de gadodiamide y usar preferentemente otros preparados como gadoteridol, gadobutrol o gadoterate. Aunque las KDIGO no hacen recomendaciones en cuanto al paciente en diálisis, existe la de realizar una sesión de diálisis inmediatamente después del procedimiento y probablemente también a las 24 horas de este. El papel de la diálisis en pacientes con FG estimado <15ml/min/1,73m2 y que no estén recibiendo tratamiento sustitutivo renal es incierto.
Asimismo, se recomienda no utilizar preparados orales con fosfatos para la preparación intestinal en pacientes con FG estimado <60ml/min/1,73m2 (GR 1A). Actualmente se debate si el potencial daño renal se debe a la deshidratación que producen estos compuestos más que al fósforo en sí. Para los enemas podrían ser más seguros los preparados sin fosfato (fisioenema). Para la preparación oral no existen preparados libres de fosfatos, por lo que recomiendan evitar la deshidratación.
Vacunaciones
Salvo contraindicación, se recomienda la vacunación contra la gripe en pacientes con FG <60 ml/min/1,73m2, la vacunación contra la infección neumocócica en pacientes con FG <30 ml/min/1,73m2 y en casos de alto riesgo como los pacientes con síndrome nefrótico, diabetes o que reciban tratamiento inmunosupresor, y la vacunación contra la hepatitis B en casos con FG <30ml/min/1,73m2 y riesgo de progresión.
Derivación al especialista en nefrología
En la tabla 7 se exponen los criterios de derivación de pacientes con ERC a Nefrología (GR 1B). Otras situaciones pueden ser manejadas por otros médicos, fundamentalmente por los especialistas en Medicina de Familia y Comunitaria con una monitorización periódica, según se ha comentado en el apartado correspondiente. En la figura 2 se indican las recomendaciones de monitorización o derivación según el grado de ERC. Estos criterios de derivación coinciden básicamente con los recomendados del citado documento de consenso S.E.N.-semFYC de 2008 y el documento sobre la ERC de diez sociedades científicas españolas7,12.

Figura 2. Recomendaciones sobre derivación del paciente con enfermedad renal crónica
al especialista en Nefrología según las categorías de filtrado glomerular y de albuminuria.
La periodicidad de la monitorización analítica será, en principio, anual en pacientes de riesgo bajo (verde),
semestral en pacientes en riesgo moderado (amarillo) y tres o más veces al año en
pacientes con riesgo alto o muy alto. Esta pauta se considera válida para pacientes estables.
aLa albuminuria se expresa como cociente albúmina/creatinina.
Tabla 7. Criterios de derivación al especialista en Nefrología 
Grado de recomendación: 1, recomendación; evidencia B.
ERC: enfermedad renal crónica; FG: filtrado glomerular; HTA: hipertensión arterial.
aPequeñas fluctuaciones del FG no indican necesariamente progresión. Cuando se detecten los citados
criterios de progresión, habrá que descartar factores potencialmente reversibles de agudización
(progresión frente a agudización), como uropatía obstructiva, depleción de volumen, situaciones de inestabilidad
hemodinámica o uso de antiinflamatorios no esteroideos, inhibidores de la ciclooxigenasa 2,
antibióticos nefrotóxicos, contrastes radiológicos o fármacos bloqueantes del
sistema renina-angiotensina en determinadas condiciones hemodinámicas.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: Evaluation, classification, and stratification. Am J Kidney Dis 2002;39(2 Suppl 1):S1-266. [ Links ]
2. Levey AS, Coresh J, Balk E, Kausz AT, Levin A, Steffes MW, et al. National Kidney Foundation practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Ann Intern Med 2003;139:137-47. [ Links ]
3. Kidney Disease Outcomes Quality Initiative (K/DOQI). K/DOQI clinical practice guidelines on hypertension and antihypertensive agents in chronic kidney disease. Am J Kidney Dis 2004;43(5 Suppl 1):S1-290. [ Links ]
4. Marín R, Goicoechea MA, Gorostidi M, eds. Guías SEN. Riñón y enfermedad cardiovascular. Nefrologia 2004;24(Suppl 6):S1-235. [ Links ]
5. Marín R, Goicoechea M, Gorostidi M, Cases A, Díez J, Escolar G, et al.; en representación del Comité de Expertos de la Guía de la Sociedad Española de Nefrología. Guía de la Sociedad Española de Nefrología sobre riñón y enfermedad vascular. Versión abreviada. Nefrologia 2006;26:31-44. [ Links ]
6. Levey AS, Eckardt KU, Tsukamoto Y, Levin A, Coresh J, Rossert J, et al. Definition and classification of chronic kidney disease: a position statement from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2005;67:2089-100. [ Links ]
7. Alcázar R, Egocheaga MI, Orte L, Lobos JM, González Parra E, Álvarez Guisasola F, et al. Documento de consenso SEN-semFYC sobre la enfermedad renal crónica. Nefrologia 2008;28:273-82. [ Links ]
8. Alcázar R, de Francisco ALM. Acción estratégica de la SEN frente a la enfermedad renal. Nefrologia 2006;26:1-4. [ Links ]
9. Otero A, de Francisco A, Gayoso P, García F, on behalf of the EPIRCE Study Group. Prevalence of chronic renal disease in Spain: Results of the EPIRCE study. Nefrologia 2010;30:78-86. [ Links ]
10. Mancia G, De Backer G, Dominiczak A, Cifkova R, Fagard R, Germano G, et al. 2007 Guidelines for the management of arterial hypertension: the Task Force for the Management of Arterial Hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2007;25:1105-87. [ Links ]
11. De la Sierra A, Gorostidi M, Marín R, Redón J, Banegas JR, Armario P, et al. Evaluación y tratamiento de la hipertensión arterial en España. Documento de consenso. Med Clin (Barc) 2008;131:104-16. [ Links ]
12. Documento de consenso sobre la enfermedad renal crónica. Available at: http://www.senefro.org/modules.php?name=news&d_op=detail&idnew=1274. [ Links ]
13. Kidney Disease: Improving Global Outcomes (KDIGO) Blood Pressure Work Group. KDIGO clinical practice guideline for the management of blood pressure in chronic kidney disease. Kidney Int Suppl 2012;2:337-414. [ Links ]
14. Kidney Disease: Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:1-150. [ Links ]
15. Chronic Kidney Disease Prognosis Consortium. Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative meta-analysis. Lancet 2010;375:2073-81. [ Links ]
16. van der Velde M, Matsushita K, Coresh J, Astor BC, Woodward M, Levey A, et al. Lower estimated glomerular filtration rate and higher albuminuria are associated with all-cause and cardiovascular mortality. A collaborative meta-analysis of high-risk population cohorts. Kidney Int 2011;79:1341-52. [ Links ]
17. Gansevoort RT, Matsushita K, van der Velde M, Astor BC, Woodward M, Levey AS, et al. Lower estimated GFR and higher albuminuria are associated with adverse kidney outcomes. A collaborative meta-analysis of general and high-risk population cohorts. Kidney Int 2011;80:93-104. [ Links ]
18. Gracia S, Montañés R, Bover J, Cases A, Deulofeu R, de Francisco ALM, et al. Documento de consenso: Recomendaciones sobre la utilización de ecuaciones para la estimación del filtrado glomerular en adultos. Nefrologia 2006;26:658-65. [ Links ]
19. Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, et al.; CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604-12. [ Links ]
20. Tangri N, Stevens LA, Griffith J, Tighiouart H, Djurdjev O, Naimark D, et al. A predictive model for progression of chronic kidney disease to kidney failure. JAMA 2011;305:1553-9. [ Links ]
21. Halbesma N, Jansen DF, Heymans MW, Stolk RP, de Jong PE, Gansevoort RT. Development and validation of a general population renal risk score. Clin J Am Soc Nephrol 2011;6:1731-8. [ Links ]
22. Levin A, Bakris GL, Molitch M, Smulders M, Tian J, Williams LA, et al. Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease. Kidney Int 2007;71:31-8. [ Links ]
23. Inker LA, Coresh J, Levey AS, Tonelli M, Muntner P. Estimated GFR, albuminuria, and complications of chronic kidney disease. J Am Soc Nephrol 2011;22:2322-31. [ Links ]
24. ACCORD Study Group, Cushman WC, Evans GW, Byington RP, Goff DC Jr, Grimm RH Jr, Cutler JA, et al. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med 2010;362:1575-85. [ Links ]
25. Appel LJ, Wright JT Jr, Greene T, Agodoa LY, Astor BC, Bakris GL, et al. Intensive blood-pressure control in hypertensive chronic kidney disease. N Engl J Med 2010;363:918-29. [ Links ]
26. Ruilope LM. Chronic kidney disease: Blood pressure control in CKD--still a matter of debate. Nat Rev Nephrol 2013;9:572-3. [ Links ]
27. Mancia G, Fagard R, Narkiewicz K, Redón J, Zanchetti A, Böhm M, et al.; Task Force Members. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens 2013;31:1281-357. [ Links ]
28. James PA, Oparil S, Carter BL, Cushman WC, Dennison-Himmelfarb C, Handler J, et al. 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8). JAMA 2014;311:507-20. [ Links ]
29. Weber MA, Schiffrin EL, White WB, Mann S, Lindholm LH, Kenerson JG, et al. Clinical practice guidelines for the management of hypertension in the community a statement by the American Society of Hypertension and the International Society of Hypertension. J Hypertens 2014;32:3-15. [ Links ]
30. Dickinson HO, Mason JM, Nicolson DJ, Campbell F, Beyer FR, Cook JV, et al. Lifestyle interventions to reduce raised blood pressure: a systematic review of randomized controlled trials. J Hypertens 2006;24:215-33. [ Links ]
31. Navaneethan SD, Yehnert H, Moustarah F, Schreiber MJ, Schauer PR, Beddhu S. Weight loss interventions in chronic kidney disease: a systematic review and meta-analysis. Clin J Am Soc Nephrol 2009;4:1565-74. [ Links ]
32. Fischer MJ, O'Hare AM. Epidemiology of hypertension in the elderly with chronic kidney disease. Adv Chronic Kidney Dis 2010;17:329-40. [ Links ]
33. Turgut F, Balogun RA, Abdel-Rahman EM. Renin-angiotensin-aldosterone system blockade effects on the kidney in the elderly: benefits and limitations. Clin J Am Soc Nephrol 2010;5:1330-9. [ Links ]
34. Aronow WS, Fleg JL, Pepine CJ, Artinian NT, Bakris G, Brown AS, et al. ACCF/AHA 2011 expert consensus document on hypertension in the elderly: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents developed in collaboration with the American Academy of Neurology, American Geriatrics Society, American Society for Preventive Cardiology, American Society of Hypertension, American Society of Nephrology, Association of Black Cardiologists, and European Society of Hypertension. J Am Soc Hypertens 2011;5:259-352. [ Links ]
35. Ojo AO. Cardiovascular complications after renal transplantation and their prevention. Transplantation 2006;82:603-11. [ Links ]
36. Kuypers DR, Neumayer HH, Fritsche L, Budde K, Rodicio JL, Vanrenterghem Y. Calcium channel blockade and preservation of renal graft function in cyclosporine-treated recipients: a prospective randomized placebo-controlled 2-year study. Transplantation 2004;78:1204-11. [ Links ]
37. Gerstein HC, Mann JF, Yi Q, Zinman B, Dinneen SF, Hoogwerf B, et al. Albuminuria and risk of cardiovascular events, death, and heart failure in diabetic and nondiabetic individuals. JAMA 2001;286:421-6. [ Links ]
38. Hallan SI, Dahl K, Oien CM, Grootendorst DC, Aasberg A, Holmen J, et al. Screening strategies for chronic kidney disease in the general population: follow-up of cross sectional health survey. BMJ 2006;333:1047. [ Links ]
39. Keith DS, Nichols GA, Gullion CM, Brown JB, Smith DH. Longitudinal follow-up and outcomes among a population with chronic kidney disease in a large managed care organization. Arch Intern Med 2004;164:659-63. [ Links ]
40. Gómez-Huelgas R, Martínez-Castelao A, Artola S, Górriz JL, Menéndez E; en nombre del Grupo de Trabajo para el Documento de Consenso sobre el tratamiento de la diabetes tipo 2 en el paciente con enfermedad renal crónica. Documento de consenso sobre el tratamiento de la diabetes tipo 2 en el paciente con enfermedad renal crónica. Med Clin (Barc) 2014;142(2):85.e1-10. [ Links ]
41. Johnson R, Nakagawa T, Jalal D, Sanchez-Lozada LG, Kang DH, Ritz E. Uric acid and chronic kidney disease. Which is chasing with? Nephrol Dial Transplant 2013;28:2221-8. [ Links ]
42. Kidney Disease: Improving Global Outcomes (KDIGO) Anemia Work Group. KDIGO clinical practice guideline for anemia in chronic kidney disease. Kidney Int Suppl 2012;2:279-335. [ Links ]
43. Kidney Disease: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. KDIGO clinical practice guideline for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD). Kidney Int Suppl 2009;(113):S1-130. [ Links ]
44. Torregrosa JV, Bover J, Cannata J, Lorenzo V, de Francisco ALM, Martínez I, et al. Recomendaciones de la Sociedad Española de Nefrología para el manejo de las alteraciones del metabolismo óseo-mineral en los pacientes con enfermedad renal crónica (S.E.N.-MM). Nefrologia 2011;31 Suppl 1:3-32. [ Links ]
45. Gaínza FJ, Liaño F, editores especiales. Guías SEN. Actuación en el fracaso renal agudo. Nefrologia 2007;27(Suppl 3):1-274. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel Gorostidi,
Red de Investigación Renal (REDinREN),
Hospital Universitario Central de Asturias,
Celestino Villamil, s/n,
33006, Oviedo
E-mail: manuel.gorostidi@sespa.princast.es
E-mail: manuel.gorostidi@gmail.com
Enviado a Revisar: 28 Ene. 2014
Aceptado el: 18 Feb. 2014














