Sr. Director:
El 90% de los casos de síndrome hemolítico urémico (SHU) se producen por Shiga-toxina entero-cólica (STEC) de alimentos contaminados (SHU típico), por activación de la vía clásica del complemento1. Están descritas las microangiopatías trombóticas (MAT) secundarias a fármacos, enfermedades autoinmunes y neoplasias, debidas a mecanismos relacionados con la vía alterna del complemento2-5.
Presentamos 3 casos de neoplasia de próstata avanzada, acontecidos en nuestro hospital, cuya forma de presentación fue MAT/SHU severo, que tuvieron buena evolución con el tratamiento (soporte, plasmaféresis y hemodiálisis).
Varón de 63 años, sin antecedentes de nefropatía atendido en urgencias por malestar general y oliguria, sin clínica gastrointestinal ni fiebre. La anamnesis general y la exploración física anodinas, presentó IRA (pCr: 6,2 mg/dl), anemia (Hb: 7,6 g/dl) y trombocitopenia (plaquetas: 49 × 109/l); LDH elevada (1.281 U/l), reticulocitosis, haptoglobina indetectable y esquistocitosis. En la orina hematíes dismórficos, leucocituria y proteinuria (<1 g/24 h); además una ecografía sin uropatía obstructiva. A las 24 h empeoró la función renal, los marcadores de autoinmunidad resultaron normales, la prueba de Coombs directa negativa y actividad de ADAMTS13 normal (56,9%), no se analizaron las heces por ausencia de clínica. Fue diagnosticado de MAT/SHU y recibió hemodiálisis (HD) y recambio plasmático (PMF) diarios.
Durante el proceso se diagnosticó de adenocarcinoma de próstata (PSA 195,6ng/ml y biopsia: Gleason 9) con metástasis óseas (fig. 1A). Recibió 13 sesiones de HD, 18 de PMF y bicalutamida, recuperando función renal, anemia y desaparecieron los datos de hemólisis (fig. 2A). A los 8 meses en consulta se encontraba asintomático, con función renal, Hb y plaquetas normales.
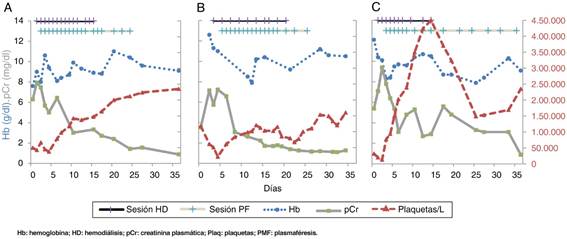
Figura 2 A-C) Evolución de la hemoglobina, la creatinina y las plaquetas en el tiempo en cada uno de los casos, paralelamente a las sesiones de hemodiálisis y plasmaféresis. El primer paciente (1A) parte de una pCr de 6,29 mg/dl, Hb 7,6 g/dl y plaquetas 49 × 109/l. Recibió tratamiento con HD (magenta) y posteriormente PMF (celeste) diarios. A las 2 semanas de iniciado el tratamiento, el paciente fue recuperando la diuresis y la función renal gradualmente (13 sesiones de HD y 18 sesiones de PMF). El segundo caso (1B), parte de cifras de pCr similares, con anemia y trombocitopenia. Recibe 10 y 17 sesiones de HD y PMF respectivamente, con recuperación al mes. El tercer caso (1C) tiene un comportamiento similar, con 10 y 15 sesiones, respectivamente, y recuperación al mes.
Varón de 82 años, hipertenso y EPOC con un cuadro de malestar general, astenia, clínica miccional y oliguria. Refería tos, expectoración blanquecina y fiebre de días de evolución, sin sintomatología gastrointestinal ni sobrecarga hídrica. Se descartó la presencia de infección severa y se objetivó una IRA (pCr: 7,5 mg/dl), acompañada de anemia (Hb: 12,6 g/dl) y trombocitopenia (plaquetas: 61 × 109/l) sugestivas de hemólisis (LDH 1.600 U/l, haptoglobina indetectable y reticulocitosis). La orina de baja densidad con microhematuria, leucocituria y proteinuria (<1 g/24 h) y la ecografía sin uropatía obstructiva. Los marcadores de autoinmunidad fueron normales, presentaba esquistocitosis, prueba de Coombs directa negativa y actividad de ADAMTS13 conservada (25,4%). El STEC en heces negativo. Con el diagnóstico de MAT/SHU, recibió HD y PMF (fig. 2B), y se diagnosticó de carcinoma de próstata avanzado (PSA: 760 ng/ml con metástasis óseas, fig. 1B) iniciándose bicalutamida. Un mes después presentaba función renal normal, con discretas trombocitopenia y anemia (Hb: 10,5 g/dl) (fig. 2B).
Varón de 89 años, diabético y con hiperplasia benigna de próstata; fue atendido por deterioro general, dolor abdominal, hematuria macroscópica y oliguria de 6 días de evolución. Sin clínica respiratoria, cardíaca o gastrointestinal, y con una exploración física anodina. Presentó una IRA (pCr: 9,4 mg/dl), con hematuria y proteinuria no nefrótica; anemia hemolítica (Hb: 10,1 g/dl, reticulocitosis, LDH: 4.411 U/l, haptoglobina: 54 mg/dl y esquistocitosis), y trombocitopenia severa (plaquetas: 13 × 109/l). La ecografía descartó causa obstructiva. La actividad de ADAMTS13 estaba conservada. Se estableció el diagnóstico de MAT/SHU y fue tratado con HD y PMF durante 3 semanas, con buena evolución de la función renal, la trombocitopenia y la anemia (fig. 2C). Tras el diagnóstico de cáncer de próstata recibió tratamiento específico. La función renal mejoró inicialmente quedando cierta insuficiencia renal residual.
En los 3 casos presentados de MAT/SHU, la CID fue excluida y el diagnóstico se estableció basado en la historia clínica completa y la búsqueda de factores desencadenantes, dado que contrariamente a lo que se pensaba, lo signos y síntomas del SHUa no son específicos según la guía de consenso publicada en nefrología (2013) (6.
La mayoría de casos de MAT/SHU son debidos a infecciones por STEC, sin embargo existen MAT/SHU secundarias a fármacos, enfermedades autoinmunes o neoplasias5,7,8. En oncología, la causa más frecuente de MAT/SHU se asocia a los quimioterápicos (la mitomicina es la más frecuente), siendo los casos directamente asociados a neoplasias menos frecuente. La serie más larga recogida consta de 168 pacientes; siendo tumores gástricos el más frecuente (26%) seguidos de mama y próstata9, lo que pone de relevancia la singularidad de nuestro reporte.
Los casos presentados presentaron una respuesta total con el tratamiento clásico del MAT/SHU (PMF, HD y soporte). Basados en la buena respuesta al tratamiento con PMF, se postula que una desregulación de la vía alterna del complemento, bien por susceptibilidades individuales por mutación en las proteínas reguladoras o por la presencia de anticuerpos contra estas, pudieran ser los desencadenantes del proceso4. También se han descrito casos de resistencia, con buena respuesta al anti-C5a (eculizumab) de manera temporal10.
La asociación de MAT/SHU a neoplasias complica gravemente la evolución del cuadro; no está necesariamente asociado al tratamiento, y como hemos descrito, un diagnóstico y tratamientos precoces pueden resolverlo sin secuelas. La pujante investigación en el campo del complemento ayudará a determinar las causas y cuál es el tratamiento más adecuado en cada caso.















