Introducción
La función renal residual (FRR) es un factor asociado a una mayor supervivencia de los pacientes renales1. En técnica de diálisis peritoneal es un aspecto crucial que vigilar, sustentado en numerosos estudios2,3. Aunque existen trabajos en hemodiálisis (HD) en los que se insiste sobre sus beneficios, este no ha sido un hecho especialmente descrito en dicha técnica1,4. Recientes trabajos han vuelto a poner de manifiesto una mayor supervivencia de los pacientes que mantienen una FRR así como han puesto en evidencia la dificultad de su control en la práctica clínica habitual5-8.
Preservar la FRR no solo se ha asociado a una mejor supervivencia, sino que puede ayudar a una mejor tolerancia de la técnica, a un mejor control de los parámetros del metabolismo calcio/fósforo, a un mejor estado nutricional, así como a una optimización en el control de la anemia e incluso a ofrecer beneficios en la percepción de la calidad de vida en situación de tratamiento renal sustitutivo (TRS)9-11.
La pérdida de FRR en los primeros meses en TRS está ampliamente descrita y se ha asociado a diversos factores: episodios de hipotensión arterial, depleción de volumen, activación de mediadores inflamatorios, biocompatibilidad de dializadores y líquido de diálisis, así como al uso de tratamientos nefrotóxicos y contrastes12,13. Las pautas incrementales, de 2 HD/semana, con ajustes de tiempo progresivo y seguimiento médico estrecho en diálisis son estrategias que han demostrado conservar la diuresis residual sin implicar otras complicaciones1,6,7,14.
En nuestro centro planteamos la posibilidad de pauta incremental al inicio del TRS en HD, de acuerdo con el modelo cinético establecido por Gotch en 1985, según el cual conseguir una dosis de diálisis adecuada era posible siempre y cuando se tuviese un aclaramiento de urea de al menos 2,5 ml/min15,16. Mostramos en este trabajo la aplicación de dicha estrategia en nuestro centro en los últimos 7 años.
Material y métodos
El objetivo del estudio es analizar la evolución de los pacientes con pauta incremental, especialmente su diuresis residual y sus repercusiones clínicas y analíticas.
Es un estudio retrospectivo de una serie de casos, sin grupo control, en el que se han analizado todos los pacientes que iniciaron TRS con pauta incremental desde el año 2008. Para el estudio no se incluyó a pacientes trasladados de otros centros, ya en técnica, o pacientes que fueron posteriormente incluidos en el programa de diálisis peritoneal.
Los criterios de inclusión que se establecieron para iniciar la pauta incremental fueron: la presencia de diuresis residual mínima de 1.000 ml en 24 h, una situación clínica estable, ausencia de datos de sobrecarga de volumen y de edemas. Los criterios de exclusión fueron: una situación clínica inestable, una diuresis inferior a 1.000 ml en 24 h o la presencia de alteraciones analíticas tales como fosforemia > 6 mg/dl o potasemia > 6,5 mEq/l de forma reiterada. También se consideró criterio de exclusión un perfil de incumplimiento terapéutico o una deficitaria comprensión de los cuidados y de las indicaciones médicas, así como pacientes con proteinurias nefróticas al inicio de TRS. Para el análisis tampoco se ha incluido a pacientes que no estuviesen como mínimo 6 meses en pauta incremental.
En nuestro centro para iniciar TRS mediante HD se requiere la presencia de al menos un filtrado glomerular estimado (FGE) por MDRD < 6 ml/min en paciente asintomático, un mayor FGE asociado a una situación clínica no controlada con tratamiento médico, una sintomatología urémica o un mal control de parámetros analíticos. Si el paciente inicia el TRS desde la consulta se pauta desde el comienzo diálisis incremental con 2 sesiones a la semana (lunes y viernes o martes y sábado) con un tiempo mínimo de 180 min si el peso es menor de 60 kg y de 210 min si el peso es mayor. A las 2-3 semanas se reevalúa su situación calculando la FRR tal como se indica en las guías KDOQI de 2006, valorando la diuresis residual y los parámetros convencionales analíticos, junto a una evaluación física17. Si el paciente inicia el TRS debido a una hospitalización, se realiza la pauta que el nefrólogo considere oportuna, según la situación clínica que ha provocado el inicio del TRS. Posteriormente, a las 2-3 semanas de estabilidad se reevalúa, calculando lo mismo que en los pacientes iniciados desde consulta. Siempre y cuando cumplan los criterios de inclusión, se transfieren a pauta de 2 HD/semana, con sus controles correspondientes.
Se consideró seguimiento en consulta a aquel paciente con control previo en la consulta de enfermedad renal crónica avanzada (ERCA) al menos durante 3 meses, presentase o no acceso vascular definitivo.
Una vez en TRS, se reevalúa la diuresis residual cada 2 meses, usando la diuresis de 24 h del día anterior a la primera sesión de diálisis de la semana. A su vez, se realiza seguimiento analítico mensual, el cálculo de la dosis de diálisis mediante la fórmula simplificada monocompartimental Kt/V Daugirdas bimensual y el cálculo del porcentaje de reducción de urea (PRU) cada 2 meses, así como un control diario de dosis de diálisis utilizando los monitores mediante el aclaramiento normalizado de urea (Kt y Kt/V). La pauta de 2 HD/semana se mantiene siempre y cuando la diuresis residual sea mayor de 1.000 ml/24 h, el aclaramiento de urea sea mayor de 2,5 ml/min, no existan edemas ni datos de sobrecarga de volumen y tampoco existan parámetros analíticos de forma persistente fuera del rango aconsejable.
Para el análisis de la presión arterial se ha considerado la tensión arterial medida al inicio de la sesión de diálisis.
Durante las sesiones de HD se estableció una ultrafiltración (UF) máxima para cada paciente entre 1.500 y 2.000 cc por sesión con el fin de evitar hipotensiones intradiálisis, reevaluando siempre la asociación o no de edemas o datos de sobrecarga de volumen acompañantes. El peso «seco» teórico era reevaluado cada semana con base en los datos de exploración física y de la UF estimada. Todos los pacientes eran instruidos en el consumo de líquidos y en consejos dietéticos específicos para el control de la sal y la hiperpotasemia. Como norma, si el paciente estaba polimedicado, no se asociaba tratamiento diurético con furosemida al empezar la práctica incremental, pero sí se mantenía si el paciente lo recibía previamente. Todos los pacientes se dializaban con baño de diálisis ultrapuro, con membranas biocompatibles de alta permeabilidad y recibían inicialmente una pauta de diálisis con un baño de calcio de 2,5 mEq/l, de potasio de 1,5 mEq/l, a una temperatura de 35,5°C si era bien tolerada.
Para el análisis de parámetros basales, a los 6 meses y al año se incluyen aquellos pacientes que iniciaron pauta de 2 HD/semana, independientemente de que al año estén en 2 o 3 HD/semana.
Análisis estadístico
Los resultados se expresan en media con desviación estándar. A su vez, también se incluye la mediana y el rango cuando la serie lo requiere. Los datos analizados tienen una distribución normal, por lo que se utilizaron test paramétricos. Se ha utilizado el test de Student para datos emparejados para la comparación de medias. Un valor de p < de 0,05 fue considerado estadísticamente significativo.
Resultados
Se ha revisado a todos los pacientes incidentes en HD desde la apertura de la Unidad de Hemodiálisis en marzo de 2008. Hasta septiembre de 2015 han iniciado TRS mediante pauta incremental, 2 HD/semana, un total de 34 pacientes. Diez pacientes han sido excluidos por no alcanzar al menos 6 meses en la pauta incremental. Seis pacientes cumplieron menos de 6 meses en HD incremental debido a criterios médicos, bien por datos de sobrecarga de volumen, bien por mal control de parámetros clínicos o bien por excesiva ganancia de peso. Se excluyó a 4 pacientes porque, tras iniciar pauta incremental, presentaron una recuperación de FRR que les permitió salir del TRS provisionalmente (3 de ellos al finalizar el estudio permanecen en situación de ERCA, estadio 4-5, sin necesidad de TRS, y el cuarto volvió a TRS en pauta de 3 HD/semana tras un infarto de miocardio, después de 18 meses fuera de diálisis).
Para el análisis final al concluir el periodo de recogida de datos (1 de septiembre de 2015), se ha considerado a aquellos pacientes que han estado en pauta incremental al menos 6 meses y como mínimo 12 meses en TRS. Diez pacientes han estado en técnica incremental al menos un año y otros 5 han cumplido al menos 6 meses en dicha pauta (fig. 1). De los 24 pacientes incluidos, 9 en pauta de 2 HD/semana no se han incluido en el análisis por llevar menos de 12 meses en TRS a fecha de cierre del estudio. Finalmente se muestran los datos de 15 pacientes que han recibido al menos 12 meses de TRS, de ellos 9 son varones y 5 mujeres, con una edad media al inicio de TRS de 60 (15 años. Las características de los pacientes y las causas de la enfermedad renal están incluidas en la tabla 1.
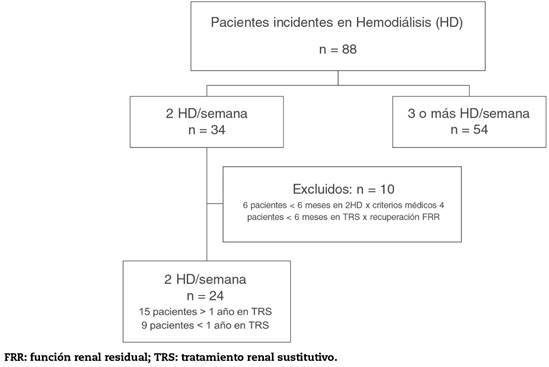
Figura 1 Distribución de los pacientes incidentes en la Unidad de Hemodiálisis del Hospital Universitario del Henares en el periodo comprendido desde julio de 2008 hasta septiembre de 2015.
Tabla 1 Características y evolución de los pacientes con pauta incremental
| N.° | Edad al inicio de TRS | Sexo | Etiología de la ERC | AV inicial | Procedencia | Situación a septiembre de 2015 | Tiempo en técnica 2 HD/semana (meses) | Tiempo en tratamiento renal sustitutivo con HD (meses) | Motivo del cambio de pauta |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 76 | Mujer | Mieloma | Catéter | Consulta | 3 HD/semana | 80 | 86 | Parámetros analíticos |
| 2 | 60 | Varón | GNF | FAV | Consulta | Fallecimiento | 12 | 12 | Trasplante renal |
| 3 | 26 | Mujer | NTI | Catéter | Consulta | 3 HD/semana | 7 | 64 | Incumplimiento |
| 4 | 75 | Varón | DM | Catéter | Hospitalización | 3 HD/semana | 9 | 62 | ICC |
| 5 | 66 | Varón | DM | FAV | Consulta | 3 HD/semana | 39 | 48 | Parámetros analíticos |
| 6 | 72 | Mujer | DM | FAV | Consulta | Fallecimiento | 10 | 17 | ICC |
| 7 | 56 | Mujer | GNF | FAV | Trasplante | Trasplante renal | 12 | 23 | Parámetros analíticos |
| 8 | 76 | Varón | NAE | FAV | Consulta | Trasplante renal | 10 | 16 | Parámetros analíticos |
| 9 | 67 | Varón | No filiada | FAV | Consulta | Trasplante renal | 18 | 18 | Trasplante renal |
| 10 | 32 | Mujer | GNF | FAV | Trasplante | 3 HD/semana | 10 | 26 | Parámetros analíticos |
| 11 | 73 | Varón | GNF | Catéter | Consulta | 2 HD/semana | 22 | 22 | Permanecea |
| 12 | 65 | Varón | PQ | FAV | Consulta | Trasplante renal | 14 | 14 | Trasplante renal |
| 13 | 49 | Varón | No filiada | Catéter | Hospitalización | 3 HD/semana | 13 | 20 | Parámetros analíticos |
| 14 | 53 | Varón | PQ | FAV | Consulta | 2 HD/semana | 18 | 18 | Permanecea |
| 15 | 57 | Varón | DM | Catéter | Consulta | 2 HD/semana | 16 | 16 | Permanecea |
AV: acceso vascular; DM: diabetes mellitus; ERC: enfermedad renal crónica; FAV: fístula arteriovenosa; GNF: glomerulonefritis; HD: hemodiálisis; ICC: insuficiencia cardiaca congestiva; NAE: nefroangiosclerosis; NTI: nefropatía túbulo-intersticial; PQ: poliquistosis renal; TRS: tratamiento renal sustitutivo.
aPermanecen en técnica de 2 HD/semana a fecha de septiembre de 2015.
Dos pacientes presentaron inicio de TRS sin seguimiento previo en consulta, transfiriéndose a pauta de 2/semana después del ingreso. Nueve pacientes iniciaron TRS con fístula arteriovenosa (FAV) funcionante, los otros 6 pacientes necesitaron un catéter tunelizado para comenzar.
El tiempo medio en pauta incremental fue de 19 (18 meses (mediana: 13; rango: 7-80), con una permanencia media en TRS de 31 (23 meses (mediana: 20; rango: 12-86).
Dos pacientes venían de consulta de trasplante renal, con disfunción crónica del injerto. En los 2 casos, uno al año y otro a los 10 meses, ante descenso de diuresis residual y empeoramiento de parámetros analíticos, fue necesaria su conversión a 3 HD/semana.
Los motivos que condicionaron el cambio de pauta se muestran en la tabla 1. Seis pacientes requirieron conversión a 3 HD/semana por parámetros analíticos y 2 debido a episodios de insuficiencia cardiaca (uno en el contexto de isquemia miocárdica y otro en el seno de una infección respiratoria) que condicionaron una necesidad de UF más estricta y una pérdida concomitante de diuresis residual. En un caso, ante el no cumplimiento farmacológico, con cifras elevadas de fósforo y potasio de forma persistente, fue necesaria la conversión a pauta de 3 HD/semana. En 3 casos el motivo de finalización de la pauta incremental fue un trasplante renal, tras 12, 18 y 14 meses en dicha pauta.
Dos pacientes han fallecido a lo largo del seguimiento, en ambos casos una vez fuera de la técnica incremental: uno de ellos tras recibir un trasplante renal y presentar complicaciones infecciosas tras varios meses, y el otro caso a los 17 meses de estar en TRS, tras llevar ya 7 meses en técnica de 3 HD/semana, a consecuencia de una hemorragia cerebral.
Los datos analíticos y los parámetros de diálisis se muestran en la tabla 2. La diuresis residual inicial media fue de 2.106 ± 606 ml al día, con descenso paulatino a lo largo del primer año; no obstante la media fue superior a un litro a los 12 meses, 1.545 ± 558 ml/día (p = 0,07). Fue concordante con el descenso asociado del aclaramiento de urea, basal de 5,7 ± 1,5 vs. 3,8 ± 1,9 ml/min a los 12 meses (p = 0,01) y el descenso de la FRR calculada (8,9 ± 2,4 basal vs. 6,9 ± 4,3 al año; p = 0,28). También pudimos observar que era paralelo al aumento del tiempo programado de cada sesión de HD (basal de 172 ± 26 min vs. 203 ± 24 min al año de seguimiento; p = 0,001) junto con aumento de la dosis de diálisis calculado por Kt/V Daugirdas y PRU (1,09 ± 0,25 y 66 ± 9,8 basal vs. 1,33 ± 0,28 y 68,5 ± 7,3 a los 12 meses; p = 0,03 y p = 0,23, respectivamente). Al inicio del estudio, 7 pacientes recibían diurético de asa (80-40 mg de furosemida); al año, 5 pacientes que mantenían diuresis residual recibían diurético asociado. El peso al inicio de la sesión de diálisis basal fue de 69,6 ± 17 kg, sin diferencias estadísticamente significativas respecto al peso medio a los 12 meses, 68,3 ± 18 kg (p = 0,096). Por otro lado la ganancia de peso media interdiálisis basal fue de 866 ± 308 ml y a los 12 meses de 1.313 ± 7 41 ml (p = 0,033), con un incremento significativo a lo largo del primer año. No observamos diferencias en los niveles de proteínas totales, pero sí un incremento significativo en la albúmina sérica a los 12 meses. El control de la tensión arterial fue semejante al basal ya los 12 meses, con una tensión arterial sistólica basal de 145 ± 12 mmHg vs. a los 12 meses de 151 ± 14 (p = 0,165) y una tensión arterial diastólica basal de 72 ± 13 vs. a los 12 meses de 67 ± 20 (p = 0,243). La hemoglobina media y el hematocrito fueron significativamente mejores al año, sin un incremento significativo de la dosis media de factores estimulantes eritropoyéticos (FEE), en nuestro caso darbepoetina (basal de 27 ± 21 y al año de 30 ± 22 mcg/semana; p = 0,725).
Tabla 2 Parámetros de diálisis y analíticos basales, a los 6 meses y al año de tratamiento renal sustitutivo
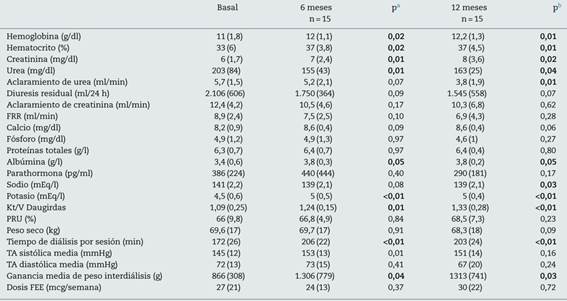
FEE: factores estimulantes eritropoyéticos; FRR: función renal residual calculada: (CCr + CUrea)/2; PRU: porcentaje de reducción de urea; TA: tensión arterial.
aComparación de control de 6 meses respecto al basal.
bComparación de control de 12 meses respecto al basal.
En negrita, significación estadística p ≤ 0,05.
Los niveles de fósforo sérico y PTH presentaron mejor control al año de seguimiento, sin alcanzar significación estadística.
Discusión
La pauta clásica de 3 HD/semana es la más extendida y aceptada en la mayoría de las guías clínicas. Pautas incrementales de 2 HD/semana en algunos países son consideradas subóptimas y en otros países son las únicas alcanzables por disponibilidad social y económica5,18,19. Preservar la diuresis residual es un objetivo firme en otras modalidades como la diálisis peritoneal, pero no es tan valorado en otras técnicas de TRS como la hemodiálisis2,3,20. Tanto los trabajos de Vilar et al. como el de Fernández-Lucas et al. han mostrado una mayor supervivencia en sus series en aquellos pacientes que empezaban en pauta incremental, 2 HD/semana, que mantenían una mayor diuresis residual que los pacientes que comenzaban con 3 HD/semana1,7. En nuestro caso, aunque no es posible establecer conclusiones de supervivencia por las limitaciones de una serie pequeña y por el tiempo de seguimiento, así como por el sesgo de selección de los pacientes, sin un grupo control, hemos podido constatar que dicha pauta permite una aceptable función renal residual, al menos hasta el primer año y que puede proporcionar algunos aspectos positivos en pacientes en TRS.
La FRR se ha asociado a una menor mortalidad en pacientes en HD, independientemente de otros factores de riesgo convencionales4,21. Por lo tanto, estrategias encaminadas a preservar la FRR, como la diálisis incremental, puede ser una opción a tener en cuenta al inicio de TRS. Lin et al., en su trabajo del 2009, observaron que los pacientes con volumen urinario suficiente que recibían 2 HD/semana mantenían unos adecuados parámetros de diálisis y preservaban más tiempo la FRR que los que recibían 3 HD/semana14. No obstante, todavía existen dudas sobre lo idoneidad de esta estrategia, especialmente si es a costa de otros potenciales riesgos como la sobrecarga de volumen o una teórica infradiálisis22,23. Aunque algunos autores plantean la necesidad de ensayos aleatorizados que comparen pautas, su desarrollo se antoja complejo y especialmente costoso para poder extraer conclusiones estadísticamente significativas5.
Desde el punto de vista de la forma de control de la pauta incremental, tampoco existe una homogeneidad en su aplicación. Nosotros nos basamos en una serie de criterios clínicos, haciendo especial hincapié en la sobrecarga de volumen mediante la exploración física y en los parámetros analíticos más aceptados como son el aclaramiento de urea y la diuresis residual1,7,24. El cuidado de esta práctica incremental puede permitir conservar la diuresis residual a la altura de otra técnica más conocida como conservadora de FRR como es la diálisis peritoneal, tal como demostró el grupo de Teruel et al.8. En su trabajo publicado en 2013, la FRR residual se mantenía de forma equiparable a los pacientes en diálisis peritoneal. Recientemente, Kalantar-Zadeh et al. han propuesto unos criterios clínicos y analíticos para pauta de 2 HD/semana, sustentados especialmente en el volumen urinario5. Aunque el control del volumen de la diuresis es un parámetro necesario, no es el único. Nosotros también tenemos en consideración otros parámetros como es el aclaramiento de urea, al igual que otros grupos8. A su vez, los parámetros convencionales de control de diálisis también son evaluados y aunque la estrategia es preservar la FRR, la presencia de parámetros límite para la técnica de 3 HD/semana puede explicar la tendencia a ir paulatinamente incrementando la dosis de diálisis, toda vez que disminuye la FRR, como se observa en nuestra serie. Algunos trabajos ponen en la balanza preservar la FRR frente a formas clásicas de medir las dosis de diálisis como aspecto que dilucidar en la estrategia incremental5,25. Aunque existen diversas formulaciones para calcular la dosis de diálisis incluyendo la diuresis residual, en nuestra unidad se establecieron parámetros convencionales de dosis de diálisis para asegurarla, aun a riesgo de anticipar un descenso de la FRR26.
En nuestra serie no se añadía de forma rutinaria furosemida a los pacientes que se iniciaban en pauta incremental, sobre todo si estaban polimedicados, salvo que la presentasen previamente, a diferencia de otras series7,27. Aunque sí puede ayudar a un mejor control del balance hídrico, otros trabajos han puesto de manifiesto que su uso no mejora la FRR28.
Otro aspecto que considerar actualmente es que las mejoras en la biocompatibilidad de las membranas, los líquidos ultrapuros y los avances técnicos en el control de las sesiones de diálisis permiten una diálisis con mejor tolerancia, que evita aquellos factores potencialmente deletéreos para la FRR13,29,30. McKane et al., en 2002, utilizando membranas de alto flujo y biocompatibles, conseguían una FRR mantenida igual que en el grupo tratado con diálisis peritoneal31. En nuestro caso todos los pacientes se dializaban con membranas de alta permeabilidad, con líquidos ultrapuros.
A su vez, la inestabilidad en la diálisis, así como los episodios de hipotensión, son factores que pueden acelerar la pérdida de FRR. En ese sentido se planteó una UF máxima por sesión siempre y cuando las condiciones del paciente lo permitiesen (ausencia de edemas y de otros datos de sobrecarga de volumen). Al no disponer de bioimpedancia y aunque existen sistemas automáticos incorporados a los monitores para la evaluación del volumen, establecimos que la persistencia de un excesivo mal control del peso «seco» era criterio de conversión a 3 HD/semana. Esa limitación nos pudo impedir alcanzar un ajuste del peso ideal más objetivo como se realiza en otras series y probablemente no nos permitió optimizar aún más la pauta incremental7.
Entre otros aspectos que considerar con la pauta incremental está el control de anemia. Pudimos observar un mejor control de las cifras de hemoglobina, si bien con dosis semejantes de FEE y no con menores necesidades, como otras series sí han mostrado7. A su vez, desde el punto de vista del metabolismo óseo-mineral, aunque observamos un mejor control del fósforo y de la PTH, este no fue significativo. Esto se acompañó de una reducción del peso «seco» medio de 1,3 kg de media a los 12 meses, sin ser significativo. No obstante, sí observamos una mejoría leve, pero significativa, de los niveles de albúmina, que se podría correlacionar con un mejor estado nutricional al preservarse la FRR, tal como otras series indican32.
Finalmente, en nuestra serie 5 pacientes recibieron un trasplante renal, 3 continuaban en pauta incremental en el momento del implante y los otros 2, aunque ya en pauta de 3 HD/semana, mantenían diuresis residual. Diversos trabajos han mostrado una mejor supervivencia en trasplante renal, relacionada con la diuresis residual, así como una menor tasa de complicaciones urológicas asociadas, por lo que preservar la FRR puede ser un aspecto favorable para el trasplante. En paciente candidatos a trasplante renal, la pauta incremental puede suponer una condición favorable33,34.
Limitaciones
Nuestro estudio presenta las limitaciones de ser retrospectivo, con un reducido número de pacientes, sin un grupo control. La evolución está sesgada por una selección de pacientes con un perfil de evolución favorable, por lo que condiciona la validez de nuestra experiencia respecto a la supervivencia con la población incluida en TRS en modalidad de 3 o más HD/semana.
A su vez existen aspectos que no se han podido evaluar por las características propias de la serie, tales como la eliminación de ß2-microglobulina o la evaluación más exacta del peso utilizando métodos como la bioimpedancia o sistemas de control automático. La imposibilidad de realizarla en nuestro medio y el no tener los datos de eliminación de medianas moléculas limitan algunos aspectos susceptibles de análisis. No obstante, la evolución de los pacientes, el establecer una práctica clínica y la experiencia descrita durante un periodo de 7 años puede ayudar a un mejor conocimiento de esta pauta.
En conclusión, la pauta incremental de 2 HD por semana puede mantener la diuresis residual, al menos en el primer año. La FRR puede ser un factor que ayude a una mejor supervivencia y potencialmente puede ser favorable en otros aspectos. Es probable que los criterios habituales del control de dosis de diálisis puedan no ajustarse a este tipo de pauta, pero ante la falta de otras evidencias deben ser considerados en el seguimiento. Este tipo de estrategia al inicio de TRS, que exige un seguimiento estrecho y cuidadoso, puede ser una opción válida en un grupo específico de pacientes.














