Introducción
La enfermedad cardiovascular (CV) es la principal causa de morbimortalidad en los pacientes con enfermedad renal1. La obesidad está estrechamente asociada con un aumento del riesgo de sufrir una enfermedad CV2. Se asocia con un proceso inflamatorio crónico de baja intensidad, ya que existe un aumento de los niveles circulantes de citocinas proinflamatorias y de proteínas de fase aguda.
La leptina es un modulador de la respuesta inmune que estimula la producción de citocinas proinflamatorias y provoca un aumento significativo de la actividad simpática3,4. La adiponectina es la adipocina que presenta una mayor expresión en el adipocito5,6. Su concentración plasmática disminuye en individuos con sobrepeso y obesidad7. Algunos estudios realizados con diferentes poblaciones han revelado que las concentraciones bajas de adiponectina pueden predecir de forma independiente el desarrollo futuro de resistencia a la insulina y otros han demostrado que la adiponectina posee propiedades antiaterogénicas y antiinflamatorias que pueden regular negativamente el proceso aterogénico8.
El factor de crecimiento de fibroblastos 21 (FGF-21) estimula la entrada de glucosa en el adipocito independientemente de la insulina, suprime la producción de glucosa hepática y está implicado en la regulación de la grasa corporal9. Además, se correlaciona directamente con el índice de masa corporal (IMC), los niveles de leptina, triglicéridos, insulina e índice HOMA-IR10. El FGF-21 se metaboliza principalmente por el riñón, por lo que la disminución de la función renal provocaría un aumento de sus niveles plasmáticos11. Además, la insuficiencia renal crónica es un estado de deficiencia de β-Klotho soluble (co-receptor del FGF-21), lo que conlleva un posible estado de resistencia, como sucede con el FGF-2312, cuyo impacto clínico no ha sido aún estudiado.
El aumento de la mortalidad CV de los pacientes en diálisis no está completamente explicado por los factores de riesgo «clásicos», por lo que, en los últimos años, han surgido numerosos factores «no clásicos». La grasa abdominal y, sobre todo, su ganancia a lo largo del tiempo, se ha consolidado como un factor de riesgo CV importante, especialmente en pacientes urémicos13.
La absorciometría dual de rayos X (DXA)14 es una técnica de referencia que permite valorar la composición corporal desde un punto de vista de 3compartimentos: masa grasa (MG), masa ósea (MO) y la masa magra (MM). Las exploraciones de cuerpo entero permiten realizar determinaciones regionales de MG15.
La escasa información disponible sobre la composición corporal en los pacientes urémicos y su influencia sobre la mortalidad CV nos animó a realizar este estudio piloto. Nuestro objetivo principal ha sido comprobar si existe una ganancia de grasa abdominal en los pacientes de hemodiálisis (HD) y estudiar sus posibles relaciones con los cambios en los niveles plasmáticos de adipocitocinas, lo que podría estar en relación con las alteraciones metabólicas inducidas por la actividad adipocitaria en la uremia. Como objetivo secundario, intentamos validar los datos obtenidos por bioimpedancia (BIA) con los obtenidos por la DXA (gold standard para la determinación de la composición corporal y técnica poco accesible en la práctica clínica diaria).
Pacientes y métodos
Diseño del estudio
Se realizó un estudio prospectivo de un año en el que se incluyó a 18 pacientes en HD. La población fue seleccionada entre los pacientes atendidos en el Servicio de Nefrología del Hospital Universitario La Paz. Los criterios de inclusión fueron los siguientes: pacientes mayores de 18 años, en tratamiento renal sustitutivo por un periodo superior a 3 meses e inferior a 5 años, sin deterioro de sus capacidades cognitivas y que firmaran el consentimiento informado. Los criterios de exclusión fueron: pacientes con neoplasia activa, o limitada esperanza de vida. La edad avanzada no constituyó por sí misma un criterio de exclusión. Se registraron datos demográficos y datos relativos al tratamiento renal sustitutivo, así como las comorbilidades o procesos intercurrentes. El período de reclutamiento de los pacientes fue de mayo del 2011 a marzo del 2013. Se diseñó un modelo de consentimiento informado que fue firmado por cada participante. Este estudio fue aprobado por el Comité Ético de Investigación Clínica del Hospital Universitario La Paz.
Las medidas antropométicas y de composición corporal, así como las muestras sanguíneas, fueron recogidas en ayunas en 2 ocasiones: en la visita inicial (entre 2011 y 2013) y 12 meses después.
El análisis bioquímico se realizó en el Servicio de Análisis Clínicos del Hospital Universitario La Paz. En ambas muestras se realizaron las siguientes determinaciones: glucemia, perfil lipídico (colesterol y triglicéridos), albúmina, insulina, índice HOMA-IR, ácidos grasos libres, proteína C reactiva (PCR), leptina, adiponectina, interleucina-6 (IL-6), factor de necrosis tumoral alfa (TNF-α) y FGF-21. Todas las determinaciones analíticas se extrajeron en ayunas: prediálisis en el turno de mañana en los pacientes en HD y coincidiendo con la realización de la cinética peritoneal en el caso de los de pacientes en diálisis peritoneal (DP).
Posteriormente se realizó una segunda parte, en la que se seleccionó un grupo control, compuesto por 17 pacientes en DP, procedentes del Servicio de Nefrología, que cumplían los mismos criterios que los pacientes en HD: se realizó un estudio transversal basal comparativo entre 29 pacientes en HD y los de DP. Este estudio sirvió para comparar los datos de composición corporal entre ambos grupos de pacientes y para realizar los estudios de concordancia entre los métodos de análisis de la composición corporal.
Antropometría y composición corporal
La obtención de las medidas antropométricas de los pacientes se ajustó a la técnica estándar y a la normativa internacional vigente recomendada (WHO, 1976). Estas medidas fueron realizadas con el sujeto descalzo y en ropa interior. Las medidas se tomaron siempre prediálisis en el caso de los pacientes en HD, y con el abdomen en vacío en los de DP. Para medir el peso se utilizó un analizador de la composición corporal (TANITA BC-420MA, Biológica Tecnología Médica S.L. Barcelona, España). La talla fue obtenida mediante un tallímetro de precisión milimétrica (rango: 80-200 cm). Para la medición de la circunferencia muscular del brazo (CMB) se utilizó una cinta métrica inextensible de precisión milimétrica (0,1 cm). El pliegue tricipital (PCT) se obtuvo mediante un plicómetro Holtain de 20 cm de amplitud y sensibilidad de 0,2 mm. A partir de las medidas antropométricas de peso y talla se calculó el índice de masa corporal (IMC) (peso [kg]/talla [m2]). La circunferencia de la cintura (Cci) se midió en cm, usando una cinta métrica de precisión milimétrica y dando la vuelta a la cintura en posición horizontal (nivel más estrecho del tronco, línea media entre la cresta ilíaca y la última costilla). La toma de la medida se hizo al final de una espiración normal.
La composición corporal se cuantificó usando tanto BIA como DXA. Para la determinación de la composición corporal por BIA se utilizó un impedanciómetro tetrapolar vectorial a 50 kHz, con una intensidad de 0,8 mA, modelo BIA101 de Akern Systems (Florencia, Italia). La medición se realizó siguiendo los criterios establecidos por el National Institute of Health Technology Assesment Conference Statement16. En el caso de que el paciente presentase acceso vascular para la realización de la diálisis, todas las mediciones se realizaron en el lado contralateral17. Como BIA multifrecuencia se empleó el monitor BCM (Body Composition Monitor, Fresenius Medical Care, Alemania), con un rango de emisión de frecuencias entre los 5 y los 1.000 kHz. La DXA fue realizada en el servicio de Medicina Nuclear del Hospital Universitario La Paz utilizando los region of interest (ROI) o área de interés recomendados por el fabricante del radiodensitómetro óseo con software enCore LUNAR 43616 ES (GE Healthcare, Buckinghamshire, Reino Unido) para las determinaciones regionales de MG (troncular, ginecoide y androide).
Procedimientos de laboratorio
Las muestras sanguíneas para la determinación del FGF-21 fueron recogidas en tubos de plasma heparina-litio y centrifugados a 3.500 rpm durante 10 min antes de su almacenaje a −40°C o a −80°C, hasta su análisis. El FGF-21 se cuantificó mediante un ensayo de tipo enzyme-linked immunosorbent sandwich assay (ELISA), según las instrucciones del fabricante (Merck-Millipore, Darmstadt, Alemania). La sensibilidad del ensayo fue 1,7 pg/ml y la precisión 5,7% intraensayo y 6,9% interensayo. El rango de normalidad esperado fue inferior a 200pg/ml. La leptina, IL-6, TNF-α y la adiponectina fueron cuantificadas mediante un inmunoanálisis multiplex (Milliplex®, Merck-Millipore, Darmstadt, Alemania). La sensibilidad para IL-6 fue de 1,4 pg/ml y su precisión intra- e interensayo del 7 y del 13%, respectivamente. La sensibilidad de la leptina fue 7,3 pg/ml y su precisión del 5 y del 11%, intra- e interensayo, respectivamente. Para el TNF-α, la sensibilidad fue de 0,4 pg/ml y la precisión de 8% intraensayo y del 7% interensayo. La determinación de los ácidos grasos libres se basó en un método enzimático colorimétrico in vitro (A25, Biosystems, Barcelona, España). Los valores esperados fueron 2,8-16,9 mg/dl para los hombres y 2,8-12,7 mg/dl para las mujeres. La precisión fue del 1,5%. La insulina se determinó por inmunoanálisis basado en quimioluminiscencia directa (Liaison, DiaSorin, Saluggia, Italia). Su sensibilidad fue 0,5μUI/ml, su precisión intraensayo del 3,9% y la interensayo del 4,3%. El índice HOMA-IR se calculó en los pacientes no diabéticos según la fórmula de Matthews18: HOMA-IR = glucosa (mmol/l) × insulina (μU/ml)/22,5.
Análisis estadístico
Los datos se expresan como media ± desviación típica (DT) para las variables continuas de distribución normal o como mediana y percentiles 25 y 75 para las variables de distribución no paramétrica, o como frecuencias absolutas y porcentajes en las variables cualitativas. Considerando el análisis basal de los datos, la comparación de las variables cualitativas entre 2 o más grupos se realizó a través del test de la Chi-cuadrado o test exacto de Fisher, dependiendo de la distribución de los datos. La comparación de variables cuantitativas entre 2 grupos se realizó a través del test de la U de Mann-Whitney o el test de la t de Student, dependiendo de la distribución de los datos. Se utilizó el test de Levene para comparar la variabilidad de la respuesta por grupo. Para analizar la asociación lineal basal de 2 variables continuas, se realizó el coeficiente de correlación de Spearman. Para la evaluación del grado de acuerdo existente entre 2 variables que evalúan un mismo concepto, se utilizaron las correlaciones bivariadas de Pearson.
Para el análisis longitudinal de los parámetros analíticos estudiados a partir de 2 puntos temporales (basal y al año), primero se realizó un análisis estratificado por modalidad e incidencia de la variable respuesta. Para ello se estimó el efecto de la modalidad, la incidencia o prevalencia y la interacción entre ambas, y se consideró el ajuste del modelo a partir de ecuaciones de estimación generalizada (GEE) para el caso de los datos longitudinales. Para analizar la posible asociación entre los diferentes parámetros analíticos estudiados y las variables independientes analizadas (parámetros antropométricos y de composición corporal estimados por BIA y DXA) se estimó el efecto a partir del Score Statistics For Type 3 GEE Analysis. Para analizar la asociación de las variables estratificadas para las que existía poco tamaño muestral, se utilizaron correlaciones de Spearman. El mismo estudio se realizó para el análisis del incremento (delta) o diferencia entre el valor final y basal, aunque en este caso el ajuste del modelo se realizó con un modelo lineal general.
Todas las pruebas estadísticas se consideraron bilaterales y, como valores significativos, aquellas p inferiores a 0,05. Los datos se analizaron con el programa estadístico SAS 9.3 (SAS Institute Inc., Cary, NC, EE. UU.).
Resultados
Hemodiálisis frente a diálisis peritoneal
Las principales características clínicas, analíticas y antropométricas basales de ambos grupos se muestran en la tabla 1. Los pacientes de HD presentaban un mayor PCT y una menor CMB que los de DP. No se objetivaron diferencias analíticas entre ambos grupos a excepción de una mayor albúmina y un menor colesterol en los pacientes de HD, a pesar de que estos pacientes llevaban más tiempo en diálisis que los de DP.
Tabla 1 Parámetros basales clínicos, bioquímicos, antropométricos y de composición corporal estudiados de la muestra global de 46 pacientes, estratificada según la modalidad de tratamiento renal sustitutivo

Los datos se muestras como media (DT) para las variables de distribución normal y la mediana (p25; p75) para las variables no paramétricas.
ACT: agua corporal total; AEC: agua extracelular; AGNE: ácidos grasos libres; AIC: agua intracelular; BIA: bioimpedancia; CB: circunferencia del brazo; Cci: circunferencia de la cintura; CMB: circunferencia muscular del brazo; Cociente A/G: cociente de grasa tejido androide/ginecoide; DM: diabetes; DXA: absorciometría dual de rayos X; FGF-21: factor de crecimiento fibroblástico 21; HOMA: Homeostasis Model Assessment; IL-6: interleucina 6; IMC: índice de masa corporal; PCR: proteína C reactiva; PCT: pliegue cutáneo tricipital; TG: triglicéridos; TNF-a: factor de necrosis tumoral α; NS: no significativo.
Los pacientes en HD presentaban un menor ángulo de fase y una mayor resistencia que los de DP. Además, tenían un mayor porcentaje de MG, menos masa muscular (MMusc) y MM. Respecto al porcentaje de agua corporal, los pacientes de HD presentaban un menor porcentaje de agua: eran estadísticamente significativas las diferencias en el agua corporal total (ACT), agua extracelular (AEC) e intracelular (AIC). Respecto a los parámetros de DXA, se objetivó un mayor porcentaje de grasa localizada en el tronco de los pacientes de HD comparados con los pacientes de DP.
Estudio longitudinal en hemodiálisis
En el estudio longitudinal realizado en los 18 pacientes en HD, se objetivó un incremento en la CB y la CMB (tabla 2). No se encontraron diferencias significativas en los parámetros analíticos, a excepción del colesterol. Se evidenció un aumento del ángulo de fase y del AIC, así como del cociente entre el porcentaje de grasa de distribución androide/ginecoide (A/G) medido por DXA (indicador de riesgo cardiovascular). También se evidenció un descenso del porcentaje de MMusc y del AEC.
Tabla 2 Parámetros bioquímicos, antropométricos, y de composición corporal estudiados en 18 pacientes de hemodiálisis, estratificados en la muestra basal y al año
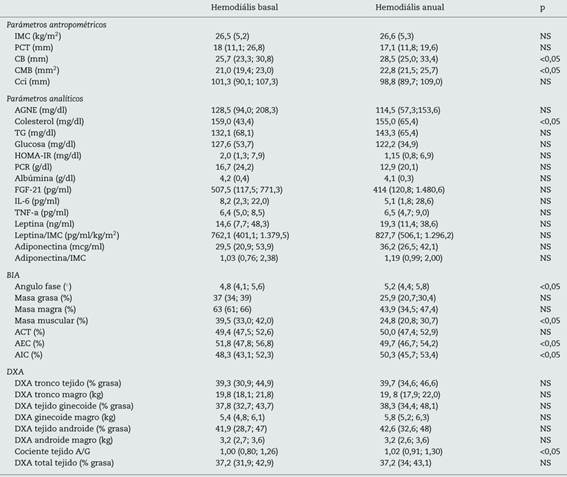
Los datos se muestras como media (DT) para las variables de distribución normal y la mediana (p25; p75) para las variables no paramétricas.
ACT: agua corporal total; AEC: agua extracelular; AGNE: ácidos grasos libres; AIC: agua intracelular; BIA: bioimpedancia; CB: circunferencia del brazo; Cci: circunferencia de la cintura; CMB: circunferencia muscular del brazo; cociente A/G: cociente de grasa tejido androide/ginecoide; DM: diabetes; DXA: absorciometría dual de rayos X; FGF-21: factor de crecimiento fibroblástico 21; HOMA: Homeostasis Model Assessment; IL-6: interleucina 6; IMC: índice de masa corporal; PCR: proteína C reactiva; PCT: pliegue cutáneo tricipital; TG: triglicéridos; TNF-a: factor de necrosis tumoral α; NS: no significativo.
Dado que el sexo influye sobre la composición corporal, en la tabla 3 se muestran los mismos datos, desglosados por sexo. En los varones se objetivó un aumento de la CMB al año. No se objetivaron cambios estadísticamente significativos en la composición corporal estimada por DXA, a excepción del incremento del cociente grasa A/G. En las mujeres no se hallaron diferencias significativas en los parámetros antropométricos, analíticos, ni de composición corporal medida por BIA. Aunque existió una tendencia al aumento de grasa en todos los parámetros estudiados (fig. 1), solo fue estadísticamente significativo el aumento del cociente grasa A/G.
Tabla 3 Parámetros demográficos, bioquímicos, antropométricos y de composición corporal estudiados en 18 pacientes de hemodiálisis, estratificados por sexo y seguidos durante un año
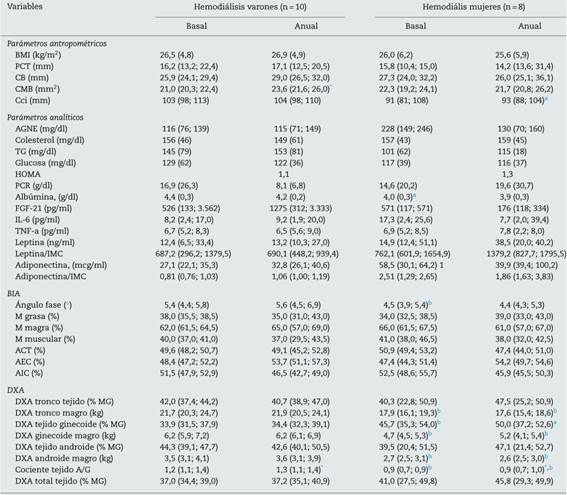
Los datos se muestras como media (DE) para las variables de distribución normal y la mediana (p25; p75) para las variables no paramétricas.
ACT: agua corporal total; AEC: agua extracelular; AGNE: ácidos grasos libres; AIC: agua intracelular; BIA: bioimpedancia; CB: circunferencia del brazo; Cci: circunferencia de la cintura; CMB: circunferencia muscular del brazo; cociente A/G: cociente grasa tejido androide/ginecoide; DM: diabetes; DXA: absorciometría dual de rayos X; FGF-21: factor de crecimiento fibroblástico 21; HOMA: Homeostasis Model Assessment; IL-6: interleucina 6; IMC: índice de masa corporal; PCR: proteína C reactiva; PCT: pliegue cutáneo tricipital; TG: triglicéridos; TNF-a: factor de necrosis tumoral α.
*p < 0,05.
ap < 0,05.
bp < 0,01 (vs. varones).

Figura 1 Evolución del porcentaje de masa grasa, estimada por DXA, a lo largo de un año en los 18 pacientes de HD. En el gráfico inferior, se representa la diferencia de dicho cambio (el incremento de MG se representa por encima del eje de ordenadas y el descenso, por debajo).
Cuando se compararon las diferencias basales entre hombres y mujeres, no se objetivaron diferencias significativas en los parámetros antropométricos ni analíticos, a excepción de los valores de albúmina y adiponectina (tabla 3). Se hallaron diferencias significativas en casi todos los parámetros de composición corporal medidos por BIA y en la mayoría de la DXA. Contrariamente a lo esperado, los varones presentaron un mayor porcentaje de MG respecto a las mujeres basalmente, no así al año de seguimiento debido a una tendencia a la ganancia de MG (sobre todo en las mujeres), que no fue significativa (fig. 2). Cuando se estudió mediante DXA, pudimos objetivar que las mujeres presentan un aumento estadísticamente significativo en el porcentaje de MG a todos los niveles (troncular, androide y ginecoide); sin embargo, cuando se consideró el cociente A/G, este fue mayor en los varones y, además, continuó aumentando durante el año de seguimiento (fig. 2).
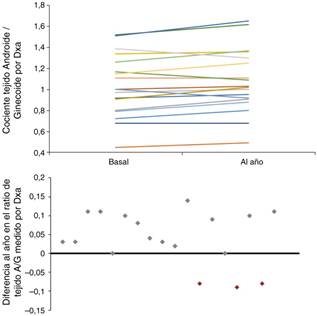
Figura 2 Evolución del cociente de masa grasa A/G en el tejido abdominal, estimada por DXA, a lo largo de un año en los 18 pacientes en HD. En el gráfico inferior, se representa la diferencia del de dicho cambio (el incremento del cociente A/G se representa por encima del eje de ordenadas y el descenso, por debajo).
No se encontraron diferencias significativas en los valores de leptina y adiponectina basales ni anuales entre hombres y mujeres, a pesar de que se objetivó una tendencia al incremento de la leptina en las mujeres y de la adiponectina en los hombres. Se encontró una relación estadísticamente significativa entre las concentraciones de leptina y adiponectina tanto con el porcentaje de masa grasa medida por BIA como con la grasa abdominal estimada mediante DXA (tabla 4). En los modelos estimados, se encontró una relación directa entre el porcentaje de MG (medida por BIA o DXA) y los niveles de leptina, así como una relación inversa entre el porcentaje de MG y los niveles de adiponectina. En ambos casos las relaciones fueron estadísticamente significativas.
Tabla 4 Estimación mediante un modelo de ecuación generalizada del efecto de la asociación entre los parámetros de composición corporal (medidos por bioimpedancia y absorciometría dual de rayos X), y las adipocitocinas estudiadas en 18 pacientes de hemodiálisis
| Variables | FGF-21 | IL-6 | Leptina | Adiponectina |
|---|---|---|---|---|
| BIA ángulo fase | 0,13 | 9,06* | 1,76 | −0,32 |
| BIA masa grasa | 0,14 | 1,92 | 10,80** | −0,59** |
| DXA tronco | −0,15 | 0,97 | 10,26** | −0,40* |
| DXA ginecoide | 0,08 | 0,14 | 6,29* | 0,03 |
| DXA androide | −0,17 | 1,12 | 10,20** | −0,50** |
| DXA total | −0,08 | 0,58 | 8,62** | −0,24 |
Mediante un modelo de ecuación de estimación generalizada, se analizó el efecto entre variables a partir del «Score Statistics For Type 3 GEE Analysis» (coeficiente β).
BIA: bioimpedancia; DXA: absorciometría dual de rayos X; FGF-21: factor de crecimiento fibroblástico 21; IL-6: interleucina 6.
*p < 0,05.
**p < 0,01.
Además, el incremento del cambio de estas adipocitocinas se correlacionó con el porcentaje de cambio de la MG (tabla 5). Se encontró una correlación estadísticamente significativa entre el cociente de grasa A/G y los niveles de leptina basales, así como una relación inversa, también estadísticamente significativa, entre el mencionado cociente y los niveles de adiponectina basal corregidos por el IMC. Esta correlación con la adiponectina corregida por el IMC se mantuvo al año de evolución, lo que no ocurrió con la leptina. No se objetivaron diferencias significativas en el estudio longitudinal en las concentraciones séricas de FGF-21, ni en la población global ni en los subgrupos según el sexo.
Tabla 5 Matriz de correlación entre la variación de los parámetros de composición corporal en un año, medidos por bioimpedancia y absorciometría dual de rayos X, en los 18 pacientes de hemodiálisis y el incremento en las adipocitocinas estudiadas
| ΔMG BIA | ΔDXA tronco total | ΔDXA Ginecoide | ΔDXA Androide | ΔCociente A/G | |
|---|---|---|---|---|---|
| Δ leptina | 0,92** | 0,32 | 0,61* | 0,85* | 0,38 |
| Δ leptina/IMC | 0,71** | 0,25 | 0,18 | 0,30 | 0,45 |
| Δ adiponectina | −0,72* | −0,36 | 0,27 | 0,27 | −0,58* |
| Δ FGF-21 | −0,18 | 0,29 | −0,32 | −0,49 | −0,01 |
| Δ IL-6 | 0,27 | −0,17 | 0,19 | 0,09 | 0,22 |
Las variables están expresadas como coeficientes de correlación para datos no paramétricos (rho de Spearman).
BIA: bioimpedancia; MG: masa grasa; cociente A/G: cociente tejido androide/ginecoide; DXA: absorciometría dual de rayos X; FGF-21: factor de crecimiento fibroblástico 21; IL-6: interleucina 6; IMC: índice de masa corporal; Δ: incremento o delta.
*p < 0,05.
**p < 0,01.
Con respecto al segundo objetivo de nuestro estudio, se encontró una correlación significativa entre los parámetros de masa grasa cuantificados por BIA y por DXA (tabla 6), lo que indica una buena concordancia entre ambos métodos de medida de la composición corporal.
Tabla 6 Evaluación del grado de concordancia existente (medida mediante correlaciones bivariadas de Pearson), entre la medición de la masa grasa, estimada por bioimpedancia de monofrecuencia y otras técnicas de composición corporal (bioimpedancia multifrecuencia y absorciometría dual de rayos X), en 29 pacientes de HD
| Variable | Global | Hombres | Mujeres |
|---|---|---|---|
| Bia multi-MG | 0,95 | 0,93 | 0,99 |
| DXA Tejido tronco total | 0,77 | 0,89 | 0,88 |
| DXA región tronco total | 0,77 | 0,9 | 0,88 |
| DXA tronco tejido | 0,85 | 0,9 | 0,88 |
| DXA región tronco | 0,85 | 0,9 | 0,88 |
| DXA tejido ginecoide | 0,58 | 0,82 | 0,86 |
| DXA región ginecoide | 0,58 | 0,82 | 0,87 |
| DXA tejido androide | 0,86 | 0,88 | 0,86 |
| DXA región androide | 0,86 | 0,89 | 0,87 |
Las variables están expresadas como coeficientes de correlación de Pearson, comparando las diferentes variables frente a masa grasa estimada por bioimpedancia vectorial. Todas las correlaciones son significativas (p < 0,001).
MG: masa grasa; HD: hemodiálisis.
Discusión
Los resultados del presente estudio muestran que se produce una ganancia de grasa en los pacientes en HD a lo largo del tiempo, incluso en periodos de seguimiento limitados, como un año. Además, esta ganancia es claramente de distribución abdominal, lo que aumenta el riesgo CV asociado al tiempo en diálisis de estos pacientes.
También pudimos comprobar que los cambios a lo largo del seguimiento en los parámetros de composición corporal (ganancias o pérdidas de MG) demostraron guardar una correlación con los cambios en las concentraciones de adipocitocinas analizadas en estos pacientes.
Solo existe un estudio que haya analizado los cambios de composición corporal en los pacientes de HD mediante DXA19. Se llevó a cabo en 72 pacientes japoneses incidentes en HD, a los que se les realizó una DXA en la visita basal y al cabo de un año, y en los que se objetivó un incremento medio de 118 ± 26 g/mes de masa grasa. Al contrario que en nuestro estudio, no encontraron diferencias por sexo y describen una correlación negativa con la albúmina y la MG basal.
Según los estudios realizados por Vague20 acerca de los patrones de distribución de la MG y su asociación con alteraciones metabólicas, la distribución androide, o de predominio abdominal, de la grasa corporal es la que tiene una mayor trascendencia desde el punto de vista clínico, dada su asociación con un aumento del riesgo CV. La proporción de grasa pélvica A/G es la relación entre el porcentaje de grasa de región androide y ginecoide. El exceso de grasa abdominal (androide) se asocia con la existencia de diversos factores de riesgo CV21. La determinación del cociente A/G mediante DXA es una herramienta simple y práctica para valorar la distribución de la grasa pélvica. Esta relación puede tener un papel para valorar el riesgo CV en los pacientes con exceso de peso15,22.
El medio urémico contribuye a la retención de las adipocitocinas, la inflamación sistémica y al estrés oxidativo y la resistencia a la insulina23,24. Datos experimentales indican que la uremia induce una lipogénesis disminuida y un aumento de la lipólisis, lo que promovería la redistribución de la grasa corporal. Nuestros resultados muestran un aumento estadísticamente significativo de los niveles plasmáticos de leptina y una disminución de los de adiponectina, incluso tras ajustar sus niveles por el IMC en los pacientes de HD. Cabe resaltar especialmente los elevados niveles de adiponectina detectados en nuestros pacientes, que algunos estudios relacionan con un incremento de la mortalidad25. En su estudio, Rhee et al. demostraron en 501 pacientes en HD que niveles de adiponectina superiores a 30 mcg/ml se asociaba a 3 veces mayor riesgo de mortalidad por cualquier causa26.
Un objetivo secundario de nuestro estudio era validar los datos obtenidos por BIA (técnica usada habitualmente en la práctica clínica) con los obtenidos por la DXA (gold standard para el estudio de la composición corporal). Nuestros datos señalan la existencia de una buena correlación entre los parámetros de composición corporal (porcentaje de masa grasa) obtenidos entre ambas técnicas.
La BIA estudia el estado nutricional y de hidratación de los pacientes en HD, permitiendo así ajustar el volumen de ultrafiltración y conocer la MMusc o MG. En los últimos años, se ha demostrado la relación de la MM y sus modificaciones con la supervivencia de los pacientes en HD27. Está descrita en la literatura la relación que existe entre el ángulo de fase medido por BIA y la supervivencia, aunque no está claro si está relación está ligada al estado nutricional. Algunos autores han demostrado que los pacientes con los ángulos de fase más bajos presentan una mayor mortalidad, independientemente de otros factores28,29. Según el estudio realizado por Di Gioia30, un ángulo mayor de 4,85° en HD parece ser un indicador de buen pronóstico en estos pacientes.
La absorciometría dual de rayos X (DXA)15 es una técnica que permite determinar el contenido de grasa corporal a través de la emisión de bajas dosis de radiación, basándose en la diferencia de atenuación de 2 niveles de energía por el hueso, la grasa y los tejidos blandos. Es una técnica de referencia, ya que las exploraciones de cuerpo entero permiten realizar determinaciones regionales de MG16. Se dispone de software asociado a los equipos que permiten seleccionar la región a estudio mediante la colocación de los denominados ROI. Como técnica de estudio de composición corporal, la DXA es útil para estimar la grasa troncular y abdominal, pero no permite valorar con precisión los compartimentos grasos subcutáneo e intraabdominal visceral y perivisceral.
Existen escasos estudios publicados que comparen la BIA y DXA en pacientes en diálisis. Formica et al.31 realizaron en 1993 el primer estudio con 42 pacientes en diálisis, para el desarrollo de ecuaciones para la estimación de la MM y MG por BIA. Otro estudio es el de Donadio32, que comparó la concordancia en las diferentes mediciones de la composición corporal mediante BIA y DXA en 27 pacientes italianos en HD. En cambio, Abrahamsen33 sí encontró diferencias entre la valoración de la composición corporal por DXA o BIA; en su estudio realizado en 19 pacientes en HD la DXA demostró una mayor exactitud en la estimación de la MM. No es posible comparar adecuadamente los resultados obtenidos en este estudio con los nuestros debido a la diferencia en las unidades de medida, aunque los pacientes en el estudio de Abrahamsen parecían presentar menores porcentajes de MG que los obtenidos en nuestro caso. Hasta donde podemos asegurar, este es el primer estudio de estas características realizado en población española en diálisis.
El tamaño muestral reducido y la dificultad para la medición de algunos parámetros son las principales limitaciones de nuestro estudio. Tampoco se tuvieron en cuenta los ingresos, ni se valoró la repercusión de la técnica dialítica ni sus dosis, aunque todos los pacientes tenían una dosis de diálisis adecuada. En el estudio longitudinal, solo se analizó a los pacientes que tenían todas las medidas antropométricas registradas, tanto basales como a los 12 meses. Debido a estas limitaciones, nuestros resultados deben interpretarse con precaución. Por otro lado, hemos podido demostrar una ganancia de grasa abdominal en los pacientes de HD (con el aumento del riesgo CV asociado que ello conlleva) y su asociación estadísticamente significativa con los cambios en los niveles plasmáticos de adipocitocinas.
En conclusión, existe una ganancia de grasa en general, y de localización abdominal en particular, según aumenta la permanencia de los pacientes en diálisis lo que podría explicar, en parte, el aumento del riesgo CV que presentan los pacientes con insuficiencia renal; el cociente A/G es el parámetro más sensible para estimar dicho riesgo. Existe, además, una buena correlación entre los diferentes métodos de valoración de composición corporal (BIA y DXA).














