Introducción
La enfermedad renal crónica (ERC) se asocia con una elevada mortalidad, especialmente la relacionada con enfermedad cardiovascular. Sin embargo, en estos pacientes resulta paradójica la escasa asociación entre mortalidad y factores clásicos de riesgo cardiovascular. Tan solo algunos marcadores relacionados con la inflamación o la nutrición (por ejemplo la proteína C reactiva y la albúmina sérica) han demostrado ser predictores consistentes de mortalidad en la ERC1.
En los últimos años algunos estudios de observación han demostrado una asociación entre concentraciones séricas elevadas de fosfatasa alcalina total (FA) y mortalidad en pacientes con ERC2-5, aunque se desconoce hasta el momento el significado biológico y clínico de este hallazgo.
La gamma-glutamil transferasa (GGT) es una enzima presente en el suero y en la superficie externa de las células de diferentes órganos como el hígado, páncreas, intestino, pulmones y riñones6. La GGT sérica no solo representa un marcador tradicional de consumo de alcohol o de enfermedades hepatobiliares, sino que, además, en diferentes estudios se ha demostrado una asociación entre niveles séricos elevados de GGT y enfermedad cardiovascular, diabetes mellitus, hipertensión arterial o síndrome metabólico7.
Los niveles de GGT son predictores de mortalidad en la población general y, de hecho, esta enzima ha sido incluida recientemente en un índice de mortalidad basado solo en parámetros bioquímicos8. Además, los niveles séricos de GGT podrían ayudar a interpretar elevaciones de la FA de origen poco claro.
Existen muy pocos estudios que hayan analizado el significado clínico y pronóstico de la GGT sérica en la ERC9,10. Así, el objetivo de este estudio fue investigar las características clínicas de los pacientes con ERC y elevación anormal de los niveles de GGT sérica, su interacción con la FA, así como determinar el valor de este parámetro como predictor de mortalidad.
Material y métodos
Se ha realizado un estudio retrospectivo y de observación, en una cohorte de pacientes adultos seguidos en la consulta de enfermedad renal crónica avanzada del Servicio de Nefrología del Hospital Infanta Cristina de Badajoz, desde enero de 2002 hasta octubre de 2013. Se incluyó a todos los pacientes con edad > 18 años y filtrado glomerular estimado (eGFR) < 30 ml/min/1,73 m2 en situación prediálisis. No se incluyó a ningún paciente con ERC por disfunción de un trasplante renal.
Los datos demográficos y los parámetros clínicos como la edad, sexo, índice de masa corporal, comorbilidades y medicación fueron recogidos en el momento de la inclusión.
La comorbilidad fue evaluada mediante el índice de Davies11 y los pacientes fueron categorizados según la agregación de las distintas comorbilidades: sin comorbilidad, leve-moderada (uno o 2 procesos comórbidos), o severa (3 o más procesos comórbidos). Las principales comorbilidades recogidas fueron: diabetes mellitus, insuficiencia cardiaca, enfermedad coronaria, enfermedad cerebrovascular o vasculopatía periférica, enfermedad pulmonar obstructiva crónica, enfermedad oncológica y procesos inflamatorios crónicos.
En este estudio, el término hepatopatía no solo incluyó a pacientes con diagnóstico de hepatopatías crónicas, cirrosis o trasplante hepático, sino también a pacientes con enolismo activo, o infección activa por virus hepatotropos (B o C). La esteatohepatitis no alcohólica (esteatosis hepática) fue un hallazgo ecográfico frecuente en estos pacientes, aunque esta enfermedad no fue incluida en la lista de hepatopatías.
Los pacientes fueron seguidos de forma regular desde el momento de la inclusión en el estudio hasta su fallecimiento, trasplante renal, pérdida de seguimiento o fin del periodo de recogida de datos evolutivos (31 de diciembre de 2014).
Dado el diseño retrospectivo del estudio, no fue preciso el consentimiento informado individual de cada paciente.
Mediciones bioquímicas
Desde enero de 2002, la GGT sérica y la FA total fueron añadidas al perfil bioquímico rutinario de los pacientes seguidos en nuestra consulta de enfermedad renal crónica avanzada.
Los niveles de GGT se determinaron mediante un analizador automatizado (Advia Chemistry, Siemens Healthcare Diagnostics, New York, EE.UU.), usando el método cinético colorimétrico con gamma-glutamil-3-carboxil 4-nitroanilina y glicilglicina. El coeficiente de variación fue inferior al 4,5%, y el rango de normalidad fue 0-36 U/l.
Los niveles de FA sérica también fueron medidos con un autoanalizador (Advia Chemistry), usando el método ALPI, que emplea fosfatasa alcalina que cataliza la transfosforilación de p-nitrofenilfosfato a p-nitrofenol en presencia de 2-amino-2-metil-l-propanol. El coeficiente de variación fue inferior al 4%, y el rango de referencia fue 45-120 U/l.
Para caracterizar a los pacientes con elevación anormal de GGT o FA sérica, los parámetros hematológicos y bioquímicos basales (mostrados en la tabla 1) también fueron incluidos en el estudio. Los parámetros bioquímicos fueron determinados por métodos de laboratorio convencionales (Advia Chemistry, New York, EE.UU.). Los niveles de PTH (molécula 7-84) fueron determinados mediante inmunoanálisis quimioluminiscente automatizado (DiaSorin, Italia), las concentraciones séricas de albúmina mediante el método de bromocresol verde, y la proteína C reactiva de alta sensibilidad mediante análisis enzimoinmunométrico por quimioluminiscencia en fase sólida (autoanalizador Immulite, Diagnostic Product Corporation, New York, EE.UU.).
Tabla 1 Características clínicas y bioquímicas del conjunto de pacientes y de los subgrupos según los valores anormalmente elevados de GGT o fosfatasa alcalina (FA)

Los datos se presentan como media (desviación estándar), salvo que se especifique lo contrario.
*ANOVA o χ2 entre grupos.
ap < 0,05 GGT-FA elevados vs. GGT-FA normal o FA elevada, prueba de Scheffé.
bp < 0,05 GGT elevado vs. GGT-FA normal, prueba de Scheffé.
cp < 0,0001 FA elevada vs. cada uno de los otros subgrupos, prueba de Scheffé.
dp < 0,0001 GGT elevado o GGT-FA elevados vs. GGT-FA normal o FA elevada, prueba de Scheffé.
ep < 0,0001 FA elevada o GGT-FA elevados vs. GGT-FA normal o GGT elevado, prueba de Scheffé.
fp < 0,001 GGT elevado o GGT-FA elevados vs. GGT-FA normal o FA elevada, prueba de Scheffé.
gDatos disponibles en 845 pacientes.
La fórmula de MDRD-4 fue empleada para estimar el filtrado glomerular (eGFR)12.
La ferritina sérica fue el único parámetro con valores perdidos. La media de los valores disponibles se incluyó en el análisis descriptivo, pero los valores perdidos no fueron imputados, y esta variable no fue incluida como covariable en el análisis de supervivencia.
Variable resultado
La variable resultado fue la muerte por cualquier causa. Todas las causas de fallecimiento fueron clasificadas en 5 grupos: muerte súbita, cardiovascular, infecciosa, malignidad y otras causas.
Análisis estadístico
Para la comparación descriptiva de las variables continuas y dependiendo de sus características se emplearon los test paramétricos o no paramétricos, y para las variables categóricas se utilizó la prueba chi-cuadrado. Para el análisis de correlación bivariada se utilizó el test de Pearson.
Para analizar las diferencias en la supervivencia entre pacientes de acuerdo con los cuartiles de GGT o FA se emplearon las curvas de Kaplan-Meier, y se compararon con el test del rango logarítmico de Mantel-Haenszel.
Para analizar la influencia de los valores basales de GGT y FA sobre la mortalidad se emplearon modelos multivariantes de riesgo proporcional de Cox.
Dado que las cifras basales de GGT y FA presentaban una distribución con sesgo positivo, los valores se transformaron en logaritmo para su inclusión como variable continua.
Para tener en cuenta los diferentes periodos de reclutamiento, los modelos multivariantes también fueron ajustados de acuerdo con una variable categórica correspondiente a los periodos de reclutamiento (2002-2005, 2006-2009, 2010-2014).
La GGT y FA se analizaron como variables continuas (transformación logarítmica) y como variables categóricas: cuartil superior y valores anormalmente elevados (GGT > 36 UI/l y FA > 120 UI/l).
Se incluyeron los siguientes modelos de regresión: 1) Univariable. 2). Ajustado a edad, sexo, índice de comorbilidad, diabetes, hepatopatía, tabaquismo activo, índice de masa corporal, eGFR basal y periodo de reclutamiento. 3) Ajustado a las mismas variables que en el modelo 2 más el calcio sérico total, fósforo, PTH, albúmina, proteína C reactiva, triglicéridos, ácido úrico, y niveles de transaminasa glutámico-pirúvica (GPT). 4) Mejor modelo ajustado mediante el proceso de eliminación progresiva condicional hacia atrás.
La hipótesis de proporcionalidad de riesgos fue evaluada mediante curvas log menos log y los residuos de Schöenfeld para cada variable. Los pacientes fueron censurados en el momento del fallecimiento, la pérdida del seguimiento, el trasplante renal, o final del seguimiento (31 de diciembre de 2014), lo que ocurriera antes.
Los datos descriptivos se presentan como media y desviación estándar, o mediana y rango intercuartílico para variables continuas, y valores absolutos y porcentajes para variables categóricas. Un valor de p < 0,05 fue considerado como estadísticamente significativo. El análisis estadístico y los gráficos se realizaron con el programa SPSS versión 21.0 (IBM Corp. Armonk, NY, EE. UU.), y STATA 11.1 (StataCorp, Texas, EE. UU.).
Resultados
Características de los pacientes
El grupo de estudio incluyó a 909 pacientes con ERC en estadios 4 o 5 prediálisis (eGFR medio 14,7 ± 5,1 ml/min/1,73 m2). La edad media (±DE) fue 65 ± 15 años, y el 53% de los pacientes eran varones. Todos eran caucásicos. Las características clínicas y bioquímicas basales se muestran en la tabla 1.
Para analizar las características clínicas y bioquímicas de los pacientes de acuerdo con la presencia de niveles anormalmente elevados de GGT o FA, se dividieron en 4subgrupos (tabla 1): con niveles normales de GGT y FA (66% de los pacientes), con elevación de GGT pero FA normal (16%), con niveles normales de GGT pero elevación de FA (11%), y con elevación simultánea de GGT y FA (7%).
Así, los pacientes con elevación anormal de GGT o FA basal fueron 209 (23%) y 172 (19%), respectivamente. El valor del cuartil superior para la GGT y FA fue 34 UI/l y 112 UI/l, respectivamente.
No hubo diferencias significativas en la edad media y la distribución de sexos entre los subgrupos. El grado de comorbilidad y el porcentaje de fumadores activos fue notablemente superior en los pacientes con elevación de GGT, especialmente en el grupo con elevación simultánea de GGT y FA (tabla 1).
Las hepatopatías fueron comorbilidades infrecuentes en el conjunto de pacientes. Sin embargo, aproximadamente un 8% de los pacientes con niveles elevados de GGT habían sido diagnosticados de enfermedades hepáticas.
La prevalencia de enfermedades cardiovasculares en los pacientes con elevación aislada de GGT o FA fue similar a la de los pacientes con valores normales de GGT y FA, aunque esta prevalencia aumentó de manera significativa en pacientes con elevación simultánea de GGT y FA.
Se observaron diferencias significativas en los parámetros bioquímicos entre subgrupos (tabla 1). Los pacientes con elevación de GGT tenían concentraciones séricas más altas de ácido úrico, triglicéridos, GPT, ferritina y proteína C reactiva que los pacientes con niveles normales de GGT y FA, o elevación aislada de FA. El subgrupo de pacientes con elevación aislada de FA presentaba los niveles más elevados de PTH. Los valores medios basales de albúmina fueron similares entre subgrupos.
Estos patrones bioquímicos asociados con GGT o FA fueron confirmados mediante análisis de correlación bivariada (tabla 2).
Tabla 2 Coeficientes de correlación entre parámetros bioquímicos
| GGT log.a | FA log.b | Hemoglobina | Úrico | Triglicéridos | GPT | Fósforo | Calcio | Ferritina | Albumina | PTH | Proteína C Reactiva | eGFR | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GGT log.a | |||||||||||||
| FA log.b | 0,337** | ||||||||||||
| Hemoglobina | −0,001 | 0,029 | |||||||||||
| Úrico | 0,162** | 0,051 | 0,068* | ||||||||||
| Triglicéridos | 0,164** | 0,011 | 0,063 | 0,083* | |||||||||
| GPT | 0,387** | 0,107** | 0,002 | 0,093** | 0,043 | ||||||||
| Fósforo | −0,013 | 0,024 | −0,092* | 0,075* | 0,020 | 0,026 | |||||||
| Calcio | 0,019 | −0,105** | 0,161** | 0,034 | 0,127** | 0,014 | −0,178** | ||||||
| Ferritina | 0,244** | 0,050 | −0,149** | 0,054 | 0,059 | 0,195** | −0,037 | −0,043 | |||||
| Albúmina | −0,072* | −0,074* | 0,208** | −0,004 | 0,029 | 0,009 | −0,097** | 0,317** | −0,112** | ||||
| PTH | −0,055 | 0,296** | −0,060 | 0,066* | −0,025 | −0,042 | 0,244** | −0,168** | −0,100** | 0,072* | |||
| Proteína C reactiva | 0,197** | 0,088** | −0,190** | 0,076* | 0,005 | 0,021 | −0,048 | −0,055 | 0,238** | −0,233** | −0,077* | ||
| eGFR | 0,080* | −0,028 | 0,163** | 0,008 | −0,015 | 0,003 | −0,555** | 0,136** | 0,044 | 0,012 | −0,268** | 0,054 | |
| Proteinuria | 0,098* | 0,131** | −0,055 | −0,081* | 0,161** | 0,077* | 0,207** | −0,250** | 0,005 | −0,534** | 0,065 | 0,005 | −0,158** |
*p < 0,05.
**p < 0,01.
aGamma glutamiltransferasa transformada en logaritmo.
bFosfatasa alcalina transformada en logaritmo.
Mortalidad y otros eventos de interés
Durante el periodo de estudio fallecieron 365 pacientes (40%), con una mediana de supervivencia del conjunto de pacientes de 74 meses (tabla 3). Como cabría esperar, las causas de mortalidad más frecuentes fueron las cardiovasculares e infecciosas, pero sin observarse diferencias significativas entre subgrupos (tabla 3).
Tabla 3 Mortalidad y otras variables resultado de interés en el grupo total y en subgrupos según GGT y fosfatasa alcalina (FA)

Durante el periodo de seguimiento, un 58% de los pacientes tuvo que iniciar diálisis, y un 15% recibió un trasplante renal (no hubo ningún trasplante anticipado). Tampoco se observaron diferencias entre subgrupos en el porcentaje de pacientes que iniciaron diálisis, que se trasplantaron, o de los que se perdió el seguimiento (tabla 3).
Gamma-glutamil transferasa y fosfatasa alcalina como determinantes de supervivencia
La figura 1 y figura 2 muestran las curvas de supervivencia de Kaplan-Meier según los cuartiles de la distribución de frecuencias de los valores de GGT y FA, respectivamente. Los pacientes con niveles elevados de GGT o FA (cuartiles superiores) mostraron una peor supervivencia.
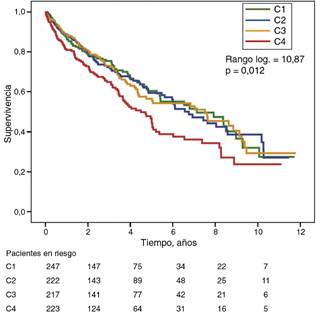
Figura 1 Curvas de supervivencia de Kaplan-Meier según cuartiles de distribución de frecuencias de los niveles de GGT sérica. (C = cuartiles).

Figura 2 Curvas de supervivencia de Kaplan-Meier según cuartiles de distribución de frecuencias de los niveles de fosfatasa alcalina sérica. (C = cuartiles).
Mediante modelos de regresión de Cox, la GGT como variable continua o categórica (cuartil superior o valor sérico >36 UI/l) se asoció significativamente con un aumento de mortalidad en los modelos analizados (tabla 4). La FA también se asoció de forma significativa e independiente con un aumento de mortalidad en todos los modelos analizados, excepto cuando la FA se incluyó en el mejor modelo como variable categórica definida como el valor del cuartil superior. En este modelo, el grado de asociación de la FA con mortalidad no alcanzó la significación estadística (p = 0,05) (tabla 4).
Tabla 4 Modelos de regresión de Cox de asociación con la mortalidad

aAjustado a edad, sexo, índice comorbilidad, diabetes, tabaco, hepatopatía, IMC, eGFR, y periodos del estudio.
bAjustado a todas las covariables del modelo 1 más calcio, fósforo, PTH, úrico, triglicéridos, GPT, albúmina y proteína C reactiva.
cMejor modelo que incluye todas las variables del modelo 1 y 2 más GGT o FA, con proceso automático de selección de variables.
La razón de riesgos instantáneos (HR) de mortalidad en los pacientes con niveles elevados de GGT (>36 UI/l) (HR = 1,39) fue similar a la observada en pacientes con elevación de FA (>120 UI/l) (HR = 1,31) en el modelo ajustado (tabla 4). La figura 3 muestra las curvas de supervivencia de Kaplan-Meier que ilustran esta asociación, y el efecto aditivo sobre una peor supervivencia de una elevación simultánea de GGT y FA.
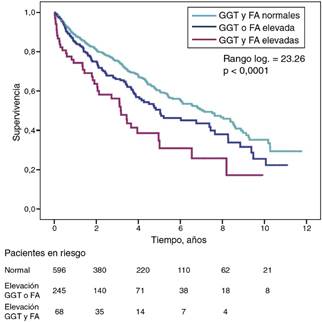
Figura 3 Curvas de supervivencia de Kaplan-Meier en pacientes estudiados según niveles de GGT y FA alcalina normales, GGT o FA anormalmente elevada (una u otra), y GGT y FA anormalmente elevada de forma simultánea.
Para evaluar el posible efecto de confusión de la comorbilidad hepática en la asociación entre GGT y FA con la mortalidad, se realizó un modelo de regresión de Cox excluyendo a 27 pacientes con diagnóstico previo de hepatopatía. En este modelo ajustado, la elevación de GGT (>36 UI/l) mantuvo una asociación estadísticamente significativa con la mortalidad (HR = 1,316; IC 95%: 1,016-1,705; p = 0,03), mientras que la elevación de la FA (>120 UI/l) mostró una asociación en el límite de la significación estadística (HR = 1,296; IC 95%: 0,999-1,680; p = 0,05).
Discusión
Los resultados de este estudio muestran que la elevación de la GGT o FA séricas se asocia de forma independiente con una mayor mortalidad en pacientes con ERC. Además, este estudio revela por primera vez que la elevación simultánea de ambos parámetros tiene un efecto aditivo en la predicción de mortalidad, incluso en pacientes sin hepatopatías.
En este estudio, los pacientes con ERC y elevación de las cifras de GGT tenían mayor comorbilidad, especialmente diabetes e insuficiencia cardiaca, y un perfil bioquímico similar al observado en el síndrome metabólico, aunque no se observaron diferencias en el índice de masa corporal en este subgrupo de pacientes.
Dado el carácter ubicuo de la FA en el organismo, la elevación de los niveles séricos de esta enzima puede ser expresión de diferentes procesos patológicos. En este sentido, la determinación de isoenzimas específicas de la FA puede ser de utilidad para discriminar su origen en los casos en los que elevaciones aisladas no pueden ser atribuidas a alto remodelado óseo.
El exceso de mortalidad descrito en pacientes con ERC y cifras elevadas de FA ha sido atribuido de manera controvertida a los potenciales efectos adversos cardiovasculares de un descontrol severo del metabolismo óseo-mineral2,3,13,14. Se han planteado diferentes mecanismos patogénicos para explicar esta asociación, incluyendo un aumento de la calcificación vascular a través de la hidrólisis del pirofosfato en la pared arterial15, la inflamación sistémica16,17, o el déficit de vitamina D18. Sin embargo, la ausencia de asociación significativa entre los niveles séricos de la isoenzima de la FA derivada del hueso (FA óseo-específica) y la mortalidad en pacientes con ERC19 plantea serias dudas sobre la hipótesis de un vínculo patogénico con el metabolismo óseo-mineral.
En el presente estudio, un 11% de los pacientes presentaron niveles elevados de FA con cifras normales de GGT, y la principal característica de este subgrupo fue las cifras medias más elevadas de PTH, lo que indica que el hueso podría ser el origen de esta elevación de FA. Sin embargo, la elevación simultánea de FA y GGT caracterizó a un subgrupo de pacientes con mayor grado de comorbilidad, principalmente enfermedades cardiovasculares, y un perfil bioquímico más parecido al de los pacientes con elevación aislada de GGT que al de los pacientes con elevación aislada de FA. De este modo, se podrían diferenciar 2perfiles de riesgo en pacientes con ERC y elevación de FA de acuerdo con la presencia o ausencia de cifras elevadas de GGT. Mientras que la elevación aislada de FA se asoció a riesgo de mortalidad moderado, la elevación simultánea de ambas enzimas se asoció a un riesgo de mortalidad más elevado.
La GGT es la enzima responsable de la hidrólisis del glutatión reducido extracelular (GSH), uno de los principales antioxidantes intracelulares de los mamíferos, que permite que los aminoácidos precursores sean usados posteriormente para nueva síntesis de GSH intracelular6. Así, el incremento de la GGT sería una expresión de la depleción intracelular de GSH y, por tanto, la GGT se podría considerar como un marcador de estrés oxidativo6.
La GGT sérica ha demostrado ser un biomarcador cardiometabólico en la población general. Diferentes estudios han encontrado una asociación significativa e independiente entre los niveles de GGT y la mortalidad tanto cardiovascular como por cualquier causa20-22. Cifras elevadas de GGT han demostrado estar asociadas a un peor pronóstico en la enfermedad coronaria y en la insuficiencia cardiaca23,24. Además, se ha observado una posible implicación patogénica de la GGT en la formación de la placa de ateroma, su erosión y posterior rotura25, lo que ayudaría a explicar desde un punto de vista biológico su relación con la morbimortalidad cardiovascular.
El valor predictivo de la GGT en pacientes con ERC apenas ha sido estudiado. Postorino et al.9 observaron una asociación fuerte e independiente entre niveles elevados de GGT y mortalidad total y cardiovascular en 584 pacientes con ERC en diálisis. Sin embargo, en este estudio no se determinaron las concentraciones séricas de FA.
En otro estudio, los niveles elevados de GGT se asociaron a una marcada disfunción endotelial en pacientes con ERC, lo que señala un vínculo entre la elevación de esta enzima y el riesgo de enfermedad cardiovascular10.
Además del posible efecto prooxidativo sistémico, otras hipótesis podrían ayudar a explicar la asociación entre cifras elevadas de GGT y mortalidad en pacientes con ERC. Así, la elevación de la GGT podría simplemente indicar abuso de alcohol o enfermedades hepáticas, comorbilidades que justificarían el exceso de mortalidad. Sin embargo, en este estudio la GGT mantuvo una asociación significativa con la mortalidad tras la exclusión de pacientes con alcoholismo crónico, hepatopatías crónicas o infecciones por virus hepatotropos, descartando así el papel exclusivo de la enfermedad hepática en esta asociación.
No obstante, la esteatosis hepática y la hepatopatía congestiva son 2 alteraciones hepáticas subclínicas que pueden provocar elevaciones de GGT26,27. La esteatosis hepática es un hallazgo relativamente frecuente en pacientes con ERC, más relacionado con factores de riesgo cardiovascular que con el desarrollo de complicaciones hepáticas27. Las características clínicas y bioquímicas asociadas a la esteatosis hepática son similares a las observadas en el subgrupo de pacientes de nuestro estudio con elevación de GGT. Sin embargo, en este trabajo el diagnóstico de esteatosis hepática no fue adecuadamente estudiado en la mayoría de los pacientes y, por tanto, no se puede asegurar que la elevación de GGT fuera debida principalmente a esta dolencia.
La hepatopatía congestiva hace referencia a un espectro de alteraciones hepáticas atribuidas a la congestión pasiva secundaria a insuficiencia cardiaca derecha o a cualquier causa que aumente la presión venosa central, incluyendo la sobrecarga de volumen, hipertensión pulmonar severa o valvulopatías28. La elevación de GGT o FA séricas son alteraciones bioquímicas características en pacientes con ERC con disfunción diastólica del ventrículo izquierdo, especialmente si se asocian a congestión pulmonar29, que al mismo tiempo es un reconocido factor de riesgo de mortalidad en estos pacientes30.
Por otra parte, la elevación de GGT también podría reflejar una inducción enzimática microsomal31. Además de la ingesta de alcohol, un gran número de fármacos pueden producir inducción de enzimas hepáticas. En el presente estudio, ninguno de los fármacos más frecuentemente prescritos en pacientes con ERC se asociaron significativamente con cifras elevadas de GGT o FA, aunque no se puede descartar la influencia potencial de medicamentos de dispensación sin receta (como los analgésicos) en la elevación de los niveles de GGT en nuestros pacientes.
Este estudio tiene una serie de limitaciones. Dado el diseño retrospectivo del estudio, no se pudieron establecer relaciones causales. El estudio se realizó en un solo centro, y la cohorte estudiada, aunque representativa de la población local, era étnicamente homogénea (caucásicos). La GGT y FA no se analizaron como variables tiempo-dependientes, y por esta razón, es probable que el significado pronóstico de elevaciones transitorias de la GGT sea diferente al de incrementos mantenidos en el tiempo. Sin embargo, en este estudio la detección de una elevación de la GGT en análisis transversal en un determinado estadio de la ERC se asoció a un fenotipo clínico de gran interés debido a su relación con la comorbilidad cardiovascular y mortalidad. Finalmente, la FA óseo-específica u otros parámetros relacionados más específicamente con el remodelado óseo no fueron medidos.
En conclusión, un nivel anormalmente elevado de GGT es un hallazgo frecuente en pacientes con ERC, que se observa más comúnmente en pacientes con mayor comorbilidad, sobre todo enfermedades cardiovasculares, y se asocia de forma independiente con la mortalidad. La elevación simultánea de GGT y FA séricas incrementa el riesgo de mortalidad. Por tanto, la medición conjunta de GGT sérica con FA podría ofrecer información predictiva adicional en pacientes con ERC.














