Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.18 no.4 Madrid jul./ago. 2003
Caso clínico
Tratamiento dietético-nutricional en la enteritis rádica crónica.
A propósito de un caso clínico complejo
A. Fernández de Bustos y A. M.ª Pita Mercé
Sección de Nutrición Clínica y Dietética. Servicio de Endocrinologia y Nutrición Cuitat Sanitària i Universitària de Bellvitge. LHospitalet de Llobregat. Barcelona. España.
| Resumen Presentamos un caso clínico de enteritis rádica crónica seguido durante 34 meses, cuyas características destacables son las siguientes: (Nutr Hosp 2003, 18:226-231) Palabras clave: Dieta Elemental. Dietoterapia. Enteritis rádica crónica. Glutamina. Nutrición parenteral domiciliaria. | DIETETIC-NUTRITIONAL TREATMENT IN CHRONIC RADIATION ENTERITIS. APROPOS OF A COMPLEX CLINICAL CASE Abstract We present a clinical case of chronic radiation enteritis, with follow-up over 34 months, the main features of which were as follows: (Nutr Hosp 2003, 18:226-231) Keywords: Basic Diet. Chronic radiation enteritis. Diet therapy. Glutamine. Parenteral nutrition at home. |
Correspondencia: A. Fernández de Bustos.
Sección de Nutrición Clínica y Dietética.
Ciutat Sanitària i Universitària de Bellvitge.
Feixa Llarga, s/n.
08907 L´Hospitalet de Llobregat. Barcelona.
Correo electrónico: apita@csub.scs.es
Recibido: 21-XI-2002.
Aceptado: 30-XII-2002.
Introducción
Entre las terapias antineoplásicas, la radioterapia (RDT) ocupa un lugar importante, bien como primera opción o coadyuvante al tratamiento quirúrgico, pudiendo producir toxicidad aguda y crónica sobre tejidos no tumorales.
La radiación sobre el área pélvica afecta especialmente a las células epiteliales intestinales produciendo además, vasculitis y lesiones linfáticas relacionadas directamente con la dosis recibida (mayor frecuencia a partir de 45 Gy), y con otros factores como quimioterapia concomitante, fijación intestinal por cirugía previa, desnutrición y predisposición personal1- 2. Estas lesiones se traducen en fibrosis, necrosis, estenosis y fístulas3 que dan lugar a cuadros suboclusivos y oclusión completa, precisando actuación médica urgente ya que pueden acompañarse de trastornos hemodinámicos, siendo frecuente la indicación quirúrgica para resecar las zonas estenóticas responsables de la persistencia del cuadro.
La intolerancia alimentaria relacionada con dolor abdominal, náuseas y vómitos acompañadas o no de diarrea conducen a pérdida de peso y desnutrición severa, siendo necesario el soporte nutricional con nutrición parenteral (NP)4 como única posibilidad de nutrición. La NP de forma prolongada y exclusiva tiene complicaciones colaterales graves, siendo las principales atrofia intestinal, sepsis y hepatopatía.
La nutrición enteral con fórmulas definidas siempre que se constate estabilidad clínica e intestino funcionante, puede ser una alternativa válida a la NP, toda vez que al ejercer un efecto trófico sobre la mucosa intestinal y mejorar el flujo hepatotrófico y esplácnico permiten la disminución en el aporte de NP. Su índice de complicaciones es mucho menor. La eficacia de estas dietas es igual que cuando son administradas por vía oral siendo mejor aceptadas por las características organolépticas y por que los pacientes no son portadores de sonda nasogástrica.
Si la tolerancia digestiva persiste podría pensarse en algunos alimentos naturales como parte de la nutrición.
Dada la escasez de trabajos en clínica sobre el tratamiento nutricional de la enteritis radica crónica especialmente tratados por vía digestiva, creemos interesante la presentación de este trabajo que combina diferentes modalidades de soporte nutricional incluyendo los alimentos naturales en algún momento de su evolución.
Presentación del caso clínico
T.M.H. Mujer de 60 años de edad, nos es remitida en agosto de 1999 para valorar necesidad de soporte nutricional domiciliario con NP por presentar desnutrición severa, trastornos hidroelectrolíticos e intolerancia progresiva a la alimentación que había requerido dos ingresos hospitalarios para nutrición con NP, cumpliendo criterios de fallo intestinal.
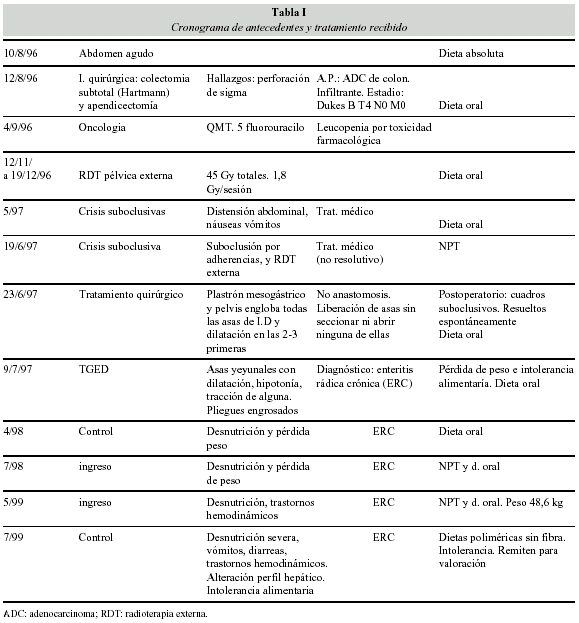
Los antecedentes patológicos y el tratamiento recibido se describen en la tabla I.
Pendiente de ingreso, acude el día 4 de octubre 1999 al servicio de urgencias con suboclusión intestinal y trastornos electrolíticos, siendo rehidratada e ingresada en el servicio de cirugía, instaurándose tratamiento con NP a través del catéter del que era portadora (Port-a-Cath), resolviéndose la suboclusión con tratamiento médico.
Su situación al ingreso era la siguiente: paciente caquéctica; con talla de 162 cm, peso 37 kg, IMC 14,2 kg/m2; (peso previo enfermedad 62 kg · IMC 23,6 kg/m2), con radiculitis rádica diagnosticada por electromiograma, acompañada de dificultades de deambulación, sin edemas ni parestesias en extremidades.
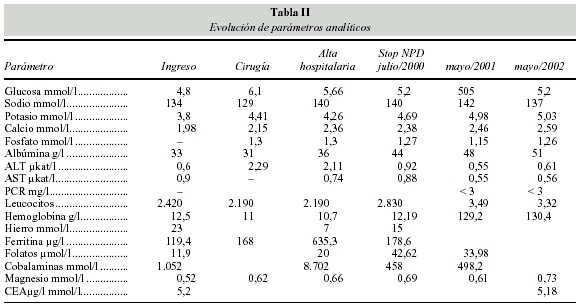
Los parámetros analíticos se expresan en la tabla II.
Se intentó la alimentación por vía digestiva confirmándose intolerancia por náuseas y vómitos que obligaron a mantener NP. Ante la persistencia del cuadro suboclusivo confirmada mediante TAC abdominal que indica bridas y lesiones sugestivas de ERC con distensión gástrica y de diversas asas yeyunales. El tránsito digestivo puso en evidencia una estenosis ileal por lo que se decide abordaje quirúrgico que se efectúa el día 8 de noviembre 1999. Como hallazgos operatorios se constata gran dilatación de las asas yeyunales, y adherencias del resto de las asas. Se realiza lisis de bridas y resección de 70 cm de intestino delgado a nivel ileal, con anastomosis termino-terminal, quedando, un intestino remanente de 160 cm de yeyuno e íleon con válvula ileocecal (VIC), colon ascendente, y transverso hasta colostomía en fosa ilíaca izquierda. El estudio anatomopatológico de la pieza informó de fibrosis marcada a nivel de la subserosa y serosa y, adherencias de asas, compatibles con ERC.
Las consecuencias constituyen un caso clínico de síndrome de intestino corto (SIC). Sin complicaciones posteriores se traslada a nuestro servicio para control clínico-nutricional.
Las exploraciones complementarias posteriores confirman la persistencia rádica:
Fibrogastroscopia: hernia de hiato mínima. Enema opaco: colon ascendente, transverso y parte de colon descendente normal. Se sobrepasa VIC, siendo el íleon terminal normal. RX simple de abdomen: distensión abdominal y niveles hidroaéreos.
Tránsito de intestino delgado: tránsito intestinal lento con asas dilatadas, edematosas, con importante atonía, pliegues conservados e íleon terminal de calibre normal. Dificultad de concretar zona estenosada responsable de crisis suboclusivas.
Colonoscopia a través de colostomia: áreas mínimas eritematosas sugestivas de angiodisplasia por radioterapia, sin signos de sangrado, no siendo posible la intubación de VIC.
Tratamiento nutricional
Ante la persistencia del cuadro suboclusivo se mantuvo NP diaria variando la fórmula según la situación clínica, las pérdidas digestivas y parámetros analíticos. Desde noviembre de 1999 hasta el alta hospitalaria (4 de febrero de 2000) recibió una solución de aminoácidos con glutamina (Glamin, laboratorios Fresenius), con un aporte de nitrógeno de 14 a 16 g día; glucosa 250 a 300 g/día; lípidos (Clinoleic laboratorio Baxter) 50 g/día (requiriendo un volumen de 3.000-3.100 ml según las pérdidas digestivas.
Los electrólitos vitaminas y minerales se aportaron diariamente también según necesidades: Sodio 200- 250 mEq; Potasio 60-100 mEq; calcio 8 mmol; magnesio: 8 mmol; fosfato: 20 mmol; selenio: 100; zinc: 6-9 mg, cromo, manganeso, molibdeno, con vitaminas a dosis estándares (1 ampolla de Cernevit/día).
Después de 79 días de NP exclusiva, presentaba buen estado general y estabilidad clínica decidiéndose iniciar nutrición por vía oral con dieta elemental (Elemental 028 ExtraR laboratorio SHS) asociándose posteriormente dieta polimérica estándar (Isosource standardR laboratorio Novartis). El volumen inicial fue de 250 ml día con buena tolerancia metabólica y digestiva lo que permitió un aumento rápido (500 ml de volumen cada 3-4 días) y una disminución del número de perfusiones semanales pasando progresivamente de 7 a 4 al alta hospitalaria de las cuales solo 2 perfusiones contenían lípidos.
Por vía oral además se administró el agua, infusiones y soluciones de rehidratación. La energía diaria tolerada fue 1.000 kcal de dieta estándar y 860 kcal de dieta elemental. Las pérdidas por colostomía se estabilizaron en una media diaria de 1.500 ml.
Previamente al alta, dos familiares de la paciente fueron adiestrados en los cuidados de la NP a domicilio (NPD): manejo aséptico del catéter y bolsa nutritiva, parámetros a controlar, síntomas por los que contactar con nuestro servicio y tratamiento farmacológico. El peso al alta hospitalaria fue de 47.200 kg con IMC de 18 kg/m2.
Ambulatoriamente continuó la reducción del número de perfusiones de NPD pasando a 3 semanales, 1 solamente con lípidos, y a 2 el último mes. Se suspendió definitivamente la NPD el 14 de julio/2000. El aporte de nitrógeno osciló entre 9 y 12 g, la glucosa se mantuvo en 200 g y 50 g de lípidos (el día que correspondía). Los iones, vitaminas y oligoelementos se administraron a dosis estándar excepto el selenio y el zinc que siguieron su pauta habitual.
Siguió la pauta de dietas fórmula poliméricas y elemental igual que en hospitalización, tolerando un aporte energético medio con dieta elemental de 1.136- 1.290 kcal/día y de dieta estándar entre 1.136-1.250 kcal/día siendo el total entre 2.300-2.500 kcal/día sin presentar vómitos ni distensión abdominal.
Cuando se suspendió la NP su peso es de 58.600 kg con IMC de 23 kg/m2. Las pérdidas digestivas oscilaban entre 1.600 cc y 2.300 cc día siendo su estado subjetivo de bienestar.
Alimentación con dieta oral
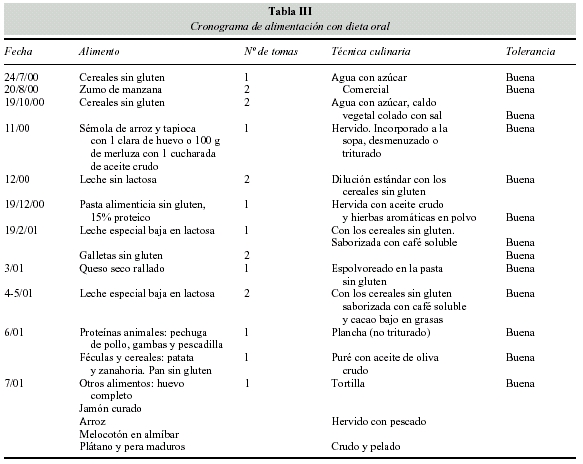
La estabilidad clínica nos animó a iniciar la dieta oral, muy testimonial al inicio manteniendo las dietas fórmula para garantizar el estado nutricional. La progresión fue lenta para confirmar la tolerancia digestiva. El cronograma se presenta en la tabla III.
Hasta el 19 de febrero 2001 realiza una comida diaria de sémola de arroz o de maizena con merluza hervida y desmenuzada o clara de huevo cocido con una cucharada de aceite de oliva crudo, y dos tomas de cereales dextrinados sin gluten. Se introduce leche especial baja en lactosa y una ración de pasta de sopa sin gluten hervida con caldo vegetal colado, o pasta alimenticia sin gluten (15% proteico) aliñada con queso seco rallado.
El fraccionamiento de la dieta se hizo en 4 comidas diarias, siguiendo el modelo:
Desayuno: leche baja en lactosa (PrésidentR) con cereales dextrinados.
Media mañana: zumo de manzana o 2 galletas sin gluten.
Comida: sémola de arroz con merluza hervida, pasta con queso rallado o sopa de pasta pequeña con caldo vegetal y clara de huevo cocido.
Cena: leche especial baja en lactosa con maizena y clara de huevo o sémola de arroz con pescado hervido.
Durante los meses de abril y mayo aumentó el número de ingestas a cinco comidas diarias añadiéndose leche baja en lactosa con cereales en la merienda. Todos fueron bien tolerados siendo posible a partir del mes de junio, una ampliación de alimentos y cambios en el cocinado.
Proteínas animales: pechuga de pollo, gambas y pescadilla a la plancha no triturados, huevo completo en forma de tortilla, jamón curado magro.
Féculas y cereales: patata y zanahoria en puré con aceite de oliva crudo, arroz hervido y en sopa, pan y galletas sin gluten.
Fruta en almíbar (melocotón) y cruda: plátano y pera maduras.
La tolerancia y la satisfacción de la paciente han sido alentadoras permitiendo al final del primer año sin NP una variabilidad de alimentos que permite ingestas más completas.
Mantiene cinco comidas diarias con un aporte energético calculado de aproximadamente 1.500 calorías y 60 g de proteínas por día. La suplementación nutricional se fija en 1.000 kcal de fórmula estándar y 430 kcal de fórmula elemental diarias.
Discusión
Existen pocas referencias en la literatura internacional sobre tratamiento nutricional en la ERC tanto en artículos originales como en descripción de casos clínicos, especialmente cuando se trata del manejo por vía digestiva5.
En el caso que presentamos hay varios aspectos que nos parecen remarcables que vamos a exponer a continuación. En primer lugar, se trata de una persona con una longitud de ID previa muy escasa, aunque el segmento resecado no tiene una longitud muy fiable dado la retracción y fibrosis que presentaba, y asimismo es conocida la menor longitud en mujeres y la variabilidad interindividual.
Otro aspecto interesante es que a pesar de la resección ileal, el ID remanente o parte del mismo presenta características de ERC, valorado por clínica y confirmado por exploraciones complementarias, circunstancia poco frecuente, pero descrita dadas las dificultades para delimitar con precisión la zona afectada.
El manejo nutricional de nuestra paciente consistió en nutrición artificial exclusiva con NP mientras persistió el síndrome oclusivo y después de la intervención quirúrgica hasta que se inició la fase de adaptación intestinal. La elección de una solución de aminoácidos con glutamina la hicimos de forma empírica por las siguientes razones: a) posible efecto preventivo sobre la translocación bacteriana citado en algunos estudios6-7, no siendo concordante en otros8; b) aumento en la altura y en el número de vellosidades9, y c) posible efecto preventivo de la atrofia intestinal del intestino sano10-11, si es que hubiere. No se contó con la mejora de las lesiones rádicas. Esta solución sólo fue administrada durante la hospitalización (4 meses) no siendo posible ambulatoriamente (5,5 meses) por falta de disponibilidad en el hospital de origen.
Después de un periodo de tiempo superior a un mes sin presentar distensión abdominal ni síndrome nauseoso se decide iniciar nutrición por vía oral, escogiendo una dieta fórmula basada en una solución de aminoácidos libres como fuente nitrogenada por varios motivos: potencial ventaja en la absorción de L-aminoácidos comparando con proteína completa en esta situación12, experiencia personal positiva en otros casos de ERC sin cirugía, tolerancia a infusiones azucaradas.
La buena tolerancia a la dieta elemental no justificó la asociación de dietas específicas sin grasa proponiéndose dieta polimérica estándar. No se indicó fórmula con glutamina por que se administraba con la NP.
Después de suspender la NPD mantuvo buen estado general y tolerancia digestiva, lo que nos animó a introducir dieta oral con alimentos convencionales13.
Basándonos en trabajos previos sobre absorción de nutrientes por vía digestiva en SIC con remanente sano14- 16 esta paciente tendría unas pérdidas energéticas por heces de aproximadamente del 30% de la energía ingerida, por lo que en aquel momento la alimentación oral no sería suficiente para cubrir sus necesidades, pero la planteamos como pauta mixta17.
Son varios los factores determinantes en el éxito de la pauta: 1) a actitud positiva personal y capacidad de registrar diariamente su situación clínica, ingestas sólidas y líquidas, pérdidas por heces y orina, además de contar con un entorno de ayuda; 2) el planteamiento del tratamiento farmacológico adecuado y sustitutivo de vitaminas y minerales; 3) trabajar en el contexto de un equipo multidisciplinar que valore íntegramente la situación clínica y nutricional, plantee el seguimiento domiciliario y cuente con la figura de un dietista especializado; 4) definir previamente los objetivos de la pauta, sopesando la conveniencia/ riesgo, y 5) seleccionar alimentos y técnicas culinarias que precisen menor trabajo digestivo.
La integración de la persona en su entorno socio-familiar y el satisfacer sus gustos y hábitos alimentarios previos, son factores tan importantes que bien merecen ser considerados.
En nuestra paciente, la dieta oral al inicio fue testimonial, la progresión lenta, no proponiendo ningún alimento nuevo sin confirmar la tolerancia de los anteriores. El tiempo que ha durado la progresión alimentaria ha sido de 6 meses (tiempo superior al habitual en SIC de otra etiología). Seguimos también las recomendaciones internacionales de la dieta en el SIC: exclusión de lactosa y fibra insoluble. Control y exclusión de oxalatos alimentarios, Reducción relativa de grasa saturada. Alto contenido energético y proteico. Fraccionamiento en 6 o más ingestas de poco volumen. El gluten fue excluido empíricamente por una posible alergia que presentaba anteriormente sustituyéndose por productos sin gluten con un contenido proteico similar al de los alimentos convencionales.
Las preparaciones culinarias han sido sencillas pero variadas con buena tolerancia a la diversificación de los alimentos. La masticación ha sido un factor muy satisfactorio.
La buena tolerancia digestiva puede explicarse parcialmente por que entre sus secuelas no puede figurar la rectitis rádica generadora siempre de tenesmo rectal y malestar digestivo, además, las pérdidas por heces son recogidas por la colostomia.
Por aumento en febrero de 2001 de pérdidas fecales se confirmó sobrecrecimiento bacteriano con breath fest iniciándose tratamiento con metronidazol lo que permitió la estabilización en límites esperables (1.500-1.800 ml día). La diuresis oscila entre 1.200- 1.500 ml diarios.
Han mejorado notablemente las alteraciones neurológicas carenciales o rádicas, continua precisando tratamiento farmacológico del sobrecrecimiento bacteriano, preventivo de la osteoporosis (densitometría ósea), y suplementación multivitamínico/mineral incluyendo vitamina B12 por vía parenteral.
La situación actual (mayo 2002) es la siguiente sensación subjetiva de bien estar, peso 60,8 kg; IMC 23,5 kg/m2, pérdidas por colostomia media de 1.400 ml día; diuresis 1.335-1.660 ml día; suplementación nutricional 1.000 kcal de dieta estándar y 645 kcal de dieta elemental e ingestas sólidas tal como se describió previamente.
Para concluir consideramos que la ERC es una entidad compleja que precisa tratamiento específico. La persistencia de lesiones rádicas, y el seguimiento de la enfermedad de base, aconsejan controles periódicos con valoración clínica, determinaciones analíticas y exploraciones complementarias que confirmen el estado físico y nutricional.
Referencias
1. Miller AR, Martenson JA, Nelson H y cols.: The incidence and clinical consequences of treatment-related bowel injury. Int J Radiation Oncology Biol Phys, 1999, 43:817-825. [ Links ]
2. Forbes A: Radiation enteritis en: Nightingale(ed) Intestinal failure. G M M. London, 2001: 141-152. [ Links ]
3. Dubois A y Earnest DL: Radiation enteritis and colitis. En: Feldmam M, Sharschmidt BF, Sleisenger MH (eds.): Gastrointestinal and Liver Disease. 6th edition. W.B. Saunders Company. Philadelphia, 1998: 1696-1707. [ Links ]
4. Scolapio JS, Ukleja A, Burnes JV y Kelly Darlene G: Outcome of patients with radiation enteritis treated with home parenteral nutrition. Am J Gastroenterol, 2002, 97:662-666. [ Links ]
5. Satman S: Chronic radiation enteritis: Womens food tolerance after radiation treatment for gynecologic cancer. J Am Diet Assoc, 2000, 100:941-943. [ Links ]
6. Souba WW, Klimberg VS, Hautamaki RD y cols.: Oral glutamine reduces bacterial translocation following abdominal radiation. J Surg Res, 1990, 48:1-5. [ Links ]
7. Van Der Hulst, RR WJ, von Meyenfeldt MF, Arends J-W y cols.: Glutamine and the preservation of gut integrity. The Lancet, 1993, 341:1363-1366. [ Links ]
8. MacArdle AH: Protection from radiation injury by elemental diet: does added glutamine change the effect? Gut, 1994, 35 (1 Suppl):60-64. [ Links ]
9. Campos FG, Waitzberg DL, Mucerino DR y cols.: Protective effects of glutamine diet on acute actinic enteritis. Nutr Hosp, 1996 XI(3):167-177. [ Links ]
10. Ersin S, Tuncyurek P, Esassolak y cols.: The prophylactic and therapeutic effects of glutamine and arginine-enriched diets on radiation-induced enteritis in rats. J Surg Resarch, 2002, 89:121-125. [ Links ]
11. Silver C: The use of elemental diets in radiation enteritis en: Bounous (ed) Uses of elemental diets in clinical situations. CRC Press Boca Ratón, 1993: 121-134. [ Links ]
12. Bines J, Francis D y Hill D: Reducing parenteral requirement in children with short bowel syndrome: impact of amino acidbased complete infant formula. J Pediatric Gastroenterol Nut, Vol Nº 2. February 1998: 123-128. [ Links ]
13. Criado MT, de Juan P, Hillman N, Koning A, del Olmo D y Vázquez C: Manejo nutricional en la enteritis rádica: a propósito de un caso. Nutr Hosp, 1999 XIV (3):138-141. [ Links ]
14. Jeppesen PB y Mortensen PB: Dietary treatment of patients with a sort bowel en: Nightingale(ed) Intestinal failure. G M M. London, 2001: 393-404. [ Links ]
15. Norddgaard I y Hansen BS: Importance of colonic support for energy absortion as small- bowel failure proceed. Am J Clinic Nutr, 1996, 64:222-231. [ Links ]
16. Rodrigues CA, Lennard Jones JE, Thompson DG y Farthing MJ: Energy absorption as a mesure of intestinal failure in the short bowel syndrome. Gut, 1989, 30:176-183. [ Links ]
17. Messing B, Pigot F, Rongier M, Morin MC, Ndeindoum V y Rambaud JC: Intestinal absortion of free oral hyperalimentation in the very short bowel syundrome. Gastroenterology, 1991, 100:1502-1508. [ Links ]