Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.19 no.4 Madrid Jul./Ago. 2004
Caso clínico
Hipofosfatemia grave tras el inicio de nutrición parenteral en una paciente con fístula intestinal
J. L. Temprano, I. Bretón, A. Zugasti, C. Cuerda, M. Camblor, M. D. Pérez-Díaz*, P. García
Unidad de Nutrición. *Servicio de Cirugía. Hospital General Universitario Gregorio Marañón. Madrid. España.
| Resumen La hipofosfatemia es una complicación que puede aparecen en pacientes malnutridos a los que se les administra nutrición, tanto de forma enteral como parenteral. Se asocia a diversas manifestaciones clínicas, entre las que destacan las cardiológicas, neurológicas y hematológicas, pudiendo llegar incluso a producir la muerte. Es por tanto obligado realizar prevención y seguimiento en aquellos pacientes con un riesgo elevado de padecerla, teniendo en cuenta la importante morbimortalidad que presenta. (Nutr Hosp 2004, 19:243-247) Palabras clave: Hipofosfatemia. Síndrome de realimentacion. | SEVERE HYPOPHOSPHATAEMIA AFTER STARTING PARENTERAL NUTRITION IN A PATIENT WITH AN INTESTINAL FISTULA Abstract Hypophosphataemia is a complication that may appear in undernourished patients who are given nutrition by either enteral or parenteral means. It is associated with several clinical manifestations, including cardiological, neurological and haematological conditions of note, and may potentially be even life-threatening. It is therefore mandatory to ensure prevention and follow-up in those patients at risk of suffering this condition, taking into account the considerable morbidity and mortality associated with it. (Nutr Hosp 2004, 19:243-247) Keywords: Hypophosphataemia. Re-feeding syndrome. |
Correspondencia: José Luis Temprano Ferreras
Gustave Dore 3 - Portal 2, 1º B 37007 Salamanca
e-mail: josetemprano@hotmail.com
Recibido: 16-XII-2003.
Aceptado: 15-I-2004.
Introducción
Presentamos el caso de una paciente en la que tras el inicio de nutrición parenteral presentó un cuadro neurológico grave secundario a hipofosfatemia, así como hipomagnesemia e hipopotasemia como parte del síndrome de realimentación.
Caso clínico
Mujer de sesenta y tres años con antecedentes personales de cifoescoliosis, insuficiencia respiratoria restrictiva y diverticulosis.
La paciente presentó una peritonitis secundaria a diverticulitis perforada, tratada con técnica de Hart-mann. En el postoperatorio desarrolló una fístula entero-cutánea, tratada con nutrición enteral por vía oral. Ante su negativa a ser intervenida, se dio de alta con este tratamiento, cuando presentaba un débito de 200 ml/día, programándose revisiones periódicas ambulatorias, a las que no acudió.
Tres meses después acudió a urgencias por presentar en los días previos, un cuadro de astenia, anorexia, náuseas, mareo, dolor abdominal, disminución de salida de heces por la colostomía y aumento importante del débito de la fístula, en ocasiones con aspecto hemático. Estaba afebril, con TA de 85/50 mmHg y presentaba dolor difuso a la palpación abdominal. Durante su estancia en urgencias presentó disminución del nivel de conciencia que mejoró tras la administración de líquidos intravenosos.
Analíticamente presentaba: hemoglobina 12,3 g/dl; leucocitos 10.400/mm3; glucemia 102 mg/dl; urea 426 mg/dl; creatinina 2,9 mg/dl; proteínas totales 9,3 g/dl; Ca 10,5 mg/dl; Na 104 mEq/l; K 6,9 mEq/l; Cl 73 mEq/l; HCO3 17 mmol/l; Na urinario 6 mEq/l. Fue diagnosticada de deshidratación, insuficiencia renal aguda, acidosis metabólica, hiponatremia grave e hiperpotasemia. Ante la sospecha de insuficiencia suprarrenal aguda se inició tratamiento con hidrocortisona y se prosiguió con reposición con líquidos i.v., con buena respuesta clínico-analítica. En las siguientes analíticas presentó un descenso de la concentración de hemoglobina hasta 7,6 g/dl y recibió transfusión de dos concentrados de hematíes.
Fue ingresada en medicina interna y posteriormente trasladada a cirugía con el diagnóstico de obstrucción intestinal. Al sexto día del ingreso comenzó a administrarse nutrición parenteral. La paciente estaba plenamente consciente, estable hemodinámicamente, sin edemas y la función renal, la hiponatremia y la hiperpotasemia se habían normalizado. Presentaba un peso de 68 Kg y una talla de 145 cm (IMC de 32 Kg/m2). La composición de la NPT fue: volumen total 2.500 ml, 1.500 kcal, N 11 g, glucosa 200 g, lípidos 40 g, Na 120 mEq, K 60 mEq, Mg 15 mEq, P 15 mEq, Zn 12 mg, Ca 12 mEq. Al día siguiente la paciente refería sensación de parestesias en manos y periorales. Se administró tiamina i.m. de forma empírica. Unas horas más tarde comenzó a presentar un cuadro de disminución del nivel de conciencia y bradipsiquia, con conservación de la motilidad en extremidades. El cuadro clínico progresó durante el día siguiente, presentando deterioro del nivel de conciencia de tipo fluctuante, con afasia y paraparesia en MSI y llegando a estar estuporosa. Estaba afebril y su presión arterial era 130/70 mmHg. Se suspendió la NTP, se mantuvo con sueroterapia y aporte empírico con vitaminas. La TAC craneal fue normal. Fue trasladada a la UCI y ante la sospecha de encefalopatía metabólica se realizó un EEG, que mostró un estatus epiléptico no convulsivo, iniciándose tratamiento con fenitoina i.v. Analíticamente presentaba: Hb 10,7 g/l; 12.800 leucocitos con 71,5% de granulocitos; glucemia 91 mg/dl; creatinina 0,5 mg/dl; Na 143 mEq/l; K 2,6 mEq/l; P 0,5 mg/dl; Mg 1,5 mg/dl; CPK 31 UI/l. El ECG no mostró la existencia de arritmias. La gasometría arterial era similar a la previa.
Fue diagnosticada de hipofosfatemia grave con hipomagnesemia e hipopotasemia. Se administraron sales de fosfato i.v., así como magnesio y potasio, con buena respuesta clínica, mejorando progresivamente la situación neurológica hasta normalizarse. Fue trasladada nuevamente a cirugía y se reinició la nutrición parenteral, incrementando progresivamente el aporte calórico y con un aporte mayor de fósforo, magnesio y potasio. Durante su ingreso presentó además varias complicaciones: intoxicación por fenitoína con síntomas neurológicos, y una sepsis por Candida spp. relacionada con el catéter central, de las que se recuperó sin secuelas. Se introdujo progresivamente nutrición enteral por vía oral y dieta oral modificada y se suspendió la NPT y los fluidos i.v. Dado que el diagnóstico de insuficiencia suprarrenal no estaba confirmado y existía al ingreso una importante deshidratación que podría explicar las alteraciones analíticas, se realizó un descenso progresivo de los corticoides hasta suspenderlos, sin que apareciesen síntomas o signos de insuficiencia suprarrenal. El cortisol tras estímulo con ACTH (250 mg) fue de 43,9 µg/dl a los 30 minutos, lo cual refleja una reserva adrenal normal.
La paciente rechazó la cirugía de reconstrucción del tránsito intestinal. Persistía la fístula entero-cutánea con un débito aproximado de 300 cc/día. La paciente fue dada de alta con buena situación clínica y analítica.
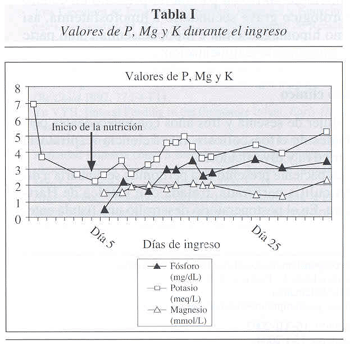
Se expone en la tabla I la evolución de los niveles de fósforo, magnesio y potasio durante el ingreso.
Discusión
La hipofosfatemia es la característica fundamental en el síndrome de realimentación, pudiendo aparecer también alteraciones del potasio, magnesio, tiamina así como de los fluidos corporales1-3.
Se ha descrito la aparición de este síndrome en pacientes malnutridos a los que se les administra nutrición por vía oral4, enteral5 o parenteral1.
La inanición y la pérdida de peso da lugar a una disminución del contenido corporal de algunos elementos intracelulares, como el potasio, magnesio y fósforo, con preservación de sus niveles séricos. Cuando se realimenta con un exceso de glúcidos y aminoácidos se crea un ambiente de anabolismo, se favorece el paso de algunos elementos al interior de la célula y aumentan los requerimientos de sustratos y micronutrientes necesarios para el metabolismo de la glucosa o la formación de ATP. Como consecuencia, disminuyen los niveles plasmáticos de fósforo, magnesio y potasio. Se produce una disminución de la producción de ATP y 2-3 DPG6, con amplias consecuencias hematológicas y neuromusculares. La secreción de insulina aumenta y agrava la hipokalemia e hipomagnesemia al tiempo que tiene un efecto antinatriurético en el túbulo renal7, contribuyendo a una rápida expansión del espacio extracelular8. Por útimo, se puede producir una deficiencia clínica de tiamina al aumentar los requerimientos de esta vitamina (fig. 1).
La tabla II recoge las manifestaciones clínicas más frecuentes de la hipofosfatemia, la hipomagnesemia y la hipopotasemia. Los síntomas de la hipofosfatemia pueden ser debidos a cambios en la glicólisis anaerobia, que se modula por el fosfato extracelular. Además, al disminuir la concentración de fósforo, disminuye la producción de 2,3 DPG y como consecuencia aumenta la afinidad de la hemoglobina por el oxígeno dando lugar a una hipoxia tisular9.
En el caso que presentamos la paciente desarrolló un cuadro neurológico grave, presentando un estatus epiléptico no convulsivo. No objetivamos la existencia de rabdomiolisis10,11, hemólisis12,13, insuficiencia cardíaca14-16 ni insuficiencia respiratoria3, que son otras de las manifestaciones clínicas de la hipofosfatemia (tabla II). Se ha descrito la mejoría de estas complicaciones con la corrección de los niveles de fósforo3,17 tal y como sucedió con nuestra paciente. Dado que se trata de un elemento intracelular, en ocasiones pueden persistir los síntomas durante más tiempo, a pesar de haber corregido los niveles plasmáticos. En su mayor parte estas complicaciones aparecen en las primeras 72 horas tras haber instaurado la nutrición18, de la misma forma que en el caso que nosotros presentamos.
Es importante no olvidar la posible aparición del síndrome de realimentación en pacientes de riesgo, tomando las medidas oportunas para minimizar esta posibilidad (tabla III). Se aconseja iniciar la administración de nutrientes de forma lenta y progresiva23, comenzando con 20 Kcal/Kg/día24 y un aporte de líquido moderado, evitando un exceso de aporte de sodio25. Se recomienda además corregir las alteraciones hidroelectrolíticas previas al inicio de la alimentación y dar suplementos de tiamina y fósforo26.
Se debe realizar un seguimiento clínico y analítico antes y después del comienzo de la alimentación para, en caso de aparecer alguna complicación, corregirla de la forma más precoz posible.
En el caso que presentamos llama la atención que se produjo una hipofosfatemia grave a pesar de haber recibido la cantidad de fósforo que se recomienda en estos casos (10-20 mmol/1.000 Kcal de carbohidratos9. El aporte calórico no fue excesivo (aproximadamente 20 Kcal/Kg), a diferencia de otros casos descritos previamente, en los que el aporte llega a ser de hasta 100 Kcal/Kg/día y la paciente no estaba gravemente malnutrida. En el cálculo del aporte de sodio (120 mEq/día), se tuvieron en cuenta las pérdidas estimadas por la fístula intestinal, por lo que nos parece adecuado, aunque supere las recomendaciones26 para prevenir el síndrome de realimentación. No disponemos de determinación de fósforo anterior al inicio de la nutrición parenteral, por lo que no podemos decartar una deficiencia previa. Sin embargo, la clara relación temporal con el inicio del soporte nutricional apoya el papel que la realimentación pudo tener en el desarrollo del cuadro clínico.
El síndrome de realimentación es una entidad clínica potencialmente grave que puede aparecer al iniciar el soporte nutricional en pacientes previamente malnutridos. En su prevención resulta fundamental identificar a los pacientes de riesgo, iniciando el soporte nutricional con un aporte calórico limitado y que proporcione cantidades suficientes de minerales y micronutrientes.
Referencias
1. Crook MA, Hally V, Panteli JV: The importance of the refeeding syndrome. Nutrition 2001, 17(7-8):632-637. [ Links ]
2. Hernández-Aranda JC, Gallo-Chico B, Luna-Cruz ML, Rayón-González MI, Flores-Ramírez LA, Ramos Muñoz R, Ramírez-Barba EJ: Desnutrición y nutrición parenteral total: estudio de una cohorte para determinar la incidencia del síndrome de realimentación. Rev Gastroenterol Mex 1997, 62(4):260-265. [ Links ]
3. Solomon SM, Kirby DF: The refeeding syndrome: a review. JPEN J Parenter Enteral Nutr 1990, 149(1):90-97. [ Links ]
4. Fisher M, Simpser E, Schneider M: Hypophosphatemia secondary to oral refeeding in anorexia nervosa. Int J Eat Disord 2000, 28(2):181-187. [ Links ]
5. Baars A, Timmer R, Slee PH: Metabolic disregulation after starting feeding: "refeeding" syndrome: the central role of phosphate (abstract). Ned tijdschr Geneeskd 2002, 146(10):906-909. [ Links ]
6. Dwyer K, Barone JE, Rogers JF: Severe hypophosphatemia in postoperative patients. Nutr Clin Pract 1992, 7(6):279-283. [ Links ]
7. Matz R: Parallels between treated uncontrolled diabetes and the refeeding syndrome with emphasis on fluis and electrolyte abnormalities. Diabetes Care 1994, 17(10):1209-13. [ Links ]
8. Mallet M: Refeeding syndrome. Age Ageing 2002, 31(1):65-66. [ Links ]
9. Brooks MJ, Melnik G: The refeeding syndrome: an approaach to understading its complications and preventing its occurrence. Pharmacotherapy 1995, 15(6):713-726. [ Links ]
10. Mezoff AG, Gremse DA, Farrell MK: Hypophosphatemia in the nutritional recovery syndrome. Am J Dis Child 1989, 143(9):1111-1112. [ Links ]
11. Sacks G, Walker J, Dickerson R, Kudsk K, Brown R: Observations of hypophosphatemia and its management in nutrition support. NCP 1994, 9(3):105-108. [ Links ]
12. Melchior J: Complications of renutrition. Ann Med Interne 2000, 115(8):635-643. [ Links ]
13. Vaszar LY, Culpepper-Morgan JA, Winter SM: Refeeding syndrome induced by cautious enteral alimentation of a moderately malnourished patient. Gastroenterologist 1998, 6(1):79-81. [ Links ]
14. Huang YL, Fang CT, Tseng MC, Lee YJ, Lee MB: Life-threatening refeeding syndrome in a severely malnourished anorexia nervosa. J Formos Med Assoc 2001, 100(5):343-346. [ Links ]
15. Kohn MR, Golden NH, Shenker IR: Cardiac arrest and delirium: presentations of the refeeding syndrome in severely malnourished adolescent with anorexia nervosa. J Adolesc Health 1998, 22(3):239-243. [ Links ]
16. Weinsier RL, Krumdieck CL: Death resulting from overzealous total parenteral nutrition: the refeeding syndome revisited. Am J Clin Nutr 1991, 34(3):393-399. [ Links ]
17. Knochel JP: Phosphorus. En: Shils ME y cols., eds. Modern nutrition in health and disease. Baltimore: Williams & Wilkins, 1999, 157-167. [ Links ]
18. González Ávila G, Fajardo Rodríguez A, González Figueroa E: Incidencia de síndrome de realimentación en enfermos con cáncer que reciben tratamiento nutricio artificial. Nutr Hosp 1996, 11(2):98-101. [ Links ]
19. Melchior JC: From malnutririon to refeeding during anorexia nervosa. Curr Opin Clin Nutr Metab Care 1998, 1(16):481-485. [ Links ]
20. Bowling TE, Silk DB: Refeeding remembered. Nutrition 1995, 11(1):32-34. [ Links ]
21. Al-Jurf AS, Chapmann-Furr F: Phosphate balance and distribution during total parenteral nutrition: effect of calcium and phosphate additives. JPEN J Parenter Enteral Nutr 1986, 10(5): 508-512. [ Links ]
22. Thompson J, Hodges R: Preventing hypophosphatemia during total parenteral nutrition. JPEN J Parenter Enteral Nutr 1984, 8(2):137-9. [ Links ]
23. Marik PE, Bedigian MK: Refeeding hypophosphatemia in critically ill patients in an intensive care unit. A prospective study. Arch Surg 1996, 22(30:239-243. [ Links ]
24. Faintuch J, Soriano FG, Ladeira JP, Janiszewski M, Velasco IT, Gama-Rodrígues JJ: Refeeding procedures after 43 days of total fasting. Nutrition 2001, 17(2):100-104. [ Links ]
25. Apovian C, McMahon M, Bistrian B: Guidelines for refeeding the marasmic patient. Crit Care Med 1990, 18(9):1030-3. [ Links ]
26. Jolly AF, Blank R: Refeeding syndrome. En: Zaloaga GP (ed.) Nutrition in clinical care. San Luis MO: Mosby 1994, 765-782. [ Links ]