Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.19 no.6 Madrid nov./dic. 2004
Original
Hipofosfatemia en nutrición parenteral: prevención y factores de riesgo asociados
J. M. Llop Talaverón*, D. Comas Sugrañes*, M. B. Badía Tahull*, A. Sáez Fernández*, R. Jódar Masanés* y J. M. Gómez Sáez**
*Servicio de Farmacia. Hospital Universitari de Bellvitge. L'Hospitalet de Llobregat. Barcelona. **Servicio de Endocrinología y Nutrición. Hospital
Universitari de Bellvitge. L'Hospitalet de Llobregat. Barcelona.
| Resumen Objetivo: Determinar la incidencia de hipofosfatemia en pacientes con nutrición parenteral, la cantidad de fosfato necesaria para prevenir esta complicación y los factores de riesgo asociados. (Nutr Hosp 2004, 19:362-366) Palabras clave: Hipofosfatemia. Factores de riesgo. Aporte de fosfato. | HYPOPHOSPHATEMIA IN PARENTERAL NUTRITION: PREVENTION AND ASSOCIATED RISKS FACTORS Abstract Aim: To determine the incidence of hypophosphatemia in parenterally fed patients, the phosphate amount necessary to prevent this complication and associated risks factors. (Nutr Hosp 2004, 19:362-366) Key words: Hypophosphatemia. Risks factors. Phosphate intake. |
Correspondencia: J. M. Llop.
Servicio de Farmacia.
Hospital Bellvitge.
Feixa Llarga, s/n.
08907 L'Hospitalet de Llobregat (Barcelona).
E-mail: josep.llop@csub.scs.es
Recibido: 15-III-2004.
Aceptado: 26-IV-2004.
Introducción
La hipofosfatemia es una complicación metabólica frecuente en la población hospitalaria1,2. Está asociada a ciertas situaciones (enfermo quirúrgico, renal, hepático, estado crítico etc.) y su incidencia se ha visto incrementada desde la introducción en la práctica clínica de la Nutrición Parenteral (NP). Después de reanudar la alimentación en un paciente desnutrido, se produce como respuesta un incremento de determinados intermediarios de la glicólisis así como un aumento de la síntesis de ATP provocando el paso de fosfato plasmático a fosfato intracelular. Por otra parte, la administración de cantidades elevadas de glucosa en la NP estimula la liberación de insulina la cual incide en la redistribución y en la caída del fosfato plasmático3. Todo ello, sumado a las especiales características del paciente con NP (desnutrición, pérdidas incrementadas o disminución de la absorción de fosfato, determinadas patologías predisponentes y estados de hipercatabolismo etc.), provoca que la hipofosfatemia pase a ser una complicación metabólica frecuente en los pacientes con NP, registrando todavía hoy en día unos valores relativamente altos de incidencia, y pudiendo revestir graves consecuencias en el paciente crítico3-6. Además, sobre todo en el caso del paciente grave, existe controversia sobre la cantidad ideal de fosfato para la prevención de la hipofosfatemia.
Los objetivos del estudio son: determinar la incidencia de hipofosfatemia en una muestra amplia de pacientes con NP en nuestro ámbito, cuáles de los datos analíticos de los pacientes recogidos sistemáticamente son indicadores de riesgo de la hipofosfatemia y la cantidad de fosfato necesaria para prevenirla.
Material y métodos
Se realizó un estudio de tipo observacional, no controlado y retrospectivo en los pacientes con NP ingresados durante 1 año en un hospital de nivel III que tuvieran al menos una analítica completa durante su tratamiento con NP. Los datos para la realización del estudio se obtuvieron del programa informático de seguimiento de la Unidad de NP del Servicio de Farmacia, donde se registran semanalmente las analíticas completas de los pacientes: urea, prealbúmina, fosfato, glucosa, calcio ionizado, γ-glutamiltranspeptidasa y leucocitos. Consideramos hipofosfatemia cuando el valor del fosfato plasmático es inferior a 0,81 mmol/L; hipofosfatemia moderada cuando las concentraciones plasmáticas de fosfato, estaban comprendidas entre 0,4 y 0,8 mmol/L e hipofosfatemia severa con concentraciones inferiores a 0,4 mmol/L). Según el tipo de fórmula de NP utilizada, el aporte de glucosa suministrado a los pacientes varió entre 75 y 300 g, el aporte de lípidos entre 50-100 g, el de aminoácidos ente 52-135 g, las calorías no proteicas fluctuó entre 800 y 2.200 y el aporte de fosfato entre 7,5 mmol-37 mmol. Siendo 7,5 mmol el fosfato incluido en las emulsiones lipídicas.
Análisis estadístico
Como variable dependiente se estudió el nivel de fosfatemia de los pacientes con NP (mmol/L). Como variables independientes se estudiaron: a) número de días con NP previos a la determinación analítica. b) nivel plasmático de urea (mmol/L). c) nivel plasmático de glucosa (mmol/L). d) nivel plasmático de GGT (µkat/L). e) nivel plasmático de leucocitos (U/µL). f) nivel plasmático de prealbúmina (mg/dL). g) nivel plasmático de calcio ionizado corregido (mmol/L). h) la media del fosfato administrado en los 3 días antes de la determinación. Los datos relativos a la población se expresaron como media, desviación estándar y porcentaje. Se aplicaron dos tipos de análisis multivariantes para determinar los factores de riesgo asociados a hipofosfatemia7.
1. Estudio cuantitativo: Se realizó una regresión lineal múltiple stepwise para obtener las variables relacionadas en una ecuación de predicción y los coeficientes de regresión relacionados con los niveles séricos de fosfato. Se consideró que las variables muestran una relación significativa con un valor de p < 0,05.
2. Estudio cualitativo: Se aplicó una regresión logística múltiple para determinar los factores de riesgo. Se analizaron las variables independientes que eran significativas en el modelo anterior. Los odds ratio y los intervalos de confianza se definieron como medidas de riesgo. Todos los datos fueron procesados en software de análisis estadístico SPSS.Resultados
La edad media de los pacientes estudiados fue de 56,8 ± 17,6 años, con un peso corporal medio de 66,8 ± 14,4 kg. Distribuidos por sexos 363 correspondían a hombres y 160 a mujeres. La media del fosfato plasmático determinado fue de 1,2 ± 0,4 mmol/L (0,23-5,5).
Los diagnósticos iniciales de estos pacientes se detallan en la tabla I. La mayoría de estos pacientes (79,4%) estuvieron sometidos a cirugía (54,7% a cirugía digestiva, 7,3% a trasplante de médula ósea y 17,4% a otros tipos). Fueron incluidas en el análisis multivariante 827 determinaciones analíticas correspondientes a 401 pacientes con NP de las cuales 78 (9,4%) se asociaron a hipofosfatemia. La incidencia de la hipofosfatemia en los 401 pacientes incluidos es del 17,7 % (1,7% con hipofosfatemia severa y 16% con hipofosfatemia moderada).
De los pacientes a los que se les administró más de 27 mmol de fosfato no se registró ningún caso de hipofosfatemia severa y sólo 10 mostraron hipofosfatemia moderada en comparación con los 6 y los 28 casos de hipofosfatemia severa y moderada respectivamente del grupo con menor aportación de fosfato (tabla II).
En el estudio cuantitativo, las variables que mostraron una relación significativa con la hipofosfatemia fueron: urea, glucosa, calcio, fosfato administrado y prealbúmina (tabla III).
La ecuación predictiva para el nivel plasmático de fosfato es:
Y= 1.0735 + 0.0196X1 + 0.0059 X2 + 0.00466 X3 - 0,0144 X4- 0.1565 X5
Y = niveles séricos de fosfato
X1 = urea plasmática
X2 = prealbúmina plasmática
X3 = fosfato administrado
X4 =glucosa plasmática
X5 =calcio ionizado
Los valores plasmáticos de urea y prealbúmina, así como el fosfato administrado, presentaron un coeficiente de correlación positivo, es decir, mantienen una relación directa con los valores plasmáticos de fosfato. La glucosa y el calcio mostraron en cambio el coeficiente de correlación negativo y la relación con el fosfato plasmático es inversa.
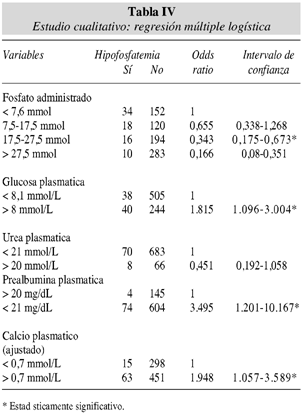
En el estudio cualitativo se determinaron los odds ratio y los intervalos de confianza (tabla IV).
El riesgo de hipofosfatemia es tres veces mayor para valores de prealbúmina menores o igual a 20 mg/dL. En cuanto al fosfato administrado, tomando como referencia el valor mínimo (7,5 mmol), el riesgo de hipofosfaternia disminuye diez veces si la administración es > 27,5 mmol aproximándose a riesgo 0. Finalmente el riesgo de hipofosfatemia casi se duplica cuando la glucosa es mayor de 8 mmol/L o el calcio ajustado aumenta a valores mayores de 0,7 mmol/L.
Discusión
Se ha descrito una incidencia de hipofosfatemia en pacientes hospitalizados entre 0,2-12% y de hipofosfatemia severa entre 0,42-0,48%1,2, 8, 9 llegando a valores del 30-40% cuando se trata de pacientes con soporte nutricional10-12. La incidencia de hipofosfatemia que hemos encontrado en nuestro estudio está por debajo de los valores descritos en la literatura debido posiblemente al tipo de población estudiada, a la metodología y a la composición de la NP. Los pacientes incluidos en nuestro estudio presentaban una gran heterogeneidad en el tipo de patología y gravedad. En general, otros estudios se centralizan en un grupo específico de pacientes críticos. Por otra parte, la forma de presentación de la hipofosfatemia durante uno o dos días en la primera semana de NP, ocasiona que según la frecuencia de las determinaciones analíticas, la hipofosfatemia puede llegar a no detectarse. Finalmente, otro factor a tener en cuenta, es la composición de la NP no siempre descrita en los estudios. Así por ejemplo, la inclusión de lípidos en la formulación de la NP permite disminuir la cantidad de glucosa administrada que en enfermos desnutridos es una de las principales causas de la caída del fosfato plasmático.
Son muchas las causas de la hipofosfatemia descritas en los pacientes hospitalizados12, sin embargo, hay pocos estudios en la literatura revisada que hayan determinado específicamente los factores de riesgo de la hipofosfatemia en pacientes con NP.
En pacientes con una disminución de la función renal (niveles altos de urea), la concentración plasmática de fosfato aumenta debido a una disminución de su aclaramiento renal. Sin embargo en pacientes desnutridos y sometidos a diálisis, la hipofosfatemia puede ser común13,14.
La prealbúmina como marcador del estado nutricional, presenta una relación directa con el fosfato plasmático. Múltiples estudios han señalado el estado de malnutrición como causa de aparición de hipofosfatemia sobre todo en la introducción de la alimentación después de un periodo en el que no se ha recibido ningún aporte nutricional ("refeeding»), sin embargo, sólo un estudio en la literatura revisada, presenta a la prealbúmina como factor pronóstico. Marik15 determinó en un estudio prospectivo con 62 pacientes críticos la incidencia de hipofosfatemia en el periodo de la introducción de alimentación, e identificó a la concentración sérica de prealbúmina como único factor de riesgo capaz de predecir la hipofosfatemia.
Respecto a la variable fosfato administrado, en nuestro estudio valores de fosfato administrado en la NP superiores a 27,5 mmol (hasta un máximo de 37,5 mmol) reduce drásticamente la hipofosfatemia, siendo el riesgo de hipofosfatemia inversamente proporcional a la cantidad de fosfato administrado.
Estudios anteriores habían intentado definir la cantidad de fosfato necesaria para prevenir la hipofosfatemia. Thompson16 en un estudio retrospectivo con 61 pacientes con NP conteniendo 13,6 mmol/L de fosfato no detectó ningún caso de hipofosfatemia severa, aunque se produjo una alta incidencia de hipofosfatemia (38% de los pacientes). Clark encontró insuficientes los 15 mmol/l o los 710 mg (23 mmol) de fósforo/L incluidos de forma estándar en las NP o fórmulas enterales respectivamente, y precisó incrementar las dosis de fosfato en los pacientes críticos administrándolo en forma de uno o más bolus endovenosos17. Takala recomienda dosis de fosfato de 0,5 mmol/kg de peso para cubrir las necesidades diarias en un estudio realizado en 24 pacientes críticos con NP, aunque pueden ser insuficientes en pacientes con prolongado hipercatabolismo18. Dosis mayores de 37,5 mmol de fosfato como las recomendadas en algunos estudios, con vistas a conseguir un balance positivo de fosfato en enfermos críticos19,20, han de valorarse por el peligro que suponen los precipitados de fosfato cálcico tal como advierte la alerta de la FDA en 199421. Como solución no parece aconsejable la alternancia de calcio y fosfato en la NP ya que la los ratios de retención de calcio-fosfato son mejores cuando se administran conjuntamente, según el estudio de Kimura realizado en pacientes pediátricos con NP22. Para aumentar la estabilidad de las mezclas de NP, la Asociación Americana de Nutrición Parenteral y Enteral (ASPEN) recomienda la utilización de calcio orgánico23. Otra posibilidad es la utilización de fosfato orgánico (D-fructosa-1,6 difosfato) según un estudio in vitro comparativo de compatibilidad entre calciofosfato24.
El aumento de glucosa en sangre ocasiona la caída del fosfato plasmático debido por una parte a la fosforilación de la glucosa y al incremento de los requerimientos del fosfato intracelular, y por otra, al aumento de la excreción de fosfato por diuresis osmótica. Por ello debe vigilarse la cantidad y la velocidad de administración sobre todo en pacientes desnutridos5,25.
En nuestro estudio, el calcio ionizado y corregido presenta una correlación negativa con el fosfato plasmático. Debido a la interrelación entre el calcio y el fosfato, un aumento del calcio en el lumen intestinal favorece un descenso en la producción de vitamina D, provocando una disminución en la absorción del fosfato. En un estudio realizado en 22 pacientes en el período postraumático inmediato el calcio ionizado no mostró relación alguna con el fosfato plasmático. Sin embargo se trataba de pacientes sin nutrición parenteral o enteral, y la determinación del calcio se realizó únicamente durante 3-4 días después del trauma26. En otro estudio retrospectivo con 44 pacientes a los que se había practicado una resección hepática mayor no se encontró relación entre hipofosfatemia y calcio aunque en este caso no se determinó el calcio ionizado y eran enfermos sin NP27.
En conclusión, es preciso suplementar rutinariamente las nutriciones con fosfato ya que el contenido en las emulsiones lipídicas comercializadas no es suficiente para evitar la hipofosfatemia en la mayoría de pacientes con NP. Debido a las especiales características de los pacientes con NP el aporte de fosfato debe ser suficiente para restaurar el déficit de fosfato intracelular y compensar la caída de fosfato plasmático, con especial cuidado para los pacientes desnutridos, hiperglucémicos o con insuficiencia renal. Aportes de fosfato en la NP entre 27-37 mmol, disminuye drásticamente la incidencia de hipofosfatemia en los pacientes estudiados, no registrándose ningún caso de hipofosfatemia severa.
Referencias
1. Halevy J, Bulvik S: Severe hypophosphatemia in hospitalized patients. Arch Intern Med 1998, 148:153-155. [ Links ]2. Camp MA, Allon M: Severe hypophosphatemia in hospitalized patients. Miner Electrolyte Metab 1990, 16:365-368. [ Links ]
3. Berner Y, Shike M: Consequences of phosphate imbalance. Am Rev Nutr 1988, 8:121-48. [ Links ]
4. Hoff SD, Rowlands BJ: Guillain-Barré Syndrome due to hypophosphatemia following intravenous hyperalimentation. JPEN 1988, 12:414-416. [ Links ]
5. Solomon SM, Kirby DF: The refeeding syndrome: a review. JPEN 1990, 14:90-97. [ Links ]
6. Weinsier RL, Krumdieck CL: Death resulting from overzealous total parenteral nutrition: the refeeding syndrome revisited. Am J Clin Nutr 1980, 34:393-399. [ Links ]
7. Domènech JM, Sarrià A: Construcción de un modelo de regresión múltiple con fines predictivos: selección de la mejor ecuación. En: Análisis multivariante en ciencias de la salud: modelos de regresión. Gráficas Signo ed. Esplugas de Llobregat: José M.ª Domènech Massons, 1997. [ Links ]
8. Betro MG, Pain RW: Hypophosphatemia and hyperphosphatemia in a hospital population. Br Med J 1973; 1:273-276. [ Links ]
9. Guy JIM, Stewart MK, Olukoga A, Horsman G, McMurray JR: Hypophosphatemia in general practice patients. Ann Clin Biochem 1999; 36:37-42. [ Links ]
10. Sacks GS, Walker J, Dickerson RN, Kudsk KA, Brown RO: Observations of hypophosphatemia and its management in nutrition support. Nutr Clin Pract 1994, 9:105-108. [ Links ]
11. Baker SS, Dwyer E, Queen P: Metabolic derangements in children requiring parenteral nutrition. JPEN 1986, 10:279-281. [ Links ]
12. Zazzo JF, Troché G, Ruel R, Maintenant J: High incidence of hypophosphatemia in surgical intensive care patients: efficacy of phosphorus therapy in myocardial function. Intensive Care Med 1995, 21:826-831. [ Links ]
13. Druml W, Kleinberger G: Hypophosphatemia in patients with chronic renal failure during total parenteral nutrition. JPEN 1999; 23:45. Letter. [ Links ]
14. Duerksen DR: Response to Drs Druml and Kleinberger. JPEN 1999, 23: 45. Letter. [ Links ]
15. Marik PE, Bedigian MIK: Refeeding hypophosphatemia in critically ill patients in an intensive care unit. A prospective study. Arch Surg 1996, 131:1043-7. [ Links ]
16. Thompson JS, Hodges RE: Preventing hypophosphatemia during total parenteral nutrition. JPEN 1984, 8:137-9. [ Links ]
17. Clark CL, Sacks GS, Dickerson RN, Kudsk KA, Brown RO: Treatment of hypophosphaternia in patients receiving specialized nutrition support using a graduated dosing scheme: results from a prospective clinical trial. Crit Care Med 1995, 23:1504-1511. [ Links ]
18. Takala J, Neuvonen P, Klossner J: Hypophosphatemia in hypercatabolic patients. Acta Anesthesiol Scand 1985, 29:65-67. [ Links ]
19. Pigon J, Lindholm M, Eklund J, Hagelbäck A: Phosphate supplementation in parenteral nutrition. Acta Anesthesiol Scand 1985, 29:50-54. [ Links ]
20. Pomposelli JJ, Pomfret EA, Burns DL y cols.: Life-threatening hypophosphatemia after right hepatic lobectomy for live donor adult liver transplantation. Liver Transpl 2001, 7:637-42. [ Links ]
21. FDA Safety alert: hazards of precipitation associated with parenteral nutrition. Am J Hosp Pharm 1994, 51:1427-8. [ Links ]
22. Kimura S, Nose O, Seino Y y cols.: Effects of alternate and simultaneous administrations of calcium and phosphorus on calcium metabolism in children receiving total parenteral nutrition. JPEN 1986, 10:513-516. [ Links ]
23. National advisory group on standards and practice guidelines for parenteral nutrition. Safe practice for parenteral nutrition formulations. JPEN 1998, 22:49-66. [ Links ]
24. Prinzivalli M, Ceccarelli S: Sodium d-fructose-1,6-diphosphate vs sodium monohydrogen phosphate in total parenteral nutrition: a comparative in vitro assessment of calcium/phosphate compatibility. JPEN 1999, 23:326-332. [ Links ]
25. Rasmussen A: Carbohydrate induced hypophosphatemia. Anasthesiol Scand 1985, 29:68-70. [ Links ]
26. Daily WH, Tonnesen AS, Allen SJ: Hypophosphatemia: incidence, aetiology, and prevention in the trauma patient. Crit Care Med 1990, 18:1210-1214. [ Links ]
27. George R, Shiu MH: Hypophosphatemia after major hepatic resection. Surgery 1992, 111:281-286. [ Links ]