Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.20 no.1 Madrid ene./feb. 2005
Alimentos funcionales
Repercusiones del consumo de mezclas calentadas de glucosa-lisina y glucosa-metionina sobre el calcio óseo
C. Delgado-Andrade, I. Seiquer y M.ª P. Navarro
Unidad de Nutrición. Estación Experimental del Zaidín. CSIC. Granada.
| Resumen Durante el tratamiento térmico de los alimentos puede desarrollarse la reacción de Maillard, que tiene lugar, fundamentalmente, entre los grupos carbonilo de azúcares reductores y los grupo amino proteicos. Los productos de la reacción de Maillard (PRM) pueden afectar la biodisponibilidad mineral por modificaciones de su forma físico-química en el alimento o en el lumen, alterando el proceso de absorción o su normal metabolismo. En este trabajo se estudió la influencia de PRM sobre aspectos de la biodisponibilidad del Ca in vitro e in vivo. Mezclas equimolares de glucosa-lisina (GL) y glucosa-metionina (GM) (40% humedad) fueron calentadas a 150º C durante 90 minutos (muestras GL90 y GM90, respectivamente). La solubilidad in vitro se midió adicionando cada muestra a una solución 3,75 mM Ca con pH y fuerza iónica del intestino; tras agitación y centrifugación se determinó el calcio soluble e insoluble. Un 3% de GL90 y GM90 se añadieron individualmente a la dieta AIN93-G para la obtención de las dietas D-GL90 y D-GM90. Con ellas y con la AIN93-G, como control, se alimentaron durante 21 días tres grupos de ratas Wistar, realizándose balance de calcio en la última semana y, tras sacrificio, extracción de distintos órganos. La presencia de GM90 no afectó a la solubilidad del calcio; GL90 la disminuyó ligeramente, quedando en ambos casos más del 94% soluble. El consumo de D-GL90 y D-GM90 no modificó la biodisponibilidad del elemento, utilizándose tan eficazmente como en la dieta control (57,6 ± 1,3%, 57,8 ± 2,3% y 63,9 ± 2,6% en las dietas control, D-GL90 y D-GM90 respectivamente). Sin embargo, la ingesta de los PRM produjo cambios en el metabolismo que disminuyeron el calcio óseo, acumulándose de forma compensatoria en otros órganos. (Nutr Hosp 2005, 20:70-76) Palabras clave: Productos de la reacción de Millard, calcio, disponibilidad, hueso.
| EFFECTS OF INTAKE OF HEATED MIXTURES OF GLUCOSE-LYSINE AND GLUCOSE-METHIONINE Abstract During food thermal treatment Maillard's reaction may occur, which implicates mainly the carbonyl groups of reductory sugars and amino protein groups. Maillard's reaction products (MRP) may interfere with mineral bioavailability because of modifications of their physical-chemical moiety in the food or the lumen, disrupting the absorption process or its normal metabolism. In this study, we sought to investigate MRP influence on issues related to Ca bioavailability in vitro and in vivo. Equimolar mixtures of glucose-lysine (GL) and glucose-methionine (GM) (40% moisture) were heated at 150º C for 90 minutes (samples GL90 and GM90, respectively). In vitro solubility was measured by additioning each samples to a 3.75 mM Ca solution at intestinal pH and ionic strength; after shaking and centrifugation, soluble and insoluble calcium was determined. Three percent of GL90 and GM90 were individually added to the AIN93-G diet to obtain D-GL90 and D-GM90 diets. Three Wistar rats groups were fed for 21 days with both diets and with AIN93-G as control, carrying out calcium balance during last week and extirpating various organs after sacrifice. GM90 did not affect calcium solubility; GL90 reduced it slightly, remaining in both cases more than 94% soluble. D-GL90 and D-GM90 did not modify calcium bioavailability, with as effective usage as with the control diet (57.6 ± 1.3%, 57.8 ± 2.3% and 63.9 ± 2.6% in control diet, D-GL90 and D-GM90, respectively). MRP intake produced, however, metabolic changes that decreased bone calcium, accumulating compensatorily in other organs. (Nutr Hosp 2005, 20:70-76) Key words: Maillard's reaction products, calcium, bioavailability, bone. |
Correspondencia: Cristina Delgado-Andrade
Unidad de Nutrición. Estación Experimental del Zaidín, CSIC
Camino del Jueves, s/n
18100 Armilla, Granada, España
E-mail: cdelgado@eez.csic.es
Recibido: 20-XI-2003.
Aceptado: 27-III-2004.
Introducción
El calcio es el catión más abundante, así como el quinto elemento más común en el organismo humano. Es, junto con la proteína, el elemento estructural más importante, participando, combinado con el fósforo, en la formación del hueso y el diente (más del 99% del Ca total corporal se encuentra en el esqueleto). Así, el desarrollo y mantenimiento del hueso es el mayor determinante de las necesidades de Ca1. Además, interviene en multitud de funciones, como la conducción nerviosa, la contracción muscular, la coagulación sanguínea, la permeabilidad e integridad de las membranas celulares, las secreciones glandulares, etc.2-5. Debido a la importancia de todos estos aspectos, es de enorme interés identificar factores que puedan afectar la disponibilidad del calcio en la dieta, modificando su utilización y estatus nutritivo.
La reacción de Maillard, que se origina entre el grupo amino de un aminoácido y el grupo carbonilo de un azúcar reductor, es una de las reacciones, favorecidas por el calor, más típicas en los alimentos, aunque también ha sido observada en sistemas que no estaban expuestos a calentamiento, como es el caso de los productos almacenados a bajas temperaturas para su mejor conservación. Incluso se ha detectado en los organismos vivos, en los que se la relaciona directamente con los procesos de envejecimiento y con las complicaciones de la diabetes6. Las características de estos productos, así como la tasa de pardeamiento que llegan a alcanzar, dependen de varios factores, como la naturaleza y la razón molar de los reactantes, contenido de humedad, pH y temperatura, entre otros9.
La consecuencia nutritiva más significativa de la reacción de Maillard es la modificación de la proteína de la dieta, siendo la lisina el aminoácido más afectado8, aunque muchos otros pueden verse involucrados. La participación de la metionina resulta interesante, debido a que los aminoácidos azufrados suelen ser limitantes en muchas proteínas alimentarias, y a la posible toxicidad de los productos de la reacción de Maillard (PRM) formados con ella9.
El efecto de los PRM sobre la biodisponibilidad mineral se atribuye a su comportamiento como agentes quelantes de metales. Rendleman (1987)10 puso de manifiesto la importancia de estos productos en la quelación de iones metálicos en alimentos, al observar, en tostadas elaboradas con leche, una mayor capacidad para unir al Ca y al Cu respecto a las tostadas convencionales. Además, encontró una considerable unión al Ca en los pigmentos pardos del café. Sin embargo, algunos autores han observado que compuestos tempranos de la reacción de Maillard, como la fructosil-lisina, no muestran una unión significativa con el Ca, sugiriendo que el mineral se acompleja preferentemente con los PRM de mayor peso molecular11.
Actualmente, parece haber quedado bien establecida la absorción intestinal de algunos PRM solubles de bajo peso molecular12. Se ha descrito que productos de la reacción más avanzados y con mayor peso molecular afectan la excreción y la absorción mineral13. En este sentido, ensayos llevados a cabo en ratas alimentadas con dietas adicionadas de mezclas calentadas de glucosa-glicina o xilosa-lisina mostraron un incremento de la digestibilidad del calcio, aunque también de su excreción urinaria14. En estudios posteriores, realizados también con PRM procedentes del sistema glucosa-glicina, no se puso de manifiesto efecto alguno sobre la digestibilidad del mineral cuando se trataba de ratas holoxénicas15. O'Brien y col. (1994)16, alimentando ratas con una dieta adicionada de un 0,5% de PRM del sistema glucosa-glutamato monosódico no observaron ningún efecto negativo sobre el balance de calcio. Otros estudios realizados usando como alimento leches infantiles en polvo o esterilizadas en botella evidenciaron que, aunque el calcio de las fórmulas esterilizadas en botella era disponible in vitro, era pobremente utilizado por las ratas recién nacidas. Los autores sugieren que este resultado podría explicarse por la interacción del calcio y la lactulosa y por la presencia de PRM avanzados, no absorbibles17.
Ya que muchos aspectos de la influencia de los PRM sobre la utilización del calcio de la dieta están aún por dilucidar, y debido al abundante consumo de estos productos en la dieta habitual humana, en el presente trabajo nos propusimos estudiar el efecto de los PRM sobre ciertos aspectos de la disponibilidad del Ca in vitro e in vivo.
Material y métodos
Preparación de las muestras
Las muestras se prepararon utilizando glucosa (Merck, Darmstad, Alemania), lisina y metionina (Sigma Chemical Co., St. Louis, Mo., U.S.A.). Mezclas equimolares de glucosa y lisina-HCI (muestra GL) o glucosa y metionina (muestra GM) (ambas con 40% de humedad) fueron calentadas en un horno (Selecta 2000210, Barcelona, España) a 150º C durante 90 min. (muestras GL90 y GM90, respectivamente), utilizando recipientes abiertos. Tras el calentamiento la reacción se detuvo como se describe en Delgado-Andrade (2002)18. El producto obtenido se extrajo con agua desmineralizada (Milli-Q Ultrapure Water System, Millipore Corp., Bedford, Mass., U.S.A.), se congeló a -20º C, se liofilizó (FTS System, INC., TDS-3, New York, U.S.A.) y se conservó en bolsas de polietileno a 4º C con silicagel hasta el momento de su utilización en los ensayos in vitro e in vivo.
El desarrollo del pardeamiento durante el tratamiento térmico se realizó mediante la medida de la absorbancia a 420 nm19 en un espectrofotómetro u.v./visible Milton Roy Spectronic-1201 (Rochester, N. Y., U.S.A.).
Ensayo de solubilidad in vitro
100 mg de cada muestra (GL, GL90; GM, GM90) fueron individualmente suspendidos en un volumen final de 10 ml de una solución 3,75 mM de Ca. Para semejar las condiciones intestinales, el pH y la fuerza iónica fueron ajustados en las soluciones que contenían las muestras a 6,5-7 y 0,165, respectivamente, usando NaOH 4N y KCl 1,65M10. Las soluciones fueron agitadas en baño a 25º C durante 2 h y centrifugadas a 8.000 r.p.m. (Hettinch Zentrifugen, Universal 30FR D-78532 Tuttligen) otras 2 h. Tras la centrifugación, se midió el contenido de Ca en las fracciones obtenidas. Los porcentajes de Ca soluble y precipitado fueron calculados a partir de la concentración inicial de Ca.
Preparación de las dietas
La dieta AIG-93G para ratas de laboratorio20 fue utilizada como control (D-C). Las muestras GL90 y GM90 fueron individualmente adicionadas a la dieta AIN-93G en una proporción final del 3%, resultando las dietas D-GL90 y D-GM90 respectivamente.
Las tres dietas fueron analizadas en cuanto a su contenido en nutrientes y no se encontraron diferencias significativas entre ellas. El contenido medio en nutrientes fue el siguiente (media ± desviación estándar): humedad (%) 8,01 ± 0,44, N2 (g/kg) 29,07 ± 0,17, grasa (g/kg) 69,43 ± 0,54 y Ca (g/kg) 4,80 ± 0,27.
Ensayo biológico
Treinta ratas Wistar recién destetadas con peso 41,7 ± 0,4 (media ± error estándar) fueron situadas individualmente en jaulas metabólicas en una habitación de ambiente controlado que se mantuvo a 20-22º C, con un ciclo de luz-oscuridad de 12h y 55-70% de humedad. Los animales fueron distribuidos en tres grupos de diez ratas (5 hembras y 5 machos) y se les asignó uno de los tratamientos dietéticos. Los grupos se denominaron C (control), GL90 y GM90. Las ratas consumieron las distintas dietas y agua desmineralizada ad libitum. El ensayo comenzó con una etapa preliminar de 14 días durante la que se monitorizó la ingesta sólida y el peso, seguida de un segundo período de 7 días en el que se realizó el balance de Ca, mediante la recogida de heces y orina, controlándose igualmente ingesta y peso. Las heces se pesaron antes de su liofilización y fueron posteriormente homogenizadas. La orina se recogió sobre HCI 0,5% (vol/vol), se filtró (Papel de filtro Whatman n.º 40, exento de cenizas, Whatman, Inglaterra) y se diluyó hasta un volumen apropiado. Para controlar en la medida de lo posible la contaminación ambiental durante la recogida de las excretas, se manipularon jaulas vacías del mismo modo para ser utilizadas como blancos.
El día 21 los animales fueron anestesiados con pentobarbital sódico (5 mg/100 g peso) (Laboratorios Abbott, Granada, España) y sacrificados por extracción total de la sangre mediante la canulación de la arteria aorta (según protocolo aprobado por el U.S. Dept. of Agriculture, Health and Human Service y por The Institutional Care and Use Committee). La sangre fue centrifugada a 1700 x g durante 10 minutos para la obtención de suero. Se extrajeron el hígado y fémur que, junto con el suero, fueron congelados a -20º C hasta el momento del análisis de calcio.
Todo el procedimiento experimental desarrollado en este estudio se realizó de acuerdo a la actual regulación europea para animales de laboratorio.
Técnicas analíticas
Alícuotas de heces y dietas fueron totalmente digeridas por la adición de HNO3 y HCIO4 concentrado y por calentamiento a altas temperaturas en un baño de arena. Los órganos fueron digeridos por vía seca en un horno muffla (Selecta, Mod. 366, Barcelona, España) a 450º C hasta la obtención de cenizas blancas, que fueron disueltas con HCI/HCNO3/H2O (1:1:2) (Suprapur, Merck, Darmstadt, Alemania). Todas las muestras fueron diluidas con agua Milli-Q (Milli-Q Ultrapure Water System, Millipore Corp. Bedford, MA) hasta un volumen adecuado para su medida.
La concentración de Ca en la orina y suero fue determinada directamente en la dilución adecuada para cada muestra.
El análisis de calcio se llevó a cabo en todas las muestras mediante la técnica de espectrofotometría de absorción atómica a la llama en un espectrofotómetro Perkin-Elmer Analyst 700 (Norwalk, Conn., U.S.A.). Se prepararon soluciones estándar de Ca a partir de una solución stock Tritisol (CI2Ca en 6,5% HCI, 1.000 mg Ca, Merck). Se adicionó cloruro de lantano (Merck) a las muestras y a los estándares (0,3%) con el fin de eliminar interferencias.
Mezclas representativas de heces, orina y dieta fueron usadas como control interno para comprobar la precisión. El coeficiente de variación inter ensayo para el calcio fue 0,85% en heces, 0,95% en orina y 2,07% en la dieta. Se utilizó polvo de leche (material de referencia certificado CRM 063; Community Bureau of Reference, Bruselas, Bélgica) para cuantificar la exactitud, conduciendo a un valor de 13,48 ± 0,04 mg/g de Ca (media ± desviación estándar; valor certificado: 13,49 ± 0,10 mg/g).
Todo el material utilizado a lo largo de los experimentos fue lavado con HNO3 10N y se utilizó agua Milli-Q sin excepciones.
Los siguientes índices fueron calculados utilizando los datos obtenidos de la ingesta y la excreción de Ca en heces y orina durante la última semana del ensayo: retención aparente o balance (Ca ingerido - Ca fecal - Ca urinario); eficacia de retención (%R/A) = retención aparente / Ca ingerido Ca fecal x 100; y eficacia de utilización o biodisponibilidad (%R/I) retención aparente / Ca ingerid x 100.
Tratamiento estadístico
Los resultados de la solubilidad del Ca in vitro, del balance de Ca y de la concentración del mismo en los distintos órganos fueron analizados mediante un Ano va de una vía y seguidos de un test de Duncan para comparar medias que mostraran diferencias significativas (p < 0,05).
Resultados y discusión
Ensayo de solubilidad in vitro
Puesto que los PRM pueden afectar la disponibilidad del Ca a traves de modificaciones en su "especiación", es decir, en su forma físico-química, lo primero que ha de tenerse en cuenta es el estado inicial (soluble o precipitado) del elemento en la solución de partida, cuya concentración era 3,75 mM Ca, en ausencia de muestra y bajo las mismas condiciones de pH y fuerza iónica. De esta forma, se obtuvo que un 93,6 ± 6,50% quedaba soluble y que el 7,02 ± 4,95% precipitaba. Al incluir la muestra GL en la solución cálcica no se observó cambio significativo en la solubilidad del elemento (tabla I), ya que prácticamente se encontraba todo soluble. Este hecho concuerda con las observaciones de Irving (1973)21, cuando señala que el efecto estimulador del aminoácido sobre la absorción del Ca no está ligado a la formación de complejos con el mismo. En el caso de la muestra GL90 (tabla I), su presencia en la solución tampoco indujo modificación cuantitativa del Ca soluble, aunque el porcentaje de Ca precipitado fue significativamente superior.
Tampoco se manifestó variación en la solubilidad del mineral debida a la inclusión de la muestra GM en la solución de Ca, ni por la inclusión de la muestra GM90, caso en el que sólo se observó un incremento leve, aunque significativo, de la fracción precipitada.
A pesar de que Rendleman ya en 1987 señalaba la unión del Ca a melanoidinas insolubles procedentes de otros reactantes, con posibilidad de uniones variables según estos últimos, nuestros resultados sugieren una unión inferior con las melanoidinas insolubles formadas. Los datos obtenidos concuerdan con los resultados del mismo autor al señalar que los pigmentos pardos del café tienen muy baja afinidad por el Ca, ya que su precipitación sólo se origina a concentraciones muy altas del catión, que no eran las de nuestro ensayo. En la misma línea algunos autores han señalado que la afinidad de estos compuestos para unir distintos minerales no está bien definida, aunque sugieren un orden en el que el Ca ocuparía el último lugar, precedido del Mg11.
Ensayo biológico
La ingesta cálcica no fue diferente significativamente en ningún grupo (tabla II). Por su previsible capacidad para fijar al Ca10, se sugería que los productos de la reacción de Maillard podrían afectar su absorción ya que, por una parte, los compuestos insolubles o solubles de elevado peso molecular, excretados totalmente vía fecal22, podrían entorpecer su absorción, mientras que la unión a premelanoidinas absorbibles favorecería su eliminación en la orina16. La bibliografía sólo señala disminuciones reales del Ca absorbido en ensayos con proteínas calentadas en los que se produce también depresión de la ingesta, que se convierte en el principal determinante del menor aporte cálcico al organismo, ya que, en ocasiones, la digestibilidad del mismo se halla aumentada17,23.
Aumentos en la excreción urinaria de Ca se han relacionado con el consumo de dietas ricas en proteína, fundamentalmente carne24, dependientes en gran medida de su contenido en aminoácidos azufrados25,26, o con dietas suplementadas con metionina27. Parece que un incremento en la filtración de SO42- es pobremente reabsorbido28 y puede afectar negativamente la reabsorción del Ca filtrado, bien haciendo más electronegativo el lumen tubular o aumentando la fracción acomplejada de Ca filtrado29. Según los últimos autores, la hiperexcreción cálcica en la orina sería proporcional al contenido en azufre de la dieta, y ello explicaría que en nuestros ensayos la metionina residual y, posiblemente, también sus productos de Maillard, si de alguna manera se metabolizan y eliminan30, contribuyeran al incremento del Ca urinario18. En consecuencia, en el grupo GM90 disminuyó la eficacia con la que el Ca se utilizó a nivel metabólico, cuyo coeficiente, %R/A (fig. 1), descendió leve pero significativamente, poniendo de manifiesto una vez más la importancia del aminoácido participante en los productos formados y en sus consecuencias fisiológicas31.
A pesar de lo expuesto, los cambios en la excreción del Ca urinario fueron cuantitativamente pequeños y compensados parcialmente por la absorción18, de manera que no se llegó a afectar el balance cálcico, similar en todos los grupos (tabla II). Estos resultados concuerdan con otras observaciones de hipercalciuria acompañadas de retenciones estables tanto con el consumo de compuestos pardos16,32 como por el de alimentos hiperproteicos ricos en aminoácidos azufrados, si bien con estos últimos resultó más frecuente el deterioro del Ca corporal33.
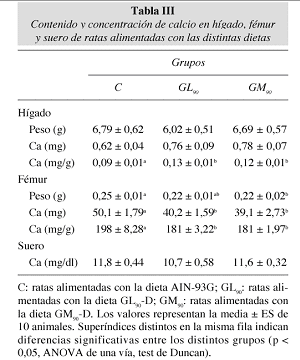
De forma global, el Ca se utilizó en la última semana de balance con una eficacia similar en todos los grupos (fig. 1). Aún así, no puede concluirse de este trabajo que la ingesta de tales productos no haya afectado en absoluto la utilización nutritiva del catión ni su metabolismo, ya que la distribución del calcio corporal parece que sí se vio modificada por el consumo de todos los productos ensayados (tabla III). De este modo, se indujo una redistribución anormal del elemento hacia órganos no específicos, como el hígado, en detrimento de su almacén natural, el hueso.
Como era de esperar, la calcemia permaneció estable, de acuerdo con lo observado por O'Brien y Walker (1988)34 a dosis mucho más elevadas de ingesta de productos pardos. Sorprendentemente, el Ca se acumuló en el hígado de los animales que ingirieron los PRM (tabla III). Nada similar se ha encontrado en la bibliografía como consecuencia del consumo de PRM, sólo cabe recordar la acumulación preferencial de estos compuestos en este órgano30,8 y sugerir que, de alguna forma, ello pudo mediar el depósito del elemento.
Sin duda, los efectos que merecen mayor atención son los ocurridos a nivel óseo (tabla III). Los fémures de las ratas que consumieron los derivados pardos contenían menos Ca, lo que no fue sólo producto del menor peso femoral, ya que en el grupo de glucosa-lisina calentada los pesos eran similares a los de las ratas controles, en las que, además, no se encontró la correlación peso de fémur-contenido cálcico, que sí se detectó en las demás. Por tanto, debieron existir mecanismos adicionales que hicieron disminuir la concentración cálcica ósea y que parecen estar relacionados con el consumo de los PRM, sin depender del tipo de aminoácido que intervino en la mezcla, ni del Ca retenido.
Describe una reducción del hueso en animales que consumieron alimentos pardos35, así como menores pesos, cenizas y contenido cálcico de huesos de ratas alimentadas con dietas cuya proteína, caseína, había sido dañada por el calor, afectándose también, en alguna cuantía, la concentración de Ca óseo23.
Ciertas observaciones que, de alguna forma, podrían estar relacionadas con los efectos de los PRM, sin depender del tipo de aminoácido que intervino en la mezcla ni del Ca retenido.
La bibliografía científica describe una reducción de la fuerza del huesos en animales que consumieron alimentos pardos35, así como menores pesos, cenizas y contenido cálcico de huesos de ratas alimentadas con dietas cuya proteína, caseína, había sido dañada por el calor, afectándose también, en alguna cuantía, la concentración de Ca óseo23.
Por último, deben señalarse ciertas observaciones que, de alguna forma, podrían estar relacionadas con los efectos de los PRM sobre el hueso. El colágeno es una proteína de vida media larga, de lento recambio, por lo que resulta muy susceptible a la glicación in vivo36. Según los estudios de varios autores37,38, el colágeno epitelial parece ser un tejido especialmente apropiado para el acúmulo de productos de Maillard. Prueba de ello es el aislamiento de histidino-alanina y lisino-alanina en matrices de colágeno óseo calcificadas39,40. Además, actualmente se piensa que la participación de azúcares derivados de glicosilaciones no enzimáticas en el entrecruzamiento de la matriz proteica podría relacionarse con el envejecimiento41,42, frecuentemente asociado con los fenómenos osteoporóticos43. De hecho, la formación de productos avanzados de la glicosilación origina cambios bioquímicos y fisiológicos en el tejido conectivo36. Aunque nosotros no hemos comprobado la existencia de tales compuestos en el hueso, sugerimos la posible participación de estos cambios en las modificaciones observadas en la calcificación ósea. En este sentido, en las investigaciones más recientes se discute si los productos pardos exógenos son sinérgicos o antagónicos con sus análogos producidos endógenamente.
En resumen, puede decirse que el consumo de estos derivados del calentamiento de las mezclas de glucosa-lisina y glucosa-metionina no modificó de forma notable la disponibilidad del Ca, ya que su presencia no modificó la solubilidad del elemento en una proporción apreciable. No se alteró tampoco la eficacia en la utilización global del Ca, esto es, su biodisponibilidad. Sin embargo, tras su ingesta en la dieta parecieron manifestarse cambios metabólicos que afectaron negativamente la mineralización ósea y ocasionaron acúmulos tisulares anormales del nutriente, lo que, a largo plazo, podría desembocar en consecuencias negativas para la salud.
Referencias1. Cashman KD, Flynn A: Optimal nutrition: calcium, magnesium and phosphorus. Proc Nut Soc 1999, 58:477-487. [ Links ]
2. Krane SN: Calcium phosphatase and magnesium. En Rasmusen H (ed.): The International Encyclopedia of Pharmacology and Therapeutics. Pergamon Press, London, vol. I, 1970:19-59. [ Links ]
3. Robertson WG: Chemistry and biochemistry of calcium. En Nordin (ed.): Calcium in Human Biology. B.E.C. International Life Science Institute. London. Springer-Verlag, 1988:1-25. [ Links ]
4. Favus, MJ: Primer on the metabolic bone diseases and disorders of mineral metabolism, 2, edition. Ed.: Favus, M. J. Raven Press, New York, 1993. [ Links ]
5. Instituto de Medicina: Dietary reference intakes: calcium, magnesium, phosphorus, vitamin D and fluoride. National Academy Press, Washington D. C., 1997. [ Links ]
6. Ledl F: Chemical pathways of the Maillard Reaction. En Finot PA, Aeschbacher HU, Hurrell RF y Liardon R (eds.): The Maillard Reaction in Food Processing, Human Nutrition and Physiology. Advances in Life Science, Birkhäuser, Verlag, Switzerland, 1990:345-353. [ Links ]
7. Kato Y, Matsuda T, Kato N, Nakamura R: Maillard Reaction of disaccharides with protein: suppresive effect of non reducing end pyranoside groups on browning and protein polymerization. J Agr Food Chem 1989, 37:1077-1081. [ Links ]
8. O'Brien J, Morrissey PA: Nutritional and Toxicological aspects of Maillard Browning reaction in foods. Crit Rev Food Sci Nutr 1989, 28:211-248. [ Links ]
9. Benevenga NJ, Steele D: Adverse effects of excessive consumption of amino acids. Ann Rev Nutr 1984, 4:157-181. [ Links ]
10. Rendleman JA: Complexation of calcium by the melanoidin and its role in determining bioavailability. J Food Sci 1987, 6,52:1699-1705. [ Links ]
11. O'Brien J, Morrissey PA: Metal ion complexation by products of the Maillad Reaction. Food Chem 1997, 58:17-27. [ Links ]
12. Faist V, Erbersdobler HF: Metabolic transit and in vivo effects of melanoidins and precursor compounds deriving from the Maillard Reaction. Ann Nutr Metab 2001, 45:1-12. [ Links ]
13. Furniss DE, Vuichoud J, Finot PA, Hurrell RF: The effect of Maillard Reaction Products on Zinc Metabolism in the rat. Brit J Nutr 1989, 62:739-749. [ Links ]
14. Adrian J, Boisselot-Lefebvres J: Efficiency of various B vitamins in zein base diets. Int Z Vitam Ernahrungsforsch Beih 1977, 47:1,32-9. [ Links ]
15. Andrieux C, Saquet E: Effects of Maillard's reaction products on apparent mineral absorption in different parts of the digestive tract. The role of microflora. Reprod Nutr Develop 1984, 23:379-386. [ Links ]
16. O'Brien J, Morrissey PA, Flynn A: Alterations of Maillard metabilism and secondary pathology in rats fed Maillard reaction products. En Labuza TP, Reineccius GA, Monnier V, O'Brien J, Baines J (eds.): Maillard Reaction in Chemistry, Food and Health. 1994:397-401. [ Links ]
17. Sarriá B, López-Fandino R, Vaquero MP: Does processing of a powder or in-bottle-sterilized liquid infant formula affect calcium bioavailability? Nutrition 2001, 17:326-331. [ Links ]
18. Delgado-Andrade: Reacción de Maillard: Influencia sobre la biodisponibilidad mineral. Tesis Doctoral. Universidad de Granada. Delgado-Andrade, Granada, España, 2002. [ Links ]
19. Friedman M, Molnar-Perl I: Inhibition of browing by sulfur amino acids. 1. Heated amino acid-glucose systems. J Agric Food Chem 1990, 38:1642-1647. [ Links ]
20. Reeves PG, Nielsen FH, Fahey GC: AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition Ad Hoc Writing Committee on the reformulation of the AIN-76A rodent diet. J Nutr 1993, 123:1939-1951. [ Links ]
21. Irving JT: Calcium and Phosphorus Metabolism. Academy Press, New York, 1973, 25. [ Links ]
22. Finot PA: Metabolism and Physiological effects of Maillard Reaction Products (MRP). En Finot PA, Aeschbacher HV, Hurrell RF, Liardon R (eds.): The Maillard Reaction in Food Processing, Human Nutrition and Physiology. Birkhäuser Verlag, Basel, Switzerland, 1990:259-272. [ Links ]
23. Yuan YV, Kitts DD: Calcium absorption and bone utilization in spontaneously hypertensive rats fed on native and heatdamaged casein and soya-bean protein. Br J Nutr 1994, 71,4:583-603. [ Links ]
24. Whiting SJ, Draper HH: The role of sulfate in the calciurua of high protein diets in adult rats. J Nutr 1980, 110:212-217. [ Links ]
25. Singh PP, Hussain F, Gupta RC, Pendse AK, Raj-Kiran, R-G: Effect of dietary methionine and inorganic sulfate with and without calcium supplementation on urinary calcium excrection of guines pigs (Calvia porcellus). Indian Exp Biol 1993, 31(11):96-97. [ Links ]
26. Block GD, Wood RJ, Allen LH: A comparation of the effects of feeding sulfur amino acids and protein on urine calcium in man. Am J Clin Nutr 1980, 33:2128-2135. [ Links ]
27. Wang XB, Zhao XH: The effect of dietary sulfur-containing amino acids on calcium excretion. Adv Exp Med Biol 1998:442495-442499. [ Links ]
28. Zemel MB: Calcium utilization: effect of varying level and source of dietary protein. Am J Clin Nutr 1988, 48:880-883. [ Links ]
29. Shuette SA, Zemel MB, Linkswiler HM: Studies on the mechanism of protein-induced hypercalciuria in older men and women. J Nutr 1980, 110:305-315. [ Links ]
30. Homma S, Fujimaki M: Growth response of rats fed a diet containing nondialyzable melanoidins. Prog Food Nutr Sci 1981, 5:209. [ Links ]
31. Abu-Dweih BM, Tukan SK, Takruri HR: The effect of browning intensity on the protein quality of qurshallah. Int J Food Sci Nutr 2000: 6:483-488. [ Links ]
32. Seiquer I, Aspe T, Vaquero P, Navarro: Effects of heat treatment of casein in the presence of reducing sugars on calcium bioavailability: in vitro and in vivoassays. J Agr Food Chem 2001, 49(2):1049-1055. [ Links ]
33. Lotspeich WD: Renal tubular absorption of inorganic sulfate in the normal dog. Am J Physiol 1974, 151:311-318. [ Links ]
34. O'Brien J, Walker R: Toxicological effects of dietary Maillard Reaction Products in the rat. Food Chem Toxicol 1988, 26(9):775-783. [ Links ]
35. Gregor JL, Emery SM: Mineral metabolism and bone strenght of rats fed coffee and decoffeinated coffee. J Agric Food Chem 1987, 35:551-556. [ Links ]
36. Sajithlal GB, Chithra P, Chandrakasan G: An in vivo study on the role of metal catalyzed oxidation in glycation and crosslinking of collagen. Mol Cell Biochem 1999:257-263. [ Links ]
37. Dunn JA, Dyer DG, Knecht KJ, Thorpe SR, McCance DR, Bailie K, Silvestri G, Lyons TJ, Baynes JW: En Finot PA, Aeschbacher HV, Hurrell RF, Liardon R (ed.): Maillard reaction in Food Processing. Human Nutrition and Physiology. Advances in life Sciences. Birkhäuser, Verlag, 1990:425-430. [ Links ]
38. Abraham E, Tsai C, Abraham A, Swamy M: Formation of early and advanced glycation products of lens crystallins with erythrose, ribose and glucose. En Finot PA, Aeschbacher HV, Hurrell RF, Liardon R (eds.): Maillard reaction in Food Processing. Human Nutrition and Physiology. Advances in life Sciences. Birkhäuser, Verlag, 1990:437-442. [ Links ]
39. Fujimoto D, Hirama M, Iwashita T: Histidinoalanine, a new crosslinking amino acid, in calcified tissue collagen. Biochem Biophys Res Commun 1982a:104,1102. [ Links ]
40. Fujimoto D, Hirama M, Iwashita T: Occurrence of lysinoalanine in calcified tissue collagen. Biochem Biophys Res Commun 1982b:103,1378. [ Links ]
41. Monnier VM, Sell DR, Nagaraj RM, Miyata S, Grandhee S, Odetti P, Ibrahim SA: Maillard reaction-mediated molecular damage to extracellular matrix and other tissue proteins in diabetes, aging and uremia. Diabetes 1992:41,36. [ Links ]
42. Reiser K: Nonenzymatic glycation of collagen in aging and diabetes. Proc Soc Exp Biol Med 1991, 196,17. [ Links ]
43. Wood RJ: Searching for the determinants of intestinal calcium absorption. Am J Clin Nutr 2000, 72:675-676. [ Links ]