Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.20 no.6 Madrid nov./dic. 2005
Nutrición enteral con dieta inmunomoduladora perioperatoria
O. Abdel-lah Fernández*, A. Abdel-lah Mohamed**, J. Sánchez Fernández** y A. Gómez Alonso**
*Servicio de Cirugía General y del Aparato Digestivo. Hospital Universitario Central de Asturias.
**Servicio de Cirugía y del Aparato Digestivo. Hospital Universitario de Salamanca. España.
| Resumen Objetivo: Valorar el estado nutricional en el perioperatorio, de pacientes afectos de cáncer esofágico o gástrico, tratados mediante esofaguectomía y gastrectomía total respectivamente, y analizar la repercusión de la dieta enteral inmunomoduladora con las complicaciones postquirúrgicas. (Nutr Hosp 2005, 20:403-408) Palabras clave: Nutrición enteral. Inmunonutrición. Nutrición perioperatoria. | ENTERAL NUTRITION WITH PERI-SURGERY IMMUNOMODULATING DIET Abstract Objective: To assess the nutritional peri-surgical status of patients suffering from esophageal or gastric cancer, treated with esophagectomy and total gastrectomy, respectively, and to analyze the impact of an enteral immunomodulating diet on postsurgical complications. (Nutr Hosp 2005, 20:403-408) Key words: Enteral nutrition. Immuno-nutrition. Peri-surgical nutrition. |
Correspondencia: Aomar Abdel-lah
Muñoz Torrero, 1
37007 Salamanca
E-mail: bad@usuarios.retecal.es
oabdel@hispavista.com
Recibido: 2-XI-2004.
Aceptado: 3-II-2005.
Introducción
La nutrición enteral (NE) se basa en el aporte de nutrientes con formulación químicamente definida, por vía digestiva, utilizando el tracto gastrointestinal viable para su correcta absorción.
La NE que es un arma terapéutica para el médico, es más fisiológica y de menor coste que la nutrición parenteral, además de disminuir la translocación bacteriana y permitir un adecuado funcionamiento del sistema inmune intestinal.
La nutrición perioperatoria en cirugía mayor abdominal es un pilar básico dentro de las medidas de soporte que precisan estos pacientes. Diversos estudios han destacado la elevada incidencia de malnutrición en los pacientes quirúrgicos. Destaca entre ellos la investigación multicéntrica de Kamat1 en la que participaron 33 hospitales con un total de 3047 pacientes, observando que el 58,4% de los pacientes tienen algún marcador analítico nutricional alterado.
Los pacientes sometidos a cirugía gastrointestinal agresiva, tardan excesivo tiempo en satisfacer sus necesidades nutricionales; si a esto le sumamos que un elevado porcentaje presenta malnutrición en el periodo preoperatorio, todo ello, constituye un motivo de preocupación para los cirujanos, debido a la correlación entre la ingesta preoperatoria inadecuada y la aparición de complicaciones2.
Los enfermos desnutridos se ven expuestos a periodos de curación más largos, padecen más complicaciones, presentan unos índices elevados de morbimortalidad e incrementan los costes3-5.
La inmunonutrición nació a principios de los 90, con la idea de ser una vía con la cual además de administrar al paciente los requerimientos nutricionales, puede mejorar su estado inmunológico con el aporte de sustratos nutricionales con capacidad inmunomoduladora, con el fin de minimizar la respuesta a la agresión quirúrgica6.
El objetivo de nuestro estudio es observar la tolerancia de la NE precoz con dieta inmunomoduladora, en los pacientes sometidos a cirugía mayor gastrointestinal alta, la evolución de sus parámetros nutricionales, días de hospitalización y su morbimortalidad.
Pacientes y métodos
Pacientes
De un total de 89 pacientes, 21 fueron excluidos por no cumplir algún criterio del estudio, obteniendo una muestra final de 68 pacientes, todos ellos con el diagnostico histológico de carcinoma de esófago o estómago y tratados quirúrgicamente practicándose esofaguectomía o gastrectomía total.
Los pacientes fueron estudiados entre enero 1998 y abril de 2002. De los 68 pacientes 36 fueron esofaguectomías y 32 gastrectomías totales, todos ellos fueron intervenidos por el mismo equipo de tres cirujanos, con la misma técnica y con los mismos materiales.
Todos fueron sometidos a controles nutricionales e inmunológicos en el preoperatorio, al 5º día y al 10º día postoperatorios.
Método
Previa realización de las determinaciones y toma de muestras para los parámetros analíticos, (tabla I) se inició en el 5º día previo a la intervención una dieta inmunomoduladora de 1000Kcal/día por vía oral, más una dieta normal por turmix. La nutrición se continuó en el postoperatorio inmediato dentro de las primeras 24h, a través de un catéter de yeyunostomía, colocado al final de la intervención, de forma progresiva hasta conseguir, hacia el 4º o 5º día, 25 Kcal/kg/día y 1,2-1,5 g de proteínas/kg/día, durante un mínimo de 10 días. Para las determinaciones antropométricas se utilizó una balanza con altímetro marca SECA y las determinaciones analíticas fueron realizadas en los autoanalizadores de nuestro hospital.
Método estadístico
Mediante el programa estadístico SPSS 11, se realizó un estudio pronóstico mediante una regresión logística, sobre parámetros generales y nutricionales (tabla I) como variables independientes y la morbimortalidad como variable dependiente.
Se evaluaron también las variables relacionadas con el estado nutricional e inmunológico en el preoperatorio y en el postoperatorio, utilizando la t-Student para muestras relacionadas y el intervalo de confianza al 95% para la diferencia de medias. Se verificó el coeficiente de correlación de Pearson (r) y su grado de significación (p) entre los dos pares de muestras; preoperatorios y postoperatorias al 5º y 10º día.
Resultados
De los 36 pacientes esofagectomizados, 35 son varones y 1 es mujer, con una media de edad de 60 ± 9,68 años con una estancia media postoperatoria de 36,97 ± 62,37 días. De los 32 pacientes gastrectomizados 21 son varones y 11 mujeres, con una edad y estancia media postoperatorias de 69,41 ± 11,53 años y 24,41 ± 13,77 días respectivamente.
Casi todos los pacientes tienen un ASA II-III/V (53% ASA II y 41% ASA III).
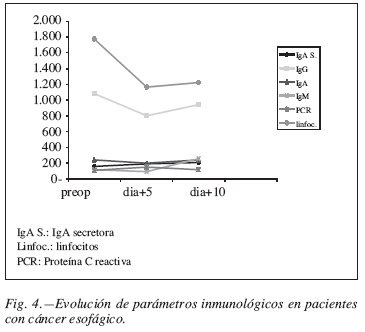
El número de infecciones, dehiscencia de sutura y mortalidad se constatan en la figura 1. La evolución de proteínas totales, albúmina, prealbúmina, transferrina colesterol y triglicéridos para pacientes esofaguectomizados se muestran en figura 2. Los mismos parámetros para pacientes gastrectomizados están en la figura 3. La evolución de escalares analíticos están representados en la figura 4 para pacientes con cáncer de esófago y en la figura 5 para pacientes con cáncer gástrico.
La ecuación de predicción que responde al modelo:
![]()
donde β corresponde a los coeficientes y X a los valores de cada variable, tiene los siguientes guarismos que figuran en la tabla II.
Y por último, los resultados de las comparaciones de medias para datos relacionados figuran en la tabla III.
Discusión
La relación entre la morbimortalidad y el estado nutricional es conocida desde hace más de cinco décadas7. Numerosos estudios han demostrado que una situación de malnutrición conduce a una respuesta metabólica inadecuada. Además, como sucede en nuestro estudio, los pacientes oncológicos presentan mayor grado de malnutrición y si a esto sumamos el estrés quirúrgico, esta situación se hace más marcada y la posibilidad de que aparezca una complicación postoperatoria aumenta4, 8.
Llama la atención el número de procesos infecciosos de estos pacientes, que es elevado, pero hemos valorado cualquier tipo de infección que estos enfermos pudieran presentar durante su evolución postoperatoria tanto las atribuibles a la técnica quirúrgica como a las complicaciones médicas. Tanto el porcentaje de dehiscencias como la mortalidad están dentro de lo descrito en la bibliografía en ambos grupos pera sus respectivas patologías9, 10.
Hay que resaltar en lo que se refiere a los pacientes afectos de carcinoma esofágico la buena correlación entre la muestras de las variables, excepto en los pares de muestras IgM5 e IgM10, linfocitos y PCR entre los pares del 5.º y 10.º día, que tienen coeficientes de correlación muy bajos.
Se produjo una disminución de las cifras de todas las variables, salvo dos, en la determinación del 5º día respecto de la determinación preoperatorio y posterior aumento en la determinación del 10º día respecto del 5º día, estas diferencias son en la mayoría de los casos significativas. Las dos variables que no se comportaron de la forma mencionada anteriormente, son la IgA secretora que aumentó sucesivamente en las determinaciones al 5º y 10º día respecto al valor preoperatorio, siendo significativa la diferencia entre preoperatorio y 5.º día. Y la PCR que aumentó de forma significativa entre la determinación preoperatorio y la del 5º día.
Respecto a los pacientes con carcinoma gástrico hay coeficientes de correlación bajos en las comparaciones de la IgA secretora y la PCR.
La IgA secretora y la PCR se comportan de forma similar a la de los pacientes con carcinoma esofágico.
En cuanto a la ecuación de regresión logística se deben descartar las variables porcentaje de perdida de peso y la constante, porque su nivel de significación es superior al 0,05, que es el habitualmente considerado. Debemos señalar que a pesar de que la variable sexo masculino tenga una influencia destacada en la probabilidad de morbimortalidad, también debe ser descartada, puesto que el predominio que este sexo tiene en estas patologías, estaría produciendo un sesgo.
La existencia de vómitos, disfagia y/o anorexia son responsables de una perdida progresiva más rápida de peso. El porcentaje de perdida de peso es un parámetro clínico que ha demostrado buena correlación con la morbimortalidad postoperatoria, una perdida de peso del 10% en 6 meses se considera muy importante, es decir, el riesgo de complicaciones aumenta con la cuantía de la perdida y la velocidad de instauración11, aunque existen estudios que consideran que una perdida de peso del 10% no es pronóstica a no ser que estén presentes otras alteraciones concomitantes12. En nuestra serie los resultados parecen apoyar esta última idea. Debemos interpretar el porcentaje de pérdida de peso, a pesar de su valor pronóstico, en función del contexto clínico global del paciente.
De los parámetros biológicos estudiados, en el caso de la albúmina plasmática, se ha demostrado en estudios epidemiológicos la correlación entre los niveles del albúmina y la mortalidad con independencia de la patología subyacente13.También, se ha objetivado correlaciones entre los niveles de albúmina < 3,5 g/dl y la morbimortalidad postoperatoria en los enfermos sometidos a cirugía mayor gastrointestinal12, 14.
La albúmina está sometida a numerosas influencias metabólicas, por lo que se han determinado otras proteínas de vida media más corta como parámetros nutricionales más precisos, como son la proteína ligada al retinol, prealbúmina y la transferrina.
La proteína ligada al retinol se encuentra disminuida en la hipovitaminosis A y puede incrementarse en los pacientes con insuficiencia renal crónica, su determinación no se realiza de forma rutinaria en los hospitales.
La prealbúmina es más sensible que la albúmina y la transferrina para determinar cambios en el metabolismo proteico-calórico15. Su vida media es más corta, presenta sensibles descensos en el curso de reacciones inflamatorias, en la infección y en los traumatismos comportándose como un reactante de fase aguda negativo16.
La transferrina puede ser utilizada como marcador del malnutrición crónica; siempre que su metabolismo no este asociado con anemia ferropénica, situación observada con frecuencia en pacientes con canceres gastrointestinales.
Existen factores ajenos que limitan la utilidad de estas proteínas plasmáticas y alteran sus valores séricos, debido a que se comportan como reactantes de fase aguda negativos, por lo que disminuyen en respuesta a la cirugía, sepsis y otros procesos agudos. Lo que explicaría el descenso de las cifras de nuestra serie en el 5º día del postoperatorio para paulatinamente recuperarse a niveles preoperatorios. Pensamos que para que los efectos inmunológicos sean mejor ponderados y los marcadores nutricionales menos influenciados por los cambios hemodinámicas típicos de este tipo de cirugía y la respuesta a la agresión, los parámetros deben ser medidos a más largo plazo.
También se intentó analizar el índice pronostico nutricional, con la finalidad de mejorar la precisión en la valoración nutricional y su capacidad pronóstica, midiendo la albuminemia y la variación del peso del paciente; pensamos como otros autores que es un índice útil y con mejor fundamento clínico para una valoración objetiva del estado nutricional17.
La NE postoperatoria precoz en pacientes que fueron sometidos a cirugía gastrointestinal alta es una terapéutica segura y bien tolerada, incluso dentro de las primeras 12 horas del postoperatorio y aunque se presentan complicaciones como diarrea y distensión abdominal entre otras, estas son leves y no suponen la suspensión de la alimentación enteral18, 19.
La función de la inmunidad humoral y la celular esta comprometida en pacientes sometidos a cirugía gastrointestinal por cáncer. La supresión inmune es un fenómeno común y parece que se relaciona con la evolución del paciente y la enfermedad en el postoperatorio. Hay varios estudios sobre el uso de NE en el postoperatorio inmediato con el fin de disminuir en lo posible la disfunción inmune producida por la cirugía y la enfermedad20. La mejor forma de determinar la situación inmune de los pacientes y con la que evaluar la administración de inmunonutrientes es el conocimiento y la determinación, si es que se produce, de la disminución del número de infecciones de la herida, de la estancia hospitalaria postoperatoria y de la mortalidad atribuida a la sepsis. Esto nos orientará acerca de sí los alimentos inmunoespecíficos aportados a los pacientes tienen alguna utilidad.
En la bibliografía internacional existen numerosos estudios, prospectivos randomizados, que comparaban el soporte nutricional enteral precoz (dentro de las primeras 24 h) con sustancias inmunomoduladoras frente a nutrición enteral estándar, concluyendo la gran mayoría de ellos, que la nutrición enteral precoz inmunomoduladora mejora la evolución clínica en los pacientes críticos21.
Debemos ser conscientes de que sobre este último punto, nuestro estudio no aporta resultados, dada la inexistencia de un grupo control. Esperamos completar el estudio con futuros trabajos.
Lo que podemos concluir es que los parámetros analizados tanto bioquímicos como inmunológicos, nos aportan información fidedigna sobre la respuesta del paciente a la agresión quirúrgica, la evolución del mismo en el postoperatorio y la monitorización nutricional del paciente.
Referencias
1. Kamat SK, Lawler MK, Smith AE y cols.: Hospital malnutrition: a 33- hospital study. J Am Diet Assoc 1986; 86:203-6. [ Links ]
2. Mughal MM, Seguid MM: The effect of nutritional status on morbidity after elective surgery for benign gastrointestinal disease. JPEN 1987; 11:140-3. [ Links ]
3. Smith P, Smith A, Toan B: Nutritional care cuts private-pay Hospital Days. Chicago: Nutritional care management institute, 1989. (Available from NCMI, 6030 N. Sheridan Rd, Chicago, IL 60660.) [ Links ]
4. Warnold I, Lundholm K: Clinical significance of preoperative nutritional status in 215 non cancer patients. Ann Surg 1984; 199:299-305. [ Links ]
5. Shukkin DJ, Kinosian B, Glick H: The economic impact of infections. An analysis of hospital costs and charges in surgical patients with cancer. Arch Surg 1993; 128:449-52. [ Links ]
6. Alexander JW. Nutritional pharmacology in surgical patients. Am J Surg 2002; 183:349-52. [ Links ]
7. Studley HO: Percentage of weigh lost: a basic indicator of surgical risk in patients with chronic peptic ulcer. JAMA 1936; 106:458-60. [ Links ]
8. Wu GH, Zhang YW, Wu ZH: Inflamatory response by immune- enchancing enteral diet in gastrointestinal cancer patients. World J Gastroenterol 2001; 7(3):357-62. [ Links ]
9. Rizk NP, Bach PB, Schrag D y cols.: The impact of complications on outcomes after resection foe esophageal and gastroesophageal junction carcinoma. J Am Coll Surg 2004; 198(1):42-50. [ Links ]
10. Konopke R, Kersting S, Ockert D, Gastmeier J, Saeger HD: Early results of esophageal surgery in carcinoma. Swiss Surg. 2003; 9(4):173-80. [ Links ]
11. Langer CJ, Hoffman JP, Ottery FD: Clinical significance of weight loss in cancer patients: rationale for the use of anabolic agents in the treatment of cancer-related cachexia. Nutrition 2001;17(1 Supl.):S1-S20. [ Links ]
12. Sitges-Serra A, Gil MJ, Refecas A y cols.: Nutritional issues in cancer patients. Nutrition 1990; 6:171-3. [ Links ]
13. Philips A, Sharper AG, Whincup PH: Association between serum albumin and mortality from cardiovascular disease, cancer and others. Lancet 1989; 16:1434-6. [ Links ]
14. Windsor JA, Hill L. Weight loss with physiologic impairment: a basic indicator of surgical risk. Am Surg 1988; 207:290-6. [ Links ]
15. Tuten MB, Wogt S, Dasse F, Leider Z: Utilization of prealbumin as a nutritional parameter. JPEN J Parenter Enteral Nutr 1985; 9:709-11. [ Links ]
16. Winkler MF, Pomp A, Caldwell MD, Albina JE: Transitional feeding: the relationship between nutritional intake and plasma protein concentrations. J Am Diet Assoc 1989; 89:969-70. [ Links ]
17. Guirao Garriga X, Sitges-Serra A: Soporte Nutricional en Cirugía. En: Celaya Pérez S (ed.): Tratado de Nutrición Artificial. Ed. Madrid, Grupo Aula Médica, 1998. [ Links ]
18. Reissman P, Teoh TA, Cohen SM, Weiss EG, Nogueras JJ,Wexner SD: Is early oral feeding safe after elective colorectal surgery? A prospective randomized trial. Ann Surg 1995; 222:73-77. [ Links ]
19. Braga M, Gianotti L, Gentilini S, Liotta S, Di Carlo V: Feeding the gut early after digestive surgery: results of nine years experience. Clinical Nutrition 2002; 21:59-65. [ Links ]
20. Cunningham Rundles S: Analytical methods for evaluation of immune response in nutrient intervention. Nutrition Reviews 1998; 56:S27-S37. [ Links ]
21. Beale RJ, Bryg DJ, Bihari DJ: Immunonutrition in the critically ill: a systematic review of clinical outcome. Crit Care Med 1999; 27:2799-2808. [ Links ]