Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.24 no.4 Madrid jul./ago. 2009
Suplementación con selenio en el paciente crítico: aspectos farmacológicos y evidencia actual
Selenium supplementation in critically ill patients: pharmacological issues and current evidence
W. Manzanares1 y G. Hardy2
1Médico intensivista. Profesor Adjunto de Medicina Intensiva. Cátedra de Medicina Intensiva. Facultad de Medicina. Universidad de la República UDeLaR. Montevideo. Uruguay.
2Professor of Clinical Nutrition. Institute of Food, Nutrition and Human Health. Massey University. Auckland. New Zealand.
Dirección para correspondencia
RESUMEN
Los antioxidantes y en particular el selenio parenteral parecen vincularse con una reducción significativa de la mortalidad en los pacientes críticos con Síndrome de Respuesta Inflamatoria Sistémica (SRIS). Actualmente, el selenio parenteral es considerado la piedra angular dentro de la estrategia de tratamiento antioxidante en los pacientes críticos. En los últimos años, diferentes estudios clínicos han evaluado el impacto clínico del uso de selenio intravenoso (selenito) aportado como monoterapia o asociado a otros micronutrientes antioxidantes ("cócteles antioxidantes"). Sin embargo, los resultados de estos estudios no han sido concluyentes. En la actualidad existe una mejor comprensión sobre la farmacocinética y farmacodinamia del selenio intravenoso, siendo reconocido el efecto pro-oxidante del bolo intravenoso inicial así como el efecto antioxidante de la infusión continua. Sin embargo, la dosis óptima y el tiempo de suplementación de selenio no han sido aun definidos planteándose la existencia de una posible sinergia entre selenio y glutamina parenteral.
Esta revisión analiza la evidencia actual sobre la suplementación de selenio en pacientes críticos con SRIS. El uso de altas dosis de selenio por vía parenteral (bolo inicial e infusión continua) parece ser una estrategia segura y efectiva en optimizar los niveles séricos de selenio y la actividad de ciertas selenoenzimas antioxidantes tales como la Glutatión Peroxidasa y la Selenoproteína P. Sin embargo, son necesarios nuevos estudios sobre la posología y farmacocinética del selenio en pacientes críticos. Estas pesquisas deberían demostrar un beneficio definitivo del uso de selenio sobre end point clínicos de relevancia.
Palabras clave: Selenio. Antioxidantes. Farmacocinética.Enfermedad crítica.
ABSTRACT
High dose intravenous selenium may be associated with a significant reduction in mortality among critically ill patients with systemic inflammation. Currently, parenteral selenium as sodium selenite seems to be a cornerstone of the antioxidant defence in the critically ill. So far, several clinical trials have evaluated the effects of selenium in monotherapy or as part of a multi-micronutrient approach, on relevant clinical end points for critically ill patients. Nonetheless, the results from these studies have sometimes been contradictory. We now have a better understanding of the pharmacokinetics of the initial and transient pro-oxidant effect of an intravenous bolus followed by the antioxidant effect of continuous infusion, which seems efficacious and safe among critically ill patients. Clinical confirmation of the potentially advantageous synergism between selenium and glutamine may soon be forthcoming but the most appropriate and the optimum time of supplementation remains undetermined.
Short-term intravenous selenite (bolus injection plus continuous infusion) has shown to be safe and capable of optimizing serum selenium and antioxidant selenoenzymes activities. However, additional dose-ranging trials are necessary to elucidate an optimal and safe posology with confirmed pharmacokinetic profiles before more definitive phase III trials can be conducted.
Key words: Selenium. Posology. Pharmacokinetics. Critically ill.
Introducción
El selenio es un elemento traza esencial en los mamíferos, el cual posee una reconocida función antioxidante e inmunológica1-5. La enfermedad crítica con inflamación sistémica se caracteriza por la existencia de estrés oxidativo con hiperproducción de especies reactivas de oxígeno y nitrógeno y de modo concomitante una depleción de los mecanismos de defensa antioxidante endógenos. En este contexto, el aporte de antioxidantes tales como el selenio, resulta una estrategia terapéutica atractiva la cual se encuentra en constante desarrollo. En la actualidad, la evidencia existente permite afirmar que el selenito (seleno-compuesto inorgánico) parenteral puede ser considerado como la piedra angular en la estrategia de defensa antioxidante en el SRIS4,6.
Hasta el momento actual, numerosos estudios han evaluado el rol del selenio inorgánico (selenito de sodio o ácido selenioso) como parte de la estrategia de suplementación antioxidante en la Unidad de Cuidados Intensivos (UCI)7,8. Sin embargo, el análisis detallado de los resultados de dichos estudios han sido muchas veces controversiales. Por otra parte, el selenio ha sido suplementado como monoterapia antioxidante o en combinación con otros elementos traza y vitaminas antioxidantes (multi-micronutrientes) en los denominados cócteles antioxidantes. La evidencia actual permite afirmar que el selenio parenteral a una dosis superior a 500 μg/d está asociado a una tendencia a disminuir la mortalidad en la UCI6. No obstante esta afirmación, la dosis optima así como el tiempo más adecuado de suplementación de selenito intravenoso en los pacientes críticos con inflamación sistémica es aún desconocido. Asimismo, ciertos aspectos vinculados al comportamiento farmacocinético y farmacodinámico del selenito intravenoso no han sido definitivamente aclarados. Es por todo lo expuesto que nuevas pesquisas se tornan necesarias para definir la dosis óptima y el verdadero rol del selenio como farmaconutriente antioxidante en los pacientes críticos con inflamación sistémica y en particular con sepsis grave / shock séptico.
La enfermedad crítica con inflamación sistémica: un estado de depleción de selenio
El selenio es incorporado en los residuos de selenocisteína (Se-cis) a nivel del sitio activo de las selenoenzimas, siendo el único elemento traza especificado en el código genético. En el plasma, el selenio es transportado en un 60% por la selenoproteína P (Se-P), la mayor selenoproteína transportadora de selenio con 10 átomos de selenio por cada cadena peptídica8-11. Por su parte, la Glutatión Peroxidasa plasmática o sérica (GPx-3) transporta el 30%, albúmina el 6-10%, en tanto que menos del 1% del selenio plasmático es selenio libre8.
En la actualidad es reconocida la amplia variabilidad existente entre los niveles normales de selenio según las diferentes regiones geográficas. Sin embargo, ha sido establecido que el nivel sérico óptimo de selenio plasmático necesario para maximizar la actividad GPx-3 es de 95 mg/L (rango 89 a 114 μg/L)2.
Durante la enfermedad crítica con SRIS se asiste a una redistribución del selenio y otros micronutrientes (elementos traza y vitaminas)12-17. En el SRIS caracterizado por hiperpermeabilidad y fuga capilar se produce un escape de selenio desde el compartimento intravascular hacia el compartimiento intersticial, en particular hacia los tejidos implicados en los procesos de síntesis proteica y respuesta inmune. Este fenómeno de redistribución de selenio es la causa más frecuente de descenso precoz de selenio y de sus selenoenzimas GPx-3 y Se-P en los pacientes críticos con SRIS12-16. Por su parte, el déficit de selenio ha sido asociado con estrés oxidativo, Disfunción Orgánica Múltiple (DOM), complicaciones infecciosas e incremento de la mortalidad en los pacientes críticos12,15. Por su parte, además de la redistribución entre los diferentes compartimentos corporales, otras causas explican la depleción de selenio durante la enfermedad crítica; entre estos se destacan el déficit previo de selenio corporal, aumento de la excreción urinaria, pérdidas con ciertos fluidos biológicos (fístulas, drenajes, etc.), hemodilución por resucitación con volumen en la etapa inicial de la enfermedad crítica, empleo de técnicas de reemplazo renal (TRR) y la nutrición enteral con dosis insuficientes (habitualmente no superiores a 50-60 μg/L de fórmula enteral administrada)17,18.
Forceville y cols.19 en 134 pacientes críticos reportaron bajos niveles de selenio plasmático al ingreso a la UCI, en particular en aquellos pacientes con sepsis grave y shock séptico los cuales exhibieron un descenso del 40% en los niveles de selenio. Asimismo, cuando dichos valores de selenio eran inferiores a 0,7 μmol/L se asociaban con una mortalidad significativamente más elevada (4 veces mayor) así como con una incidencia 3 veces mayor de Neumonia Asociada a la Ventilación Mecánica (NAV) y DOM18.
Sakr y cols.20 confirmaron el descenso de los niveles de selenio a la admisión en 55 de 60 (92%) de los pacientes quirúrgicos críticos estudiados con SRIS. Por su parte, el descenso mayor en los niveles de selenio fue apreciado en aquellos pacientes con DOM y en particular en los que ingresaban con sepsis severa y en los que no sobrevivirían a la enfermedad crítica. Por su parte, el selenio sérico y el score SAPS II se comportaron como los factores predictores de mortalidad más importantes20.
En Uruguay, nuestro grupo ha estudiado los niveles de selenio sérico y GPx-3 en una población de pacientes críticos y voluntarios sanos21; en efecto selenio sérico y GPx-3 fueron estudiados en 23 individuos sanos y 36 pacientes críticos (29 de los cuales presentaban SIRS a la admisión a la UCI con un score APACHE II > 15). En este grupo se observó un descenso significativo de los niveles de selenio y GPx-3 dentro de las primeras 48 horas del ingreso a la UCI con relación al grupo control y a los críticos no inflamados (GPx-3, p = 0,001 y selenio sérico, p = 0,002). Por su parte, el análisis univariado reveló que el selenio séricopero no la GPx-3 tuvo un buen valor predictivo de mortalidad en la UCI (p = 0,034 y p = 0,056, respectivamente). Asimismo, estableciendo un valor de corte de 60 μg/L para el selenio sérico y de 0,5 U/mL para GPx-3 determinamos que ambos valores tenían una importante especificidad y sensibilidad para el diagnóstico de SRIS y de severidad de la enfermedad crítica (sensibilidad 90%, especificidad del 86%)21. Finalmente, el análisis ROC (Receiver Operator Curve) reveló que el Área bajo la Curva (AUC) de GPx-3 y selenio se comportaban como excelentes predictores de SRIS, siendo la actividad GPx-3 la de mayor valor discriminativo con un AUC de 0,921 (IC 95% 0,844-0.999)21.
Efectos metabólicos de los seleno-compuestos utilizados en el paciente críticos
De acuerdo a los últimos hallazgos se puede especular con que el modo de administración del selenio parenteral (selenito de sodio o ácido selenioso), como estrategia antioxidante y farmaconutriente única o asociada a otros micronutrientes antioxidantes, en bolo o en perfusión intravenosa continua o en perfusión intravenosa continua luego de un bolo inicial (dosis carga) parece influenciar de modo evidente los resultados de los diferentes estudios de investigación. En la actualidad, los selenocompuestos inorgánicos tales como el selenito de sodio y el ácido selenioso son las fórmulas más eficaces para suplementar selenio intravenoso en pacientes críticos. Por su parte, los seleno-compuestos orgánicos tales como la selenometionina no se encuentran disponibles para ser administrados por vía intravenosa17.
Carecemos de estudios clínicos que hayan comparado el aporte de selenio enteral y parenteral puesto que los estudios más importantes sobre suplementación de selenio en pacientes críticos han usado selenito parenteral, ya sea como micronutriente único o combinado con otros micronutrientes antioxidantes (cócteles antioxidantes).
La evidencia actual, permite afirmar que bajos ciertas circunstancias los seleno-compuestos se comportan tanto como pro-oxidantes y antioxidantes7,8. En efecto, cuando el selenito es administrado por vía intravenosa, el mismo tiene una acción bifásica: 1) inicialmente presenta una acción pro-oxidante y 2) acción antioxidante, la cual depende de la incorporación del selenio al sitio activo de las selenoenzimas (en el residuo de Se-cis).
En modelos de sepsis grave/shock séptico ha sido determinado que el efecto pro-oxidante del selenito de sodio es inicial y transitorio; este efecto es dependiente del bolo inicial y dicha acción podría ser utilizada como estrategia terapéutica7,8. En efecto, una dosis carga administrada como bolo inicial en la etapa temprana del shock séptico puede ejercer los siguientes efectos: a) inhibición reversible de la traslocación nuclear del factor de transcripción nuclear kappa-B (NF-κB) con posterior unión a la molécula de ADN, cuando la concentración sérica de selenio es superior a 5 μmol/L; este efecto sería responsable de la inhibición en la expresión de genes proinflamatorios y por lo tanto de la síntesis de citoquinas proinflamatorias en la fase precoz del SRIS22-24; b) inducción de apoptosis y citotoxicidad sobre células proinflamatorias en la microcirculación25; c) efecto virucida y bactericida24. Finalmente, la acción antioxidante del selenito es secundaria a la incorporación del selenio en el residuo de Se-cis a nivel de sitio activo de las selenoproteínas GPx, SeP y otras selenoenzimas con función antioxidante3,5,10,11. Por otra parte, Forceville ha determinado que el efecto tardío del bolo intravenoso y la posterior infusión continua de selenito de sodio puede ser capaz de inducir la síntesis de SeP exhibiendo de este modo una acción protectiva sobre la disfunción endotelial en el shock séptico8.
Recientemente, Whang y cols.26 han evaluado los efectos del bolo intravenoso inicial de selenito de sodio (2.000 mg) continuado con una infusión intravenosa continua de 0,6 mg/kg/h en la aurícula derecha en un modelo experimental de sepsis severa peritoneal con shock séptico en ovejas. Un segundo grupo de animales recibió una infusión continua (sin bolo inicial) de 4 μg/kg/h de selenito de sodio en tanto que un tercer grupo (control) recibió una infusión continua de solución salina. El análisis de los resultados reveló que únicamente el grupo de animales que recibió el bolo inicial de selenito de sodio fue capaz de alcanzar una concentración plasmática pico de selenio de 7,7 ± 2,7 μmol/L(valores límites entre 4-14 μmol/L)26.
Asimismo, los niveles séricos de interleuquina 6 (IL-6) disminuyeron significativamente en el grupo que recibió bolo inicial de selenio (p < 0,05) lo cual traduce el efecto anti-inflamatorio del bolo inicial de selenito de sodio. Por otra parte, el bolo intravenoso se asoció a una optimización del status hemodinámico evaluado mediante el incremento de la presión arterial, índice cardíaco, índice de volumen sistólico y por una mejor respuesta a la reposición de fluidos (p < 0,05). Estos hallazgos sustentan la teoría sobre el efecto beneficioso y anti-inflamatorio de una dosis elevada prooxidante administrada como bolo intravenoso inicial de selenito en la etapa precoz de un estado proinflamatorio como es la sepsis grave/shock séptico26.
Evidencia clínica actual sobre la suplementación de selenio en la UCI: comparativa de los estudios clínicos
En los pacientes críticos con inflamación sistémica, los requerimientos diarios de selenio pueden ser ampliamente variables y de acuerdo al conocimiento actual una dosis única no puede ser actualmente recomendada12,19-21. Hasta el momento, diferentes estudios realizados en Suiza y Alemania han evaluado los efectos de diferentes dosis y esquemas de suplementación de selenio en la UCI17.
En el año 2006, la revisión sistemática de la Cochrane27 concluyó luego del análisis de 8 estudios (n = 813) que existía insuficiente evidencia para recomendar en pacientes críticos el aporte de selenito o ebselen (un seleno-compuesto orgánico). El análisis de la mortalidad reveló que el uso de selenio no se asociaba a una reducción significativa de la mortalidad (RR 0,52, 95% CI 0,20-1,34)27.
En el año 2007, Heyland y cols.28 han actualizado el primer metanálisis realizado para las Guías Canadienses de Soporte Nutricional en el paciente crítico. Estos nuevos datos permiten afirmar que la estrategia de suplementación antioxidante está asociada a un efecto positivo sobre la mortalidad (RR 0,69, 95% IC 0,59-0,829). Es importante destacar que el efecto sobre la mortalidad es dosis dependiente; en efecto, los estudios alemanes que han utilizado las dosis más altas de selenio son los que presentan un efecto positivo (RR 0,73, 95% IC 0,53-0.99, p = 0,04)28. En el presente año, el mismo grupo ha actualizado las recomendaciones sobre supelementación antioxidante en el paciente crítico concluyendo que basado en 3 estudios nivel 1 y 13 estudios nivel 2 de evidencia el uso combinado de vitaminas y elementos traza antioxidante debería ser considerado28. Por su parte, con referencia al uso de selenio como monoterapia antioxidante las recomendaciones actuales señalan que la evidencia existente es insuficiente para recomendar la suplementación con selenio a todo el universo de pacientes críticos28.
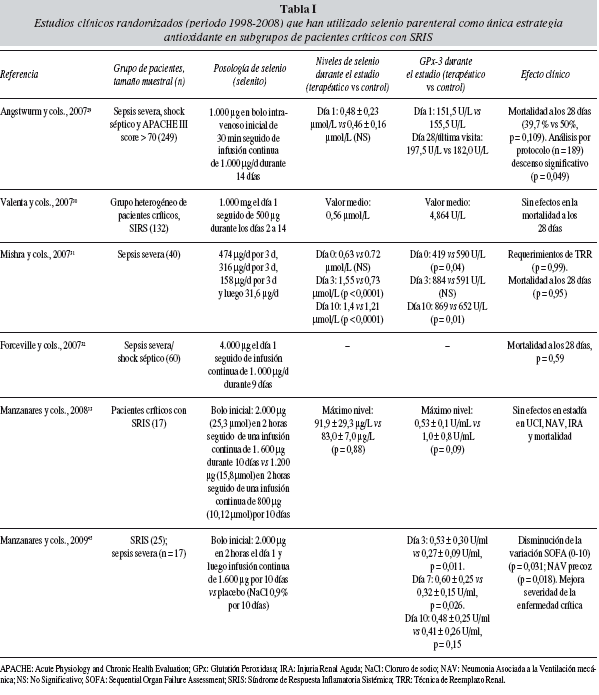
En los últimos dos años diferentes estudios han evaluado los efectos de la suplementación de selenio en Terapia Intensiva (tabla I). Hasta el momento actual, el estudio más importante es el "Selenium in Intensive Care" (SIC)29, un estudio multicéntrico, prospectivo, doble ciego, controlado, realizado en 11 UCI de Alemania. Este estudio incluyó 249 pacientes con sepsis severa, shock séptico y un score APACHE III (Acute Physiology and Chronic Health Evaluation III) mayor a 70. Los pacientes fueron randomizados para recibir 1.000 μg de selenito de sodio (Selenase® Biosyn, Alemania) como un bolo intravenoso inicial en 30 minutos seguido de una infusión intravenosa continua de 1.000 μg/d durante 14 días o placebo. El perfil farmacocinético y farmacodinámico del selenio revela que niveles plasmáticos de selenio y la actividad GPX-3 se mantuvieron dentro de límites fisiológicos durante todo el período de estudio, no habiéndose referido efectos tóxicos atribuibles al uso de altas dosis de selenio. El análisis de tipo "intention to treat" reveló que en los 238 pacientes (luego de haber excluido 11 pacientes) la mortalidad fue del 50,0% en el grupo placebo y de 39,7% en el grupo terapéutico (p = 0,109)29. Por su parte, el análisis "por-protocolo" evidenció que la mortalidad a los 28 días en el grupo terapéutico fue significativamente menor (42,4% vs 56,7%, p = 0,049, OR 0,56, 95% IC 0,32-1,00). Es importante destacar que la reducción en las cifras de mortalidad fue significativamente más importante en aquellos pacientes mas graves, en particular en aquellos con shock séptico, coagulación intravascular diseminada (p = 0,018), DOM con más de 3 órganos en falla (p = 0,039) y en los que exhibían mayor severidad de su enfermedad crítica con un score APACHE III > 102 (p = 0,04)29.
En la república Checa, Valente y cols.30 en 123 pacientes críticos hallaron que la suplementación de selenito parenteral con el siguiente esquema (día 1: 1.000 μg seguido de 500 μg del día 2 al día 14) fue capaz de incrementar de modo significativo los niveles plasmáticos de selenio y GPx-3 (p < 0,001) sin la aparición de efectos colaterales graves atribuibles a toxicidad por selenio. Por su parte, la mortalidad a los 28 días descendió en el grupo terapéutico, aunque no de modo significativo (33% vs 37%)30
Mishra y cols.31 evaluaron en 40 pacientes con sepsis grave el efecto de la suplementación de selenio sobre parámetros bioquímicos y "end points" clínicos de importancia en la UCI. El esquema de suplementación de selenio en el grupo terapéutico fue 474 μg/d, 316 μg/d, 158 μg/d, cada dosis repetida durante 3 días consecutivos continuando posteriormente con una dosis estándar de 31,6 μg/d (0,4 μmol/d)31. La aplicación de este protocolo no se asoció a una reducción significativa de la mortalidad aunque si redujo la puntuación del score SOFA (Sequential Organ Failure Assessment) al día 7 y 10 con una correlación negativa entre los valores de selenio plasmático y el score SOFA (r = -0,36, p = 0,03). Sin embargo, el estrés oxidativo evaluado mediante la determinación de los niveles de F2 isoprostanos no se redujo de modo significativo en el grupo terapéutico31.
En el año 2007, Forceville y cols.32 publicaron los resultados del estudio SERENITE, el cual enroló 60 pacientes críticos con sepsis grave/shock séptico. Este estudio multicéntrico realizado en Francia incluyó dos grupos; n = 29 recibieron (placebo) y a n = 31 se les administró una dosis de 4.000 μg de selenito de sodio en perfusión continua de 24 horas durante el día 1, continuando luego con una infusión continua de 1.000 μg/d durante 9 días (total: 13 mg en 10 días)32. A diferencia del estudio SIC29, el análisis de los resultados reveló que la mortalidad no se redujo significativamente en el grupo terapéutico (45% vs 45%, p = 0,59, al día 28; 59% vs 68%, p = 0,32 a los 6 meses y 66% vs 71%, p = 0,43 al año en losgrupos placebo y selenio, respectivamente32.
Nuestro grupo ha presentado recientemente los resultados de un estudio piloto33 en pacientes críticos con SRIS donde hemos evaluado el perfil farmacocinético y farmacodinámico de dos dosis de ácido selenioso (Rivero®, Argentina). Las dosis empleadas han sido las siguientes: un primer grupo denominado dosis bajas recibió una dosis carga de 1.200 μg (15,18 μmol) en 2 horas seguido de una infusión intravenosa continua de 800 μg/d (10,12 μmol/d) durante 10 días; el segundo grupo (denominado dosis altas) recibió una dosis carga de 2.000 μg (25,3 μmol) en 2 horas continuando luego con una infusión continua de 1.600 μg/d (20,24 μmol) durante un periodo de 10 días33. La infusión intravenosa fue realizada utilizando una bomba de infusión continua por una vía venosa exclusiva para evitar potenciales interacciones del selenio con otras drogas. El análisis del perfil farmacocinético permite afirmar que las curvas concentración/tiempo para selenio se superponen y ambas fueron independientes de la dosis de ácido selenioso administrada. Sin embargo, el análisis del perfil farmacodinámico para la GPx-3 mostró diferencias entre ambosesquemas terapéuticos de suplementación (aunque no significativas); en efecto GPx-3 logra niveles óptimos solo en el grupo de altas dosis alcanzando niveles fisiológicos a partir del día 2 de infusión intravenosa continua solamente en este grupo. Asimismo, es importante destacar que en ambos grupos e independientemente de la dosis utilizada, la actividad GPx-3 desciende a partir del día 7. El análisis farmacocinético reveló que la concentración máxima de selenio sérico al día 10 fue de 83,0 ± 7,0 μg/L en el grupo de dosis bajas vs 91,9 ± 29,3 μg/L en el grupo de dosis altas, p = 0,88). Por su parte, la máxima actividad GPx-3 fue al día 7 (0,53 ± 0,1 vs 1,00 ± 0,8 U/mL, p = 0,009 en los grupos de dosis baja y alta, respectivamente). La evaluación de los resultados clínicos permite afirmar que no existieron diferencias entre ambos grupos tales como: variación del score SOFA (día 0-10) (10 vs 8, p = 0,10); mortalidad en la UCI (44% vs 37,5%, p = 0,77), estadía en la UCI (15,0 ± 2,9 d vs 13,6 ± 4,1 d, p = 0,43), incidencia de NAV (44% vs 25%, p = 0,40) e incicencia de Injuria Renal Aguda (IRA) (44% vs 50%, p = 0,82). Por su parte, los parámetros de SRIS, las variables hemodinámicas y el intercambio gaseoso no mostraron diferencias significativas entre ambos grupos. Es importante puntualizar que en ambos grupos los niveles de selenio sérico se normalizaron en el día 10 (último día de infusión) alcanzando los niveles necesarios para maximizar la actividad de la GPx-3 (95 mg/L, 89 a 114 μg/L). Nuestro grupo concluyó que esta dosis y esquema de administración de selenito parenteral (dosis carga de 2.000 μg administrado como bolo intravenoso inicial en 2 horas seguida de una infusión continua de 1.600 μg durante 10 días) fue capaz de optimizar la actividad GPx-3 dentro de un rango fisiológico y por consiguiente dentro de niveles de seguridad sin efectos colaterales graves por toxicidad del selenio33. Por su parte, con respecto a la caída de la actividad GPx-3 (más precoz en el grupo de dosis bajas) a pesar de la optimización de los niveles de selenio sérico, hemos planteado que este hallazgo puede ser debido a la carencia de precursores necesarios para la síntesis de GSH y selenocisteína, tales como la glutamina y/o cisteína33.
Recientemente, un interesante estudio suizo34 ha evaluado el efecto de una dosis diaria de 30 g de glutamina asociada a un cóctel antioxidante (selenio, zinc, b-caroteno y vitaminas C, B1 y E) en 86 pacientes críticos con trauma grave y quemaduras críticas. En dicho estudio el aporte de selenio enteral fue de 300 μg/d; por su parte los pacientes quemados recibieron 485,5 μg/d de selenito de sodio intravenoso por un periodo máximo de 10 días. Esta combinación de glutamina enteral y micronutrientes antioxidantes demostró ser segura aunque no presentó un impacto positivo sobre la evolución clínica34. Posteriormente, el mismo grupo suizo ha culminado otro estudio en 200 pacientes cursando el postoperatorio de cirugía cardíaca, trauma grave o neuroinjuria grave por hemorragia subaracnoidea35. El grupo terapéutico o intervención (n = 102) recibió un cóctel antioxidante por vía parenteral consistente en zinc, vitaminas C y B1 asociadas a una dosis diaria de selenio de 270 μg; los pacientes incluidos en este grupo recibieron una dosis carga doble en los primeros 2 días. El análisis de los resultados muestra que la intervención antioxidante se asoció a una disminución significativa de los parámetros de respuesta inflamatoria en los pacientes de cirugía cardíaca y en los traumatizados graves35.
Más recientemente, Collier y cols.36 publicaron los resultados de un interesante estudio en 4.294 traumatizados, de los cuales 2.272 recibieron suplementación antioxidante (selenio, vitamina C y α-tocopherol). El aporte de selenio fue realizado mediante un bolo intravenoso de 200 μg en 2 horas durante 7 días. El grupo antioxidante mostró una reducción significativa de la estadía en la UCI y hospitalaria (p = 0,001 y p < 0,001, respectivamente) así como una menor mortalidad (6,1% vs 8,5%, p = 0,001)36. Heyland y cols.37 en un estudio fase I han demostrado que altas dosis de glutamina enteral y parenteral (0,35 g/kg/d por vía intravenosa y 30 g/d por vía enteral) asociado a selenito de sodio 500 μg/d intravenoso en una combinación estable37 junto a un cóctel antioxidante enteral (selenio 300 μg, zinc, β-caroteno, vitamina C y vitamina E) es una asociación segura. Por otra parte, los autores demostraron que esta posología fue capaz de optimizar la función mitocondrial (evaluada mediante el cociente ADN mitocondrial/ADN nuclear) y la capacidad antioxidante (evaluada por los niveles de Thiobarbituric Acid Reactive Substances, TBARS)37.
Actualmente, dos grandes estudios multicéntricos están próximos a ser finalizados. Estos son el "Reducing Deaths due to Oxidative Stress" (REDOXS study)39,40 y el "Scottish Intensive care Glutamine or seleNium Evaluative Trial" (SIGNET)41. El estudio REDOXS es una investigación multicéntrica, que randomizará un total de 1.200 pacientes críticos. Este estudio39 evalúa los efectos sobre la mortalidad a los 28 días del uso de altas dosis de glutamina parenteral (0,35 g/kg) y enteral (30 g) asociado a selenio intravenoso (500 μg) junto a un cocktel de antioxidantes por vía enteral, el cual incluye 300 mg de selenio. El análisis de los resultados preliminares del estudio REDOXS incluyendo los primeros 102 pacientes muestra que el uso de estos dos farmaconutrientes por vía enteral y parenteral es una estrategia segura40. Por su parte el estudio SIGNET41 el cual está próximo a ser finalizado es un estudio multicéntrico que ha randomizado 4 grupos de pacientes críticos (n = 500): a) glutamina: 30 g/d, b) selenito de sodio: 500 μg/d, c) glutamina asociado a selenito de sodio(30 g y 500 μg/d, respectivamente) y d) placebo41.
Es posible que una vez conocidos los resultados de estos dos grandes estudios actualmente en desarrollo pueda ser confirmada una sinergia entre glutamina y selenio. Esta asociación farmaconutriente antioxidante de glutamina y selenio es precursora de la síntesis de GSH y por consiguiente de Secis y de la selenoenzima GPx. Esta estrategia inmunonutrientes, podría ser capaz de optimizar el perfil farmacodinámico de la GPx-3 evitando el descenso a partir del día 7 en la curva de perfil farmacodinámico de la GPx-3, como ha sido observado por nuestro grupo33.
Definiendo una dosis segura de selenio en los pacientes críticos. Toxicidad por selenio en lainflamación sistémica
Berger y Shenkin15,16 han expresado "More is not always better". Nosotros compartimos esta expresión; sin embargo en los pacientes críticos con inflamación sistémica la suplementación con una mayor dosis de selenio ha demostrado ser mejor. Asimismo, es posible afirmar que de acuerdo a nuestros propios hallazgos el selenio presenta curvas dosis-respuesta por lo cual el riesgo de toxicidad existe con el uso de dosis elevadas y durante largos períodos de suplementación. Olson42 ha revisado la toxicidad del selenio habiendo concluido que la dosis máxima de seguridad para selenio es de 0,05 mg/kg. Por su parte, Forceville y cols.43 han demostrado que en ratas sépticas la mortalidad por selenio es observada con el uso de dosis superiores a 0,6 mg/kg en tanto que en ratas normales la mortalidad se incrementa con dosis superiores a 3,0 mg/kg43.
Actualmente, los datos existentes sobre toxicidad de selenio en humanos hacen referencia a toxicidad secundaria a suplementación crónica de selenio. Sin embargo, en el paciente crítico con inflamación y depleción de selenio, el aporte de selenio intravenoso es por cortos períodos de tiempo nunca superiores a las 2-3 semanas. Es por lo expuesto, que los datos sobre toxicidad crónica por selenio no pueden ser extrapolados a los pacientes críticos con inflamación sistémica17.
Vincent y Forceville7 han propuesto que dosis de 400 μg/d en perfusión intravenosa continua pueden ser beneficiosas, sugiriendo que las dosis inferiores a 800 μg/d son seguras. No obstante, actualmente sabemos en base a los datos derivados de estudios de experimentación animal que el pico plasmático precoz de selenio secundario al bolo intravenoso inicial ejerce un efecto prooxidante transitorio el cual la sepsis grave/shock séptico podría ser anti-inflamatorio y por consiguiente beneficioso26. Por su parte, en un interesante comentario editorial, Heyland44 ha sugerido que dosis superiores a 1.000 μg/d podrían ser nocivas en tanto que dosis inferiores a 800 μg/d serían inadecuadas en pacientes críticos. El análisis de los datos existentes permite concluir que estas afirmaciones son especulativas y las mismas se contraponen con nuestra propia experiencia.
Recientemente hemos presentado los resultados preliminares de nuestro estudio prospectivo, controlado, randomizado, unicéntrico en 25 pacientes críticos con SRIS y APACHE II mayor a 15 de los cuales 15 presentaban sepsis severa45. En dicho estudio el grupo terapéutico recibió una dosis carga de ácido selenioso (Rivero, Argentina) de 2.000 μg (25,3 μmol) en 2 horas seguido de una infusión intravenosa continua de 1.600 μg/d (20,24 μmol) durante 10 días44. Los resultados preliminares muestran que la actividad GPx-3 se incrementó significativamente en el grupo terapéutico al día 3 (0,53 ± 0,30 U/mL vs 0,27 ± 0,09 U/mL, p = 0,011) y al día 7 (0,60 ± 0,25 U/mL vs 0,32 ± 0,15 U/mL, p = 0,026)45. Asimismo, el impacto clínico de esta estrategia terapéutica se traduce en una reducción significativa de la variación en el score SOFA (días 0-10) en el grupo terapéutico (8 ± 3 vs 4 ± 2, p = 0,031) y en una menor incidencia de NAV precoz (en los primeros 5 días de ventilación mecánica) con 1 episodio en el grupo intervención versus 5 episodios (p = 0,018). Sin embargo, otros relevantes end point clínicos tales como días de antibióticos, NAV tardía, dosis de vasopresores, estadía en la UCI, duración de ventilación mecánica, uso de técnicas de reemplazo renal no mostraron diferencias significativas; por su parte la mortalidad en UCI fue 21% vs 27%, p = 0,633 en el grupo terapéutico y control respectivamente. Nuestro grupo ha concluido que un tratamiento intravenoso de corta duración de 10 días con una dosis diaria de 1.600 μg (20 μmol) de selenito luego de una dosis carga inicial permite optimizar la actividad GPx sin efectos colaterales graves45. La búsqueda de efectos adversos secundarios al uso de altas dosis de selenito parenteral no encontró diferencias significativas entre ambos grupos (selenio vs. placebo): convulsiones (no se detectaron en ninguno de los grupos); shock refractario (p = 0,71); falla respiratoria (p = 0,36);IRA (p = 0,82) e intolerancia digestiva alta (p = 0,76)45.
Conclusiones
El selenio es un elemento traza esencial que resume el concepto actual de farmaconutriente. En la actualidad existe vasta evidencia sobre el rol antioxidante del selenio, actuando como cofactor enzimático de numerosas selenoenzimas antioxidantes, en particular de la GPx y la SeP.
En los últimos años, se han sucedido múltiples ensayos clínicos los cuáles han estudiado los efectos de la suplementación con dosis variables de selenito intravenoso. Sin embargo, los resultados de estos estudios en términos de end points clínicos de relevancia en pacientes críticos tales como mortalidad, incidencia infecciones y días de ventilación mecánica no han sido concluyentes. La evidencia reciente permite afirmar que en el paciente crítico, el aporte de selenito intravenoso mediante un bolo inicial continuado con una infusión intravenosa continua durante un período de tiempo no mayor a 2-3 semanas es una posología segura no asociada con la aparición de efectos adversos graves atribuibles a toxicidad por selenio. Asimismo, este esquema de suplementación ha sido capaz de optimizar los niveles séricos de selenio así como la actividad de la selenoenzima GPx-3.
Recientemente, a partir de nuestros hallazgos, hemos sostenido que el aporte combinado de glutamina y selenio puede ser capaz de optimizar el perfil farmacodinámico de la GPx-3 optimizando de este modo el status antioxidante a través del incremento de la biodisponibilidad de GSH33. En tal sentido, es posible que en el futuro próximo, estudios multicéntricos actualmente en desarrollo puedan confirmar una probable sinergia entre estos dos farmaconutrientes. Nosotros creemos que en los próximos años, la determinación de selenio y glutamina plasmática al ingreso a la UCI formará parte de la evaluación paraclínica inicial en los pacientes críticos permitiendo seleccionar a aquellos pacientes que se beneficiarán del aporte de selenio y glutamina. Asimismo, creemos que la suplementación precoz de estos de estos dos farmaconutrientes será parte de la estrategia terapéutica inicial en pacientes críticos con sepsis grave y en grandes quemados. Sin embargo, nuevos estudios clínicos fase II así como estudios de experimentación animal son necesarios para definir la dosis más adecuada y el tiempo óptimo de suplementación de selenito intravenoso en los pacientes críticos con inflamación sistémica, así como agregar conocimiento sobre la toxicidad aguda del selenio.
Por otra parte, se impone la búsqueda de nuevo y mejor conocimiento sobre la toxicidad atribuible a la suplementación de selenio en la UCI. Finalmente, el conocimiento actual permite sugerir que nuevos estudios multicéntricos, doble ciego, metodológicamente correctos son necesarios para definir el verdadero rol del selenio dentro del esquema general de tratamiento del paciente crítico.
Referencias
1. Geoghegan M, McAuley D, Eaton S y cols. Selenium in critical illness. Curr Opin Crit Care 2006; 12: 136-141. [ Links ]
2. Rayman MP. The importance of selenium to human health. The Lancet 2000; 356: 233-41. [ Links ]
3. Hardy G, Hardy I. Selenium: the Se-XY nutraceutical. Nutrition 2004; 20: 590-593. [ Links ]
4. Berger MM. Can oxidative damage be treated nutritionally? Clin Nutr 2005; 24: 172-183. [ Links ]
5. Dodig S, Cepelak I. The facts and controversy about selenium. Acta Pharm 2004; 54: 261-276. [ Links ]
6. Heyland DK, Dhaliwall R, Suchner U y cols. Antioxidants nutrients: a systematic review of trace elements and vitamins in the critically ill patient. Intensive Care Med 2005; 31: 327-337. [ Links ]
7. Vincent JL, Forceville X. Critically elucidating the role of selenium. Curr Opin Anesthesiol 2008; 21: 148-154. [ Links ]
8. Forceville X, Van Antwerpen P. Selenocompounds and selenium: a biochemical approach to sepsis. In 2008 Yearbook in Intensive Care and Emergency Medicine, Vincent JL (Ed). Springer-Verlag Berlin Heidelberg, pp. 454-466, 2008. [ Links ]
9. Berger MM, Shenkin A. Selenium in intensive care: probably not a magic billet but an important adjuvant therapy. Crit Care Med 2007; 35: 306-307. [ Links ]
10. Burk RF, Hill KE. Selenoprotein P: an extracelular protein with unique physical characteristics and role in selenium homeostasis. Ann Rev Nutr 2005; 25: 2125-235. [ Links ]
11. Papp LV, Lu J, Holmgren A y cols. From Selenium to selenoproteins. Synthesis, Identity and their role in human health. Antioxid Redox Signal 2007; 9: 775-806. [ Links ]
12. Maehira F, Luyo GA, Miyagy I y cols. Alterations of serum selenium concentration in the acute phase of pathological conditions. Clin Chim Acta 2002; 316: 137-146. [ Links ]
13. Berger MM. Antioxidant micronutrients in major trauma and burns: evidence and practice. Nutr Clin Pract 2006; 21: 438-449. [ Links ]
14. Berger MM, Chiólero R. Antioxidant supplementation in sepsis and systemic inflammatory response syndrome. Crit Care Med 2007; 358 (Supl.): S584-S590. [ Links ]
15. Berger MM, Shenkin A. Selenium in intensive care: probably not a magic bullet but an important adjuvant therapy. Crit Care Med 2007; 35: 306-307. [ Links ]
16. Berger MM & Shenkin A. Update on clinical micronutrient supplementation studies in the critically ill. Curr Opin Clin Nutr Metab Care 2006; 9: 711-716. [ Links ]
17. Angstwurm MWA, Gaertner R. Practicalities of selenium supplementation in critically ill patients. Curr Opin Clin Nutr Metab Care 2006; 9: 233-238. [ Links ]
18. Klein CJ, Nielsen FH, Moser-Veillon PB. Trace element loss in urine and effluent following traumatic injury. JPEN 2008; 32: 129-139. [ Links ]
19. Forceville X, Vitoux D, Gauzit R y cols. Selenium, systemic immune response syndrome, sepsis and outcome in critically ill patients. Crit Care Med 1998; 26: 1536-1544. [ Links ]
20. Sakr Y, Reinhart K, Bloos F y cols. Time course and relationship between plasma selenium concentrations, systemic inflammatory response, sepsis and multiorgan failure. Br J Anaesth 2007; 98: 775-784. [ Links ]
21. Manzanares W, Biestro A, Galusso F y cols. Serum selenium and glutathione peroxidase-3 activity: biomarkers of systemic inflammation in the critically ill. [ Links ]
22. Maehira F, Miyagi I, Eguchi Y. Selenium regulates transcription factor NF-kappa beta activation during the acute phase reaction. Clin Chem Acta 2003; 334: 163-171. [ Links ]
23. Jeong DW, Yoo MH, Kim TS y cols. Protection of mice from allergen-induced asthma by selenite: prevention of eosinophil infiltration by inhibition of NF-kappa beta activation. J Biol Chem 2002; 277: 17871-17876. [ Links ]
24. Stewart MS, Spallholz JE, Neldner KH y cols. Selenium compounds have disparate abilities to impose oxidative stress and induce apoptosis. Free Radic Biol Med 1999; 26: 42-48. [ Links ]
25. Chung YW, Kim TS, Lee SY y cols. Selenite-induced apoptosis of osteoclasts mediated by the mitochondrial pathway. Toxicol Lett 2006; 160: 143-150. [ Links ]
26. Wang Z, Forceville X, Van Antwerpen P y cols. A large bolus, but not a continuous infusion, of sodium selenite improves outcome in peritonitis. Shock 2008. DOI: 10-1097/SHK.0b013e318193c35d. Epub ahead of print. [ Links ]
27. Avenell A, Noble DW, Barr J y cols. Selenium supplementation for critically ill adults. Cochrane Database Syst Rev 2006; 2: 1-19. [ Links ]
28. Heyland DK, Dhaliwal R, Drover J y cols. Canadian Clinical Practice Guidelines for nutrition support in mechanically ventilated, critically ill-ventilated patients. Update 2007-2009. http://www.criticalcarenutrition.com. Último acceso: 15 de febrero de 2009. [ Links ]
29. Angstwurm MWA, Engelmann L, Zimmermann T y cols. Selenium in Intensive Care (SIC) study: Results of a prospective, randomized, placebo-controlled, multiple-centre study in patients with severe systemic inflammatory response syndrome, sepsis and septic shock. Crit Care Med 2007; 35: 118-126. [ Links ]
30. Valenta J, Brodska H, Kazda A y cols. Effect of high-dose selenium substitution on selected laboratory parameters and prognosis in critically ill patients. Crit Care 2007; 11 (Supl. 2): P155. [ Links ]
31. Mishra V, Baines M, Perry SE y cols. Effect of selenium supplementation on biochemical markers and outcome in critically ill patients. Clin Nutr 2007; 26: 41-50. [ Links ]
32. Forceville X, Laviolle B, Annane D y cols. Effects of high doses of selenium, as sodium selenite, in septic shock: a placebo-controlled, randomized, double-blind, phase II study. Crit Care 2007; 11: R73. [ Links ]
33. Manzanares W, Torre MH, Biestro A y cols. Pharmacokinetics and pharmacodynamics of high dose selenium in systemic inflammatory response syndrome. Clin Nutr 2008; 3 (Supl. 1): 6-7. [ Links ]
34. Soguel L, Chioléro RL, Ruffieux C y cols. Monitoring the clinical introduction of a glutamine and antioxidant solution in critically ill trauma and burn patients. Nutrition 2008; 24: 1123-32. [ Links ]
35. Berger MM, Soguel L, Shenkin A y cols. Influence of early antioxidant supplements on clinical evolution and organ function in critically ill cardiac surgery, major trauma and subarachnoid hemorrhage patients. Crit Care 2008; 12: R101. [ Links ]
36. Collier BR, Giladi A, Dosset LA y cols. Impact of high-dose antioxidants on outcomes in acutely injured patients. JPEN J Parent Enteral Nutr 2008; 31: 384-388. [ Links ]
37. Heyland DK, Dhaliwalm R, Day A y cols. Optimizing the dose of glutamine dipeptides and antioxidants in critically ill patients: a phase I dose-finding study. JPEN 2007; 31: 109-18. [ Links ]
38. Hardy G, Hardy IJ, Powell-Tuck J. compatibility of sodium selenite with L-alanyl L-glutamine dipeptide in normal saline admixtures. Clin Nutr 2008; (Supl. 1): 161-162. [ Links ]
39. Heyland DK, Dhaliwal R, Day AG y cols. REducing Deaths due to OXidative Stress (The REDOXS Study): rationale and study design for a randomized trial of glutamine and antioxidant supplementation in critically ill patients. Proc Nutr Soc (2006); 65: 250-263. [ Links ]
40. Dhaliwal R, Drover J, Muscedere J y cols. The REDOXS Study: feasibility of pharmaconutrition in critically ill patients. Clin Nutr 2008; (Supl. 1): 41. [ Links ]
41. Andrews PJD, Avenell A, Noble DW y cols. Randomised trial of glutamine and selenium supplemented parenteral nutrition for critically ill patients. SIGNET (Scottish Intensive care Glutamine or seleNium Evaluative Trial). Trials 2007; 8: 25 doi: 10.1186/1745-6215-8-25. [ Links ]
42. Olson OE. Selenium toxicity in animals, with emphasis on man. J Am Coll Toxicol 1986; 5: 45-69. [ Links ]
43. Forceville X, Chancerelle Y, Agay D y cols. At moderately high level, sodium selenium seems to decrease mortality in lipopolysaccharide rat model. Intensive Care Med 2004; 30: S110 (abst). [ Links ]
44. Heyland DK. Selenium supplementation in critically ill patients: can too much of a good thing be a bad thing? Crit Care 2007; 11: 153. [ Links ]
45. Manzanares W, Biestro A, Torre MH y cols. Clinical effects of high dose selenious acid in critically ill patients with systemic inflammation. JPEN J Parenter Enteral Nutr 2009; 33: 186 (Abstr 536-4). [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
William Manzanares.
Cátedra de Medicina Intensiva.
Hospital de Clínicas. Facultad de Medicina - UDELAR.
Avda. Italia, s/n, Piso 14, CP 11600. Montevideo. Uruguay.
E-mail: wmanzanares@adinet.com.uv
Recibido: 14-II-2009.
Aceptado: 20-IV-2009