My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.25 n.2 Madrid Mar./Apr. 2010
Distribución regional de la grasa corporal. Uso de técnicas de imagen como herramienta de diagnóstico nutricional
Regional distribution of the body fat. Use of image techniques as tools for nutritional diagnosis
M.ª J. Pérez Miguelsanz1, W. Cabrera Parra1, G. Varela Moreiras2 y M. Garaulet3
1Departamento de Anatomía y Embriología humana I. Facultad de Medicina. Universidad Complutense de Madrid.
2Departamento de Nutrición, Bromatología y Tecnología de los Alimentos. Facultad de Farmacia. Universidad CEU-San Pablo.
3Departamento de Fisiología. Facultad de Biología. Universidad de Murcia. España.
Dirección para correspondencia
RESUMEN
La masa grasa es el componente más variable en la composición corporal, tanto si se comparan varios individuos o se consideran los cambios de una persona a lo largo de la vida. La obesidad se caracteriza por un exceso de masa grasa que afecta a la salud y al bienestar de las personas. Los riesgos asociados al exceso de grasa se deben, en parte, a la localización de la grasa, más que a la cantidad total. Hoy se postula que las causas y consecuencias metabólicas de la distribución regional de la grasa tienen particular importancia clínica. Por ello, el ideal sería identificar un compartimento de tejido adiposo mórbido y poder actuar sobre él. En la presente revisión se evalúa la bibliografía existente sobre la localización y características de la grasa en el ser humano adulto. Nos centramos en la región abdominal, a la luz de los principios de las modernas técnicas de imagen disponibles como la tomografía computarizada y la resonancia magnética, considerando sus ventajas y limitaciones. El objetivo de esta revisión es valorar si es posible conocer la composición corporal y la distribución de la grasa basándonos en los métodos de imagen. La tomografía fue la primera técnica en aplicarse a estudios de obesidad, pero en la actualidad, debido a los inconvenientes de irradiar al paciente, esta técnica va cediendo paso a la resonancia magnética que, además de evitar las radiaciones, proporciona una calidad de imagen extraordinaria. Ambos métodos de imagen permiten subdividir los depósitos adiposos clásicos en otros más específicos. Así, el depósito graso subcutáneo puede ser superficial o profundo, mientras que el depósito graso visceral puede estar constituido por grasa mesentérica, omental o epiploica, retroperitoneal y perirrenal. Además, la utilización de estas técnicas de imagen modernas permite el estudio de la grasa muscular, considerada por algunos autores como el nuevo compartimento graso. La grasa muscular comprende los depósitos de grasa localizados entre las fibras musculares esqueléticas o extramiocelulares, así como los lípidos localizados dentro de las fibras muculares esqueléticas o intramiocelulares. Su importancia radica, no sólo en su tamaño, similar a la grasa visceral, sino en sus posibles implicaciones fisiopatológicas. En definitiva, las técnicas de análisis de imagen han resultado ser sumamente útiles en el estudio de la localización y medida de los depósitos de grasa abdominal, pasando a ser la técnica de referencia para validar ecuaciones obtenidas a partir de los métodos denominados indirectos.
Palabras clave: Grasa cutánea. Grasa visceral. Grasa muscular. Tomografía computerizada. Resonancia magnética. Obesidad.
ABSTRACT
Fat mass is the most variable component in the human body, both when comparing several individuals and when considering changes in the same person throughout life. Obesity is characterized by an excess of body fat that affects health and well-being of individuals. Risk associated with excess body fat is due, in part, to location of fat rather than to total amount. Today is stated that causes and metabolic consequences of regional distribution of fat are of particular clinical importance. To identify a compartment of morbid adipose tissue and to be able to act on it is one of the main aims of the present research. In this review, we have revised the existing literature on location and characteristics of total body fat in human adult. We have focused on abdominal region, basing this review on the use of modern imaging techniques available nowadays, such as computerized tomography and magnetic resonance imaging, with their advantages and limitations. The purpose of this review is to assess whether it is possible to know the body composition and fat distribution on the basis of image methods. Computed tomography technique was first applied in studies of obesity, but today, due to the inconvenience of irradiating the patient, this technique is being replaced by magnetic resonance that, in addition to avoid radiation, provides images of extraordinary quality. Both methods allow to subdivide the classic general fat depots in others more specific. Subcutaneous fat depot can be superficial or deep, while visceral can be divided in mesenteric, omental or epiploic, retroperitoneal and perirrenal fat. In addition, these modern techniques of imaging permit to study muscular fat, considered by some authors asthe new fat compartment. Muscular fat includes fat located between skeletal muscle fibers, called extramyocellular fat, as well as lipids located within skeletal mucle fibers (intramyocellular fat). Its importance lies not only in size, similar to visceral fat, but on its pathophysiological implications. Finally, techniques of image analysis have prove to be extremely useful in studying the location and extent of abdominal fat compartments, becoming reference to validate equations obtained from the so-called "indirect methods".
Key words: Subcutaneous fat. Visceral fat. Muscle fat. Computed tomography. Magnetic resonance image. Obesity.
Introducción
El estudio de la composición corporal, a pesar de no ser una disciplina nueva, despierta cada día más interés. Se refiere al estudio anatómico, molecular o tisular de los distintos componentes del cuerpo humano, y es precisamente en el campo de la nutrición donde se ha demostrado en mayor medida su aplicación clínica, tanto para la valoración del estado nutricional como para la evaluación de la respuesta a la intervención nutricional en patologías diversas.
La grasa es un componente del cuerpo humano que se acumula en forma de tejido graso o adiposo. En la actualidad se reconoce que el tejido adiposo (TA), además de ser la reserva de lípidos, es un órgano endocrino que produce una variedad de hormonas y citoquinas que regulan el metabolismo e influyen en la composición corporal1. Recientemente, el TA está surgiendo como fuente importante de células madre adultas2.
La distinción entre grasa y TA en el lenguaje corriente es normalmente irrelevante, y los términos se usan indistintamente. Sin embargo, en el campo de la composición corporal y el metabolismo, "grasa" y TA son distintos términos, y la distinción semántica es importante cuando se determina la masa o se estudian las características metabólicas. Aunque muchas veces puedan considerarse como términos sinónimos, es importante recordar que, con la edad, el contenido de "grasa" del "TA" puede variar. Por ejemplo, el contenido de grasa del TA es del 66% en los recién nacidos y aumenta gradualmente hasta la edad adulta, siendo del 80% a partir de los 13 años de edad3.
Desde el punto de vista de la histología, el TA es uno de los considerados tejidos conectivos o conjuntivos laxo.
La distribución anatómica del TA también muestra patrones de cambio con la edad y un dimorfismo sexual acentuado. En general, el grosor del TA subcutáneo aumenta en el tronco en los niños durante la adolescencia, y en la zona glúteo-femoral en las niñas, lo que conduce a fenotipos distintivos en la edad adulta que se han descrito como patrón de grasa androide frente a ginoide.
Otro factor a considerar es que la masa de TA es el elemento más variable de la composición corporal. Así, la variabilidad entre individuos puede oscilar desde alrededor del 6% hasta más del 60% del peso corporal total. La variabilidad en el mismo individuo (intra-individuo), puede ser también considerable a lo largo del tiempo si pasa por fases sucesivas de obesidad y delgadez.
La mayoría de los métodos que proporcionan datos por regiones anatómicas miden o estiman el TA, no determinan la grasa, que es un término químico, como ya hemos mencionado.
Nuestra especie presenta varios tipos de TA según la función que realice: el TA o grasa parda, marrón o multilocular y la grasa blanca, amarilla o unilocular, ambos con capacidad para almacenar grandes cantidades de lípidos, pero con diferentes papeles en el metabolismo energético. A continuación se revisan las características, importancia, función y distribución de estos dos tipos de tejido graso, interesantes desde el punto de vista de la nutrición.
TA pardo: grasa parda, marrón o multilocular
El TA marrón, también llamado grasa parda, porque su color varía del dorado al marrón rojizo, se caracteriza por presentar adipocitos o células grasas con un gran núcleo central, amplio citoplasma y mitocondrias muy numerosas, redondeadas con crestas muy juntas y bien desarrolladas. Estas mitocondrias contienen citocromos que les confieren ese color oscuro característico. En el citoplasma se encuentran dispersas varias gotas de ácidos grasos de distinto tamaño, que durante la preparación histológica rutinaria se pierden disueltas en los distintos alcoholes, proporcionando el aspecto agujereado característico al observarlo al microscopio. Los adipocitos son poligonales y grandes, aunque más pequeños que las células del TA blanco. Estas distinciones no son absolutas, puesto que los adipocitos pueden ser uniloculares y tener un reducido número de mitocondrias cuando los niveles de termogénesis son bajos. La diferencia fundamental con el TA blanco, se basa en sus características bioquímicas, puesto que el TA pardo presenta una proteína desacoplada propia que falta en la grasa blanca4.
El TA marrón se caracteriza por estar lobulado, recordando a una glándula. Tiene más capilares que el blanco, así como numerosas terminaciones nerviosas simpáticas. Después de un ayuno prolongado, las células adoptan un aspecto similar a un epitelio, acentuándose la semejanza con una glándula.
La función principal de la grasa parda es producir calor, bien para la termorregulación o en relación con la regulación del balance de energía, produciéndose grandes cambios en animales como respuesta al frío. Los ácidos grasos almacenados en la grasa parda se usan directamente por el tejido en el que están almacenados, aunque también pueden ser movilizados y utilizados en situaciones críticas por otros tejidos4.
La grasa parda ejerce una importante función en el feto y recién nacido, llegando a representar el 2-5% del peso corporal. Este tipo de grasa se encuentra localizada entre las escápulas, en las axilas, en la nuca, y alrededor de los grandes vasos del tronco. La función principal es termogénica durante el primer año de vida, al final del cual se creía prácticamente desaparecida en su totalidad, transformándose en grasa blanca o amarilla5. Sin embargo, hoy ya se acepta su existencia también en la edad adulta.
Es fácil comprender que la relación entre superficie y volumen del cuerpo en nuestra especie es muy diferente a la de los animales pequeños, y que la termodispersión en humanos es mucho menor que en roedores. Los recién nacidos presentan una cantidad considerable de grasa parda. En el adulto, se han descrito adipocitos marrones dispersos entre los blancos en biopsias perirrenales en el 24% de casos, que alcanzaban valores de hasta el 50% si se excluían los pacientes mayores de 50 años. Se ha calculado la presencia de un adipocito marrón por cada 100-200 adipocitos blancos como media en los depósitos de grasa visceral de adultos delgados6, también está descrito un aumento de adipocitos marrones en trabajadores al aire libre del norte de Europa7. La señal para la activación de los adipocitos marrones es una temperatura por debajo de la considerada neutra (34 ºC para los ratones, 28 ºC para las ratas y 20-22 ºC para los humanos). La dieta podría activar del mismo modo el TA marrón, que sería el responsable de la termogénesis inducida por los alimentos8.
En animales de experimentación, el porcentaje relativo de adipocitos marrones y blancos es variable, dependiendo de la cepa, edad, sexo, condiciones ambientales y nutricionales. Las ratas poseen una evidente plasticidad que permite que adipocitos blancos retroperitoneales, a temperatura ambiente, se transformen en pardos en animales aclimatados al frío por transdiferenciación. Estos cambios histofisiológicos se producen a través de un estímulo adrenérgico, probablemente por la activación de los adrenoceptores beta-3, y esta conversión contribuye al tratamiento de la obesidad y diabetes en estos animales9, abriendo una puerta al futuro tratamiento en humanos.
El desarrollo de técnicas de imagen cada vez más complejas aplicadas al estudio de trazadores de metástasis tumorales, como la FDG PET (tomografía por emisión de positrones con fluorodeoxyglucosa), ha proporcionado como hallazgo colateral y sorpendente, la visualización de áreas simétricas de gran actividad en la parte superior del cuerpo que corresponden a TA pardo. Los depósitos humanos son diferentes a los de roedores, el depósito principal se encuentra en las regiones supraclavicular y del cuello, con depósitos adicionales paravertebrales, mediastínicos o para-aórticos y suprarrenales, pero no interescapulares como los que existen en los recién nacidos10 (fig. 1).
La utilización de la FDG PET tiene una dificultad todavía inexplicable, consistente en que cuando un paciente se examina varias veces, la presencia o ausencia del TA marrón no es reproducible, esta cuestión impide dar datos concretos sobre la prevalencia de depósitos de TA marrón en adultos. En un estudio realizado en 33 mujeres que fueron examinadas con éxito en cinco ocasiones sucesivas durante el período de tratamiento anticancerígeno11, se observó que del total de mujeres, 6 no parecían tener TA marrón marcado en alguno de los cinco exámenes, y solamente una lo presentó en las cinco ocasiones. En el resto de pacientes, la intensidad de señal era diferente en todos los casos. La prevalencia de TA marrón estimada en esta pequeña población era del 80%, aunque los investigadores destacan que una única medida puede infravalorar enormemente la verdadera prevalencia de TA marrón debido a su variabilidad en la detección. Recientemente, revisando las historias clínicas de 1972 pacientes, se han encontrado depósitos de TA pardo en 7,5% de las mujeres frente al 3,1% de varones, en una relación 2:1 de mujeres/hombres12.
Estos porcentajes aumentarían durante la exposición al frío y no en condiciones termoneutras, con actividad significativamente menor en personas con sobrepeso y obesas frente a las delgadas13,14
Actualmente se acepta que la presencia de TA pardo en adultos jóvenes es alta, pero su actividad es reducida porque se relaciona inversamente con el IMC, y el porcentaje de grasa corporal13, especialmente en las personas mayores12. El TA pardo puede ser metabólicamente importante en humanos, y el hecho de que esté reducido, aunque todavía presente en la mayoría de las personas con sobrepeso u obesas puede ser fundamental para el tratamiento de la obesidad.
TA blanco: grasa blanca, amarilla o unilocular
La grasa blanca recibe esta denominación por contraposición a la grasa de color pardo o marrón. En este tejido, el color depende en parte de la dieta: en los primates, grupo al que pertenece nuestra especie, el color amarillo se debe a los carotenos, entre otras sustancias. En preparaciones histológicas rutinarias, los adipocitos aparecen con una gran vacuola o espacio vacío en posición central que corresponde a una única y gran gota de ácidos grasos que se ha disuelto durante la preparación y que hace que el citoplasma quede reducido a una fina película en la parte periférica, con un núcleo de menor tamaño, el número de mitocondrias es reducido y con escasas crestas. El tamaño de los adipocitos puede ser muy grande, con diámetros superiores a las 100 micras. El TA blanco posee una escasa vascularización e inervación.
Las funciones de la grasa blanca pueden resumirse en cuatro principales: sintetizar lípidos a partir de excedentes de hidratos de carbono o proteínas; responder a estímulos hormonales y nerviosos; secretar sus propias hormonas (leptina, TNF-alfa, adiponectina, etc.); y la más clásica de todas, actuar como reservorio de energía, formando, almacenando y descomponiendo ácidos grasos en equilibrio con la concentración correspondiente en el torrente sanguíneo15, aunque recientemente el TA está surgiendo como fuente importantísima de células madre adultas2.
En el ayuno prolongado, los adipocitos liberan gradualmente los lípidos almacenados y la vacuola central disminuye de tamaño, siendo reemplazada por numerosas gotas de lípidos más pequeñas. Si se moviliza todo el lípido almacenado, las células se asemejan a fibroblastos. Una excepción a esta regla son los acúmulos grasos que se localizan alrededor de los riñones, las órbitas oculares, algunas articulaciones como la rodilla o la cadera, las palmas de las manos o las plantas de los pies, cuyas células adiposas, en situaciones de ayuno, no liberan los lípidos acumulados. En estas regiones, la función principal del tejido graso parece ser de tipo mecánico, es decir, amortiguar golpes y servir de sostén a los distintos órganos5.
El número de células de grasa se puede determinar de forma aproximada cuando tenemos una medida de la grasa corporal total y una estimación del tamaño celular medio. La grasa corporal total en un individuo normopeso es del orden de 10 a 20 kg lo que corresponde aproximadamente a 3 x 1.010 adipocitos. El número de adipocitos en individuos obesos fluctúa generalmente entre 4-6 x 1.010 y aunque aumenta más rápidamente en la infancia y en la adolescencia, en la actualidad se sabe que el número de adipocitos también puede aumentar en la edad adulta16,17.
Desde el punto de vista de las características histológicas del TA, clásicamente la obesidad se define en función del tamaño y número de adipocitos. Así, se considera obesidad hiperplásica o hipercelular, aquella con número de adipocitos > 5 x 1.010 y generalmente se presenta en la infancia18. En la edad adulta esta hiperplasia celular se produce normalmente en aquellos individuos con más del 75% de su peso deseable (IMC > 35 kg/m2) y se asocia en general con la obesidad ginoide19. Cuando la obesidad se implanta en la edad adulta o durante el embarazo, se le llama obesidad hipertrófica e implica un aumento del tamaño de las células de grasa. La obesidad hipertrófica tiende a correlacionarse con una distribución androide o troncal de la grasa y está a menudo asociada con desórdenes metabólicos tales como intolerancia a la glucosa, hiperlipidemia, hipertensión y enfermedades cardiovasculares19. Se considera obesidad hipertrófica aquella en la que el peso de los adipocitos es > 0,42 mg en individuos menores de 35 años y > 0,82 mg en individuos de más de 35 años18.
En realidad, hoy en día sabemos que el TA muestra habitualmente características mixtas de hipertrófiahiperplásia, pero en situaciones extremas puede hacerse más manifiesto el predominio de la hipertrofia sobre la hiperplasia o viceversa, siendo la primera forma más típica de la obesidad severa del adulto y la segunda de la del niño.
Clasificación del TA blanco
A pesar del aumento de interés en el conocimiento de los distintos compartimentos de TA, todavía no existe un consenso sobre la nomenclatura de estos depósitos. La anatomía clásica ha dejado de lado un tejido que no era considerado como "un órgano", y que además molestaba a la hora de preparar las disecciones para el estudio de otras estructuras consideradas "nobles". Esta situación explica que en la mayoría de los textos de anatomía falte una clasificación detallada del TA, considerando simples categorías tales como: TA subcutáneo o fascia superficial (sería la capa comprendida entre la dermis y las fascias y aponeurosis musculares); TA que rodea órganos y que puede recibir un nombre específico del órgano que rodea (TA perirrenal);TA intersticial o infiltrado entre otros tejidos, de tal forma que es imposible disecar como una estructura continua, o el TA de la médula ósea.
Esta clasificación fue útil para los anatomistas en el pasado, principalmente porque el enfoque se centraba en los órganos y había escasa patología atribuida o relacionada directamente con el compartimento del TA. Sin embargo, en la actualidad se considera que el TA no es un compartimento homogéneo único, sino que tiene depósitos regionales específicos con importantes propiedades metabólicas. Por tanto, hoy en día, a la luz de los nuevos conocimientos, el estudio de los depósitos de TA requiere una clasificación más exhaustiva y una localización anatómica precisa, ya que estos compartimentos adiposos individuales podrían tener mayor asociación con procesos fisiológicos y patológicos que la masa de TA total.
El término distribución de la grasa se refiere a la cantidad relativa de grasa en los compartimentos principales en donde se almacena TA y grasa en el cuerpo. El perfeccionamiento de los métodos de valoración de la composición corporal ha hecho posible medir la grasa en sitios de tejido no adiposo como el músculo o el hígado, constituyendo la llamada grasa ectópica.
Clasificación del TA propuesta por Shen y cols.20
Desde el punto de vista anatómico Shen y colaboradores20 han realizado una clasificación exhaustiva del TA blanco (tabla I). Esta clasificación es de gran interés por ser extremadamente detallada y precisa, permitiendo caracterizar cada región anatómica del TA en el humano, proponiendo una nomenclatura de consenso para los distintos depósitos, rescatando del olvido algunos tradicionalmente no considerados. La clasificación que propone es, además, un híbrido entre regiones y propiedades funcionales, puesto que es especialmente exhaustiva respecto al TA visceral.
El estudio del TA, adquiere especial relevancia cuando se refiere al individuo obeso. Por ello, y teniendo en cuenta aspectos relativos a la distribución topográfica de la grasa corporal, Vague en 1947 clasificó la obesidad como de tipo androide y ginoide. En la tabla II se representa la clasificación de la distribución del tejido adiposo en el individuo obeso según la Sociedad Española del Estudio de la Obesidad (SEEDO)21.
Distribución topográfica de la grasa abdominal
En la presente revisión, vamos a estudiar la distribución del TA abdominal siguiendo básicamente la clasificación propuesta por Shen y colaboradores20, considerando además aspectos metabolicos y fisiopatológicos del TA. Hemos escogido la región abdominal debido a la abundante bibliografía y gran interés existente en los depósitos de grasa abdominal, pues incluso los estudios antropométricos incluyen la medida de la cintura y su relación con la cadera, como indicador indirecto de grasa visceral.
Los depósitos de TA se clasifican según su localización topográfica en tres grandes grupos en el abdomen: TA subcutáneo y TA interno, subdividido en visceral y muscular.
TA subcutáneo
El TA subcutáneo se ha estudiado clásicamente a través de las técnicas antropométricas (pliegues cutáneos). Las diferencias de distribución del TA según el sexo son insignificantes desde la lactancia, durante la niñez y hasta el comienzo de la adolescencia. Con el tiempo, los varones acumulan más grasa subcutánea en el tronco que en las extremidades. Esto sucede de forma desproporcionada durante la adolescencia y más lentamente hasta los 50 años aproximadamente. Por el contrario, las mujeres, acumulan cantidades de grasa similares en el tronco y las extremidades hasta los 40 años de edad, aproximadamente. Con el tiempo, en la mujer, el grosor de los pliegues cutáneos del tronco aumenta proporcionalmente más que el de las extremidades. La variación étnica en la distribución de la grasa subcutánea es también superior en mujeres que en varones22.
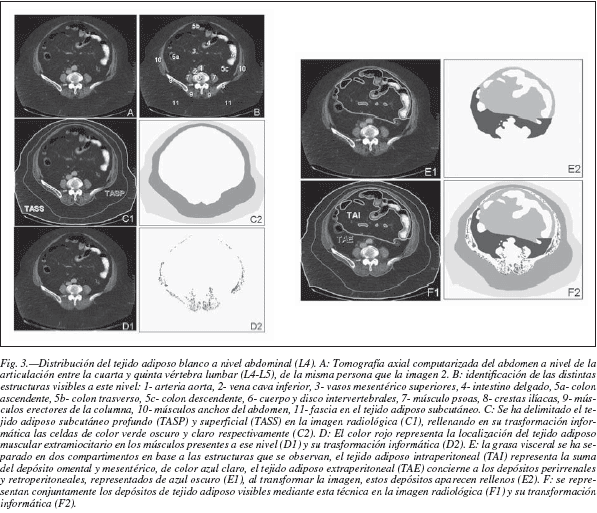
En el abdomen, la grasa subcutánea puede subdividirse en dos compartimentos distintos23,24 (fig. 2):
1) Tejido adiposo subcutáneo superficial (TASS): una capa superficial de TA distribuida bajo la piel abdominal, que presenta un grosor relativamente constante en toda la región, dentro de la variación entre los distintos individuos. Esta grasa es compacta y uniforme y está soportada por septos próximos que conectan la dermis con la fascia subcutánea circunferencial. El grosor de esta capa es lo que normalmente se mide utilizando los lipocalibres y combinando los datos obtenidos de los distintos pliegues antropométricos, da idea aproximada de la grasa subcutánea total.
2) Tejido adiposo subcutáneo profundo (TASP): otro compartimento tisular adiposo más profundo, localizado bajo la capa superficial anterior y separado de ella por una fascia subcutánea circunferencial que se fusiona con la pared muscular en regiones anatómicas determinadas, como la línea alba anteriormente o las apófisis espinosas posteriormente. Esta capa grasa subcutánea profunda es la más susceptible de aumentar en grosor en casos de obesidad, principalmente en las regiones periumbilical, paralumbar, glútea y caderas, quedando más delgada lateralmente al ombligo, en los costados. La grasa de este compartimento tiene una estructura de septos mucho más escasos y desordenados, que conectan la fascia subcutánea con la que cubre la musculatura de la pared abdominal de forma incompleta.
La razón fundamental para la división de la grasa subcutánea en profunda y superficial, proviene de los estudios en animales que indican que los lípidos se depositan a mayor velocidad en la capa profunda haciendo que sea un tejido más activo en términos metabólicos y que actuaría más como aislante térmico o capa de reserva25,26. Monzon y cols.27 confirmaron en humanos que la actividad lipolítica era mayor en adipocitos provenientes del tejido graso subcutáneo profundo que en los procedentes del compartimiento superficial.
Existen diferencias entre las proporciones de ambos compartimentos subcutáneos en función del sexo. Así, un estudio reciente realizado sobre imágenes de tomografía computarizada en L4-L5, muestra que en mujeres ambas grasas subcutáneas, superficial y profunda, se presentan en una proporción semejante. En los hombres, por el contrario, la grasa profunda corresponde al 60% de la grasa subcutánea total y el índice de tejido adiposo subcutáneo profundo/tejido adiposo subcutáneo total (TASP/TAST) es significativamente superior. Otro dato interesante es que la grasa subcutánea ventral, la de alrededor del ombligo, es superior en el hombre que en la mujer y además se correlaciona positivamente con al Índice de Masa Corporal (IMC) en este sexo, lo que significa que en el hombre, la grasa subcutánea abdominal aumenta con el grado de obesidad, de forma paralela, situación que no siempre sucede en la mujer28.
TA subcutáneo y riesgo metabólico
Algunos autores han sugerido que el TA subcutáneo de la región abdominal es el que mejor se correlaciona con los valores de insulina plasmáticos29,30 y de triglicéridos31, aunque no existe consenso sobre si la subdivisión de TA subcutáneo abdominal está relacionada con el riesgo metabólico. Así, para Kelley y cols.32 y Piernas y colaboradores28, la grasa subcutánea posterior representa en mayor medida a la grasa subcutánea profunda y, por tanto, podría tener un mayor impacto sobre la resistencia a la insulina que la cantidad de grasa que pueda existir en la región anterior del abdomen. Por el contrario, Ross y cols.33 defienden que la cantidad de grasa subcutánea profunda del abdomen no es un factor pronóstico independiente de la resistencia a la insulina.
Otros trabajos indican que no es la grasa subcutánea en si misma o sus diferentes compartimentos lo que determina el riesgo metabólico, sino su relación con el área visceral. Así, se ha propuesto un nuevo índice entre el área del tejido adiposo subcutáneo profundo y del tejido adiposo visceral (TASP/TAV) que cuando es mayor de 3,65 en la mujer o menor de 1,01 en el hombre, los sujetos presentan un mayor riesgo metabólico28. En este trabajo, realizado en 85 pacientes a partir de imágenes de tomografías computarizadas, se demuestra que este nuevo índice (TASP/TAV), es un buen predictor de riesgo metabólico. En particular es un indicativo de la variabilidad de HDL-C en el hombre y de HOMA en la mujer.
Estos resultados tan dispares sobre el impacto metabólico de los tejidos subcutáneos superficial y profundo, podrían deberse al diferente grado de obesidad entre los sujetos de los diferentes estudios. Recientemente se ha postulado que la grasa subcutánea superficial es la de mayor impacto metabólico mientras que no se alcancen valores significativamente elevados de grasa visceral y subcutánea profunda. Es entonces, cuando se alcanza este límite, cuando los compartimentos subcutáneo profundo y visceral, alcanzan la verdadera relevancia metabólica y esto sucede tanto en hombres como en mujeres, en la edad adulta28.
Grasa intraabdominal, visceral o perivisceral
La denominada grasa intraabdominal, visceral o perivisceral se encuentra dentro de las paredes óseas y musculares del abdomen, por tanto, para su medición no es posible el uso de las técnicas antropométricas de pliegues cutáneos o el perímetro de cintura, sino que es necesario un estudio con técnicas de imagen o diámetros. Esta región de TA forma parte del TA interno visceral de Shen y colaboradores20, y se refiriere exclusivamente a la región abdominal que sería visible con técnicas de imagen. La grasa intaabdominal se puede subdividir en (fig. 2)
1) TA intraperitoneal (TAI): corresponde al territorio tributario de la vena porta-hepática.
- Grasa omental, se encuentra en el omento o epiplon mayor, cuatro hojas de peritoneo que cuelgan a modo de delantal desde la curvatura mayor del estómago y el colon transverso, entre las asas delgadas y la pared anterior del abdomen.
- Grasa mesentérica, se deposita en el mesenterio o doble hoja de peritoneo que une el yeyuno-íleon a la pared posterior del abdomen.
2) TA extraperitoneal (TAE): corresponde al territorio tributario de las venas cavas
- Retroperitoneal, se encuentra entre el peritoneo y la fascia transversal que cubre la cara profunda de los músculos del abdomen, y que incluye la grasa pararrenal, grasa que se encuentra entre la aorta abdominal y la vena cava inferior, delante de los cuerpos vertebrales, y la grasa perirrenal que rodea los riñones, separada del TA retroperitoneal por una celda incompleta.
En general, las personas obesas tienen más grasa visceral que las delgadas. Además el TA visceral difiere entre sexos, mientras que los varones tienen mayor cantidad de grasa visceral que las mujeres, estas últimas presentan un aumento marcado de la grasa visceral principalmente durante la menopausia. Además, en el varón existe una correlación positiva entre la grasa visceral y el índice de masa corporal (IMC), indicando que la grasa intraabdominal se acumula en proporción al grado de obesidad. Sin embargo, en la mujer esta situación no se presenta. Hay que tener en cuenta que en el sexo femenino el aumento de grasa visceral está limitado por barreras anatómicas28. Además, la mujer se protege a sí misma de un aumento de grasa visceral, incrementando la grasa subcutánea hasta que se alcanza un cierto grado de obesidad, a partir del cual comienza el aumento de grasa visceral34. Durante la vejez, las cantidades absolutas de grasa visceral pueden permanecer más o menos estables, aunque la grasa visceral puede aumentar en mayor medida que la grasa corporal total, ya que ésta disminuye durante la senectud y se redistribuye35. Sin embargo, en el adulto, la cantidad de grasa visceral está relacionada sólo de forma moderada con la grasa corporal total, con una varianza que va desde alrededor de 30 a 50%36,37.
Por el contrario, algunos autores consideran que el sexo no es una variable predictora de la grasa visceral, siendo la edad el factor fundamental responsable del incremento de los depósitos grasos viscerales que se producen con el envejecimiento, estableciendo que cada año más de edad está asociado con un incremento del área grasa visceral de 3,30 cm238.
TA visceral y riesgo metabólico
Numerosos estudios han mostrado, usando técnicas de imagen, que el tamaño del compartimento adiposo visceral se asocia con factores de riesgo de enfermedad cardiovascular39-41, con variables de comorbilidad asociadas a la obesidad, tales como elevadas concentraciones plasmáticas de triglicéridos y apolipoproteína B, mayor proporción de partículas LDL, aumento en la relación colesterol total/HDL colesterol, valores inferiores de HDL-colesterol, resistencia a la insulina e hiperinsulinemia, y cambios en las concentraciones séricas de leptina, TNF-alfa, y distintas hormonas sexuales33,42-54.
Los desórdenes en la distribución de la grasa, especialmente con la acumulación de grasa visceral en la parte superior del tronco y las complicaciones metabólicas asociadas, han hecho que algunos autores denominen al síndrome metabólico como "síndrome de grasa visceral" que correspondería a la suma de la intolerancia a la glucosa, hiperlipidemia, hipertensión y la acumulación de grasa visceral.
Existen numerosos estudios que relacionan la disposición de la grasa corporal con los valores de insulina. En general, se considera el acúmulo de grasa visceral como factor fundamental en la resistencia a la insulina33,55, incluso con una correlación más fuerte que otros factores de riesgo como las alteraciones de la relación lípidos-proteínas56. Sin embargo, para algunos autores, las medidas del compartimento graso subcutáneo profundo serían mejores predictores de resistencia a la insulina que el propio tejido visceral32,57-59. Algunos investigadores consideran que la importancia de la grasa visceral radica en los compartimentos mesentérico y omental exclusivamente, los denominados depósitos portales o intraperitoneales frente a los extraperitoneales. Estos autores, se fundamentan en que los ácidos grasos de estas zonas se liberan a un ritmo mayor y drenan directamente en la vena porta. La exposición continua del hígado a elevadas concentraciones de ácidos grasos daría como resultado los desórdenes metabólicos asociados con la acumulación de grasa visceral41,60,61.
La heterogeneidad metabólica del TA de los distintos compartimentos, particularmente las diferencias entre los depósitos adiposos subcutáneos y los denominados portales (grasa mesentérica y omental), puede acompañar a anomalías metabólicas severas. Existen autores que defienden que esta grasa está directamente relacionada con las alteraciones cardiovasculares que se observan en individuos no obesos, como el aumento del grosor de la íntima en la pared de la arteria carótida común, lo que demostraría que el TA portal juega un papel fundamental en el desarrollo potencial de la arteriosclerosis propia de la obesidad41. Además, se ha sugerido por Enevoldsen y cols.62 y por nuestro propio grupo63, que el determinante más importante en el impacto metabólico es la masa relativa de los diferentes compartimentos de grasa, y no su tamaño absoluto. Así, el clásico índice de grasa visceral respecto al subcutáneo (TAV/TAST) se ha propuesto como un criterioadecuado de diagnóstico de alteraciones metabólicas64.
El exceso de grasa visceral es por tanto un marcador de la incapacidad del tejido adipose subcutáneo de actuar como un protector metabólico, por lipodistrofia o por hipertrofia y por tanto resistencia a la insulina. En esta situación, los individuos sedentarios que no pueden almacenar su exceso de energía en el tejido adiposo subcutáneo depositarán está grasa en lugares "indeseables" como son el hígado, el corazón, el páncreas y finalmente, el músculo esquelético65.
TA muscular
La grasa muscular comienza a considerarse como un "nuevo" compartimento graso66 y se refiere a distintos depósitos de almacenamiento de lípidos en el tejido del músculo esquelético: por un lado, los lípidos que están dentro de los adipocitos localizados entre las fibras musculares, los llamados lípidos extramiocelulares o extramiocitarios; por otro lado, los lípidos localizados dentro de las fibras musculares en forma de triacilgliceroles citosólicos, en el sarcoplasma, generalmente en contacto directo con las mitocondrias, también llamados lípidos intramiocelulares o intramiocitarios. La grasa intermuscular, por su parte, se refiere a los depósitos localizados entre los distintos músculos, visibles mediante tomografía computarizada (TC, fig. 2) o resonancia magnética (RM).
Desde el punto de vista fisiológico, se ha sugerido que los lípidos intramiocelulares son una fuente energética durante el ejercicio, puesto que este tipo de lípidos decrece durante el ejercicio prolongado, y del mismo modo que el glucógeno, aumenta durante el entrenamiento. Además, los lípidos intramiocitarios son más abundantes en las fibras musculares tipo 1, lo que sugiere que aumentarían hasta alcanzar el punto óptimo de capacidad oxidativa de grasa, resultando un combustible ventajoso. Sin embargo, cuando se elevan los valores de ácidos grasos en el plasma o aumenta el contenido de grasa en la dieta, también aumentan los lípidos intramiocelulares, sugiriendo que las fibras del músculo esquelético sirven de almacén de ácidos grasos si la disponibilidad es alta67. Con el estilo de vida actual en los paises occidentalizados, de baja actividad física y consumo excesivo de alimentos grasos, la capacidad de utilizar los lípidos almacenados como fuente de energía ha quedado reducida, teniendo efectos muy negativos sobre la sensibilidad a la insulina.
Los lípidos intramiocitarios pueden ser cuantificados mediante Resonancia Magnética Espectroscópica (RMS), de forma no invasiva y repetitiva en un determinado músculo a lo largo del tiempo, y en el mismo paciente, aportando datos de un volúmen muscular proporcionalmente mayor que una biopsia. Dentro del músculo, las pequeñas gotas de lípidos están rodeadas por una fase acuosa (el sarcoplasma), diferente a la de los lípidos rodeados por otros lípidos (en el TA) y a la de los lípidos extramiocelulares (capas de lípidos entre fibras musculares), lo que proporciona distintas señales dentro de un campo magnético.
El mayor inconveniente de esta técnica es que aunque el espectro que se obtiene proporciona dos picos separados que corresponden a los lípidos intra y extramiocitarios, éstos se superponen parcialmente, y se necesita un sofisticado programa informático que ajuste y cuantifique los picos por separado. Especialmente en sujetos obesos, la gran cantidad de lípidos extramiocitarios dificulta la localización de un área libre de ellos, obteniéndose un gran pico que se superpone en gran medida con el pico correspondiente a los lípidos intramiocitarios. Se ha estimado que el coeficiente de variación en la cuantificación de lípidos intramiocitarios por RMS está entre 6% y 14%68.
La mayoría de los estudios sobre lípidos intramiocitarios se limita a un número reducido de músculos. La pierna ha sido ampliamente analizada, debido al alineamiento paralelo de las fibras y de las capas de lípidos que las rodean respecto al campo magnético estático. El mayor contenido de grasa se encuentra en la parte interna del músculo sóleo, mientras que los tibiales anterior y posterior y los gemelos presentan valores dos o tres veces más reducidos69,70. Esta diferencia concuerda con los distintos tipos de fibras musculares y los sustratos que utilizan. El sóleo tiene un alto porcentaje de fibras tipo 1 caracterizadas por mayor contenido en grasa y mitocondrias, dependiendo más de la oxidación de los lípidos que los otros músculos.
La sarcopenia o disminución de la masa muscular es un tema de gran interés, por la pérdida de fuerza que puede implicar, limitación funcional y discapacidad, así como aumento del riesgo de caídas y fracturas óseas. La causa principal puede ser el envejecimiento, aunque también puede sumarse un nuevo factor que es el aumento de lípidos del músculo esquelético, tanto intramiocelular como total, y este contenido influye negativamente en la fuerza y la función muscular71,72.
Los cambios en el músculo esquelético dependientes de la edad están relacionados con cambios en otros componentes de la composición corporal. Forbes73 observó que los cambios en masa grasa y masa libre de grasa están relacionados, y en general ocurren, de forma proporcional y constante con el cambio de peso: 70% de grasa a 30% de la masa libre de grasa, pero la regulación de esta relación se pierde durante la senectud produciéndose cambios discordantes en los componentes de tejido magro y blando, lo que lleva a una composición corporal caracterizada por una masa muscular reducida en presencia de exceso de peso corporal, esta forma "desordenada" de composición corporal se ha denominado obesidad sarcopénica74,75.
La obesidad sarcopénica se desarrolla cada vez más en personas mayores a medida que aumenta su edad, y se considera una consecuencia tardía de la obesidad prolongada que puede acelerar la pérdida muscular en la vejez. Se ha estimado que la prevalencia de este nuevo tipo de composición corporal puede aumentar del 2 al 10% de los 65 a los 85 años de edad, estando fuertemente asociada con limitaciones funcionales: trastornos del equilibrio/marcha, discapacidad, etc.76
TA muscular y riesgo metabólico
En su conjunto, cuando la adiposidad es baja, la cantidad de TA intermuscular no difiere significativamente entre afroamericanos, asiáticos y blancos. Sin embargo, cuando aumenta, la cantidad de grasa intramuscular crece más rápidamente en mujeres afroamericanas, constituyéndose un depósito que puede llegar a ser de tamaño similar al TA visceral66. La relevancia de la localización de estos depósitos radica en que los lípidos intramiocelulares, y no los extramiocelulares, están relacionados con la resistencia a la insulina77. Aunque es el hígado el órgano que mayor cantidad de ácidos grasos recibe, los músculos y el páncreas también están sometidos a un flujo incrementado de ácidos grasos en la obesidad. En esta situación el músculo esquelético disminuye su captación de glucosa, hecho que contribuye a la hiperglucemia.
El músculo esquelético es el tejido sensible a insulina más abundante del cuerpo humano, capaz de captar el 40% de la glucosa postprandial, a la vez que consume el 20% de la energía corporal. Su incapacidad para almacenar energía y para transformar la grasa a glucosa, se ha denominado inflexibilidad metabólica. Investigaciones recientes han identificado defectos específicos en la señalización posterior a la unión de la insulina al receptor que se acompañan con una disminución de la capacidad oxidativa de la mitocondria, un aumento del acúmulo de la grasa intramuscular, un incremento de la generación de especies reactivas a oxígeno, y una estimulación de las vías de inflamación lo que finalmente conlleva un riesgo metabólico aumentado78.
Técnicas de imagen: Tomografía Computarizada (TC) y Resonancia Magnética (RM)
La determinación de la distribución regional de la grasa es cada vez más importante en la valoración de la composición corporal.
La antropometría ha sido utilizada desde hace décadas, es un método barato y sin demasiadas complicaciones técnicas que debe complementar toda valoración de la composición corporal. Así, la determinación del peso, talla y perímetro de cintura son imprescindibles en cualquier exploración clínica. En concreto, el perímetro de cintura es un parámetro de medida imprescindible por su relación con el riesgo cardiovascular asociado a la obesidad y al síndrome metabólico,independientemente del índice de masa corporal79.
Las técnicas de imagen como la TC o la RM son de referencia para estimar el área grasa abdominal, proporcionando información acerca de la composición corporal a nivel tisular. En cualquier caso, estos métodos tienen aplicaciones clínicas limitadas en el estudio de la composición corporal de cuerpo entero y en el estudio de modelos compartimentales, pero tienen cada vez más interés para estudios de la distribución regional de la grasa corporal, no sólo en obesidad sino también en la detección de estados de desnutrición como la caquexia.
En la tabla III se analizan brevemente los puntos fuertes y débiles de estas técnicas.
Comparación entre ambas técnicas. Ventajas y desventajas
Cualquiera de las dos técnicas permite distinguir entre tejido graso subcutáneo y visceral, dando idea de la relación entre el fenotipo obeso y el riesgo de salud, pero la contribución independiente de cada uno de los depósitos descritos sigue siendo motivo de controversia80,81.
Los fundamentos de cada técnica son distintos. La TC se basa en rayos X que se atenúan al atravesar las distintas estructuras corporales antes de llegar a los receptores que generarán una imagen digital, proporcionando distintas tonalidades de gris para los distintos tejidos. Por su parte, la RM no utiliza radiaciones ionizantes, se basa en un campo magnético externo que orienta el protón del núcleo de hidrógeno, se aplica un pulso de radiofrecuencia a los tejidos corporales, la energía absorbida por algunos protones se libera al terminar el pulso y volver a la posición original. La variación es detectada por un receptor.
El avance de la medicina nuclear ha permitido generar imágenes mediante el uso de trazadores radioactivos que se fijan con diferente afinidad a los distintos tipos de tejidos, la informática ha proporcionado herramientas que hacen reconstrucciones tridimensionales instantáneas del cuerpo entero o de una determinada estructura, con preparación o sin ella. Ya hemos mencionado la técnica de PET que utiliza isótopos radiactivos que se introducen en moléculas orgánicas o radiofármacos que son inyectadas al paciente y posteriormente se analiza la emisión radiactiva de los diferentes tejidos según la captación del radiofármaco que presenten. Generalmente se utiliza glucosa marcada con Flúor-18, por lo que existe mayor afinidad por parte de las lesiones tumorales o inflamatorias. Los estudios combinando TAC y PET permiten mayor resolución espacial junto con imágenes funcionales, han sido fundamentales en el estudios del TA pardo.
La ventaja de la RM sobre la TC reside en que en esta última, la intensidad de la señal producida por la grasa es muy baja, mientras que en la RM aparece hiperintensa y el resto de los tejidos tienen distinto grado de hipointensidad. Esta característica permite aplicar técnicas digitales de segmentación para fragmentar en dos compartimentos la grasa subcutánea y visceral de forma automática, reduciendo enormemente el tiempo de estudio empleado82 y usando imágenes que se obtienen durante la RM rutinaria. Por todo ello, la RM es una técnica muy interesante, no sólo en caso de obesidad sino también de patologías como el cáncer, para prevenir o detectar estados de desnutrición y permitir la intervención nutricional antes de que comiencen a manifestarse los signos clínicos82.
Una vez determinadas las áreas de grasa abdominal visceral (AV) y la grasa abdominal subcutánea (AS) se calcula un índice AV/AS, que cuando es superior a 0,4 indicaría obesidad visceral83. Para la obtención del índice grasa visceral/grasa subcutánea es suficiente con la realización de un único corte, a nivel de L4, la cuarta vértebra lumbar, que generalmente coincide con el ombligo24,82, y que se considera de referencia. Aunque algunos autores realizan esta medición entre la cuarta y quinta vértebra lumbar (L4-L5, fig. 3)84. El índice AV/AS es el que mejor refleja la distribución de la grasa corporal y se relaciona con la presencia de alteraciones metabólicas en mayor medida que el índice cintura/cadera85.
Es importante que la imagen que se va a estudiar corresponda realmente al nivel L4. En personas con obesidad mórbida, el abdomen presenta gran cantidad de grasa subcutánea, produciendo un pliegue que hace que el ombligo se desplace caudalmente, incluso cuando el individuo está tumbado, dejando de corresponder al nivel vertebral de referencia. Las diferencias del valor de la grasa visceral pueden ser muy grandes en cada nivel20. La figura 4 pertenece a una persona con obesidad mórbida, en la que el ombligo está desplazado hasta el nivel de la tercera vértebra sacra, en esta persona, si se compara el valor de la grasa visceral real en L4 (360,37 cm2) con el obtenido en S3 (221,62 cm2), la diferencia es del 38,50%. Además, si el estudio se hace con métodos automáticos, es muy importante comprobar y delimitar correctamente los territorios de estudio, ya que la grasa de otro depósito, como puede ser el muscular, o artefactos como el disco intervertebral, pueden añadirse al TA visceral debido a que la fascia o envuelta que los separa no se aprecia bien en la imagen, o los tejidos presentan parecida intensidad.
Para los estudios comparativos de grasa abdominal entre distintos sujetos, lo ideal es realizar cuatro secciones entre las vértebras lumbares segunda y cuarta86-88 debido a la enorme variabilidad de la disposición de la grasa intrabdominal que existe entre los distintos sujetos a un mismo nivel, lo que para algunos autores89, cuestiona los resultados obtenidos mediante un único corte. Si a ello añadimos las considerables variaciones entre los protocolos usados, podemos explicar, al menos en parte, las grandes diferencias de los resultados obtenidos en poblaciones aparentemente similares.
Tanto la TC como la RM son herramientas que proporcionan a los investigadores la oportunidad de evaluar los componentes del nivel tejido-órgano en los individuos vivos, pudiendo proporcionar información fundamental para comprender las diferencias sexuales y étnicas en la distribución del TA, incluso antes del nacimiento, pues la RM es el único método aplicable que no perjudica ni a la madre ni al feto90.
La calidad de imagen de la RM es extraordinaria, proporcionando valores de grasa muscular que posteriormente han sido validados mediante disección66,91, con pequeñas diferencias de entre el 2 y 6% para el TA subcutáneo o visceral, y hasta del 20% en el músculo esquelético del adulto, pero con gran correlación entre las medidas con TC y RM85,92-94. Sin embargo, se han descrito variaciones en las estimaciones de TA en lactantes de hasta el 40%95.
Limitaciones de las técnicas de imagen
Una limitación muy importante, común a las dos técnicas, es que los obesos, debido a sus dimensiones, a veces no caben en el aparato de medida, sobretodo cuando son cerrados, pudiendo quedar parte del cuerpo fuera del campo de análisis, o en caso de obesidades móbidas, la camilla sobre la que tiene que situarse no puede aguantar el peso del individuo, aunque estos problemas técnicos están comenzando a resolverse.
Dentro del compartimento subcutáneo, la fascia superficial no es fácilmente distinguible en las imágenes de RM, lo que impide determinar los depósitos de grasa profundos y superficiales de forma similar a la TC, pero como las tres cuartas partes de la capa profunda están localizadas en la mitad posterior del abdomen, se puede trazar una línea imaginaria que separe estos depósitos y que permita asumir la analogía de las medidas realizadas por las dos técnicas57-58.
La subdivisión del TA visceral en depósitos intraperitoneal y extraperitoneal en las imágenes de TC y RM no es clara, ya que el peritoneo no es fácilmente visible con ninguno de los dos métodos, por lo que se trazarían líneas imaginarias que unen detalles anatómicos claros como el borde anterior del disco de las vértebras lumbares L4 y L5, los músculos psoas, el colon ascendente y descendente, los riñones, la arteria aorta o la vena cava inferior, con las paredes del abdomen, para segmentar la grasa visceral. De esta forma, entre el 60 y 75% del TA visceral abdominal se encuentra por delante de estas líneas y se considera TA portal92,96, aunque no existe consenso sobre si esta división mejora o no la relación observada entre el tejido graso visceral por sí mismo y la acción de la insulina29,33,95,97,98.
A pesar de todos los inconvenientes propios de estas técnicas, se están realizando estudios con gran número de personas con TC y RM que deben ayudar a comprender las repercusiones de la distribución del TA en la salud71,72,99-103.
Modelos antropométricos derivados de las técnicas de imagen
Una de las prioridades de la investigación del TA es la mejora en la identificación de individuos de riesgo. Se trata de definir medidas antropométricas simples que se asocien con alteraciones metabólicas. Tal y como se ha comentado a lo largo de esta revisión, estas alteraciones se relacionan con mayor frecuencia con la grasa visceral. La determinación del TAV no es fácil, y aunque las técnicas de imagen lo hacen de forma precisa y fiable, en numerosos casos su aplicación es inviable por su elevado coste. Este es el caso de los estudios epidemiológicos o de la práctica clínica diaria. Sin embargo, las técnicas de imagen de RM y TC son de gran utilidad como técnicas de referencia para definir nuevos índices o ecuaciones antropométricas. A partir de ellas, numerosos autores han definido medidas rápidas de estimación del área visceral, y como consecuencia de riesgo metabólico, que no requieren importantes gastos y que se pueden utilizar en estudios epidemiológicos.
No existe consenso entre los distintos autores sobre cuáles son las medidas antropométricas más indicativas del TAV.
La circunferencia de la cintura es la más utilizada, entre los diversos índices propuestos, ya que algunos autores defienden que esta medición es mejor para la estimación de grasa visceral que el uso del índice cintura-cadera (ICC)103. Sin embargo, la medición de la circunferencia de cintura conlleva algunos problemas, ya que no siempre se siguen definiciones estándares, y la medición varía en función del criterio utilizado104. Por ejemplo, se puede determinar el perímetro de cintura a la altura del ombligo, en la línea media entre la cresta suprailíaca y la última costilla, o en la zona más estrecha del tronco. Además, la medición también varía en función del sujeto, de la localización de los huesos, del músculo o del TA. Diversos estudios defienden que el diámetro sagital (fig. 5) presenta numerosas ventajas sobre las circunferencias de cintura y sobre el ICC105. Aún así, tanto las mediciones de circunferencias como las de diámetros son variables unidimensionales y por tanto no son modelos completos para determinar una variable bidimensional como es el área visceral.
Para resolver este problema se ha desarrollado un modelo circular en el que el área visceral (AV) se calcula como si fuera el área de un círculo con la siguiente ecuación104.
Área visceral (AV) = π (Cintura (m)1/2 π - pliegue abdominal)2
Diversos autores consideran que el área del compartimiento visceral del abdomen se asemeja más a la de una elipse que a la del círculo, incluso en sujetos obesos. Basándose en este supuesto, He y colaboradores106, han desarrollado un modelo elíptico para estimar el área visceral. Sin embargo este modelo presenta problemas en el individuo obeso ya que implica la medición de pliegues de grasa subcutánea de difícil medición. Recientemente, se ha desarrollado un modelo elíptico para clasificar la obesidad visceral en la práctica clínica107. Este modelo incluye la medición de dos diámetros, sagital y coronal (fig. 5), y un solo pliegue, el pliegue tricipital, de fácil medición por su accesibilidad, incluso en individuos obesos. A partir de estas medidas se determina el índice de área visceral y subcutánea (AV/AS). Cuando este índice es > 0,42 se considera que el individuo presenta obesidad visceral107:
AV/AS = 0,868 + 0,064 _ diámetro sagital - 0,036 x diámetro coronal- 0,022 x tríceps
Para Soto González y cols.108 y Bouza y cols.38, habría que añadir otras variables de efecto independiente sobre la grasa visceral, como la edad, el sexo y el diámetro intrabdominal determinado por DEXA.
Conclusión general
El TA se ha revelado como un órgano endocrino que presenta un importante papel metabólico. Si tenemos en cuenta, además, el gran problema de salud pública que constituye hoy en día la obesidad, comprenderemos el interés creciente que presentan la ciencia y la medicina actual, en el conocimiento de la distribución anatómica, topográfica y funcional del tejido adiposo. Los avances recientes en la metodología de estudio de la distribución del TA, principalmente la TC y RM, en sus diversas modalidades, nos aportan las herramientas necesarias para evaluar el verdadero impacto de la compartimentalización de la grasa sobre los factores de riesgo metabólicos. El ideal sería identificar un compartimiento de TA mórbido y poder actuar sobre él, pues las causas y consecuencias metabólicas de la distribución regional de la grasa tienen particular importancia clínica. Estas observaciones pueden ayudar a diseñar mejores estrategias terapéuticas preventivas y de intervención dirigidas hacia los depósitos regionales de grasa y sus implicaciones metabólicas.
Agradecimientos
Al Servicio de Diagnóstico por Imagen del Hospital Rúber Internacional de Madrid por las imágenes de TC.
Referencias
1. Waki H, Tontonoz P. Endocrine functions of adipose tissue. Annu Rev Pathol 2007, 2: 31-56. [ Links ]
2. Fernyhough ME, Hausman GJ, Guan LL, Okine E, Moore SS, Dodson MV. Mature adipocytes may be a source of stem cells for tissue engineering. Biochem Biophys Res Commun 2008; 368 (3): 455-7. [ Links ]
3. White DR, Widdowson EM, Woodard HQ, Dickerson JW. The composition of body tissues (II). Fetus to young adult. Br J Radiol 1991; 64: 149-59. [ Links ]
4. Trayhurn P, Ashwell M. Control of white and brown adipose tissues by the autonomic nervous system. Proc Nut Soc 1987; 46: 135-42. [ Links ]
5. Geneser F. Histología. Sobre bases biomoleculares. Editorial Médica Panamericana, pp: 227-33, 3ª edición, Madrid, 2000. [ Links ]
6. Oberkofler H, Dallinger G, Liu YM, Hell E, Krempler F, Patsch W. Uncoupling protein gene: quantification of expression levels in adipose tissues of obese and non-obese humans. J Lipid Res 1997; 38: 2125-33. [ Links ]
7. Huttunen P, Hirvonen J, Kinnula V. The occurrence of brown adipose tissue in outdoor workers. Eur J Appl Physiol 1981; 46: 339-45. [ Links ]
8. Cinti S. The role of brown adipose tissue in human obesity. Nutr Metab Cardiovasc Dis 2006; 16: 569-74. [ Links ]
9. Himms-Hagen J, Melnyyk A, Zingaretti MC, Cinti S. Multilocular fat cells in WAT of CL-316243-treated rats derive directly from white adipocytes. Am J Physiol 2000; 279: C670-81. [ Links ]
10. Nedergaard J, Bengtsson T, Cannon B. Unexpected evidence for active brown adipose tissue in adult humans. Am J Physiol Endocrinol Metab 2007; 293: E444-52. [ Links ]
11. Rousseau C, Bourbouloux E, Campion, L, Fleury N, Bridji B, Chatal FJ, Resche I, Campone M. Brown fat in breast cancer patients:analysis of serial (18)F-FDG PET/CT scans. Eur J Nucl Med Mol Imaging 2006; 33: 785-91. [ Links ]
12. Cypress AM, Lehman S, Williams G, Tal I, Rodman D, Goldfine AB, Kuo FC, Palmer EL, Tseng YH, Doria A, Kolodny GM, Kahn CR. Identification and importance of brown adipose tissue in adult humans. N Engl J Med 2009; 360 (15): 1509-17. [ Links ]
13. Van Marken Lichtenbelt WD, Vanhommering JW, Smulders NM, Drossaerts JM, Kemerink GJ, Bouvy ND, Schrauwen P, Teule GJ. Cold-activated brown adipose tissue in healthy men. N Engl J Med 2009; 360 (15): 1500-8. [ Links ]
14. Virtanen KA, Lidell ME, Orava J, Heglind M, Westergren R, Taittonen M, Laine J, Savisto NJ, Enerbäck S, Nuutila P. Functional adipose tissue in healthy adults. N Engl J Med 2009; 360 (15): 1518-25. [ Links ]
15. Trayhurn P, Beattie JH. Physiologycal role of adipose tissue: white adipose tissue as an endocrine and secretory organ. Proc Nut Soc 2001; 60: 329-39. [ Links ]
16. Björntorp P. Metabolic implications of body fat distribution. Diabetes Care 1991; 14 (12): 1132-43. [ Links ]
17. Bray GA. A retrospective view of obesity. Int J Obes Relat Metab Disord 1992; (Supl. 3): S1-4. [ Links ]
18. Sjöström L, Smith U, Krotkiewshi M, Björntorp P. Cellularity in different regions of adipose tissue in young men and women. Metabolism 1972; 21 (12): 1143-53. [ Links ]
19. Rebuffé-Scrive M, Eldh J, Hafström LO, Björntorp P. Metabolism of mammary, abdominal and femoral adipocytes in women before and after menopause. Metabolism 1986; 35 (9): 792-7. [ Links ]
20. Shen W, Wang ZM, Punyanita M, Lai J, Sinav A, Oral JG, Imielinska C, Ross R, Heymsfield SB. Adipose tissue Quantification by imaging methods: a proponed classificatio. Obesity Res 2003; 11: 5-16. [ Links ]
21. Salas-Salvadó J, Rubio Herrera MA, Barbany M, Moreno B. Consenso SEEDO 2007 para la evaluación del sobrepeso y la obesidad y el establecimiento de criterios de intervención terapéutica. Med Clin 2007; 128 (5): 184-96. [ Links ]
22. Malina RM. Variación en la composición corporal asociada con sexo y etnicidad. En: Composición corporal. Heysmsfiels SB, Lohman TG, Wang Z, Going SB. Capítulo 17. McGraw-Hill Interamericana, 2005. [ Links ]
23. Markman B, Barton FE. Anatomy of the subcutaneous tissue of the trunk and lower extremity. Plast Reconstruct Surg 1987; 80: 248-54. [ Links ]
24. Johnson D, Dixon AK, Abrahams PH. The abdominal Subcutaneous Tissue: Computed Tomographic, Magnetic Resonante, and Anatomical Observations. Clin Anat 1996; 9: 19-24. [ Links ]
25. Carey GB. The swine as a model for studying exercise-induced changes in lipid metabolism. Med Sci Sports Exerc 1997; 29: 1437-43. [ Links ]
26. Mersmann HJ and Leymaster KA. Differential deposition and utilization of backfat layers in swine. Growth 1984; 48: 321-30. [ Links ]
27. Monzon JR, Basile R, Heneghan S, Udipi V, Green A. Lipolysis en adipocytes isolated from deep and superficial subcutaneous adipose tissue. Obesity Research 2002; 10: 266-9. [ Links ]
28. Piernas C, Hernández-Morante JJ, Canteras M, Zamora S, Garaulet M. New computed tomography-derived índices to predict cardiovascular and insulin-resistance risks in overweight/obese patients. Aceptado para su publicación en Eur J Clin Nutr 29 October 2008; doi:10.1038/ejcn.2008.47 [ Links ]
29. Abate N, Garg A, Peshock RM, Stray-Gundersen J, Grundy SM. Relationships of generalized and regional adiposity to insulin sensitivity in men. J Clin Invest 1995; 96: 88-98. [ Links ]
30. Goodpaster BH, Thaete FL, Simoneau JA, Nelly DE. Subcutneous abdominal fat and thigh muscle composition predict insulin sensitivity independently of visceral fat. Diabetes 1997; 46: 1579-85. [ Links ]
31. Marcus MA, Murphy L, Pi-Sunyer FX, Albu JB. Insulin sensitivity and serum triglyceride level in obese white and blackwomen: relationship to visceral and truncal suctutaneous fat. Metabolism 1999; 48: 194-9. [ Links ]
32. Kelley DE, Thaete FL, Troost F, Huwe T, Goodpaster BH. Subdivision of subcutaneous abdominal adipose tissue and insulin resistance. Am J Physiol 2001; 278: E941-8. [ Links ]
33. Ross R, Aru J, Freeman J, Hudson R, Janssen I. Abdominal adiposity and insulin resistance in obese men. Am J Physiol 2002; 282: E657-63. [ Links ]
34. Lemieux S, Prud'homme D, Bouchard C, Tremblay A, Després JP. Sex differences in the relation of visceral adipose tissue accumulation to total body fatness. Am J Clin Nutr 1993; 58 (4): 463-7. [ Links ]
35. Baumgartner RN, Rhyne RL, Garry PJ, Heymsfield SB. Imaging techniques and anatomical body composition in aging. J Nutr 1993; 123: 444-8. [ Links ]
36. Bouchard C. Current understanding of the etiology of obesity: Genetic and nongenetic factors. Am J Clin Nutr 1991; 53: 1561S-5S. [ Links ]
37. Ferland M, Despres JP, Tremblay A, Pinault S, Nadeau A, Moorjani S, Lupien PJ, Thériault G, Bouchard C. Assesment of adipose tissue distribution by computed axial tomography in obese womwn: Association with body density and anthropometric measurements. Brit J Nutr 1989; 61: 139-48. [ Links ]
38. Bouza A, Bellido D, Rodríguez B, Pita S, Carreira J. Estimación de La grasa abdominal visceral y subcutánea en pacientes obesos a través de acuaciones de regresión antropométricas. Rev Esp Obes 2008; 6 (3): 143-62. [ Links ]
39. Kissebah AH, Krakower GR. Regional adiposity and morbidity. Physiol Rev 1994; 74: 761-811. [ Links ]
40. Wajchenberg BL. Subcutaneous and visceral adipose tissue: their relation to the metabolic sysndrome. Endocr Rev 2000; 21: 697-738. [ Links ]
41. Liu KH, Chan YL, Chan JC, Chan WB. Association of carotid intima-media thickness with mesenteric, preperitoneal and subcutaneous fat thickness. Atherosclerosis 2005; 179 (2): 299-304. [ Links ]
42. Kissebah AH, Vydelingum N, Murray R, Evans DJ, Hartz AJ, Kalkhoff RK, Adams PW. Relation of body fat distribution to metabolic complications of obesity. J Clin Endocrinol Metab 1982; 54: 254-60. [ Links ]
43. Krotkiewski M, Bjorntorp P, Sjostrom L, Smith U. Impact of obesity on metabolism in men and women. Importance of regional adipose tissue distribution. J Clin Invest 1983; 72: 1150-62. [ Links ]
44. Després JP, Moorjani S, Ferlnad M, Tremblay A, Lupien PJ, Nadeau A, Pinault S, Thériault G, Bouchard C. Adipose tissue distribution and plasma lipoprotein levels in obese women: importance of intra-abdominal fat. Arteriosclerosis 1989; 9: 203-10. [ Links ]
45. Kaplan NM. The deadly quartet: Upper-body obesity, glucose intolerance, hypertriglyceridemia and hypertension. Arch Intern Med 1989; 149: 1514-20. [ Links ]
46. Kannel WB, Cupples LA, Ramaswami R, Stokes J III, Kreger BE, Higgins M. Regional obesity and risk of cardiovascular disease: the Framingham Study. J Clin Epidemiol 1991; 44: 183-90. [ Links ]
47. Pouliot MC, Després JP, Nadeau M, Moorjani S, Prud'Homme D, Lupien PJ, Tremblay A, Bouchard C: Visceral obesity in men: association with glucose tolerance, plasma insulin, and lipoprotein levels. Diabetes 1992; 41: 826-34. [ Links ]
48. Nakamura T, Tokunaga K, Shimomura I, Nishida M, Yoshida S, Kotani K, Islam AH, Keno Y, Kobatake T, Nagai Y y cols.contribution of visceral fat accumulation to the development of coronary artery disease in non obese men. Atherosclerosis 1994; 107: 239-46. [ Links ]
49. Tchernof A, Lamarche B, Prund'Homme D, Nadeau A, Moorjani S, Labrine F, Lupien PJ, Després JP. The dense LDL phenotype: association with plasma lipoprotein levels, visceral obesity, and hyperinsulinemia in men. Diabetes Care 1996; 19: 629-37. [ Links ]
50. Williams MJ, Hunter GR, Kekes-Szabo T, Snyder S, Treuth MS: Regional fat distribution in women and risk of cardiovascular disease. Am J Clin Nutr 1997; 65 (3): 855-60. [ Links ]
51. Rexrode KM, Carey VJ, Hennekens CH, Walters EE, Colditz GA, Stampfer MJ, Willett WC, Manson JE. Abdominal adiposity and coronary heart disease in women. JAMA 1998; 280: 1843-8. [ Links ]
52. Garaulet M, Pérez-Llamas F, Fuente T, Zamora S, Tebar J. Anthropometric, computed tomography and fat cell data in an obese population: relationship with insulin, leptin, tumor necrosis factor-alpha, sex hormone-binding globulin and sex hormones. Eur J Endocrinol 2000; 143: 657-66. [ Links ]
53. Garaulet M, Marín C, Pérez-Llamas F, Canteras M, Tebar FJ, Zamora S: Adiposity and dietary intake in cardiovascular risk in an obese population from a Mediterranean area. J Physiol Biochem 2004; 60 (1): 39-49. [ Links ]
54. Hernández-Morante JJ, Pérez-de-Heredia F, Luján JA, Zamora S, Garaulet M. Role of DHEA-S on body fat distribution: Gender-and depot-specific stimulation of adipose tissue lipolysis. Steroids 2008; 73: 209-15. [ Links ]
55. Lovejoy JC, Smith SR, Rood JC. Comparison of regional fat distribution and health risk factors in middle-aged white and African American women: the Healthy Transitions Study. Obes Res 2001; 9: 10-6. [ Links ]
56. Deschênes D, Couture P, Dupont P, Tchernof A. Subdivision of the subcutaneous tissue compartment and lipid-lipoprotein levels in women. Obes Res 2003; 11: 469-76. [ Links ]
57. Misra A,Garg A, Abate N, Peshock RM, Stray-Gundersen J, Grundy SM. Relationship of anterior and posterior subcutaneous abdominal fat to insulin sensivity in nondiabetic men. Obes Res 1997; 5: 93-9. [ Links ]
58. Smith SR, Lovejoy JC, Greenway F, Ryan D, deJonge L, de la Bretonne J, Volafova J, Bray GA. Contribution of total body fat, abdominal subcutaneous adipose tissue compartments, and visceral adipose tissue to the metabolic complications of obesity. Metabolism 2001; 50: 425-35. [ Links ]
59. Toth MJ, Sites CK, Cefalu WT, Matthews DE, Poehlman ET. Determinants of insulin-stimulated glucosa disposal in middleaged, premenopausal women. Am J Physiol 2001; 281: E113-21. [ Links ]
60. Björntorp P. "Portal" adipose tissue as a generator of risk factors for cardiovascular disease and diabetes. Arteriosclerosis 1990; 10: 493-6. [ Links ]
61. Björntorp P. Metabolic implications of body fat distribution. Diabetes Care 1991; 14: 1132-43. [ Links ]
62. Enevoldsen LH, Simonse L, Stallknecht B, Galbo H, Bülow J. In vivo human lipolytic activity in preperitoneal and subdivisions of subcutaneous abdominal adipose tissue. Am J Physiol Endocrinol Metab 2001; 281 (5): E1110-4. [ Links ]
63. Garaulet M, Hernández-Morante JJ, Tébar FJ, Zamora S, Canteras M. Two-dimensional predictive equation to classify visceral obesity in clinical practice. Obesity 2006; 14 (7): 1181-91. [ Links ]
64. Fujiota S, Matsuzawa Y, Tokunaga K, Tarui S. Contribution of intra-abdominal fat accumulation to the impairment of glucose and lipid metabolism in human obesity. Metabolism 1987; 36 (1): 54-9. [ Links ]
65. Després JP, Lemieux I, Bergeron J, Pibarot P, Mathieu P, Larose E, Rodés-Cabau J, Bertrand OF, Poirier P. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk. Arterioscler Thromb Vasc Biol 2008; 28 (6): 1039-49. Erratum in: Arterioscler Thromb Vasc Biol 2008; 28 (7): e151. [ Links ]
66. Gallagher D, Kuznia P, Heshka S, Albu J, Heymsfield SB, Goodpaster B, Visser M, Harris TB. Adipose tissue in muscle: a novel depot similar in size to visceral adipose tissue. Am J Clin Nutr 2005; 81 (4): 903-10. [ Links ]
67. Schrauwen-Hinderling VB, Hesselink M, Schrauwen P, Kooi ME. Intramyocellular lipid content in human skeletal muscle. Obesity 2006; 14: 357-67. [ Links ]
68. Boesch C, Slotboom J, Hoppeler H, Kreis R. In vivo determination of intra-myocellular lipids in human muscle by means of localized 1H-MR-spectroscopy. Magn Reson Med 1997; 37: 484-93. [ Links ]
69. Vermathen P, Kreis R, Boesch C. distribution of intramyocellular lipds in human calf muscles as determined by MR spectroscopic imaging. Magn Reson Med 2004; 51: 253-62. [ Links ]
70. Hwang JH, Pan JW, Heydari S, Hetherington HP, Stein DT. Regional differences in intramyocellular lipids in humans observed by in vivo 1H-MR spectroscopic imaging. J Appl Physiol 2001; 90: 1267-74. [ Links ]
71. Goodpaster BH, Carlson CL, Visser M, Kelley DE, Scherzinger A, Harris TB, Stamm E, Newman AB. Attenuation of skeletal muscle and strength in the elderly: the Health ABC Study. J Appl Physiol 2001; 90: 2157-65. [ Links ]
72. Visser M, Kritchevsky SB, Goodpaster BH, Newman AB, Nevit M, Stamm E, Harris TB. Leg muscle mass and composition in relation to lower extremity performance in men and women aged 70 to 79: the health, aging and body composition study. J Am Geriatric Soc 2002; 50 (5): 897-904. [ Links ]
73. Forbes GB. Exercise and body composition. J Appl Physiol 1991; 70 (3): 994-7. [ Links ]
74. Baumgartner RN. Body composition in healthy aging. Ann N Y Acad Sc 2000; 904: 437-48. [ Links ]
75. Roubenoff R. Sarcopenic obesity: does muscle loss cause fat gain? Lessons from rheumatoid arthritis and osteoarthritis. Ann N Y Acad Sc 2000; 904: 374-6. [ Links ]
76. Morley JE, Baumgartner RN, Roubenoff R, Nair KS. Sarcopenia. J Lab Clinic Med 2001; 137: 231-43. [ Links ]
77. Jacob S, Machann J, Rett K, Brechtel K, Volk A, Renn W, Maerker E, Matthaei S, Schick F, Claussen CD, Häring HU. Association of increased intramyocellular lipid content with insulin resistance in lean nondiabetic offspring of type 2 diabetic subjects. Diabetes 1999; 48: 1113-9. [ Links ]
78. Nistala R, Stump CS. Skeletal muscle insulin resistance is fundamental to the cardiometabolic syndrome. J Cardiometab Syndr 2006; 1 (1): 47-52. [ Links ]
79. Wang Y, Rimm EB, Stampfr MJ, Willett WC, Hu FB. Comparison of abdominal adiposity and overall obesity in predicting risk of type 2 diabetes among men. Am J Med Nutr 2005; 81: 555-63. [ Links ]
80. Frayn KN. Visceral fat and insulin resistance - causative or correlative? Br J Nutr 2000; 83: S71-7. [ Links ]
81. Seidell JC, Bouchard C. Visceral fat in relation to health: is it a major culprit or simply an annocent bystander? Int J Obes 1997; 21: 626-31. [ Links ]
82. Gronemeyer SA, Steen RG, Kauffman WM, Reddick WE, Glass JO: Fast adipose tissue (FAT) assessment by MRI. Magnetic Resonance Imaging 2000; 18: 815-8. [ Links ]
83. Garaulet Aza M. Distribución de la grasa corporal en la obesidad. Alimentación y Salud. Alulas del Mar. Capítulo 15, Editores: Francisca Pérez Llamas, Marta Garaulet Aza, Fermín Sánchez de Medina Contreras, Salvador Zamora Navarro. Servicio de Publicaciones de la Universidad de Murcia. Universidad Internacional del Mar. Universidad de Murcia, 2001. [ Links ]
84. Abate N, Garg A, Coleman R, Grundy S.M, Peshock RM: Prediction of total subcutaneous abdominal, intraperitoneal, and retroperitoneal adipose tissue masses in men by a single axial magnetic resonance imaging slice. Am J Clin Nutr 1997; 65: 403-8. [ Links ]
85. Seidell JC, Oosterlee A, Thijssen M.A, Burema J, Deurenberg P, Hautvast JG, Ruijs JH. Assessment of intra-abdominal and subcutaneous abdominal fat: relation between anthropometry and computed tomography. Am J Clin Nutr 1987; 45 (1): 7-13. [ Links ]
86. Sobol W, Rossner S, Hinson B, Hiltbrandt E, Karstaedt N, Santago P, Wolfman N, Hagaman A, Crouse JR 3rd. Evaluation of a new magnetic resonance imaging method for quantitating adipose tissue areas. Int J Obe 1991; 15: 589-99. [ Links ]
87. Fowler PA, Fuller MF, Glasbey CA y cols. Total and subcutaneous adipose tissue in women: the measurement of distribution and accurate predicition of quantity by using magnetic resonance imaging. Am J Clin Nutr 1991; 54: 18-25. [ Links ]
88. Gray DS, Fuhioka K, Colletti PM, Kim H, Devine W, Cuyegkeng T, Pappas T. Magnetic resonance imaging used for determining fat distribution in obesity and diabetes. Am J Clin Nutr 1991; 54: 623-7. [ Links ]
89. Greenfield JR, Samaras K, Chisholm DJ, Campbell LV. Regional intra-subject variability in abdominal adiposity limits usefulness of computed tomography. Obes Res 2002; 10: 260-5. [ Links ]
90. Deans HE, Smith FW, Lloyd DJ, Law AN, Sutherland HW. Fetal fat measurement by magnetic resonance imaging. British J Radiol 1989; 62: 603-7. [ Links ]
91. Abate N, Burns D, Peshock RM, Garg A, Grundy SM. Estimation of adipose tissue mass by magnetic resonance imaging: validation against dissection in human cadavers. J Lipid Res 1994; 35: 1490-6. [ Links ]
92. Rössner S, Bo Wj, Hiltbrandt E,Hinson W, Karstaedt N, Santago P, Sobol WT, Crouse JR. Adipose tissue determinations in cadavers - a comparison between cross-sectional planimetry and computed tomography. Int J Obes 1990; 14: 893-902. [ Links ]
93. Seidell JC, Bakker CJ, van der Kooy K. Imaging techniques for measuring adipose-tissue distribution: a comparison between computed tomography and 1.5-T magnetic resonance. Am J Clin Nutr 1990; 51 (6): 953-7. [ Links ]
94. Abate N, Garg A. Heterogeneity in adipose tissue metabolism: causes, implications and management of regional adiposity. Progress Lipid Res 1995; 34: 53-70. [ Links ]
95. Olhager E, Thuomas KA, Wigstróm L, Forsum E. Description and evaluation of a method based on magnetic resonance imaging to estimate adipose tissue volume and total body fat infants. Pediatr Res 1998; 44 (4): 572-4. [ Links ]
96. Ashwell M, Cole TJ, Dixon AK. Obesity: new insight into the anthropometric classification of fat distribution shown by computed tomography. Br Med 1985; 290: 1692-4. [ Links ]
97. Rice B, Janssen I, Hudson R, Ross R. Effects of aerobic or resistance exercise and/or diet on glucose tolerance and plasma insulin levels in obese men. Diabetes Care 1999; 22 (5): 684-91. [ Links ]
98. Ross R. Magnetic resonance imaging provides new onsights into the characterization of adipose and lean tissue distribution. Canadian J Physiol Pharmacol 1996; 74: 778-85. [ Links ]
99. Janssen I, Heymsfield SB, Wang ZM, Ross R. Skeletal muscle mass and distribution in 468 men and women aged 18-88 yr. J Appl Physiol 2000; 89: 81-8. [ Links ]
100. Janssen I, Heymsfield SB, Allison DB, Kotler DP, Ross R. Body mass index and waist circumference independently contribute to the prediction of nonabdominal, abdominal subcutaneous, and visceral fat. Am J Clin Nutr 2002; 75: 683-8. [ Links ]
101. Lee RC, Wang Z, Heo M, Ross R, Janssen I, Heymsfield SB. Total-body skeletal muscle mass: development and cross-validation of anthropometric prediction models. Am J Clin Nutr 2000; 72: 796-803. [ Links ]
102. Goodpaster BH, Krishnaswami S, Resnick H, Kelley DE, Haggerty C, Harris TB, Schwartz AV, Kritchevsky S, Newman AB.Association between regional adipose tissue distribution and both type 2 diabetes and impaired glucose tolerance in elderly men and women. Diabetes Care 2003; 26: 372-9. [ Links ]
103. Pouliot MC, Després JP, Lemieux S, Moorjani S, Bouchard C, Tremblay A, Nadeau A, Lupien PJ. Waist circumference and abdominal sagittal diameter: best simple anthropometric indexes of abdominal visceral adipose tissue accumulation and related cardiovascular risk in men and women. Am J Cardiol 1994; 73: 460-8. [ Links ]
104. Wang J, Thornton JC, Bari S, Williamson B, Gallagher D, Heymsfield SB, Holick M, Kotler D, Laferrère B, Mayer L, Pi-Sunyer FX, Pierson RN JR. Comparisons of waist circumferences measured at 4 sites. Am J Clin Nutr 2003; 77: 337-84. [ Links ]
105. Wang J, Thornton JC, Russell M, Burastero S, Heymsfield S, Pierson RN Jr. Asians have lower body mass index (BMI) but higher percent of body fat than do whites: comparisons of anthropometric measurements. Am J Clin Nutr 1994; 60: 23-8. [ Links ]
106. He Q, Engelson ES, Wang J, Kenya S, Ionescu G, Heymsfield SB, Kotler DP. Validation of an Elliptical Anthropometric Model to estimate visceral compartment area. Obes Res 2004; 12 (2): 250-7. [ Links ]
107. Garaulet M, Hernández-Morante JJ, Tébar FJ, Zamora S. Anthropometric indexes for visceral fat estimation in overweight/obese women attending to age and menopausal status. J Physiol Biochem 2006; 62 (4): 245-52. [ Links ]
108. Soto González A, Bellido D, Buño MM, Pértega S, De Luis D, Martínez-Olmos M, Vidal O. Predictors of the metabolic syndrome and correlation with computed axial tomography. Nutrition 2007; 23: 36-45. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
M.ª J. Pérez Miguelsanz.
Departamento de Anatomía y Embriología Humana I.
Facultad de Medicina. Universidad Complutense de Madrid.
Plaza Ramón y Cajal, s/n.
28040 Madrid.
E-mail: jperez@med.ucm.es
Recibido: 1-VII-2009.
Aceptado: 9-VIII-2009.