Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.25 no.3 Madrid may./jun. 2010
Deficiencia y sobrecarga de hierro; implicaciones en el estado oxidativo y la salud cardiovascular
Iron deficiency and overload. Implications in oxidative stress and cardiovascular health
L. Toxqui1, A. De Piero2, V. Courtois2, S. Bastida2, F. J. Sánchez-Muniz2 and M.a P. Vaquero1
1Departamento de Metabolismo y Nutrición. Instituto de Ciencia y Tecnología de Alimentos y Nutrición (ICTAN). Instituto del Frío. Consejo Superior de Investigaciones Científicas (CSIC). Madrid. España.
2Departamento de Nutrición. Facultad de Farmacia. Universidad Complutense. Madrid. España.
Esta revisión se ha realizado como parte del curso de Doctorado "Nutrición y Enfermedades Cardiovasculares", de la Universidad Complutense de Madrid, y ha sido financiado por el Ministerio de Ciencia e Innovación (proyectos AGL2006-09519/ALI y AGL2009-11437) y por una beca predoctoral del Consejo Nacional de Ciencia y Tecnología (CONACyT) de México.
Dirección para correspondencia
RESUMEN
El hierro es un metal esencial para la vida, pero en cantidades elevadas resulta tóxico. La regulación del metabolismo del hierro es actualmente un tema de intensa investigación al haberse descrito el papel clave de la hepcidina, hormona cuyo gen HAMP está muy conservado. Las alteraciones del metabolismo del hierro dan lugar a sobrecarga, destacando la hemocromatosis hereditaria clasificada como enfermedad rara, o en el otro extremo deficiencia de hierro y anemia ferropénica que constituyen un problema de Salud Pública de proporciones mundiales. Las variantes genéticas implicadas en sobrecarga y deficiencia de hierro se han centrado en los genes HFE, TFR2, HAMP, HJV, Tf y TMPRSS6.
El hierro tiene la capacidad de ceder o donar electrones con facilidad y puede catalizar reacciones vía radicales libres e incrementar el estrés oxidativo. Así, la peroxidación lipídica y riesgo cardiovascular son consecuencias de la sobrecarga de hierro. Recientemente, se ha descrito también una relación entre el metabolismo del hierro y la resistencia a la insulina y la obesidad. Por el contrario, aún existe gran controversia en cuanto a la relación anemia ferropénica-enfermedad cardiovascular.
Esta revisión presenta de forma breve los conocimientos actuales sobre la regulación del metabolismo del hierro, su biodisponibilidad y los trastornos por sobrecarga y deficiencia de hierro, para posteriormente examinar las relaciones existentes entre el hierro y el riesgo cardiovascular, tanto en la deficiencia como en la sobrecarga. Finalmente presenta propuestas para desde la nutrición utilizar estrategias para paliar la sobrecarga o prevenir la anemia por falta de hierro.
Palabras clave: Metabolismo del hierro. Anemia ferropénica. Sobrecarga de hierro. Enfermedad cardiovascular. Nutrigenómica.
ABSTRACT
Although iron is an essential mineral for maintaining good health, excessive amounts are toxic. Nowadays, much interest is focused on the mechanisms and regulation of iron metabolism by down-regulation of the hormone hepcidin. The HAMP gene encodes for hepcidin appears to be exceptionally preserved. Disorders of iron metabolism could lead to iron overload, mainly causing the rare disease hereditary hemochromatosis, or on the other hand, iron deficiency and iron deficiency anaemia. Currently, these alterations constitute an important problem of public health. The genetic variation implicated in iron overload and iron deficiency anaemia, involves mutations in several genes such as HFE, TFR2,HAMP, HJV, Tf and TMPRSS6.
Iron has the capacity to accept and donate electrons easily and can catalyze reactions of free radicals production. Therefore, iron overload causes lipid peroxidation and increases cardiovascular risk. Recently, a relationship between iron metabolism and insulin resistance and obesity has been described. In contrast, regarding a possible relationship between iron deficiency anaemia and cardiovascular disease, many aspects remain controversial.
This review presents an overview of the most recent information concerning iron metabolism, iron bioavailability and iron overload/deficiency related diseases. The relation between iron and cardiovascular risk, in iron overload and in iron deficiency situations, is also examined. Finally, strategies to modify dietary iron bioavailability in order to prevent iron deficiency or alleviate iron overload are suggested.
Key words: Iron metabolism. Iron deficiency anemia. Iron overload. Cardiovascular disease. Nutrigenomics.
Función, necesidades, almacenamiento e ingestas recomendadas de hierro
El hierro es un mineral vital para el ser humano1,2. Participa en múltiples procesos metabólicos, ya que se encuentra como componente de enzimas y otros complejos moleculares2,3. Dentro de sus funciones principales se pueden mencionar: transporte de oxígeno a través de la hemoglobina; síntesis de ADN, al formar parte de la enzima ribonucleotido reductasa; y transporte de electrones, por tener la capacidad de aceptar los y donarlos3,4.
El papel del hierro en la función del sistema nervioso es muy importante. El hierro parece intervenir en la síntesis, degradación y almacenamiento de neurotransmisores, serotonina, dopamina y ácido gammaaminobutírico (GABA). La distribución del GABA y la dopamina coincide aproximadamente con la de este metal, y se ha sugerido que debe existir alguna participación del hierro en las funciones dopaminérgicas y gabaminérgicas5.
El recambio cerebral del hierro es muy lento; por lo tanto, las deficiencias producidas en etapas tempranas de la vida son muy difíciles de corregir y tienden a persistir5. Además, el hierro es imprescindible para la mielinización. El oligodendrito, responsable de la producción de mielina, es el tipo de célula que predominantemente contiene hierro en el cerebro5,6. También se ha relacionado la influencia de este mineral en el hipocampo y áreas de memoria. De hecho muchas enfermedades degenerativas cerebrales como Parkinson o demencia, parecen tener su origen en alteraciones del metabolismo del hierro7-9.
Otros aspectos menos estudiados relacionan la falta de hierro con alteraciones hepáticas como las colelitiasis10. Muy posiblemente en estas alteraciones está implicada la 7-alfa-hidroxilasa de colesterol, enzima dependiente de hierro y ligada al sistema de los citocromos11, que interviene en la transformación de colesterol a ácido cólico12.
Así mismo, se ha correlacionado la falta de hierro con la Pica, trastorno de la conducta alimentaria del que aún se conoce muy poco. Ésta se define como el consumo constante e inadecuado de sustancias no nutritivas durante un período de por lo menos un mes. Aunque la causa de la Pica aún sea desconocida, algunos estudios epidemiológicos y clínicos la relacionan con la falta de hierro y zinc. Se dice que su origen radica en que la carencia de dichos minerales, tiene como respuesta una conducta secundaria del organismo a dichas necesidades. Se ha descrito Pica y déficit de hierro en mujeres embarazadas, niños y personas con pérdidas sanguíneas digestivas, entre otros. Se ha visto que la administración de hierro resuelve la Pica en muchos casos, incluso antes de verse corregida la anemia. El poco conocimiento de dicho trastorno hace que actualmente sea objeto de estudio por parte de antropólogos, geógrafos, pediatras, ginecólogos, hematólogos, psiquiatras, psicólogos y nutricionistas13.
Todos estos datos, demuestran la importancia del hierro en numerosas funciones orgánicas, siendo imprescindible para la función cognitiva y el rendimiento físico, lo que explica el reciente interés en las posibles repercusiones de la deficiencia de hierro en el rendimiento académico de adolescentes y en la productividad laboral de las mujeres.
Un adulto promedio sano contiene un total de 3-4 mg de hierro corporal (40-50 mg por kg de peso corporal), del cual aproximadamente un 50% se encuentra en forma de hemoglobina, 25% como reserva hepática (ferritina), y el resto está constituido por las mioglobinas y proteínas que contienen hierro en su estructura1,2.
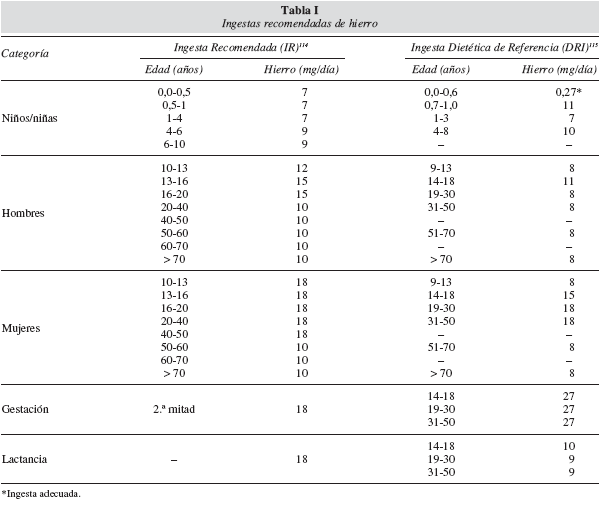
El hierro absorbido se almacena en forma de ferritina o se utiliza para formar hemoproteinas (hemoglobina, mioglobina, citocromos, etc). El exceso de hierro se deposita intracelularmente como ferritina y hemosiderina en el sistema retículo endotelial del hígado, bazo y medula ósea. Cada día, se movilizan de 20 a 30 mg de hierro que proviene de la destrucción de los eritrocitos por el sistema retículo endotelial. El hierro se reutiliza, predominando cuantitativamente su incorporación a los precursores de eritrocitos de la medula ósea. Una pequeña cantidad se pierde por la orina y el sudor. Un promedio de 0,5 a 2 mg diarios se eliminan a través de pérdidas sanguíneas, secreciones intestinales y de la continua exfoliación de células epiteliales3,14, por lo que la ingesta dietética debe ser la adecuada para mantener la homeostasis del micronutriente14. La tabla I muestra las ingestas recomendadas de hierro.
En humanos, no existe un mecanismo eficiente para la eliminación de este micronutriente, una vez absorbido se reutiliza de forma bastante eficaz, de forma que la absorción está regulada por las demandas metabólicas. Así, cuando las reservas de hierro están disminuidas o cuando hay un incremento en la demanda de eritropoyesis, hay una mayor absorción1,14,15.
Factores dietéticos determinantes de la absorción intestinal
Forma del hierro ingerido
El hierro de los alimentos se encuentra básicamente en dos formas: hemo y no hemo1,14. El hierro hemo está presente en los productos de origen animal y está compuesto por una molécula de protoporfirina IX y un ion de Fe2+16. El hierro no-hemo (Fe2+ yFe3+) se encuentra en alimentos de origen animal y vegetal (cereales, verduras, legumbres, frutas). Éste constituye el 90-95% de la ingesta total del micronutriente14.
La mayor reserva de hierro en plantas y animales es la ferritina. Muchos textos nutricionales consideran únicamente el hierro hémico y no hémico (o inorgánico), ignorando la posibilidad de la ferritina como posible fuente dietética del metal14. Aunque su biodisponibilidad aun está en controversia, varios estudios muestran que la ferritina tanto de animales y plantas se absorbe de manera similar al sulfato ferroso. Por otro lado, recientemente se ha destacado el potencial de la lactoferrina añadida a los alimentos como antiinflamatorio y a la vez su capacidad para mejorar el estado de hierro17.
El hierro no-hemo presenta una absorción muy baja, que está influenciada por otros componentes de la dieta18. Por su parte, el hierro hemo presenta una absorción del 20-35%, al no verse influida prácticamente por otras sustancias. La absorción de ambas formas de hierro tiene lugar fundamentalmente en el duodeno14. No obstante, únicamente en torno a un 10% de hierro que se ingiere es absorbido en este tramo del intestino, lo que implica que el 90% llega al colon y es excretado en heces. Sin embargo, hay evidencia que sugiere que el colon proximal tiene capacidad transportadora de hierro a través de mecanismos que pueden ser similares a los del duodeno19-21. Se ha demostrado que la expresión de los transportadores de hierro en el colon puede estimularse, pero la capacidad de transporte en este segmento del intestino es muy limitada, incluso en situación de anemia19-20. Así, un estudio en el que se emplearon isótopos estables para conocer si la suplementación con prebióticos incrementaba la absorción de hierro en cerdos, mostró que el hierro absorbido en el colon no contribuye significativamente a la absorción total del mineral. No obstante, la evaluación del papel fisiológico de la absorción de hierro en el intestino grueso requiere una investigación más profunda20,21.
Biodisponibilidad
La biodisponibilidad de un nutriente o componente de un alimento se entiende como la proporción del mismo que es digerida, absorbida y finalmente se utiliza para funciones metabólicas normales. Es importante tener en cuenta que dicho nutriente debe ser también disponible para ser transportado a los lugares de acción o a sus reservorios corporales según el metabolismo normal del mismo. Los factores individuales y exógenos que intervienen en la biodisponibilidad mineral se han revisado anteriormente22-24.
Dado que el proceso digestivo constituye el principal regulador fisiológico del hierro corporal y que una vez absorbido los mecanismos para excretarlo son ineficaces, los componentes de los alimentos que afectan su solubilidad y transporte intestinal, modificarán su biodisponibilidad. El conocimiento de dichos factores, estimuladores o inhibidores, puede ser muy útil para los pacientes que sufren trastornos del metabolismo del hierro, bien por deficiencia o por sobrecarga, como se comentará al final de ésta revisión.
A continuación se presentan de forma breve los principales estimuladores e inhibidores de la absorción de hierro, y por tanto de su biodisponibilidad.
Estimuladores
El medio ácido en el intestino favorece la absorción de los minerales en general, debido a que a pH bajo se mantienen en solución. Así, el hierro en la forma Fe2+, al ser más soluble, es más disponible que en la forma oxidada Fe3+.
Los alimentos de origen animal (carne, pescado, pollo) contienen el denominado "factor carne" que incrementa la absorción de hierro. Dicho factor parece estar constituido por una serie de péptidos que se liberan durante la digestión de estos alimentos proteicos. Dichos péptidos se combinarían con el hierro formando complejos solubles y lo protegerían de otros componentes inhibitorios de la dieta permitiendo su absorción más eficazmente25. Más recientemente se ha descrito que puede tratarse de fracciones de hidratos de carbono (glucosaminoglucanos)26 o fosfolípidos27, presentes de forma natural en estos alimentos.
Se ha documentado muy bien el papel estimulante de la absorción de hierro que ejerce la vitamina C o ácido ascórbico18,22. Este nutriente actúa de varias maneras: reduce el hierro a la forma Fe2+, más soluble; y forma en el medio ácido del estómago un complejo ascorbato férrico muy estable, que permanece soluble al pH más alto del duodeno. Constituye por tanto el mejor potenciador de la biodisponibilidad del hierro no-hemo que se conoce. Para que esta activación de la absorción sea efectiva, deben ingerirse en la misma comida los alimentos ricos en hierro y los que aportan vitamina C (por ejemplo, carne y naranja), requisito de simultaneidad que a menudo se ignora. Así, es habitual que aunque las personas con deficiencia de hierro conozcan que los cítricos aumentan la absorción de hierro, suelen tomarlos en ayunas o separarlos de las comidas principales que generalmente son las que aportan una proporción mayor del hierro de la dieta.
Respecto a la grasa, los ácidos grasos saturados y el aceite de oliva, también favorecen la absorción de hierro, mientras que la grasa más insaturada, particularmente el ácido linoleico y los omega-3 (eicosapentaenoico y docosahexaenoico), en exceso, pueden reducir la biodisponibilidad de éste23.
Inhibidores
Tradicionalmente se ha considerado que la fibra dietética es un inhibidor de la absorción de minerales. Sin embargo, junto con la fibra dietética se consumen una serie de componentes, como polifenoles y fitatos, cuya acción sobre la absorción del hierro es mucho más importante que la de la fibra en sí misma. Por otro lado, muchos alimentos que aportan una cantidad apreciable de minerales son a su vez ricos en fibra y otros compuestos, con lo que la biodisponibilidad del hierro de estos alimentos puede estar disminuida, pero en valor absoluto la cantidad absorbida puede ser suficiente. El ácido fítico (inositol hexafosfato) es un potente inhibidor de la absorción del hierro no-hemo. No obstante, por determinados tratamientos culinarios o industriales (fermentación, germinación), este ácido pierde grupos fosfatos reduciéndose en consecuencia su capacidad de secuestrar hierro. Respecto a los polifenoles (ácidos fenólicos, flavonoides, polifenoles condensados), aun siendo solubles, como en el caso de los del té, pueden tener la capacidad de secuestrar fuertemente el hierro impidiendo su absorción22.
Es importante resaltar que el consumo de bebidas antioxidantes ricas en polifenoles, goza de gran popularidad, y las personas con predisposición a anemia ferropénica, desconocen la importancia de separar su consumo de las comidas principales.
Así mismo, se han descrito las capacidades de diferentes fuentes de fibra dietética para quelar varios metales, entre ellos, el hierro28. Sin embargo en un estudio realizado por Vaquero y cols.29, se observó que la influencia del consumo de una fibra insoluble hipocolesterolemiante rica en taninos condensados procedente de algarroba, como única fibra dietética o en combinación con celulosa o con pectina, no modificaba la biodisponibilidad de hierro.
Sin embargo, la fibra presente en algunas algas parece inhibir la absorción de hierro. Bocanegra et al30 estudiaron la biodisponibilidad de hierro en dietas que contenían algas con poder hipocolesterolemiante31,32. Se observó que la absorción aparente de hierro disminuía por la presencia del alga Nori, pero no por la del alga Konbu, en la dieta32.
Otros minerales (Ca, Zn, Cu, Cd, etc.) interaccionan con el hierro en el tracto gastrointestinal. Así, ingestas excesivas de calcio y zinc pueden reducir la biodisponibilidad del hierro, interaccionando en la propia mucosa. Además, el calcio, es el único componente de los alimentos que en condiciones particulares puede inhibir el hierro tipo hemo ingerido22. No obstante, la repercusión del consumo de suplementos de calcio o alimentos enquiquecidos con él en personas susceptibles de padecer anemia no está suficientemente documentada.
Mecanismos de absorción del hierro hemo y no-hemo
En las células del epitelio intestinal o enterocitos duodenales, tiene lugar la mayor parte de la absorción del hierro5,33 (fig. 1).
Para la absorción del hierro no-hemo, es preciso que éste se encuentre en una forma soluble, siendo el Fe2+ más soluble que el Fe3+, como hemos comentado. El hierro ferroso se absorbe utilizando el transportador de metales divalente (Dimetal Transporter 1, DMT1), que se encuentra en el borde de cepillo de la membrana apical del enterocito y es el encargado de transportarlo a su interior14,15,34. El hierro férrico, puede transformarse a ferroso, por acción de una serie de componentes reductores de los alimentos (ácido ascórbico, aminoácidos, etc) o bien a través la acción de una proteína que se expresa en la membrana apical, llamada citocromo B duodenal (DcytB), cuya función es reducir el metal14,15,34,35.
Algunos autores proponen que el hierro férrico se absorbe en el enterocito por un mecanismo distinto a la reducción previa y transporte vía DMT1. En este modelo, el hierro férrico, sería liberado del alimento en el ambiente ácido del estómago y quelado por mucinas en la superficie del borde de cepillo, manteniendo el hierro en su forma férrica. El Fe3+ atravesaría la membrana apical del enterocito al interactuar con la β3-integrina y la mobilferrina. Una vez en el citosol, este complejo se combinaría con una reductasa, la flavina monooxigenasa, y la β2-microglobulina para formar un gran conglomerado conocido como paraferritina, resultando la reducción del hierro absorbido de la forma férrica a la forma ferrosa. Hay evidencia que sugiere que el complejo de paraferritina contiene DMT1, que permite la entrada del hierro Fe2+ a los orgánulos intracelulares. El hierro en forma ferrosa podría almacenarse en forma de ferritina1,14 (fig. 1).
Por su parte, el hierro hemo se absorbe por un sistema diferente (fig. 1). Se ha identificado una proteína de la membrana apical de la célula del epitelio intestinal, denominada proteína transportadora de hemo (Heme Carrier Protein 1, HCP1) como posible transportador del hierro hemo14,15. Una vez dentro del enterocito, la hemo-oxigenasa 1 (HO-1) y sus homólogos HO-2 y HO-3 son las encargadas de romper la molécula de hierro para liberar Fe2+14-16. La reacción también genera monóxido de carbono (CO), que está involucrado en vías de señalización, y biliverdina, que se convertirá enzimáticamente en el antioxidante bilirrubina16.
Una vez dentro del enterocito, el hierro puede almacenarse en forma de gránulos de ferritina (como Fe3+) que se eliminan por descamación, o bien ser exportado a la circulación por la acción combinada de una reductasa denominada hepaestina (Hp) y una proteína transportadora de la membrana basolateral denominada ferroportina (FPN)15. El hierro ferroso debe ser oxidado a férrico, mediante la ceruloplasmina, y así se une a la transferrina (Tf), la cual distribuye el metal por todo el cuerpo para su utilización y almacenamiento14,15,34.
Hepcidina
La hepcidina es una proteína plasmática de 20-25 aminoácidos, considerada actualmente una hormona del hierro, proveniente de un precursor de mayor tamaño, que reduce la absorción intestinal de hierro al tiempo que impide su liberación excesiva de los macrófagos34,36-38.
El gen que codifica la hepcidina (HAMP), se expresa y secreta en el hepatocito15,34, aunque hay evidencia de que también se expresa en corazón, riñón, tejido adiposo, páncreas, células hematopoyéticas, monocitos y macrófagos. Sin embargo, la relevancia biológica de la hepcidina extrahepática aún es objeto de intensa investigación36.
Mutaciones en el gen HAMP en humanos generan enfermedad por sobrecarga severa de hierro36. Una completa deficiencia de hepcidina causa hemocromatosis juvenil, teniendo lugar una excesiva absorción de hierro dietético a pesar de las reservas excesivas del metal34. Por el contrario, una expresión incrementada induce una anemia por deficiencia en la absorción de hierro a pesar de una dieta normal o rica en hierro34,36.
El mecanismo de acción de la hepcidina en la absorción se ejerce mediante la unión al transportador ferroportina, causando su internalización y degradación lisosomal34,36,39, lo que impide el transporte basolateral del hierro34.
La síntesis de hepcidina es estimulada por las reservas y los niveles plasmáticos de hierro (fig.2), así como por la inflamación a través de citoquinas (TNFα, IL-6). Por el contrario, la expresión de la hepcidina es inhibida por la actividad eritropoyética, para asegurar que las concentraciones de hierro plasmático extracelular y las reservas se mantienen estables, a la vez que la demanda eritropoyetica de hierro está cubierta34,39.
Alteraciones en el metabolismo del hierro
Sobrecarga de hierro
Como se mencionó anteriormente, aunque el hierro es un nutriente esencial para el ser humano un exceso en el organismo implica una amenaza para células y tejidos16,40.
En condiciones fisiológicas, la cantidad total de hierro en el organismo es dependiente de la absorción de dicho elemento y en ella intervienen mecanismos genéticamente regulados. En numerosas enfermedades, genéticas o adquiridas, se puede producir acumulación del micronutriente.
Hemocromatosis
La hemocromatosis se puede definir como una enfermedad donde hay un incremento de almacenes de hierro, causando cambios patológicos. Hay dos tipos de hemocromatosis: idiopática primaria (o hereditaria) y secundaria41.
En base a las alteraciones clínicas y genéticas, según la Online Mendelian Inheritance in Man Database (OMIN), se han identificado 4 tipos de hemocromatosis hereditarias (HH)42, siendo la tipo I la más frecuente y la tipo II la más grave, tal como se observa en la tabla II.


Según Wolff y cols. (sic)43, a medida que transcurre el tiempo y aumenta la sobrecarga férrica, los pacientes con hemocromatosis pasan por las siguientes fases:
1. "Fase genética", con predisposición a la enfermedad, pero sin anormalidad bioquímica, ni histológica, ni manifestaciones clínicas.
2. "Fases de sobrecarga férrica asintomática", con acumulación de hierro (depósito férrico 2-5 g) y sin síntomas.
3. "Fases de sobrecarga férrica con síntomas precoces", con acumulación de hierro y síntomas como astenia, letargia, artralgia.
4. "Fases de sobrecarga férrica con lesión orgánica", en que destaca especialmente la cirrosis hepática.
En etapas avanzadas es posible observar la tríada clásica descrita desde sus primeras definiciones que contempla cirrosis hepática, hiperpigmentación cutánea y diabetes. También se pueden observar síntomas menos frecuentes e inespecíficos como dolor abdominal, debilidad, letargia y pérdida de peso. El cuadro clínico puede incluir, además, manifestaciones dependientes de diversos órganos y sistemas, según el grado de daño producido por el depósito de hierro43.
En general, en estos casos el contenido total de hierro en el organismo llega a ser superior a 5 g43. La frecuencia de portadores (heterocigotos para hemocromatosis hereditaria) es de 8-10%, con una proporción de homocigotos de 0,3-0,8%. Estas patologías se clasifican como enfermedades raras, al afectar a menos de 5 casos por cada 10.000 habitantes en la comunidad, según la definición de la Unión Europea.
La HH es 5 veces más frecuente y de aparición más temprana en los hombres que en las mujeres. Las primeras manifestaciones clínicas en hombres se producen entre los 30 y los 50 años, mientras que en mujeres después de los 50 años. Algunas personas pueden presentar síntomas a edades más tempranas en la hemocromatosis juvenil.
Causas de sobrecarga de hierro no asociadas a hemocromatosis
Existe sobrecarga de hierro por otras causas diferentes a hemocromatosis. Entre las principales causas se pueden mencionar43:
• Anemia sideroblástica y ciertas anemias hemolíticas.
• Talasemia mayor.
• Transfusiones sanguíneas frecuentes.
• Causas "médicas" (iatrogénicas) como administración de dextrano ferroso para el tratamiento de algunas anemias.
• Hepatopatías crónicas: alcohólica, asociada a virus C.
• Esteatohepatitis no alcohólica.
• Porfiria cutánea tarda.
• Aceruloplasminemia.
• Atransferremia congénita: rara anemia hipocrómica microcitica.
• Tirosinemia hereditaria.
• Síndrome cerebrohepatorrenal (síndrome de Zellweber).
• Hemodiálisis crónica.
• Sobrecarga dietética.
• Sobrecarga parenteral.
• Cortocircuito portocava.
• Siderosis en algunos subsaharianos y afroamericanos.
Sobrecarga de hierro y factores genéticos
Años atrás, se han identificado las llamadas "Nuevas proteínas del metabolismo del hierro", tales como: hepcidina, hemojuvelina, transportador de metales divalentes (DMT1), ferroportina, proteína transportadora de hemo (HCP); las cuales se han estudiado para relacionar la posibles mutaciones de los genes que las codifican con la sobrecarga de hierro44. Más recientemente, se están describiendo otras proteínas que desempeñan distintos papeles, receptores de membrana y factores de transcripción45.
La mejor representación de exceso de hierro es la HH clásica, que se diagnostica por la existencia de las mutaciones del gen HFE, C282Y y/o H63D46-48. La mutación C282Y es más frecuente en el norte de Europa, mientras que la H63D abunda más en los países mediterráneos como España y ocasiona trastornos más leves. Además de la HH, existen situaciones patológicas en las que se da una sobrecarga férrica secundaria (hemocromatosis secundaria) que constituye una complicación severa de la enfermedad con manifestaciones clínicas superponibles a la HH. Algunas de estas patologías son las talasemias severas o los síndromes mielodisplásicos.
Un déficit de hepcidina conduce a elevados niveles de hierro plasmático y a una sobrecarga de hierro. Los pacientes con HH no producen hepcidina o la producen en cantidad insuficiente38. Por otro lado, las mutaciones en el gen de la hemojuvelina (HJV), que codifica el receptor de membrana HJV, modulador de la expresión de la hepcidina, produce una elevación en los niveles de hierro. A este respecto, la variabilidad genética de hepcidina y hemojuvelina está siendo objeto de estudios, si bien restringidos a casos clínicos concretos o en poblaciones distintas a la española44,49-52.
Dado que ha podido demostrarse la importancia del receptor de transferrina en la homeostasis del hierro, otros factores genéticos en el metabolismo del hierro pueden ser las mutaciones en el gen del receptor de transferrina (TFR2)45,53-56. Así, algunos autores han descrito que la homocigosis para la mutación Y250X en TFR2 dentro de familias de origen siciliano produce HH tipo 345,57. Otros autores, sin embargo, han concluido que las mutaciones del gen TFR2 no son relevantes para explicar las alteraciones del metabolismo del hierro58, por lo que todavía no resulta claro su papel en estados patológicos relacionados con el metabolismo del metal.
Recientemente, se ha descrito una hemocromatosis juvenil que no está relacionada con el gen HFE, el del TFR2 o el de la ferroportina. Esta sobrecarga temprana de hierro se relaciona con mutaciones del gen HJV, concretamente se ha señalado la mutación G320V.
Deficiencia de hierro
A diferencia de la sobrecarga, la deficiencia de hierro y anemia ferropénica son muy frecuentes y constituyen un problema de salud pública de orden mundial, siendo la deficiencia nutricional con más prevalencia en el mundo y la principal causa de anemia incluso en los países desarrollados59,60. La anemia es un proceso patológico en el cual la concentración de hemoglobina en los eritrocitos está anormalmente baja.
Se habla de anemia cuando existe una disminución en el organismo de la masa eritrocitaria y de la concentración de hemoglobina circulantes por debajo de los límites considerados normales para un sujeto, teniendo en cuenta factores como la edad, sexo, condiciones medioambientales, y estado fisiológico.
Según la Organización Mundial de la Salud (OMS)59, se denomina anemia, cuando la hemoglobina (Hb) se encuentra en los siguientes valores:
- Hombre adulto: Hb < 13 g/dL.
- Mujer adulta no embarazada: Hb < 12 g/dL.
- Mujer adulta embarazada: Hb < 11 g/dL.
- Niños:- 6 meses-5 años: Hb < 12 g/dL.
- 5-11 años: Hb < 11,5 g/dL.
- 12-13 años: Hb < 12 g/dL.
Un descenso brusco o gradual de 2 g/dL o más de la cifra de Hb habitual de un paciente, aun cuando se mantenga dentro de los límites normales para su edad y sexo.
También puede clasificarse a la anemia según su severidad como:
- Anemia leve a moderada: Hb 8-11g/dL.
- Anemia marcada: Hb 6-7 g/dL.
- Anemia severa: Hb 4-5 g/dL.
- Anemia crítica: Hb menor a 4 g/dL.
La anemia ferropénica está caracterizada por la reducción o ausencia de depósitos de hierro, bajas concentraciones séricas de hierro y Hb, disminución del hematocrito e incremento en la cantidad de plaquetas, ferritina sérica baja y un aumento marcado en la capacidad de transporte del hierro en plasma60.
Así mismo, se ha visto que en pacientes críticos con deficiencia de hierro causada por inflamación, existe una respuesta inapropiada del sistema inmunitario, lo que ocasiona un peor pronóstico para los mismos61. Sería interesante conocer si en la etiología de dicha deficiencia participa la elevación de la hepcidina.
Debido a los efectos en el desarrollo y crecimiento humano, las infecciones y asociación con mortalidad en niños, la repercusión en el rendimiento físico y función cognitiva, la anemia por deficiencia de hierro es una prioridad de la OMS59. Una deficiencia de hierro en el período postnatal, tiene como consecuencia importantes alteraciones del Sistema Nervioso Central, ya comentadas al inicio de esta revisión5,62.
Deficiencia de hierro y factores genéticos
Los descubrimientos en los que se van ampliando las "nuevas proteínas del metabolismo del hierro" han animado una serie de estudios con el fin de identificar las mutaciones de genes que codifican éstas proteínas y con ello, tratar de relacionar las mutaciones con la deficiencia de hierro63,64.
Como ya se ha indicado, las mutaciones C282Y y H63D del gen HFE, están involucradas en la hemocromatosis hereditaria. Sin embargo, aún no hay estudios de asociación que evidencen una clara asociación entre polimorfismos o haplotipos y un fenotipo de deficiencia de hierro o anemia ferropénica63. Teóricamente, la presencia de mutaciones que predisponen a sobrecarga de hierro protegerían frente a la anemia. Sin embargo, se ha observado que las mujeres con unas reservas de hierro más bajas presentaban un mayor número de mutaciones en diversos genes del hierro, incluído el HFE, lo que indicaría una alteración compleja de su metabolismo.
En este campo, es preciso mencionar los trabajos preliminares enfocados a la mutación G277S del gen Tf de transferrina. Por sí misma esta mutación no es un factor de riesgo para anemia63, ya que se ha observado que la absorción de hierro se incrementa en el mismo grado en mujeres con deficiencia de hierro que presentan dicha mutación y en las del fenotipo normal, cuando ambos grupos consumen alimentos que contienen pescado como estimulante de la absorción63.
Cuando se realizó la secuencia completa del gen HAMP de la hepcidina en 162 mujeres en edad fértil, únicamente se detectó la mutación 17V, la cual se encontraba en el segmento del péptido líder y sustituye dos aminoácidos bioquímicamente similares, por lo que no parece suficiente para ocasionar cambios funcionales44,65. Tampoco se ha descrito ninguna mutación del gen HJV en pacientes con deficiencia de hierro.
Recientemente se ha asociado al gen de la matriptasa-2 (TMPRSS6) con la deficiencia de hierro66. La matriptasa-2 es una proteasa que regula negativamente la expresión de la hepcidina, al hidrolizar la hemojuvelina (receptor de membrana que estimula la transcripción del gen HAMP de la hepcidina). Los estudios se han realizado en modelos en ratones TMPRSS+/- y TMPRSS-/- que muestran una marcada anemia ferropénica y reducción de ferroportina en la membrana basolateral de los enterocitos, lo que conduce a retención del hierro en el endotelio e inhibición de su absorción. No obstante, aún es preciso realizar investigaciones específicas en humanos que padecen anemias.
Hierro y riesgo cardiovascular
Sobrecarga de hierro y riesgo cardiovascular
La eficiencia del hierro Fe2+ para ceder electrones y la del hierro Fe3+ para aceptarlos, es una característica fundamental para muchas reacciones bioquímicas del organismo. Sin embargo, ésta característica lo convierte también en un peligro potencial, ya que bajo condiciones aerobias, fácilmente puede catalizar la formación de radicales libres nocivos, especies reactivas de oxígeno o más coloquialmente radicales libres16.
La toxicidad del hierro se basa en la química de Fenton y de Haber-Weiss16,67, donde pequeñas cantidades del mineral son suficientes para formar radicales hidroxilo (OH·) a partir de superoxido (O2·-) y peróxido de hidrógeno (H2O2), conocidos como intermediarios reactivos de oxígeno (ROS)16,65.
Cabe mencionar que los ROS se producen inevitablemente por la respiración aerobia y se forman a través de la reducción incompleta de oxígeno molecular en la mitocondria. Así mismo, se pueden generar durante reacciones enzimáticas en otros subcompartimentos de la célula, tales como peroxisomas, retículo endoplásmico o en el citoplasma. También se producen en el borde de la membrana celular a través del complejo NADPH oxidasa, una enzima que se expresa principalmente en neutrofilos y macrófagos, pero también es expresada en otros tipos celulares. La NADPH oxidasa es una herramienta importante para la defensa del organismo16.
El potencial redox del hierro no sólo cataliza la formación de radicales hidroxilo; también cataliza la formación de especies reactivas orgánicas, tales como ROOs, ROs, RS o RSOOs. Del mismo modo, el hierro hemo (contenga o no hemoproteínas) cataliza la formación de radicales libres, vía formación de intermediarios de oxoferrilo16.
Finalmente, el hierro ferroso también puede contribuir como reactivo más que como catalizador, para la generación de radicales libres a través de una interacción directa con el oxígeno.
Los radicales libres son especies muy reactivas y promueven la oxidación de proteínas, peroxidación de lípidos de membrana y modificación de ácidos nucleicos.
Un incremento en los niveles de especies reactivas de oxígeno, que va más allá de la capacidad antioxidante del organismo, ocasionando estrés oxidativo, se puede encontrar en ciertas situaciones patológicas como inflamación crónica, reperfusión isquémica causada por una lesión o neurodegeneración69,16, y en general las enfermedades cardiovasculares70.
Un exceso de hierro con actividad redox agrava el estrés oxidativo y acelera la degeneración tisular. Esto se hace evidente en desórdenes hereditarios o sobrecargas secundarias de hierro.
En condiciones fisiológicas, el hierro extracelular se encuentra ligado a la transferrina, que además de transportar el hierro a través del plasma, lo mantiene soluble y "prácticamente" no-tóxico, por no ser capaz de llevar a cabo las reacciones de Fenton y Haber-Weiss. En situaciones de sobrecarga de hierro, se satura la capacidad de unión con la transferrina. Así, el hierro no ligado a transferrina, se internaliza en tejidos, a través de mecanismos poco definidos que originan daño celular16.
Diversos estudios han investigado el efecto del hierro en la peroxidación lipídica4,71,72. El hierro podría estar involucrado en la patología aterosclerótica mediante la promoción de la modificación oxidativa de LDL, aumentando así su potencial aterogénico. La peroxidación lipídica, puede incluso dañar las membranas de otras células; con lo cual se incrementa LDL-colesterol (LDL-C), disminuye HDL-colesterol (HDLC) y se altera la presión sistólica sanguínea; por lo que se define como factor de riesgo de aterosclerosis y enfermedad cardiovascular73.
Hipótesis de hierro
Diversos factores de riesgo se asocian claramente con aterosclerosis: edad, género, dislipemias, tabaquismo, hipertensión, diabetes mellitus, obesidad y estilo de vida sedentario. Sin embargo, se sugiere que la causa de casi la mitad de los casos de aterosclerosis no se define por dichos factores. De ahí que la investigación de los posibles factores de riesgo o protección de enfermedades cardiovasculares sigue siendo motivo de estudio74.
En 1981, Jerome Sullivan propuso que la deficiencia de hierro era un posible factor protector contra enfermedades cardiovasculares. Inicialmente, la "hipótesis de hierro" fue formulada para explicar las diferencias entre sexo y riesgo cardiovascular, de modo que la menstruación en las mujeres constituiría un factor que condicionaría un escaso reservorio corporal de hierro y por tanto menor riesgo cardiovascular. Sin embargo, este razonamiento es aún motivo de discusión75-78.
En 1992, Salonen y cols.79, publicaron un estudio prospectivo acerca de la hipótesis del hierro y las enfermedades cardiovasculares. Se encontró que una asociación positiva entre las concentraciones de ferritina sérica, indicador de almacenes de hierro, y determinados factores de riesgo de enfermedades cardiovasculares. La asociación fue fuerte en hombres con altos niveles de LDL-colesterol sérico, sugiriendo un papel sinérgico de altos depósitos de hierro y altos niveles de LDL-colesterol80. Estos hallazgos fueron confirmados por otros investigadores, que muestran que el exceso de hierro estimula la formación de lesiones ateroscleróticas en conejos hipercolesterolémicos81. Kiechl y cols.82, comprobaron en un estudio asintomático de aterosclerosis carotídea evaluado por ecografía dúplex, la existencia de una fuerte correlación entre la aterosclerosis y los depósitos de hierro en hombres y mujeres, los cuales fueron más prominentes cuando se asociaron con hipercolesterolemia.
Por lo tanto, aunque hay pruebas de que la cantidad total de hierro en el cuerpo está relacionada con la enfermedad aterosclerótica, no está claro si es una relación gradual ni la existencia de una relación causa-efecto. Además, los procesos inflamatorios que cursan con ferritina elevada constituirían un factor confundente. No obstante, sí se conoce una clara relación entre sobrecarga de hierro, peroxidación lipídica elevada y cirrosis hepática en enfermos de hemocromatosis hereditaria16.
Por otro lado, en un estudio epidemiológico de envejecimiento, se ha observado una interesante asociación positiva entre resistencia a la insulina e hiperlipemia y número de eritrocitos. La hiperinsulinemia es en sí misma un factor de riesgo independiente de enfermedades cardiovasculares, debido a la capacidad de la insulina de promover el crecimiento de células vasculares y aterosclerosis. Además, se ha visto in vitro que el efecto de la insulina sobre el crecimiento celular ocurre también en las células eritropoyéticas. Un incremento de la masa eritrocitaria se asocia con enfermedad cardiovascular83. Barberi y cols.83, demostraron in vivo que en la resistencia a la insulina hay un incremento en el número de glóbulos rojos, lo cual contribuye a que las personas con síndrome de resistencia a la insulina, tengan un alto riesgo de desarrollar enfermedades cardiovasculares.
Deficiencia de hierro y riesgo cardiovascular
Existe gran controversia sobre la susceptibilidad de células para la peroxidación lipídica en la anemia por deficiencia de hierro (Iron Deficiency Anemia, IDA)84,85.
Por un lado, hay teorías que afirman que la deficiencia de hierro no sólo afecta la producción de hemoglobina, sino que también afecta la producción de otras proteínas que contienen Fe2+, tales como citocromos, mioglobina, catalasas y peroxidasas. Se ha indicado que el debilitamiento del sistema de defensa antioxidante, reduce la inmunidad celular y la actividad mieloperoxidasa en pacientes con anemia por deficiencia de hierro. Isler y cols.86, determinaron las actividades antioxidantes de las enzimas de los eritrocitos en pacientes con anemia por deficiencia de hierro y las alteraciones de las actividades enzimáticas después de tratamientos oral y parenteral con hierro y tratamiento parenteral con hierro suplementado con vitamina E. Como conclusión, destacaron que en el tratamiento oral con hierro, además de mejorar la anemia, se incrementa el sistema de defensa antioxidante mediante el aumento de la actividad de superóxido-dismutasa, manteniéndose la actividad glutation peroxidasa en niveles normales. De hecho, cuando se precisa tratamiento con hierro vía parenteral, es necesario suplementar con vitamina E para restaurar el estatus antioxidante en este tipo de anemia86.
Así mismo, se ha descrito que en pacientes con IDA, los agentes pro-oxidantes incrementan con respecto a los antioxidantes, teniendo como resultado un balance positivo hacia el lado oxidativo85.
Aslan y cols.85 manifiestaron que el incremento del estrés oxidativo puede ser una causa que contribuye a la patogénesis de la anemia por deficiencia de hierro, y que parece ser un factor importante que induce daño al DNA. A su vez, la relación entre el incremento del estrés oxidativo y daño al DNA en una anemia severa por deficiencia de hierro pueden tener un papel importante en la patogénesis de la misma85.
Por el contrario, autores como Díaz-Castro y cols.84 afirman que la IDA es un factor que no afecta la estabilidad del DNA o la peroxidación lipídica en ratas. Esto se explicaría por la existencia de una capacidad compensatoria suficiente para mantener elevadas las defensas antioxidantes84.
Un estudio de cohortes prospectivo realizado en comunidades de Estados Unidos, evaluó el riesgo de aterosclerosis en la población general, en sujetos cuya edad se encontraba entre 45 y 64 años87. Los autores sugirieron que la presencia de anemia constituye un factor de riesgo independiente para enfermedad cardiovascular. Sin embargo, se trataba de una muestra con bajo riesgo cardiovascular88.
La deficiencia temporal de hierro sensibiliza la acción de insulina89, tal como sucede en pacientes lacto-ovo vegetarianos, donde además de tener incrementada la sensibilidad a insulina, tienen menores reservas de hierro, con respecto a los que consumen carne90. Sin embargo, una deficiencia crónica de hierro con anemia, puede acelerar el desarrollo de enfermedad cardiovascular, tanto en pacientes diabéticos como no diabéticos89.
Un estudio realizado por nuestro grupo91 en una población de neonatos, se encontró una correlación significativa entre los niveles de hierro en plasma y los de HDL-colesterol y apolipoproteína A-1. Cuando la población de neonatos se clasificó en cuartiles para los niveles de hierro en plasma, también se observó que aquellos con niveles más bajos de hierro presentaron niveles más reducidos de HDL-colesterol. En dicho trabajo91 se sugirió que estos datos son relevantes dado que el estrés oxidativo en el parto es el resultado normal de hiperoxia. Berger y cols.92 señalaron que el plasma del neonato a menudo presenta altos niveles de saturación de la transferrina y que los niveles bajos de ceruloplasmina y elevados de ascorbato permitirían al hierro del recién nacido existir en forma reducida. Dado que las HDL poseen un sistema enzimático relacionado con la paraoxonasa93,94 y limitan la oxidación de las LDL70, debe entenderse como un mecanismo protector que se induce en el recién nacido frente a niveles elevados de hierro en plasma.
En cuanto a la relación de anemia y obesidad, diversos estudios en niños y adolescentes muestran correlaciones significativas entre el exceso de adiposidad y deficiencia de hierro95,96. Aunque la etiología de la relación anemia-obesidad sigue sin conocerse, se han sugerido factores como: rápido crecimiento, incremento del volumen sanguíneo, inicio temprano de la menstruación, dieta deficiente, escasa actividad física y factores genéticos96.
Un exceso de grasa, particularmente de distribución visceral, se ha asociado al incremento de citoquinas proinflamatorias e inflamación leve, pero de índole crónica96-98. En este sentido, se sabe que las citoquinas incrementan la expresión de la hepcidina, lo que ocasiona un bloqueo en la absorción del hierro y tendencia a deficiencia34,39. No obstante, es preciso profundizar en estos mecanismos y su implicación en la deficiencia de hierro en obesos.
Un estudio realizado en adultos obesos, demostró que las demandas celulares de hierro pueden ser medidas a través del receptor de transferrina y la inflamación a través de la proteína C reactiva. Ambas mediciones, constituyen un buen predictor de los niveles séricos de hierro96,99.
En un estudio cruzado realizado en 2009, Tussing-Humphreys y cols.96 investigaron la relación entre el estatus de hierro y el exceso de adiposidad, inflamación, menarquia, dieta y actividad física en mujeres adolescentes. Se concluyó que las mujeres con mayor peso corporal incrementaron la prevalencia de deficiencia de hierro comparadas con las normopeso.
Una hipótesis propone que la relación entre obesidad y deficiencia de hierro puede ser similar a la relación entre inflamación y anemia, causando un incremento en la producción de hepcidina. Los niveles elevados de hepcidina inducidos por la inflamación pueden reducir la absorción de hierro (figs. 1 y 2) e intensificar el secuestro del mineral por los macrófagos del sistema retículoendotelial. Sin embargo, es preciso incrementar las investigaciones sobre los efectos metabólicos que conlleva dicho secuestro intracelular del hierro96,99.
Modificación de la biodisponibilidad del hierro en deficiencia y en sobrecarga
Sobrecarga
La quelación es el tratamiento por el cual se elimina suficiente cantidad de hierro para prevenir daño a órganos endocrinos, hígado y corazón por una sobrecarga de hierro41. Los quelantes se dan principalmente por vía parenteral.
En relación a posibles quelantes de los alimentos, se ha observado que el poder inhibitorio del té en la absorción del hierro puede ser útil para disminuir el acumulo de hierro en pacientes con hemocromatosis, y reducir las secuelas de esta enfermedad. La recomendación a estos pacientes deberá ser consumir té en las comidas principales para que la interacción se produzca con el hierro de los alimentos. Además se evitará ingerir en las mismas componentes que aumenten la absorción del metal. Kaltwasser y cols.100, demostraron que el consumo de té negro con las comidas, reducía las frecuencias de flebotomías requeridas en el manejo de pacientes con hemocromatosis.
Lo mismo ocurre con el consumo de té verde y otros alimentos que contienen compuestos fenólicos, tales como el vino tinto y el café que condicionan una inhibición en la absorción del hierro no-hemo101,102. Por lo tanto, se podrían utilizar combinados de inhibidores de la absorción, para paliar los efectos de la sobrecarga de hierro.
Las acciones benéficas del té verde van más allá del secuestro de hierro como complemento en la terapia médica de hemocromatosis. Esto es debido a que dentro de su composición química se encuentran un tipo de polifenoles, las catequinas, que tienen acciones benéficas en la prevención de enfermedades cardiovasculares.
Se han identificado ocho catequinas diferentes al extraer los polifenoles del té. Principalmente se pueden mencionar: galato epigalocatequina y galocatequina, que constituyen el 51,8% de las catequinas totales del té103. Dichas catequinas pueden disminuir el daño celular causado por estrés oxidativo104. Así mismo, se ha visto que su consumo puede ser útil en el tratamiento de control de peso104, al incrementar la termogénesis y la oxidación de la grasa103 y en el tratamiento de la hipercolesterolemia104, pues disminuye la absorción intestinal del colesterol al reducir su solubilidad en las micelas. Además los polifenoles del té presentan una fuerte actividad protectora contra la oxidación de las LDL ayudando así en la prevención enfermedades cardiovasculares103,105.
Deficiencia
La suplementación con hierro es considerada la manera más efectiva de tratar la anemia ferropénica. Sin embargo, el papel de la suplementación en la prevención no es muy claro, debido a inconvenientes económicos, aceptabilidad a largo plazo y efectos secundarios. Por tanto la prevención de anemia a través de la dieta es uno de los principales objetivos de la Organización Mundial de la Salud59.
En pacientes con deficiencia de hierro, el consejo médico consiste en aumentar el consumo de carne, por su contenido en hierro-hemo. Sin embargo, a la población en general se le recomienda un consumo moderado de carne, lo que beneficiaría la salud cardiovascular. Navas-Carretero y cols.106 en un estudio de absorción en mujeres con deficiencia de hierro, en el que se empleó marcaje con isótopos estables, comprobaron que tomar salmón (muy rico en proteínas y ácidos grasos omega 3) incrementa la absorción de hierro no-hemo proveniente de alimentos ricos en fitatos, por lo que dietas ricas en alimentos de origen animal, no sólo carne, han de ser compatibles con el mantenimiento del estado del hierro, sin perjudicar la salud cardiovascular. No obstante, el consumo de una dieta rica en carne roja frente a pescado azul, no fue capaz de incrementar el estado de hierro en la misma población, probablemente porque tanto la carne como el pescado estimulan la biodisponibilidad de este micronutriente107. Sí se observó en estas voluntarias una asociación entre un estado de hierro relativamente menor tras consumir la dieta de pescado e incremento en la sensibilidad a la insulina, sin cambios en los marcadores de oxidación (lipoperóxidos)108.
Por tanto, parece que la intervención dietética no es capaz de incrementar el estado de hierro tan eficazmente como la suplementación o los alimentos enriquecidos en hierro60, por lo que se han creado estrategias para prevenir la deficiencia de hierro mediante la fortificación de alimentos con sales ferrosas y férricas. La fortificación ideal debe permitir la adición de altas dosis de hierro en el alimento, sin cambiar sus propiedades físicas, químicas o sensoriales. Así mismo, el hierro adicionado se debe poder absorber efectivamente. Los fortificantes más estudiados han sido bisglicinato-férrico, fumarato ferroso y pirofosfato férrico, siendo éste último el que produce menos cambios en el color o palatabilidad del alimento109,110. Así mismo, se está estudiando el hierro-hemo proveniente de plantas (leg-hemoglobina) como una nueva fuente de hierro para la fortificación de alimentos. Las leghemoglobinas son hemoglobinas monoméricas presentes en las raíces de legumbres y son un compuesto indispensable para el sistema de fijación de nitrógeno de las plantas111,112. Proulx y Reddy112 estudiaron si la leg-hemoglobina parcial o totalmente purificada de raíces de soja podía incrementar la biodisponibilidad de hierro, utilizando el modelo celular Caco-2. Los resultados aun no son concluyentes, pero demuestran que la leg-hemoglobina es una línea nueva de investigación que puede proveer hierro biodisponible para la fortificación de alimentos.
La utilización de alimentos funcionales enriquecidos en hierro es una novedosa actividad científica. Sin embargo, aún hacen falta más estudios en éste campo.
Un estudio novedoso realizado por Young y cols.113 investigaron la relación entre hepcidina sérica y prohepcidina con la absorción del hierro no-hemo en presencia o ausencia de comida, utilizando técnicas de isótopos estables en mujeres sanas. Como resultado, obtuvieron que la hepcidina, aunque no la prehepcidna, estuvo inversamente asociada con la absorción de hierro procedente de suplementos y alimentos enriquecidos en hierro no-hemo.
Esto nos da una idea de que con la manipulación de la dieta y alimentos funcionales se puede incrementar la absorción de hierro. Sin embargo, la difusión de los resultados científicos de las propiedades antioxidantes e hipocolesterolemiantes de una serie de productos que contienen fibra dietética y polifenoles debe tomarse con precaución en colectivos con riesgo elevado de anemia ferropénica, mujeres en edad fértil y niños.
Futuras investigaciones
Teniendo en cuenta la literatura revisada creemos que es necesaria la realización de más investigaciones sobre la relación de la deficiencia o exceso de hierro sobre diversos factores de riesgo cardiovascular. En particular deben programarse estudios donde se analice la influencia de diferentes grados de deficiencia/exceso de hierro sobre los niveles de lipoproteínas aterogénicas (LDL, VLDL, Lp(a)), antiaterogénicas (HDL) y sobre el grado de peroxidación de las mismas.
Dada la falta de información bibliográfica existente, también deben analizarse los efectos de los grados de ferropenia o sobrecarga de hierro sobre trombogénesis, agregación plaquetaria, factores de la coagulación sanguínea y fibrinolisis.
Teniendo en cuenta la relación entre hepcidina, estatus del hierro y procesos inflamatorios, desde esta revisión se insta a investigar sobre las posibles implicaciones del hierro tisular sobre citoquinas y/o adipoquinas. Además, dado que la enfermedad cardiovascular y el síndrome metabólico tienen una base inflamatoria, los estudios futuros deben incidir en las implicaciones que suplementos de hierro o consumo de alimentos enriquecidos en dicho mineral puedan tener en personas anémicas o con deficiencia de hierro sobre los niveles de insulina y/o citoquinas proinflamatorias y antiinflamatorias.
La búsqueda de genes candidatos (p.e. HFE, TRF2, HAMP, HJV, Tf, y TMPRSS6) que expliquen la variabilidad de respuesta interindividual al consumo de suplementos/alimentos enriquecidos en hierro es un tema de enorme actualidad. Con relación al papel de la dieta en la expresión génica (nutrigenómica), futuras investigaciones deben incidir en la acción moduladora de la ingesta de diferentes niveles de hierro, tanto hemo como no-hemo, sobre los genes HFE, TRF2, HAMP, HJV, Tf, y TMPRSS6 u otros, y sus consecuencias sobre la expresión de proteínas codificadas por tales genes. Por último, dado que el hierro tiene relación con el metabolismo y peroxidación de lipoproteínas, parece adecuado sugerir también investigaciones de los efectos del hierro de la dieta sobre genes que codifican proteínas implicadas en el metabolismo lipoproteico (p.e. receptor de LDL) y en la protección/inducción oxidante (p.e. PPARs).
Referencias
1. Conrad M, Umbreit J. Pathways of iron absorption. Blood Cells Mol Dis 2002; 29: 336-55. [ Links ]
2. Nadadur SS, Srirama K, Mudipalli A. Iron transport & homeostasis mechanisms: their role in health & disease. Indian J Med Res 2008; 128: 533-44. [ Links ]
3. Conrad M, Umbreit J. Iron Absorption and Transport- An Update. Am J Hematol 2000; 64: 287-98. [ Links ]
4. West AR, Oates PS. Mechanisms of heme iron absorption: current questions and controversies. World J Gastroenterol 2008; 14: 4101-10. [ Links ]
5. Suárez, Heberto; Cimino, Franco; Bonilla, Ernesto. Hierro en el sistema nervioso central: metabolismo y consideraciones fisio-patológicas. Invest Clín 1985; 26: 247-322. [ Links ]
6. Guyton A.C y Hall JE. Textbook of Medical Physiology. 11a edición: Saunders, 2006. [ Links ]
7. Oakley AE, Collingwood JF, Dobson J, Love G, Perrott HR, Edwardson JA, Elstner M, Morris CM. Individual dopaminergic neurons show raised iron levels in Parkinson disease. Neurology 2007; 68: 1820-5. [ Links ]
8. Koziorowski D, Friedman A, Arosio P, Santambrogio P, Dziewulska D. ELISA reveals a difference in the structure of substantia nigra ferritin in Parkinson's disease and incidental Lewy body compared to control. Parkinsonism Relat Disord 2007; 13: 214-8. [ Links ]
9. Friedman A, Galazka-Friedman J, Bauminger ER, Koziorowski D. Iron and ferritin in hippocampal cortex and substantia nigra in human brain-implications for the possible role of iron in dementia. J Neurol Sci 2006; 248: 31-4. [ Links ]
10. Fiel MI, Schiano T. A woman with chronic anemia and cholestatic liver disease. Hepatology 2009; 49: 1390-1. [ Links ]
11. Pikuleva IA. Cholesterol-metabolizing cytochromes P450. Drug Metab Dispos. 2006; 34: 513-20. [ Links ]
12. Lehninger A, Nelson D, Cox M. Principios de Bioquímica. 3a Edición. Omega, 2001. [ Links ]
13. Viguria Padilla F, Miján de la Torre A. La pica: retrato de una entidad clínica poco conocida. Nutr Hosp 2006; 21: 557-66. [ Links ]
14. Sharp P, Srai SK. Molecular mechanisms involved in intestinal iron absorption. World J Gastroenterol 2007; 13: 4716-24. [ Links ]
15. Darshan D, Anderson GJ. Liver-gut axis in the regulation of iron homeostasis. World J Gastroenterol 2007; 13: 4737-45. [ Links ]
16. Papanikolaou G, Pantopoulos K. Iron metabolism and toxicity. Toxicol Appl Pharmacol 2005; 202: 199-211. [ Links ]
17. Lönnerdal B. Nutritional roles of lactoferrin. Curr Opin Clin Nutr Metab Care 2009; 12: 293-7. [ Links ]
18. Vidal Miñana MC, Farré Rovira R. Evaluación antropométrica del estado nutricional y estimación de las ingestas de hierro y de vitamina C de mujeres posmenopáusicas y hombres mayores de 45 años. Nutr Hosp 2001; 15: 162-9. [ Links ]
19. Tako E, Glahn RP, Welch RM, Lei X, Yasuda K, Miller DD. Dietary inulin affects the expression of intestinal enterocyte iron transporters, receptors and storage protein and alters the microbiota in the pig intestine. Br J Nutr 2008; 99: 472-80. [ Links ]
20. Patterson JK, Rutzke MA, Fubini SL, Glahn RP, Welch RM, Lei X, Miller DD. Dietary inulin supplementation does not promote colonic iron absorption in a porcine model. J Agric Food Chem 2009; 57: 5250-6. [ Links ]
21. Johnston KL, Johnson DM, Marks J, Srai SK, Debnam ES, Sharp PA. Non-haem iron transport in the rat proximal colon. Eur J Clin Invest 2006; 36: 35-40. [ Links ]
22. Van Dokkum. The concept of mineral bioavailability. En: Bioavailability of minerals and minor dietary components. Metabolic and technological aspects (MP Vaquero, T García-Arias, A Carbajal, FJ Sánchez-Muniz, eds), Research Signpost, Trivadrum, pp. 1-18, 2003. [ Links ]
23. Pérez-Granados AM, Navarro MP, Vaquero MP (2003). The frying process. Influence on the bioavailability of dietary minerals. En: Bioavailability of minerals and minor dietary components. Metabolic and technological aspects (MP Vaquero, T García-Arias, A Carbajal, FJ Sánchez-Muniz, eds), Research Signpost, Trivadrum, pp. 95-104. [ Links ]
24. Vaquero MP. Factores que intervienen en la biodisponibilidad mineral. Prevención de deficiencias. Revista de Nutrición Práctica 1998; 2: 15-23. [ Links ]
25. Hurrell RF, Reddy MB, Juillerat M, Cook JD. Meat protein fractions enhance nonheme iron absorption in humans. J Nutr 2006; 136: 2808-12. [ Links ]
26. Huh EC, Hotchkiss A, Brouillette J, Glahn RP. Carbohydrate fractions from cooked fish promote iron uptake by Caco-2 cells. J Nutr 2004; 134: 1681-9. [ Links ]
27. Armah CN, Sharp P, Mellon FA, Pariagh S, Lund EK, Dainty JR, Teucher B, Fairweather-Tait SJ. L-alpha-glycerophosphocholine contributes to meat's enhancement of nonheme iron absorption. J Nutr 2008; 138: 873-77. [ Links ]
28. Fernández R, Phillips SF. Components of fiber impair iron absorption in the dog. Am J Clin Nut 1989; 35: 107. [ Links ]
29. Vaquero MP, Pérez-Olleros L, García-Cuevas M, Veldhuizen. Ruíz-Roso B, Requejo A. Absorción de minerales de dietas que contienen fibra natural de algarrobas comparada con celulosa, pectina y varias combinaciones de estas fibras. Foof Sci Tech Int. 2000; 6: 463-71. [ Links ]
30. Bocanegra A, Nieto A, Blas B, Sánchez-Muniz FJ. Diets containing high percentage of Nori or Konbu algae are well accepted and efficiently used by growing rats but induce different degrees of histological changes in the liver and bowel. Food Chem. Toxicol 2003; 41: 1473-80. [ Links ]
31. Bocanegra A, Bastida S, Ródenas S, Benedí J, Sánchez-Muniz FJ. Characterisitics and nutricional and cardiovascular-heath properties of seaweeds. J Med Food 2009; 12: 236-58. [ Links ]
32. Bocanegra A, Nieto A, Bastida S, Benedí J, Sánchez-Muniz FJ. A Nori, but not a Konbu, dietary supplement decreases the cholesterolaemia, liver fat infiltration and mineral bioavailability in hypercholesterolemic growing Wistar rats. Br J Nutr 2008; 99: 272-80. [ Links ]
33. Lynch SR. Iron. In: Sadler MJ, Strain JJ, Caballero B, eds. Encyclopedia of Human Nutrition, Academic Press, vol. 2, pp. 1153-9, Londres, 1998. [ Links ]
34. Ganz T. Molecular control of iron transport. J Am Soc Nephrol 2007; 18: 394-400. [ Links ]
35. Mckie AT. The role of Dcytb in iron metabolism: an update. Biochem Soc Trans 2008; 36: 1239-41. [ Links ]
36. Piperno A, Mariani R, Trombini P, Girelli D. Hepcidin modulation in human diseases: from research to clinic. World J Gastroenterol 2009; 15: 538-51. [ Links ]
37. Weinstein D, Roy CN, Fleming MD, Loda MF, Wolfsdorf JI, Andrews NC. Inappropiate expresion of hepcidin is associated with iron refractory anemia: implication for the anemia chronic disease. Blood 2002; 100: 3776-81. [ Links ]
38. Papanikolaou G, Samuels ME, Ludwig EH, MacDonald MLE, Franchini PL, Dubé MP y cols. Mutations in HFE2 cause iron overload in chromosome 1q-linked juvenile hemochromatosis. Nat Genet 2004; 36: 77-82. [ Links ]
39. De Domenico I, Nemeth E, Nelson JM, Phillips JD, Ajioka RS, Kay MS, Kushner JP, Ganz T, Ward DM, Kaplan J. The hepcidin-binding site on ferroportin is evolutionarily conserved. Cell Metab 2008; 8: 146-56. [ Links ]
40. Vaiopoulos G, Papanikolaou G, Politou M, Jibreel I, Sakellaropoulos N, Loukopoulos D. Arthropathy in juvenile hemochromatosis. Arthritis Rheum 2003; 48: 227-30. [ Links ]
41. Beutler E, Hoffbrand AV, Cook JD. Iron deficiency and overload. Hematology Am Soc Hematol Educ Program 2003; 40-61. [ Links ]
42. Online Mendelian Inheritance in Man Database (OMIMD). En línea [http://www.ncbi.nlm.nih.gov/omim/] 20 de mayo de 2009. [ Links ]
43. Wolff F, Carreño N, Armas M, Caravallo A. Hemocromatosis Hereditaria. Complicaciones Reumatológicas. Reumatología 2004; 20: 139-48. [ Links ]
44. Arroyo E, Vaquero MP. Detección de mutaciones y su implicación en estados patológicos del metabolismo del hierro. En: Vaquero MP, ed. Genética, nutrición y enfermedad. Consejo Superior de Investigaciones Científicas, Instituto Tomás Pascual Sanz, Edimsa, pp. 147-156, Madrid, 2008. [ Links ]
45. Camaschella C, Roetto A, Cali A, De Gobbi M, Garozzo G, Carella M y cols. The gen TfR2 is mutated in a new type of haemochromatosis mapping to 7q22. Nat Genet 2000; 25: 14-15. [ Links ]
46. Feder JN, Gnirke A, Thomas W y cols. A novel MHC class Ilike gene is mutated in patiens with hereditary haemochromatosis. Nat Genet 1996; 13: 399-408. [ Links ]
47. Merryweather-Clarke AT, Pointon M, Jouanolle AM y cols. Geography of HFE C282Y and H63 mutations. Genet Test 2000; 4: 183-98. [ Links ]
48. Beutler L, Beutler E. Hematogically important mutations: iron storage diseases. Blood Cells Mol Dis 2004; 33: 40-44. [ Links ]
49. Delatycki MB, Allen KJ, Gow P, MacFarlane J, Radomski C, Thompson J, Hayden MR, Goldberg YP, Samuels ME. A homozygous HAMP mutation in a multiply consanguineous family with pseudo-dominant juvenile hemochromatosis. Clin Genet 2004; 65: 378-83. [ Links ]
50. Lanzara C, Roetto A, Daraio F, Rivard S, Ficarella R, Simard H, Cox TM, Cazzola M, Piperno A, Gimenez-Roqueplo AP, Grammatico P, Volinia S, Gasparini P, Camaschella C. Spectrum of hemojuvelin gene mutations in 1q-linked juvenile hemochromatosis. Blood 2004; 103: 4317-21. [ Links ]
51. Lee PL, Beutler E, Rao SV, Barton JC. Genetic abnormalities and juvenile hemochromatosis: mutations of the HJV gene encoding hemojuvelin. Blood 2004; 103: 4669-71. [ Links ]
52. Majore S, Binni F, Pennese A, De Santis A, Crisi A, Grammatico P. HAMP gene mutation c.208T > C (p.C70R) identified in an Italian patient with severe hereditary hemochromatosis. Hum Mutat 2004; 23 (4): 400. [ Links ]
53. Aleo Luján E, Gil López C, González Fernández FA, Villegas Martínez A, Valverde Moreno F. Receptor sérico de transferrina en niños sanos. Valor diagnóstico en la anemia infecciosa y en la ferropénica. An Pediatr (Barc) 2004; 60: 428-35. [ Links ]
54. Trinder D, Baker E. Tranferrin receptor 2: a new molecule in iron metabolism. Int J Biochem Cell Biol 2003; 35: 292-6. [ Links ]
55. Hofmann WK, Tong XJ, Ajioka RS, Kushner JP, Koeffler HP. Mutation analysis of transferrin-receptor 2 in patients with atypical hemochromatosis. Blood 2002; 100: 1099-100. [ Links ]
56. Mattman A, Huntsman D, Lockith G y cols. Tranferrin receptor 2 (TFR2) and HFE mutational analysis non C_282Y iron overload. Identification of a novel mutation. Blood 2002; 100: 1075-7. [ Links ]
57. Piperno A, Roetto A, Mariani R, Pelucchi S, Corengia C, Daraio F, Piga A, Garozzo G, Camaschella C. Homozygosity for transferrin receptor-2 Y250X mutation induces early iron overload. Haematologica 2004; 89: 359-60. [ Links ]
58. Lee PL, Halloran C, West C, Beutler E. Mutation analysis of the transferrin receptor-2 gene in patients with iron overload. Blood Cells Mol Dis 2001; 27: 285-9. [ Links ]
59. Organización Mundial de la Salud (OMS). En línea [http://www.who.int/es/] 20 de mayo de 2009. [ Links ]
60. De Paz R, Hernández-Navarro R. Manejo, prevención y control de síndrome anémico secundario a deficiencia férrica. Nutr Hosp 2005; 20: 364-7. [ Links ]
61. Muñoz M, Romero A, Morales M, Campos A, García-Erce JA, Ramírez G. Iron metabolism, inflammation and anemia in critically ill patients. A cross-sectional study. Nutr Hosp 2005; 20: 115-20. [ Links ]
62. Connor JR, Menzies SL. Relationship of iron to oligodendrocytes and myelination. Glia 1996; 17: 83-93. [ Links ]
63. Sarriá B, López-Parra AM, Navas-Carretero S, Pérez-Granados AM, Baeza C, Arroyo-Pardo E, Vaquero MP. Hepcidin, Transferrin (exon 7) and Hemochromatosis genotyping suggests that haplotype block analysis is the best strategy for predicting iron deficiency phenotype in women. Nutr Res 2007; 27: 672-8. [ Links ]
64. Navas-Carretero S, Baeza C, López-Parra AM, Tirado M, Arroyo-Pardo E, Vaquero MP. Ingesta de nutrientes y presencia de mutaciones en genes implicados en la deficiencia de hierro en un grupo de mujeres trabajadoras de la Comunidad de Madrid. Nutr Hosp 2008; 1: 144-5. [ Links ]
65. Sarriá B, Navas-Carretero S, Lopez-Parra AM, Perez-Granados AM, Arroyo-Pardo E, Roe MA, Teucher B, Fairweather-Tait SJ, Vaquero MP. The G277S transferrin mutation does not affect iron absorption in iron deficient women. Eur J Nutr 2007; 46: 57-60. [ Links ]
66. Ramsay AJ, Hooper JD, Folgueras AR, Velasco G, López-Otín C.Matriptase-2 (TMPRSS6): a proteolytic regulator of iron homeostasis. Haematologica 2009; 94: 840-9. [ Links ]
67. Kruszewski M. Labile iron pool: the main determinant of cellular response to oxidative stress. Mutat Res 2003; 531: 81-92. [ Links ]
68. Brewer GJ. Iron and copper toxicity in diseases of aging, particularly atherosclerosis and Alzheimer's disease. Exp Biol Med (Maywood) 2007; 232: 323-35. [ Links ]
69. Ischiropoulos H, Beckman JS. Oxidative stress and nitration in neurodegeneration: cause, effect, or association? J Clin Invest 2003; 111: 163-9. [ Links ]
70. Ross R. Atherosclerosis: an inflammatory disease. N Engl J Med 1999; 340: 115-26. [ Links ]
71. Bartzokis G, Lu PH, Tishler TA, Fong SM, Oluwadara B, Finn JP, Huang D, Bordelon Y, Mintz J, Perlman S. Myelin breakdown and iron changes in Huntington's disease: pathogenesis and treatment implications. Neurochem Res 2007; 32: 1655-64. [ Links ]
72. Crichton RR, Wilmet S, Legssyer R, Ward RJ. Molecular and cellular mechanisms of iron homeostasis and toxicity in mammalian cells. J Inorg Biochem 2002; 91: 9-18. [ Links ]
73. Edison ES, Bajel A, Chandy M. Iron homeostasis: new players, newer insights. Eur J Haematol 2008; 81: 411-24. [ Links ]
74. Meyers DG. The iron hypothesis:does iron play a role in atherosclerosis? Transfusion 2000; 40: 1023-9. [ Links ]
75. Sullivan JL. Iron and the sex difference in heart disease risk. Lancet 1981; 1: 1293-4. [ Links ]
76. Sullivan JL. Macrophage iron, hepcidin, and atherosclerotic plaque stability. Exp Biol Med (Maywood) 2007; 232: 1014-20. [ Links ]
77. Sullivan JL. Iron in arterial plaque: A modifiable risk factor for atherosclerosis. Biochim Biophys Acta 2009; 1790: 718-23. [ Links ]
78. Fanchini M, Targher G, Montagnana M, Lippi G., Iron and thrombosis. Ann Hematol 2008; 87: 167-173. [ Links ]
79. Salonen JT, Nyyssonen K, Korpela H, Toumiletto J, Seppanen R, Salonen R. High stored iron levels are associated with excess risk of myocardial infarction in Eastern Finnish men. Circulation 1992; 86: 803-811. [ Links ]
80. Lauffer Rb. Iron stores and the international variation in mortality from coronary artery disease. Med Hypotheses 1991; 35: 96-102. [ Links ]
81. Sullivan JL. Heterozygous hemochromatosis as a risk factor for premature myocardial infarction. Med Hypotheses 1990; 31: 1-5. [ Links ]
82. Kiechl S, Aichner F, Gerstenbrand F, Egger G, Mair A, Rungger G y cols. Body iron stores and presence of carotid atherosclerosis: results from the Bruneck Study. Arterioscler Thromb 1994; 14: 1625-30. [ Links ]
83. Barbieri M, Ragno E, Benvenuti E, Zito GA, Corsi A, Ferrucci L, Paolisso G. New aspects of the insulin resistance syndrome: impact on haematological parameters. Diabetologia 2001; 44: 1232-7. [ Links ]
84. Díaz-Castro J, Alférez MJ, López-Aliaga I, Nestares T, Granados S, Barrionuevo M, Campos MS. Influence of nutritional iron deficiency anemia on DNA stability and lipid peroxidation in rats. Nutrition 2008; 24: 1167-73. [ Links ]
85. Aslan M, Horoz M, Kocyigit A, Ozgonül S, Celik H, Celik M, Erel O. Lymphocyte DNA damage and oxidative stress in patients with iron deficiency anemia. Mutat Res 2006; 601: 144-149. [ Links ]
86. Isler M, Delibas N, Guclu M, Gultekin F, Sutcu R, Bahceci M, Kosar A. Superoxide dismutase and glutathione peroxidase in erythrocytes of patients with iron deficiency anemia: effects of different treatment modalities. Croat Med J 2002; 43: 16-9. [ Links ]
87. The Atherosclerosis Risk in Communities (ARIC) Study: design and objectives. The ARIC investigators. Am J Epidemiol 1989; 129: 687-702. [ Links ]
88. Sarnak MJ, Tighiouart H, Manjunath G, MacLeod B, Griffith J, Salem D, Levey AS. Anemia as a risk factor for cardiovascular disease in The Atherosclerosis Risk in Communities (ARIC) study. J Am Coll Cardiol 2002; 40: 27-33. [ Links ]
89. Liu Q, Sun L, Tan Y, Wang G, Lin X, Cai L. Role of iron deficiency and overload in the pathogenesis of diabetes and diabetic complications. Curr Med Chem 2009; 16: 113-29. [ Links ]
90. Hua NW, Stoohs RA, Facchini FS. Low iron status and enhanced insulin sensitivity in lacto-ovo vegetarians. Br J Nutr 2001; 86: 515-9. [ Links ]
91. Batida S, Vaquero MP, Veldhuizen M, Sánchez-Muniz FJ. Selected trace elements and minerals in cord blood: association with lipis and lipoproteins at bith. Acta Paediatr 2000; 89: 1201-6. [ Links ]
92. Berger HM, Mimby S, Gutteridge JMC. Ferrous ions detected in iron-overloaded cord blood plasma from preterm and term babies: implications for oxidative stress. Free Rad Res 1995; 22: 555-9. [ Links ]
93. Canales A, Sánchez-Muniz FJ. Paraoxonasa ¿Algo más que un enzima? Med Clin (Barc) 2003; 12: 537-48. [ Links ]
94. Nus M, Sánchez-Muniz FJ, Sánchez-Montero JM. Arilesterasa. Aspectos metodológicos y funcionales de una enzima clave en la enfermedad cardiovascular. Parte I. An R Acad Nac Far 2007; 74: 5-27. [ Links ]
95. Nead KG, Halterman JS, Kaczorowski JM, Auinger P, Weitzman M. Overweight children and adolescents: a risk group for iron deficiency. Pediatrics 2004; 114: 104-8. [ Links ]
96. Tussing-Humphreys LM, Liang H, Nemeth E, Freels S, Braunschweig CA. Excess adiposity, inflammation, and irondeficiency in female adolescents. J Am Diet Assoc 2009; 109: 297-302. [ Links ]
97. Mohamed-Ali V, Pinkney JH, Coppack SW. Adipose tissue as an endocrine and paracrine organ. Int J Obes Relat Metab Disord 1998; 22: 1145-58. [ Links ]
98. Sharma AM. Adipose tissue: a mediator of cardiovascular risk. Int J Obes Relat Metab Disord 2002; 26 (Suppl. 4): S5-7. [ Links ]
99. Yanoff LB, Menzie CM, Denkinger B, Sebring NG, McHugh T, Remaley AT, Yanovski JA. Inflammation and iron deficiency in the hypoferremia of obesity. Int J Obes (Lond) 2007; 31: 1412-9. [ Links ]
100. Kaltwasser JP, Werner, Schalk K, Hansen C, Gottschalk R, Seidlc C. Clinical trial on the effect of regular tea drinking on iron accumulation in genetic haemochromatosis. Gut 1998; 43: 699-704. [ Links ]
101. Samman S, Sandström B, Toft MB, Bukhave K, Jensen M, Sørensen SS, Hansen M. Green tea or rosemary extract added to foods reduces nonheme-iron absorption. Am J Clin Nutr 2001; 73: 607-12. [ Links ]
102. Kim EY, Ham SK, Shigenaga MK, Han O. Bioactive dietary polyphenolic compounds reduce nonheme iron transport across human intestinal cell monolayers. J Nutr 2008; 138: 1647-51. [ Links ]
103. Hernández-Figueroa T, Rodríguez-Rodríguez E, Sánchez-Muniz FJ. El té verde ¿una buena elección para la prevención de enfermedades cardiovasculares? ALAN 2004; 54: 380-94. [ Links ]
104. Butt MS, Sultan MT. Green tea: nature's defense against malignancies. Crit Rev Food Sci Nutr 2009; 49: 463-73. [ Links ]
105. Schneider C, Segre T. Green tea: potential health benefits. Am Fam Physician 2009; 79: 591-4. [ Links ]
106. Navas-Carretero S, Pérez-Granados AM, Sarriá B, Carbajal A, Pedrosa MM, Roe MA, Fairweather-Tait SJ, Vaquero MP. Oily fish increases iron bioavailability of a phytate rich meal in young iron deficient women. J Am Coll Nutr 2008; 27: 96-101. [ Links ]
107. Navas-Carretero S, Pérez-Granados AM, Schoppen S, Sarriá B, Carbajal A, Vaquero MP. Iron status biomarkers in iron deficient women consuming an oily fish versus a red meat diet. J Physiol Biochem 2009; 65 (2). [ Links ]
108. Navas-Carretero S, Pérez-Granados AM, Schoppen S, Vaquero MP. An oily fish diet increases insulin sensitivity compared to a red meat diet in young iron-deficient women. Br J Nutr 2009; 19: 7. [ Links ]
109. Navas-Carretero S, Pérez-Granados AM, Sarriá B, Vaquero MP. Iron absorption from meat pate fortified with ferric pyrophosphate in iron-deficient women. Nutrition 2009; 25: 20-4. [ Links ]
110. Navas-Carretero S, Pérez-Granados AM, Sarriá B, Vaquero MP. A comparative study of iron bioavailability from cacao supplemented with ferric pyrophosphate or ferric fumarate in rats. Ann Nutr Metab 2007; 51: 204-7. [ Links ]
111. Kundu S, Trent III JT, Hargrove MS. Plants, humans and hemoglobins. Trends Plant Sci 2003; 8: 387-93. [ Links ]
112. Proulx AK, Reddy MB. Iron Bioavailability of Hemoglobin from Soy Root Nodules using Caco-2 cell culture model. J Agric Food Chem 2006; 54: 1518-22. [ Links ]
113. Young MF, Glahn RP, Ariza-Nieto M, Inglis J, Olbina G, Westerman M, O'Brien KO. Serum hepcidin is significantly associated with iron absorption from food and supplemental sources in healthy young women. Am J Clin Nutr 2009; 89: 533-8. [ Links ]
114. Moreiras O, Carbajal A, Cabrera L, Cuadrado C. Ingestas recomendadas de energía y nutrientes para la población española (Revisadas 2006). Departamento de Nutrición. Universidad Complutense de Madrid (pp. 227-230). En: Tablas de composición de alimentos. Ediciones Pirámide (Grupo Anaya, S. A.). 13a edición revisada y ampliada. 2009 (295 pp) (ISBN: 978-84-368-2273-1). [ Links ]
115. Institute of Medicine. Iron. En: Food and Nutrition Board Institute of Medicine, ed. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. National Academy Press, pp. 290-393, Washington, 2001. [ Links ]
116. Swinkels DW, Janssen MC, Bergmans J, Marx JJ. Hereditary hemochromatosis: genetic complexity and new diagnostic approaches. Clin Chem 2006; 52: 950-68. [ Links ]
117. Aronow WS, Ahn C. Three-year follow-up shows no association of serum ferritin levels with incidence of new coronary events in 577 persons aged > or = 62 years. Am J Cardiol 1996; 78: 678-9. [ Links ]
118. Moore M, Folsom AR, Barnes RW, Eckfeldt JH. No association between serum ferritin and asymptomatic carotid atherosclerosis. The Atherosclerosis Risk in Communities (ARIC) Study. Am J Epidemiol 1995; 141: 719-23. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
M.a P. Vaquero.
Departamento de Metabolismo y Nutrición.
ICTAN. Instituto del Frío.
Consejo Superior de Investigaciones Científicas (CSIC).
C/ José Antonio Novais, 10.
28040 Madrid. Spain.
E-mail: mpvaquero@if.csic.es
Recibido: 2-XI-2009.
Aceptado: 14-XI-2009.