Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.26 no.3 Madrid Mai./Jun. 2011
Efecto del soporte nutricional sobre la supervivencia en pacientes con esclerosis lateral amiotrófica
Effect of nutritional support on survival in patients with amyotrophic lateral sclerosis
J. J. López Gómez1, M.a D. Ballesteros Pomar1, F. Vázquez Sánchez2, A. Vidal Casariego1, A. Calleja Fernández1 y I. Cano Rodríguez1
1Sección de Endocrinología y Nutrición.
2Sección de Neurología. Complejo Asistencial de León. España.
Dirección para correspondencia
RESUMEN
Introducción: La desnutrición influye en la morbimortalidad del paciente con ELA. La unidad de nutrición debe evaluar al paciente precoz y periódicamente ofreciendo las medidas necesarias en la evolución de la enfermedad.
Métodos: Estudio retrospectivo de cohortes en el que se analizaron 46 pacientes con diagnóstico de ELA, de los cuáles 21 se encontraban en tratamiento nutricional. Se estudió la edad, forma de inicio de la enfermedad, fecha de entrada en protocolo nutricional, la colocación o no de PEG, y la supervivencia. Se realizó un test de Breslow comparando pacientes que estuvieron en protocolo nutricional respecto de aquellos que no recibieron terapia nutricional, y de aquellos que entraron antes en protocolo respecto de los que entraron después.
Resultados: Existió un aumento en la mediana de supervivencia en los pacientes en tratamiento nutricional tanto en ELA bulbar (452 vs 55 días) como en ELA espinal (1.798 vs 357 días; p = 0,002). La mediana de retraso en el inicio de tratamiento nutricional en la ELA espinal fue de 557 días mientras que en la ELA bulbar fue de 230 días: en la ELA espinal los que entraron en protocolo nutricional antes de la mediana tuvieron una supervivencia de 325 días respecto a 181 días (p = 0,09); en la ELA bulbar los que entraron antes de la mediana tuvieron una supervivencia de 435 días respecto a 177 días (p = 0,38).
Conclusiones: La entrada de los pacientes con ELA en un protocolo nutricional conlleva un aumento de la supervivencia. Existe una ventaja en la evolución en los pacientes que comienzan antes el tratamiento nutricional.
Palabras clave: Esclerosis lateral amiotrófica. Nutrición. Gastrostomía endoscópica percutánea. Disfagia.
ABSTRACT
Introduction: Malnutrition affects morbidity and mortality of patients with ALS. The nutrition unit should evaluate these patients early and regularly providing the necessary steps in the evolution of the disease.
Methods: A retrospective cohort study in which we analyzed 46 patients diagnosed with ALS, 21 of them received nutritional therapy. We studied age, mode of onset, date of entry into a nutritional protocol, placement of PEG and survival. We performed a test of Breslow comparing patients who were at nutritional protocol with those not receiving nutritional support, and those who received early nutritional therapy with those with delayed nutrition.
Results: There was an increase in median survival for patients in nutritional therapy in bulbar ALS (452 vs 55 days) and in spinal ALS (1,798 vs 357 days) (p = 0.002). The median delay in the initiation of nutritional therapy in spinal ALS was 557 days while in bulbar ALS was 230 days. The survival in the spinal ALS of those who entered into nutritional protocol before the median survival was 325 days to 181 days (p = 0.09) while in bulbar ALS those who entered before had a median survival of 435 days to 177 days (p = 0.38).
Conclusions: The entry of patients with ALS in a nutritional protocol increases survival. There is an advantage in the evolution of patients with early nutritional treatment.
Key words: Amyotrophic lateral sclerosis. Nutrition. Percutaneous endoscopic gastrostomy. Dysphagia.
Abreviaturas
ELA: Esclerosis lateral amiotrófica.
PEG: Gastrostomía endoscópica percutánea.
GRI: Gastrostomía radiológicamente insertada.
Introducción
La esclerosis lateral amiotrófica (ELA) es una enfermedad neurológica degenerativa que se produce por una alteración de las neuronas de la vía piramidal lo que da lugar a distintos trastornos motores que van apareciendo de manera progresiva. Se distinguen dos tipos de ELA en función de su forma de inicio: una ELA espinal que se inicia con trastornos motores a nivel de extremidades y una ELA bulbar con trastornos motores a nivel de pares craneales1.
La ELA esporádica tiene una incidencia en países occidentales de entre 1,5-2,7 casos nuevos por 100.000 personas/año (en España 1 caso nuevo por 100.000 personas/año)2 con una prevalencia de entre 2,7-7,4 por 100.000 personas (en España 3,5 casos por 100.000 habitantes)2. La distribución es similar en hombres y mujeres, dándose en edades entre 55 y 65 años. La mortalidad varía entre 1,45-2,55 por 100.000 personas/año. La supervivencia media en estos pacientes desde el diagnóstico es de entre 2 y 5 años34. Aunque la mayoría de los casos son esporádicos un 5% de los pacientes con ELA tienen un componente familiar con una herencia autosómica dominante con alta penetrancia5.
Esta enfermedad se caracteriza por una pérdida de fuerza y del tono de la masa muscular, disminuyendo la misma por las consecuentes alteraciones tróficas y por un estado de malnutrición más o menos temprana.
El tratamiento de esta enfermedad puede ser: a) etiológico, basado en el control de la excitotoxicidad sobre las neuronas que produce el daño, con resultados bastantes discretos sobre el pronóstico6; b) sintomático, en el que tienen especial importancia el soporte respiratorio y nutricional7.
La malnutrición es frecuente en este tipo de pacientes caracterizada por una pérdida de peso en relación con la disminución de la ingesta: por la disfagia, anorexia, trastornos gastrointestinales o por debilidad en la extremidad superior; y, por otra parte, un aumento de los requerimientos energéticos por un hipercatabolismo paradójico8.
Este déficit nutricional incrementa la pérdida de masa magra y grasa acelerando la atrofia muscular, especialmente de la musculatura respiratoria, por otra parte ocasiona una disfunción del sistema inmune incrementando el riesgo de infecciones. Ambas situaciones desencadenan la muerte de manera más temprana9.
Se suele remitir a los pacientes afectos de ELA a la consulta de nutrición ante los primeros indicios de disfagia, lo que suele darse en la mayoría de los casos en fases muy avanzadas de la enfermedad.
Ante los datos expuestos se decidió estudiar si la nutrición influye en la evolución de la enfermedad, planteándonos los siguientes objetivos: 1) Demostrar que la intervención nutricional mejora la supervivencia en el paciente con ELA. 2) Demostrar que la entrada precoz en un protocolo nutricional mejora la supervivencia en pacientes con ELA. 3) Demostrar que la implantación de gastrostomía endoscópica percutánea (PEG) en pacientes con ELA mejora su evolución y supervivencia.
Material y métodos
Diseño del estudio
Se realizó un estudio observacional analítico retrospectivo de cohortes. Todos los pacientes se encontraban diagnosticados de ELA y se describió una cohorte de pacientes en seguimiento por el especialista en Endocrinología y Nutrición y otra cohorte de pacientes sin ese seguimiento. Dentro de los pacientes con nutrición se distinguió entre aquellos portadores de PEG y aquellos que no lo eran.
Pacientes
Los pacientes se reclutaron a partir del servicio de codificación del Complejo Asistencial de León estableciendo como criterio de selección el diagnóstico de esclerosis lateral amiotrófica. Se seleccionaron pacientes desde el año 1995 y, de estos, se excluyeron aquellos cuya supervivencia superaba el intervalo medio de supervivencia (24-60 meses), debido a que se suele tratar de casos que no se corresponden con la evolución natural de la enfermedad. Se estratificaron los pacientes en función de la forma de inicio de la ELA (bulbar o espinal).
Se encontraron un total de 46 pacientes de los cuales se seleccionaron 45 y se desechó 1 paciente. De estos 45 pacientes: 29 tenían diagnóstico de ELA espinal y 16 de ELA bulbar (fig. 1).
Se consideraron pacientes con nutrición aquellos que estuvieron en un protocolo nutricional durante un tiempo mayor de 30 días, de la misma manera consideramos portadores de PEG a los que la tuvieron al menos durante 30 días. Se acotó de esta manera porque la intervención nutricional en un período tan corto no influye en el pronóstico10,11,12,13.
Revisión de los pacientes
A partir de aquí se realizó una revisión sistemática de las historias clínicas de la que se obtuvieron: sexo; fecha de nacimiento; fecha de diagnóstico de la ELA (se tomó la fecha en la que en la historia clínica aparecía el diagnóstico cierto de ELA); fecha de inicio del tratamiento nutricional (se tomó como fecha aquella en la que se realiza la primera consulta con el especialista en Endocrinología y Nutrición); fecha de inicio de tratamiento con gastrostomía endoscópica percutánea (PEG) (en aquellos pacientes en tratamiento nutricional en los que se realizó PEG); última fecha (última fecha a la que se hacía referencia en la historia de neurología o nutrición); fecha de muerte (reflejada en el informe de exitus del paciente; en pacientes con un retraso de más de 6 meses sin causa justificada a la asistencia a la consulta, con mal estado general y/o derivación a centro de larga estancia se le considera fecha de exitus probable).
Análisis estadístico
En la estadística descriptiva de los datos recogidos de la historia se calcularon las medias y medianas de edad, de retraso en el inicio de la nutrición, en la implantación de la PEG y de supervivencia en todos los grupos.
La supervivencia se midió calculando los días en función del lapso de tiempo entre el diagnóstico y la última fecha reflejada en la historia o la fecha de éxitus en el caso de que la hubiese.
Se procedió a realizar un análisis de la supervivencia mediante el test de Breslow (Kaplan-Meier) de los datos obtenidos comparando: a) El grupo de pacientes en protocolo nutricional y los que no lo estaban. b) Dentro del grupo de pacientes con nutrición aquellos portadores de PEG y aquellos que no lo eran, c) Entre los pacientes en protocolo nutricional aquellos que entraron antes de la mediana de retraso de inicio de dicho protocolo y los que entraron después, para valorar si la entrada temprana mejoraba la supervivencia de los pacientes. Se analizó sobre el total de pacientes y estratificando en función del tipo de ELA (espinal o bulbar) ya que cada una tiene un pronóstico diferente.
Los resultados se expresan en forma de media (desviación estándar) y mediana. Se considera estadísticamente significativa un valor p < 0,05.
Resultados
Se analizaron un total de 45 pacientes (26 hombres y 19 mujeres), 29 pacientes (69,44%) padecían ELA espinal y 16 pacientes (35,56%) ELA bulbar. Un 46,67% de los pacientes entraron en protocolo nutricional y a un 11,11% se les implantó PEG: en ELA espinal 13 pacientes (2 pacientes con PEG) y en ELA bulbar 8 pacientes (3 pacientes con PEG).
La media de edad en pacientes con nutrición era de 63,37 (13,17) años [(ELA bulbar: 68,72 (9,22) años; ELA espinal: 59,66 (14,50) años] y en pacientes sin nutrición 68,44 (11,18) años [(ELA bulbar: 69,85 (7,69) años; ELA espinal: 67,73 (12,74) años)]. No se encontró diferencia significativa entre los distintos grupos (p = 0,165).
La mediana de retraso entre el diagnóstico y la primera consulta de Nutrición es de 230 días en los pacientes con ELA bulbar y de 557 días en ELA espinal. Entre estos pacientes los portadores PEG tienen un retraso en la implantación desde el diagnóstico de 933,40 (1.398,58) días [(en ELA bulbar 255,75 (250,58) y en ELA espinal 1.385,17 (1.694,37) días)].
La media de supervivencia en pacientes con ELA que entraron en un protocolo nutricional durante más de 30 días fue 1.568,62 (388,80) días, con una mediana de 873 días (IC 95%: 494,5-1.251,5), mientras que en pacientes que no entraron la media fue 572,05 (136,05) y la mediana 214 días (IC 95%: 0-479,3, p = 0,013). La diferencia resultó significativa con p = 0,004.
Estratificando en función del tipo de ELA también existió una mejora en la supervivencia en pacientes con nutrición de manera significativa con p = 0,002 (tabla I). Observamos un aumento en la probabilidad de supervivencia en pacientes con ambos tipos de ELA dentro del grupo que estaban en protocolo nutricional (fig. 2).
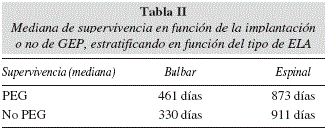
Dentro del grupo de pacientes en tratamiento nutricional se colocó PEG en 5 pacientes (2 en ELA espinal y 3 en ELA bulbar) y la tuvieron durante más de 30 días. Al comparar los datos con el resto de pacientes en tratamiento nutricional la mediana de supervivencia fue de 873 días respecto a 513 días en el grupo sin PEG (con y sin nutrición), aunque estos resultados fueron no significativos p = 0,258. Estratificando en función del tipo de ELA se observó una discreta mejoría en la supervivencia de los pacientes con ELA bulbar (tabla II), pero tampoco resultó significativo.
Entre los pacientes en tratamiento nutricional: a) En ELA bulbar la mediana de retraso de inicio del tratamiento fue de 230 días, aquellos que entraron antes de la mediana tuvieron una media de supervivencia de 806,5 (442,15) días respecto a 128,90 (41,82) días en los que entraron después (mediana: 435 vs 177 días). La diferencia no fue significativa p = 0,36. b) En ELA espinal la mediana de retraso de inicio del tratamiento fue de 557 días, aquellos que entraron antes de la mediana tuvieron una media de supervivencia de 1.024,5 (452,47) días respecto a 185,57 (64,91) días en los que entraron después (mediana: 325 vs 181 días). Los resultados tampoco fueron significativos p = 0,09 (fig. 3).
Discusión
El beneficio de la nutrición en el paciente con esclerosis lateral amiotrófica es un hecho contrastado y recomendado en las guías clínicas publicadas a este respecto14,15. Los objetivos de la intervención nutricional son, en primer lugar, asegurar las necesidades de energía, líquidos, vitaminas y minerales. En segundo lugar, prevenir las complicaciones de la disfagia como la aspiración7, para ello usamos las siguientes técnicas: a) Medidas higiénico-dietéticas, para aumentar la ingesta ante el hipercatabolismo existente y mejorar la deglución9: consejo dietético; consistencia de la comida; medidas mecánicas. b) Medidas intervencionistas, en pacientes con desnutrición severa: gastrostomía endoscópica percutánea (PEG) (requiere una capacidad vital mayor del 50% y un estado nutricional aceptable); gastrostomía radiológicamente insertada (GRI) (en aquellos pacientes con capacidad vital < 50% se ha mostrado más segura que la GEP y con beneficios en la supervivencia)16,27; sonda nasogástrica (en pacientes con mal estado general que no soportan una intervención más agresiva); nutrición parenteral (en el paciente en estado terminal, es una técnica segura y bien tolerada que estabiliza el peso y los parámetros nutricionales)17.
El objetivo de este estudio era comprobar el cumplimiento de las guías en nuestro centro e ir un paso más allá evaluando si la precocidad en la implantación de las distintas medidas (más o menos intervencionistas) puede ser un factor que influya en el pronóstico y, por lo tanto la supervivencia de los pacientes.
Este estudio nos ha ayudado a comprobar la situación de la enfermedad en el área de salud de León aunque no fuese el fin último del mismo. La distribución de la población con diagnóstico de ELA en León se corresponde con las características epidemiológicas en el resto de España2, con un ligero predominio en varones (26 hombres frente a 19 mujeres) y una media de edad en torno a los 65 años. Menos de la mitad de los pacientes estuvieron en seguimiento por un especialista en Nutrición, al no ser derivados o por ser derivados en etapas demasiado tardías de la evolución en las que la intervención nutricional ya no podía implicar un cambio en el pronóstico y la calidad de vida.
Entre los pacientes que fueron seguidos por el endocrinólogo el retraso de la derivación a la consulta fue muy elevado sobre todo en ELA espinal (557 días) siendo bastante menor en ELA bulbar (230 días), lo que se puede achacar a que el paciente es enviado con la aparición de las primeras manifestaciones de la disfagia (atragantamiento con los líquidos, tos con la ingesta...), cuya aparición y progresión es muy variable24. Este retraso en la derivación supone una mayor influencia de los factores que desencadenan la desnutrición, sobre todo en ELA espinal, lo que nos podría empeorar el pronóstico8.
Existe un aumento notable de la probabilidad de supervivencia en los pacientes que estuvieron en tratamiento nutricional respecto de los que no lo estuvieron con resultados altamente significativos. Para evitar el sesgo debido a la progresión irregular de la enfermedad se estratificaron los pacientes en dos grupos (ELA bulbar y ELA espinal) obteniendo un incremento en la supervivencia en ambos grupos. Esto demuestra la hipótesis del estudio y corrobora los datos de los distintos estudios realizados a este respecto18.
Dentro de los pacientes que entraron en protocolo nutricional, se valoró la utilidad de la entrada precoz en el mismo teniendo en cuenta la mediana de supervivencia en cada uno de los grupos. Se obtuvo una ventaja de la supervivencia en aquellos pacientes que entraron antes pero sin significación estadística, en relación probablemente con el escaso número de pacientes analizados (13 pacientes en ELA espinal y 8 pacientes en ELA bulbar).
No se pudieron comparar los diferentes parámetros nutricionales entre el grupo control y el grupo de estudio19, al no existir una valoración de éstos desde el diagnóstico. Tampoco se realizaron cuestionarios de calidad de vida para estimar la situación clínica y social del paciente y la influencia de la nutrición en ellas20.
Estos resultados plantean la necesidad de estandarizar la atención al paciente con ELA desde un punto de vista multidisciplinar en la cual la nutrición tiene un papel primordial, más teniendo en cuenta que el tratamiento etiológico con riluzole e IGF-1 recombinante no tiene un impacto importante en la supervivencia (2-3 meses) ni resulta coste-efectivo21. Se debería realizar la derivación al especialista en Nutrición al diagnóstico o en estadios iniciales de la enfermedad para evitar los efectos del hipercatabolismo y, sobre todo, antes de la aparición de la disfagia22. La disfagia es uno de los hechos que condiciona el pronóstico porque acelera el deterioro nutricional y da lugar a complicaciones, como la neumonía por aspiración que pueden provocar la muerte prematura. Normalmente aparece tarde y de manera muy variable en la ELA espinal, pero suele ser uno de los primeros síntomas en la ELA bulbar23,24. Es necesario detectar la disfagia de manera precoz para lo que se utiliza: la realización de una anamnesis detallada, test de disfagia basados en el uso de distintas sustancias de consistencia variable, la manometría esofágica y la videofluoroscopia que es el "gold standard"25,26.
Otra de las características estudiadas era valorar la influencia de la PEG en la supervivencia No existe ningún ensayo aleatorio controlado que demuestre que mejora la supervivencia pero se ha observado una ventaja en la misma en los portadores en estudios de cohortes prospectivos27. También ha demostrado que ayuda a la ingesta nutricional adecuada y la estabilización del peso28.
El número de pacientes a los que se les implantó PEG y la tuvieron más de 30 días fue muy escaso (5 pacientes (2 en ELA espinal y 3 en ELA bulbar)), con un retraso muy importante desde el diagnóstico y con la disfagia plenamente instaurada. Como consecuencia se obtuvieron resultados muy poco valorables de los que no se pueden sacar conclusiones significativas. La PEG es una técnica que, en esta enfermedad, tiene una utilidad contrastada asegurando la ingesta y manteniendo el peso, pero resultados muy dispares en cuanto a supervivencia y calidad de vida debido a la dificultad de realizar estudios con resultados consistentes22. Por otra parte el retraso de la PEG se puede relacionar con el potente componente psicológico de su implantación en el paciente en fases tempranas de la enfermedad donde podría tener un mayor impacto en la supervivencia. Esta situación nos lleva a una ejecución tardía de la técnica, en una fase avanzada de la enfermedad donde los efectos son más modestos y que incluso puede empeorar el curso de la misma29,30.
Las principales limitaciones de este estudio son por una parte las debidas a la evolución de la enfermedad al existir una gran dispersión en los datos de supervivencia; por otra parte las relacionadas con el escaso número de pacientes en protocolo nutricional.
Conclusiones
En conclusión, el soporte nutricional se asocia a un aumento de la supervivencia de los pacientes con ELA. Aunque se hace necesario un estudio prospectivo con un mayor número de casos en el que poder valorar de manera fehaciente que su intervención precoz y la implantación de gastrostomía endoscópica percutánea son actuaciones que pueden mejorar la supervivencia y la calidad de vida de estos pacientes.
Referencias
1. Andrews J. Amyotrophic lateral sclerosis: clinical management and research update. Curr Neurol Neurosci Rep 2009; 9 (1): 59-68. [ Links ]
2. Prieto Yerro I, García Ortiz T, Martín Martínez MT, Cortés Rubio JA, López Arteaga N. Guía para la atención de la esclerosis lateral amiotrófica (ELA) en España. Madrid: MSC; 2007. [ Links ]
3. Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. Preliminary report on geographic distribution, with special reference to the Mariana Islands, including clinical and pathological observations. Part 1. Neurology 1954; 4: 355-78. [ Links ]
4. Kurland LT, Mulder DW. Epidemiologic investigations of amyotrophic lateral sclerosis. Preliminary report on geographic distribution, with special reference to the Mariana Islands, including clinical and pathological observations. Part 2. Neurology 1954; 4: 355-78. [ Links ]
5. Andersen PM, Borasio GD, Dengler R, Hardiman O, Kollewe K, Leigh PM et al. EFNS task force on management of amyotrophic lateral sclerosis: guidelines for diagnosing and clinical care of patients and relatives. Eur J Neurol 2005; 12: 921-938. [ Links ]
6. Brooks BR. Managing amyotrophic lateral sclerosis: slowing disease progression and improving patient quality of life. Ann Neurol 2009; 65 (Suppl. 1): S17-23. [ Links ]
7. Hardiman O. Symptomatic treatment of respiratory and nutritional failure in amyotrophic lateral sclerosis. J Neurol 2000; 247: 245-251. [ Links ]
8. Bouteloup C, Desport JC, Clavelou P, Guy N, Derumeaux H, Ferrier A et al. Hypermetabolism in ALS patients: an early and persistent phenomenon. J Neurol [pendiente de publicación] 2009 [Citado el 2 de junio de 2009] Disponible en: URL: http://www.springerlink.com/content/1652602575571k33/. [ Links ]
9. Wijesekera LC, Leigh PN. Amyotrophic lateral sclerosis. Orphanet J Rare Dis. [edición electrónica] 2009 [citado 15 mayo 2009]; 4:3. Disponible en URL: http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=19192301 [ Links ]
10. Mazzini L, Corrà T, Zaccala M, Mora G, Del Plano M, Galante M. Percutaneous endoscopic gastrostomy and enteral nutrition in amyotrophic lateral sclerosis. J Neurol 1995; 242: 695-8. [ Links ]
11. Kasarkis EJ, Scarlata D, Hill R, Fuller C, Stambler N, Cedarbaum JM. A retrospective study of percutaneous endoscopic gastrostomy in ALS patients during the BDNF and CTNF trials. J Neurol Sci 1999; 169 (1-2): 118-25. [ Links ]
12. Chiò A, Galletti R, Finocchiaro C, Righi D, Ruffino MA, Calvo A, et al. Percutaneous radiological gastrostomy: a safe and effective method of nutritional tube placement in advanced ALS. J Neurol Neurosurg Psychiatry 2004; 75 (4): 645-7. [ Links ]
13. Borasio GD, Voltz R. Palliative care in amyotrophic lateral sclerosis. J Neurol 1997; 244 (Suppl. 4): S11-7. [ Links ]
14. Ludolph AC. 135th ENMC International Workshop: Nutrition in Amyotrophic Lateral Sclerosis 18-20 of March 2005, Naarden, The Netherlands. Neuromuscul Disord 2006; 16: 530-538. [ Links ]
15. Andersen PM, Borasio GD, Dengler R, Hardiman O, Kollewe K, Leigh PM et al. Good practice in the management of amyotrophic lateral sclerosis: clinical guidelines. An evidence-based review with good practice points. EALSC Working Group. Amyotroph Lateral Scler 2007; 8: 195-213. [ Links ]
16. Chio A, Bottachi E, Buffe C, Mutani R, Mora G. Possitive effects of ALS tertiary centres on outcome and use of hospital facilities. J Neurol Neurosurg Psichiatry 2006; 77: 948-950. [ Links ]
17. Verschueren A, Monnier A, Attarian S, Lardillier D, Pouget J. Enteral and parenteral nutrition in the later stages of ALS: an observational study. Amyotroph Lateral Scler 2009; 10: 42-46. [ Links ]
18. Hefferman C, Jenkinson C, Holmes T, Feder G, Kupfer R, Nigel Leigh, Mc Gowan et al. Nutritional management in MND/ALS patients: an evidence based review. Amyotroph Lateral Scler Other Motor Neuron Disord 2004; 5 (2): 72-83. [ Links ]
19. Rio A, Cawadias E. Nutritional advice and treatment by dietitians to patients with amyotrophic lateral sclerosis/motor neurone disease: a survey of current practice in England, Wales, Northern Ireland and Canada. J Hum Nutr Diet 2007; 20: 3-13. [ Links ]
20. Bromberg MB. Quality of life in amyotrophic lateral sclerosis. Phys Med Rehabil Clin N Am 2008; 19 (3): 591-605. [ Links ]
21. Ginsberg G, Lowe S. Cost effectiveness of treatments for amy-otrophic lateral sclerosis: a review of the literature. Pharmacoeconomics 2002; 20 (6): 389-91. [ Links ]
22. Desport JC, Preux PM, Truong TC, Vallat JM, Sautereau D, Couratier P. Nutritional status is a prognostic factor for survival in ALS patients. Neurology 1999; 53: 1059. [ Links ]
23. Kühnlein P, Gdynia HJ, Sperfeld AD, Lindner-Pfleghar B, Ludolph AC, Prosiegel M et al. Diagnosis and treatment of bul-bar symptoms in amyotrophic lateral sclerosis. Nat Clin Pract Neurol 2008; 4 (7): 366-74. [ Links ]
24. Ryuzaburo H, Tayama N, Takaharu N. Longitudinal analysis of progression of dysphagia in amyotrophic lateral sclerosis. Auris Nasus Larynx 2004; 31: 247-254. [ Links ]
25. Clavé P, Arreóla V, Romea M, Medina L, Palomera E, Serra-Prat M. Accuracy of the volumen-viscosity swallow test for clinical screening of oropharyngeal dysphagia and aspiration. Clin Nutr 2008; 27: 806-15. [ Links ]
26. Clavé P, Terré R, Kraa M, Serra M. Approaching oropharyngeal dysphagia. Rev Esp Enferm Dig 2004; 2: 119-31. [ Links ]
27. Langmore SE, Kasarskis EJ, Manca ML, Olney RK. Enteral 30. tube feeding for amyotrophic lateral sclerosis/motor neuron disease. Cochrane Database Syst Rev 2006; (4): CD004030. [ Links ]
28. Klor BM, Milianti FJ. Rehabilitation of neurogenic dysphagia with percutaneous endoscopic gastrostomy. Dysphagia 1999; 14 (3): 162-4. [ Links ]
29. Forbes RB, Colville S, Swingler RJ. Frequency, timing and outcome of gastrostomy tubes for amyotrophic lateral sclerosis/ motor neurone disease. J Neurol 2004; 251: 813-817. [ Links ]
30. Cline D. Nutrition Issues and tools for Palliative Care. Home Healthc. Nurse 2006; 24 (1): 54-7. [ Links ]
![]() Correspondence:
Correspondence:
Juan José López Gómez.
Sección de Endocrinología y Nutrición.
Complejo Asistencial de León.
Altos de Nava, s/n.
24008 León. España.
E-mail: jjlopez161282@hotmail.com
Recibido: 3-XI-2009.
Aceptado: 22-XI-2009.