Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.26 no.4 Madrid Jul./Ago. 2011
Citrulina plasmática como marcador de pérdida de masa enterocitaria en la enfermedad celíaca en la infancia
Plasma citrulline as a marker of loss of enterocitary mass in coeliac disease in childhood
J. Blasco Alonso, J. Serrano Nieto, V. M. Navas López, A. Barco Gálvez, I. Vicioso, B. Carazo Gallego, P. Ortiz Pérez y C. Sierra Salinas
Sección de Gastroenterologia y Nutrición Infantil. Servicio de Pediatría Hospital Materno-Infantil. Hospital Regional Universitario Carlos Haya. Málaga. España.
Dirección para correspondencia
RESUMEN
Introducción: La citrulina plasmática no está incorporada a las proteínas endógenas ni exógenas y constituye un teórico marcador de la atrofia vellositaria. El objetivo del estudio es relacionar los niveles plasmáticos de citrulina y arginina con la severidad de la afectación de la mucosa intestinal en pacientes celiacos.
Material y métodos: Estudio transversal de cohortes en niños entre 16 meses y 14 años: 46 con enfermedad celíaca al diagnóstico; 9 celíacos siguiendo dieta sin gluten y 42 controles. Se determina concentración plasmática de aminoácidos, en mmol/L, y variables clínicas y analíticas asociadas.
Resultados: No diferencias estadísticamente significativas en IMC, edad o función renal, con ligero incremento de esteatorrea en celíacos. Citrulina, arginina y glutamina plasmáticas significativamente más bajas en los casos (17,7 μmol/l, 38,7 μmol/l, 479,6 μmol/l respectivamente) que en controles (28,9 μmol/l, 56,2 μmol/l, 563,7 μmol/l). Citrulina plasmática significativamente más baja en grados avanzados de atrofia (13,8 μmol/l vs 19,7 μmol/l, p < 0,05), no así con el resto de aminoácidos.
Discusión: La medida postabsortiva de citrulina plasmática constituye buen marcador de reducción de masa enterocitaria en celíacos con atrofia vellositaria; secundariamente disminución también de arginina. Grados bajos de alteración histológica de la biopsia intestinal son suficientes como para diferenciar su citrulina de los controles y además se puede afirmar que grados altos de lesión histológica tienen menor citrulina plasmática que grados bajos.
Palabras clave: Citrulina plasmática. Enfermedad celíaca. Glutamina. Atrofia vellositaria. Infancia.
ABSTRACT
Introduction: Plasma citrulline is not incorporated in endogenous or exogenous proteins so it is a theoretical marker of villous atrophy. Our aim was to correlate plasma citrulline levels with severity of villous atrophy in celiac patients.
Methods: Observational case-control study longitudinal in children 16 month-old to 14 year-old: 48 with untreated celiac disease, 9 celiac children under gluten free diet and 35 non-celiac healthy children. Plasma amino acids concentration is determined, expressed in μmol/L, and so are other clinical and analytical data.
Results: No statistically significative difference found in the referring to BMI, age or renal function. Small increase in fecal fat in celiac children. Citrulline, arginine and glutamine are significantly lower in cases (17.7 μmol/l, 38.7 μmol/l, 479.6 μmol/l respectively) than in controls (28.9 μmol/l, 56.2 μmol/l, 563.7 μmol/l). Citrulline levels are significantly lower in the severe degrees of atrophy than in mild ones (13.8 μmol/l vs. 19.7 μmol/l, p < 0.05), not happening so with rest of amminoacids.
Summary: Postabsortive mean of plasma citrulline is a good marker of reduction in enterocyte mass in celiac patients with villous atrophy; secondary reduction in plasma arginine too. Just a small histological alteration in intestinal biopsy is enough to differentiate citrulline in cases and controls and besides it can be seen that high levels of atrophy present with lower plasma citrulline.
Key words: Celiac disease. Plasma citrulline. Glutamine. Enterocyte athrophy. Childhood.
Introducción
La citrulina se considera un aminoácido no esencial no proteico, sintetizado en la mucosa intestinal en animales a partir de la glutamina y aminoácidos derivados1. La citrulina se transforma en arginina en los túbulos renales2, las células endoteliales y los macrófagos. De acuerdo a esto, la citrulina plasmática se correlaciona directamente con la masa enterocitaria y además la insuficiencia renal provoca un aumento en sus niveles. Las concentraciones normales de citrulina plasmática están alrededor de 30-50 μmo/l, siendo discretamente menores en la infancia de acuerdo a la menor longitud intestinal3,4.
La enfermedad celíaca (EC) es hoy en día entendida como una enteropatía inmune que afecta al intestino delgado. La principal consecuencia fisiopatológica es un descenso en la superficie intestinal absortiva útil, por lo cual la biopsia intestinal es aún fundamental para demostrar la atrofia y por tanto hacer el diagnóstico de EC.
El intestino delgado es uno de los tejidos metabólicamente más activos del cuerpo. Junto con el hígado, bazo y estómago, son menos del 6% del peso corporal, pero son responsables de hasta un 50% del turnover de algunos aminoácidos5,6,7, siendo éstos el principal combustible para el enterocito8. En un estudio francés en seres humanos adultos4 se confirmó que el recambio proteico en la mucosa duodenal es alto y que los aminoácidos que ayudan a la síntesis proteica durante el ayuno tienen dos posibles orígenes: endoluminal y vascular. También probaron que la síntesis proteica no era diferente durante el ayuno y la alimentación, al menos en esas condiciones experimentales.
Diferentes estudios demostraron que la pérdida de longitud de intestino delgado derivaba en una disminución de la citrulina sérica: rechazo agudo tras trasplante intestinal2,9,10, intestino corto10,11,12 y daño intestinal por irradiación12. Se ha estudiado en EC en adultos por Crenn en 200313, describiendo que la atrofia vellositaria causa un descenso en la citrulina plasmática.
El objetivo de este estudio es determinar la correlación de la citrulina y la arginina plasmáticas con la lesión/atrofia enterocitaria en la celiaquía.
Métodos
Población de estudio
Cuarenta y dos niños sanos como grupo control A, 9 pacientes celíacos estables bajo dieta sin gluten con marcadores serológicos negativos como un grupo control B (A+B es el grupo control C), 28 niños celíacos clasificados como leves de acuerdo a la biopsia intestinal como grupo de casos D, 18 pacientes celíacos clasificados como grave atrofia como un grupo de casos E (D+E son un grupo de casos F).
Se recogieron diversos datos, incluyendo clínicos (sexo, edad, peso, talla, índice de masa corporal (IMC)) y analíticos tras ayuno de una noche entera (proteínas totales, albúmina, aminoácidos plasmáticos como glutamina, citrulina, arginina e isoleucina, por cromatografía de intercambio líquido; creatinina, anticuerpos antigliadina-IgA, transglutaminasa-IgA y antiendomisio- IgA; grasa en heces de 24 horas por espectrofotometría cercana al infrarrojo (FENIR)). Los anticuerpos antitransglutaminasa son de clase Ig A y se determinan por ELISA utilizando transglutaminasa recombinante humana como fuente antigénica (EUROSPITAL EutTG IgA). Los AAE-IgA (anticuerpos antiendomisio tipo IgA) se determinaron por método de inmunofluorescencia indirecta considerándose positivo a partir de diluciones de 1:5. Según recomendación del fabricante se considera valores positivos cifras > 16 U/ml, con zona dudosa entre 9 y 16 U/ml y valores negativos < 9 U/ml. Se realizó una evaluación histológica de la mucosa intestinal dando a cada muestra una puntuación en base a la clasificación de Marsh. Finalmente, los casos fueron agrupados en atrofia leve (Marsh 1, 2 y 3a) o grave (Marsh 3b y 3c).
Se obtuvo consentimiento informado de todos los padres de los participantes. El estudio fue aprobado por el Comité de Ética de nuestro hospital.
Estadísticas
Se realizó un análisis descriptivo bajo estimación puntual y con intervalos de confianza para un 95% de seguridad, expresando las variables continuas como media y desviación estándar y las variables categóricas como frecuencias y porcentajes; se aplicó el coeficiente de regresión para valorar la correlación entre citrulina e histología. Un análisis multivariado intermedio de la distribución poblacional de acuerdo a las variables interesantes se realizó mediante el test de t de Student. Intentamos establecer puntos de corte para citrulina y arginina séricas que fueran predictivos de pérdida de masa enterocitaria: se hicieron distintos puntos de corte pero sólo se muestran los resultados de un punto de corte de citrulina de 20 μmol/l.
Resultados
No hay diferencia en lo referente al sexo, con porcentajes similares de varones (48,5%) y mujeres (51'5%). En cuanto a la edad ambos grupos son similares (media de 3,3 años en los casos y 4,9 años en los controles). No hay diferencia estadísticamente significativa en lo referente a IMC (15,9 kg/m2 en los casos y 16,5 kg/m2 en los controles). La grasa fecal de 24 horas en los pacientes con EC es4 g/24 h (considerando normal < 3,5g/24 h) comparado con 2,2 g/24 h en los controles (tabla I). La creatinina es similar en ambos grupos (0,34 mg/dl en casos y 0,38 mg/dl en controles), así como las proteínas totales y la albúmina.
En las tablas I y II podemos ver los niveles medios de los principales aminoácidos analizados. Comparando los casos y los controles, la glutamina es discretamente menor en los primeros (479,6 μmol/l y 563,7 μmol/l respectivamente, p = 0,005), pero con un coeficiente de regresión de Pearson de 0,28 (p < 0,05). Sin embargo no hay diferencia estadísticamente significativa en cuanto a la glutamina entre los celíacos con atrofia leve (480,4 μmol/l) y los de atrofia grave (478,5 μmol/l). La citrulina plasmática media de 17,7 μmol/l en los pacientes EC es significativamente menor que en los controles que tienen una citrulinemia media de 28,9 μmol/l (p = 0,0001), con un coeficiente de regresión de Pearson de 0,52 (p < 0,05). En los casos con atrofia vellositaria grave la citrulina es significativamente menor que en aquellos con atrofia leve (13,8 μmol/l y 19,7 μmol/l respectivamente, p = 0,016) (fig. 3). Lo mismo ocurre cuando se analiza la arginina, siendo menor en los casos que en los controles (38,7 μmol/l vs 56,2 μmol/l, p = 0,0001), aunque similar en ambos grupos de atrofia (39,8 μmol/l y 38,6 μmol/l).
Analizando los otros aminoácidos, aquellos derivados de la glutamina sin formar citrulina (glutamato, ornitina, prolina) no presentan diferencias estadísticamente significativas entre casos y controles. El aminoácido esencial isoleucina es similar en ambos grupos (50,1 μmol/l y 56,7 μmol/l).
De acuerdo a la alteración histológica de la biopsia intestinal la distribución es como sigue: MARSH 1 y 2, 7 casos; MARSH 3a, 21 casos; MARSH 3b and 3c, 18 casos (fig. 1). Se puede ver que la concentración media de citrulina plasmática en los controles es significativamente mayor que en aquellos niños con algún tipo de alteración histológica (fig. 3). Sólo hay diferencia estadísticamente significativa entre la atrofia vellositaria grave (MARSH 3b y 3c) y leve en lo referente a la citrulina plasmática (a mayor alteración histológica, menor nivel de citrulina plasmática), no ocurriendo así con las otras variables analizadas (figs. 2 y 3). Agrupando todos los grados de alteraciones histológicas hay una diferencia entre arginina, isoleucina y grasa fecal comparando casos y controles.
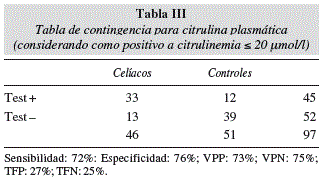
Si seleccionamos 20 μmol/l como un punto de corte de citrulina plasmática para detectar atrofia vellositaria, tenemos la tabla de contingencia representada en la tabla III. Por sí misma sola tiene una sensibilidad del 72% en indicar atrofia vellositaria con una especificidad de 76%, valor predictivo positivo de 73% y valor predictivo negativo de 75% (tasa de falsos positivos del 27% y de falsos negativos del 25%).
Discusión
En primer lugar queríamos comprobar si había alguna diferencia estadísticamente significativa entre niños sanos normales a los que se les determinaban marcadores indirectos de enfermedad intestinal (42 sujetos) y niños previamente diagnosticados de enfermedad celíaca que estuvieran bajo una dieta sin gluten estricta y prolongada durante más de 12 meses con marcadores serológicos negativos y grasa fecal normal (9 sujetos). Todos los parámetros analizados eran similares en ambos por lo que los hemos agrupado como grupo control (51 sujetos).
De acuerdo a la similar edad media de ambos grupos podemos asumir que las diferencias encontradas no serán influenciadas por ella. Dado el precoz y extendido uso de los marcadores serológicos de EC en la práctica habitual, la mayoría de los pacientes se diagnostican antes de que él IMC se vea afectado, lo que podría explicar que no exista diferencia en este parámetro entre los casos y los controles en este estudio. La grasa fecal de 24 horas en los pacientes EC es discretamente mayor que en los controles, indicando un discreto grado de mala absorción en los primeros. Hace algunos años atendíamos pacientes con mayor grado de mala absorción debido al retraso en el diagnóstico. La función renal es normal en ambos grupos (expresada como valores de creatinina plasmática), así que las diferencias en los niveles de citrulina no se deben a insuficiencia renal, que limitaría la transformación de la citrulina en arginina en los riñones14. (fig. 4)
Los aminoácidos plasmáticos elegidos para el análisis son citrulina (sintetizada en el enterocito), arginina (sintetizada en los riñones, en gran parte, a partir de la citrulina), glutamina (precursor de la citrulina) e isoleucina (aminoácido que pudiera estar relacionado con la ingesta proteica al ser un aminoácido esencial no metabolizado en el enterocito).
En algunos estudios se ha probado que la citrulina es similar en los pacientes que sufren de anorexia nerviosa y personas sanas, ya que la malnutrición proteico calórica no dependiente de fallo intestinal sino de baja ingesta no causa pérdida de masa enterocitaria13. La citrulina el arginina se convierten en aminoácidos esenciales en el fallo intestinal permanente (resecciones extensas...). Los pacientes celíacos normalizan el daño intestinal tras la dieta sin gluten, por lo que en la citrulina plasmática alcanza niveles normales posteriormente, como hemos comprobado en los nueve pacientes celíacos sin gluten más de un año con biopsia normal (29,7 mmol/l).
Entre MARSH 1-2 y MARSH 3a no hay diferencia significativa en ningún parámetro analizado, por lo que podemos asumir que ambos grupos son similares en los análisis estadísticos, siendo nombrados como atrofia leve. Los grados elevados de atrofia (MARSH 3b y 3c) se han tomado como atrofia grave para el análisis estadístico.
Como la glutamina es más baja en los pacientes celíacos no tratados con atrofia, asumimos que hay ciertas diferencias en la ingesta proteica o al menos en su digestión o absorción en el intestino; aunque, si comparamos con los valores normales de referencia, se puede ver que sus niveles están en el rango normal (420-730 μmol/l), por lo que no hay un déficit real para este aminoácido. En los pacientes con enfermedad celíaca, la glutamina se podría convertir en un aminoácido esencial, dado que estamos en una situación de daño mucoso que hay que tratar, al ser el inicio de diferentes reacciones bioquímicas, y podemos apreciar que, aunque no desciende a niveles que obliguen a un suplemento externo, deberíamos monitorizarlos ya que en algunos pacientes podría estar tan descendida que fuera necesario un aporte extra.
La citrulina es significativamente menor en los casos que en los controles y además su valor está bajo los niveles considerados como normales (18-35 μmol/l)3 y ocurre lo mismo con los casos de atrofia grave en los que la citrulina desciende de forma significativa. Por ello podemos afirmar que hay una correlación entre la pérdida de masa enterocitaria en la enfermedad celíaca en la infancia y el descenso de producción de citrulina, como ya fue publicado en adultos por Crenn13.
La arginina plasmática también está disminuida significativamente en los casos, lo que se explica por su menor síntesis en los riñones a partir de una menor citrulina circulante, mientras que la función renal sea mantenida normal, lo que debe comprobarse en todos los pacientes. Sin embargo, una vez que los niveles descienden en los pacientes con atrofia, no hay correlación directa con el grado de la misma por lo que no es un buen parámetro para estimar el nivel de daño intestinal.
La isoleucina no es significativamente menor en celíacos, indicando similar ingesta proteica en nuestros pacientes al no estar gravemente afectados clínicamente debido a un diagnóstico precoz como ya se explicó arriba (IMC normal y ligero síndrome malabsortivo) aunque un registro dietético que reflejara la ingesta proteica hubiera sido lo ideal para hacer esta afirmación.
La lesión intestinal en la atrofia leve es suficiente para diferenciar los niveles de citrulina de los controles y puede afirmarse que los grados elevados de atrofia tienen menor citrulina que los leves, no siendo así con el resto aminoácidos.
La citrulina como un predictor de atrofia vellositaria tiene una sensibilidad y especificidad no muy elevadas (72% y 76% respectivamente) por sí sola si consideramos 20 μmol/l como punto de corte. Tiene la capacidad de identificar como pacientes con atrofia (citrulina < 20 μmol/l) al 73% de aquellos con atrofia verdadera y como niños sanos (citrulina > 20 μmol/l) al 75% de los que realmente lo son. Podemos afirmar que como marcador único no es suficientemente bueno para diagnosticar a pacientes celíacos pero que junto con autoanticuerpos y otros test (grasa fecal ) podemos aumentar su sensibilidad y especificidad.
Todo esto demuestra que la citrulina plasmática es un buen marcador de daño intestinal en lo referente a pérdida de más entero citaría, siendo otro parámetro analítico útil para la evaluación del niño celíaco especialmente en los casos en los que la biopsia intestinal no se realice.
Referencias
1. Wu G. Synthesis of citrulline and arginine from proline in enterocytes of postnatal pigs. Am J Physiol 1997; 272: G1382-G1390. [ Links ]
2. David AI, Gaynor JJ, Zis PP, Conanan L, Goldsmith L, Esquenazi V et al. An association of lower serum citrulline levels within 30 days of acute rejection in patients following small intestine transplantation. Transplant Proc 2006; 38: 1731-2. [ Links ]
3. Crenn P, Coudray-Lucas C, Thuillier F, Cynober L, Messing B. Postabsorptive Plasma Citrulline Concentration Is a Marker of Absorptive Enterocyte Mass and Intestinal Failure in Humans. Gastroenterol 2000; 119: 1496-1505. [ Links ]
4. Bouteloup-Demange C, Boirie Y, Déchelotte P, Gachon P, Beaufrére B. Gut mucosal protein synthesis in fed and fasted humans. Am J Physiol 1998; 274: E541-E546. [ Links ]
5. Stoll B, Henry J, Reeds PJ, Yu H, Jahoor F, Burrin DG. Catabolism dominates the first-pass intestinal metabolism of dietary essential amino acids in milk protein-fed piglets. J Nutr 1998; 128: 606-614. [ Links ]
6. Wu G, Flynn NE, Knabe DA. Enhanced intestinal synthesis of polyamines from proline in cortisol-treated piglets. Am J Physiol 2000; 279: E395-E402. [ Links ]
7. Wu G. Intestinal Mucosal Amino Acid Catabolism. J Nutr 1998; 128: 1249-1252. [ Links ]
8. Alpers DH. Is glutamine a unique fuel for small intestinal cells? Current Opinion in Gastroenterol 2000; 16: 155-159. [ Links ]
9. Gondolesi GE, Kaufman SS, Sansaricq C, Magid MS, Raymond K, Iledan LP et al. Defining normal plasma citrulline in intestinal transplant recipients. Am J Transplant 2004; 4: 414-418. [ Links ]
10. Pappas PA, Saudubray JM, Tzakis AG, Rabier D, Carreno MR, Gómez-Marín O et al. Serum citrulline and rejection in small bowel transplantation: a preliminary report. Transplantation 2001; 72: 1212-1216. [ Links ]
11. Picot D, Garin L, Trivin F, Kossovsky MP, Darmaun D, Thibault R. Plasma citrulline is a marker of absorptive small bowel length in patients with transient enterostomy and acute intestinal failure. Clin Nutr 2010; 29: 235-42. [ Links ]
12. Lutgens LC, Deutz NE, Gueulette J, Cleutjens JP, Berger MP, Wouters BG et al. Citrulline: a physiologic marker enabling quantitation and monitoring of epithelial radiation-induced small bowel damage. Int J Radiat Oncol Biol Phys 2003; 57: 1067-1074. [ Links ]
13. Crenn P, Vahedi K, Lavergne-Slove A, Cynober L, Matuchan-sky C, Messing B. Plasma Citrulline: A Marker of Enterocyte Mass in Villous Atrophy-Associated Small Bowel Disease. Gastroenterology 2003; 124: 1210-1219. [ Links ]
14. Luiking YC, Steens L, Poeze M, Ramsay G, Deutz NE. Low plasma arginine concentration in septic patients is related to diminished de novo arginine production from citrulline. Clin Nutr 2003; 22: S26. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier Blasco Alonso.
Avda. Arroyo de los Ángeles, s/n.
29011 Málaga. España.
E-mail: javierblascoalonso@yahoo.es
Recibido: 4-VII-2010.
1a Revisión: 29-VIII-2010.
2a Revisión: 19-IX-2010.
Aceptado: 22-IX-2010.