Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.26 no.6 Madrid nov./dic. 2011
El entrenamiento de fuerza reduce la acidosis metabólica y la hipertrofia hepática y renal consecuentes del consumo de una dieta hiperproteica en ratas
Resistance training reduces the metabolic acidosis and hepatic and renal hypertrophy caused by the consumption of a high protein diet in rats
V. A. Aparicio1,2, E. Nebot1, G. Kapravelou1, C. Sánchez1, J. M. Porres1, M. López Jurado1 y P. Aranda1
1Departamento de Fisiología e Instituto de Nutrición y Tecnología de los Alimentos. Facultad de Farmacia. Universidad de Granada. Granada. España.
2Departamento de Educación Física y Deportiva. Facultad de Ciencias de la Actividad Física y del Deporte. Universidad de Granada. Granada. España.
El presente estudio ha sido en parte financiado por el proyecto 2007/20SVC del Centro Andaluz de Medicina Deportiva, por el proyecto DEP2008-04376 del Ministerio de Ciencia e Innovación, y por becas del Ministerio de Ciencia e Innovación del Gobierno de España (BES-2009-013442) y del Plan Propio de Investigación de la Universidad de Granada.
Dirección para correspondencia
RESUMEN
Introducción: El consumo de dietas hiperproteicas (HP) podría tener un efecto adverso sobre la acidosis metabólica y la salud hepática y renal. Sin embargo, existen pocos estudios que analicen los efectos del entrenamiento de fuerza sobre los parámetros sensibles de ser alterados por dichas dietas.
Material y métodos: Un total de 32 ratas Wistar adultas fueron distribuidas de forma aleatoria en 4 grupos experimentales (n = 8): dieta normoproteica o HP, con o sin entrenamiento de fuerza. Las dietas estuvieron basadas en un hidrolizado de proteína de lactosuero (whey). Tras 90 días de diseño experimental los animales fueron sacrificados para los posteriores análisis.
Resultados y discusión: El consumo de una dieta HP provocó acidosis metabólica (hipercalcemia e hipocitraturia urinarias, acidificación del pH urinario y niveles elevados de urea plasmática), (P < 0,05), e incremento del peso de hígado y riñón (P < 0,001). Así mismo, tras el consumo de dicha dieta HP, se redujeron los depósitos de tejido adiposo y los niveles plasmáticos de colesterol y triglicéridos (P < 0,05). El entrenamiento de fuerza mostró un efecto tamponador protector especialmente significativo en la reducción del peso del hígado, riñones, niveles de urea plasmática y triglicéridos plasmáticos y hepáticos (P < 0,001).
Conclusiones: El entrenamiento de fuerza redujo la acidosis metabólica y la hipertrofia hepática y renal ocasionada por la ingesta de una dieta HP en ratas a la vez que mejoró el perfil lipídico plasmático y hepático.
Palabras clave: Dieta hiperproteica. Dieta normoproteica. Entrenamiento de fuerza. Acidosis metabólica. Perfil lipídico.
ABSTRACT
Introduction: High protein (HP) diet consumption may adversely affect metabolic acidosis and hepatic and renal health. Despite such potentially adverse effect, there are only few studies analyzing the effects of resistance training on the parameters that could be altered by such diets.
Material and methods: A total of 32 adult male Wistar rats were randomly distributed in 4 experimental groups (n = 8): normoprotein or HP diets, with or without resistance training. Diets were based on a whey protein hydrolyzate, and the experimental period lasted for 90 days.
Results and discussion: Consumption of HP diets and resistance training significantly affected food intake, body composition and plasmatic levels of total cholesterol and triglycerides. Consumption of HP diets led to a considerable increase in liver and kidney weight (P < 0.001), urinary volume and acidity, as well as in the urinary excretion of Ca, with a parallel reduction in the urinary excretion of citrate (P < 0.05). The buffering action of resistance training on such diet-induced alterations was especially evident in the levels of hepatic and plasma triglycerides, plasmatic urea, and in liver and kidney weight (P < 0.001).
Conclusion: Resistance training had a protective action against alterations of hepatic and renal health status and some metabolic parameters like hepatic and plasma triglycerides.
Key words: High protein diet. Normo-protein diet. Resistance training. Metabolic acidosis. Lipid profile.
Abreviaturas
HP: Hiperproteica.
NP: Normoproteica.
LDL: Low Density Lipoprotein (lipoproteína de baja densidad).
HDL: High Density Lipoprotein (lipoproteína de alta densidad).
MCP-1: Renal monocyte chemoattractant protein-1.
N: Nitrógeno.
EEM: Error Estándar de la Media.
Ca: Calcio.
ANOVA: Análisis de la varianza.
MS: Materia Seca.
Introducción
Los posibles efectos adversos que una dieta hiperproteica (HP) pudieran ocasionar sobre la salud continúan sin ser completamente esclarecidos1. Las dietas HP producen un descenso de la energía total ingerida, favorecen la pérdida de peso, reducen el acúmulo de grasa y mejoran el perfil lipídico plasmático2,3. De hecho, tras varios meses consumiendo una dieta HP no asociada a altas fuentes lipídicas (como pueden ser los productos cárnicos), las concentraciones de colesterol total, colesterol LDL y triglicéridos se reducen2,3.
Los suplementos proteicos basados en hidrolizados de lactosuero (también denominados suplementos de "proteína whey") han ganado en popularidad en los últimos años, especialmente entre personas interesadas en conseguir ganancias de masa y fuerza muscular4. Estudios desarrollados en humanos5-8 y roedores3,9-10 han demostrado la capacidad de dicha proteína para favorecer mejoras en la composición corporal, incrementando la masa muscular y reduciendo la deposición de grasa y el peso corporal. Sumado a esto, la proteína de lactosuero parece incrementar la sensibilidad a la insulina9. Parte de los efectos beneficiosos de dichas dietas suelen ocasionarse como consecuencia de una reducción de la ingesta9,11, y de ahí que haya una pérdida de peso al reducirse el aporte energético total de la dieta.
Sin embargo, a pesar de estas virtudes, un exceso de proteína de origen animal, como es la de lactosuero, en principio más ácida por su mayor contenido en sulfuros contenidos en los aminoácidos, ocasionaría acidosis metabólica que podría comprometer a largo plazo la salud renal12. De hecho, un reciente estudio ha encontrado daño histológico e hipertrofia en riñones de cerdos que consumieron una dieta HP durante 8 meses13.
En un estudio desarrollado en hombres adultos sanos, tras varios meses de consumo de una dieta HP, se detectó un aumento de la ratio de filtración glomerular, niveles plasmáticos elevados de urea, acido úrico y glucagón y niveles urinarios elevados de proteínas, albúmina y urea14. Sin embargo, a pesar de que el consumo a largo plazo de este tipo de dietas podría comprometer la salud renal, algunos autores sugieren que la hiperfiltración renal (el mecanismo propuesto como origen del daño renal) podría ser una respuesta adaptativa normal que acontece en respuestas a numerosas situaciones fisiológicas15. Hasta la fecha, se han comprobado los efectos beneficiosos de las restricciones proteicas sobre aquellas personas con insuficiencia renal o riesgo de formación de cálculos renales16, pero, sin embargo, en personas sanas, no se ha encontrado evidencia científica que demuestre un efecto adverso de las dietas HP sobre la función renal, al menos a corto plazo15,17.
El entrenamiento de fuerza incrementa notablemente la masa, fuerza y potencia muscular20, pero además, es una herramienta eficaz para reducir los niveles de grasa corporal, incrementando los niveles de colesterol HDL y disminuyendo los de colesterol LDL y triglicéridos21-23. Sumado a esto, el entrenamiento de fuerza podría reducir la inflamación renal y mejorar los niveles plasmáticos de albúmina y la filtración glomerular24-26.
Los estudios desarrollados en roedores han observado un notable incremento del peso del hígado tras el consumo de una dieta HP18,19. Por otra parte, el ejercicio aeróbico27 y especialmente el de fuerza28, parece disminuir los niveles de grasa en hígado en humanos. Además, el ejercicio físico ha demostrado reducir el estrés del retículo endoplasmático y la resistencia a la insulina en el tejido adiposo y hepático de ratas obesas29. Sumado a esto, en el estudio de Johnson et al.27 el ejercicio aeróbico regular redujo los lípidos hepáticos en personas obesas, incluso sin la pérdida paralela de peso.
Debido a que pretendemos valorar los potenciales efectos adversos del consumo de una dieta HP, y a que son múltiples las variables que buscamos controlar de la forma más objetiva y cuantitativa posible, el presente estudio ha sido diseñado en ratas. Los objetivos del estudio fueron los siguientes: 1) Examinar los efectos del consumo de altas dosis de proteína sobre la composición corporal, el perfil lipídico, parámetros de acidosis metabólica, renales y hepáticos en ratas; 2) Valorar los efectos de un programa de entrenamiento de fuerza adaptado a la rata sobre dichas variables, y su posible interacción con la dieta.
Material y método
Animales y diseño experimental
Un total de 32 ratas Wistar macho albinas fueron distribuidas en 4 grupos experimentales: grupo de ratas con dieta normoproteica (NP) y sedentarias, grupo NP con entrenamiento de fuerza, grupo HP sedentarias y grupo HP con entrenamiento de fuerza (8 ratas por grupo).
Los animales, con un peso inicial de 150 ± 8 g, fueron alojados desde el primer día del periodo de adaptación (una semana antes del comienzo del periodo experimental) en jaulas individuales de metabolismo diseñadas para la recogida por separado de heces y orina. Las jaulas estaban ubicadas en una habitación bien ventilada, termorregulada (21 ± 2oC), con un rango de humedad relativa de entre el 40 y el 60% y un ciclo inverso de luz de 12:12 horas (08:00-20:00 h). Durante todo el periodo experimental (90 días) los animales tuvieron pleno acceso al agua bidestilada, y consumieron los diferentes tipos de dietas ad libitum.
El peso de los animales fue registrado todas las semanas a la misma hora del día (08:00 de la mañana), tras 12 horas de ayunas. Así mismo, la cantidad de dieta diaria consumida por cada unos de los animales fue cuantificada.
A los 89 días del periodo experimental, una muestra de 12 horas de orina de cada animal fue recogida para su análisis bioquímico. Durante esas 12 horas, localizadas en el ciclo de oscuridad para hacerlas coincidir con el periodo previo al pesaje de los animales, el agua y la comida fueron retirados para evitar interferencias en la recogida debidas a que los animales suelen verter agua bidestilada y comida sobre la orina, lo que altera los marcadores urinarios. La orina fue posteriormente pesada y transferida a tubos graduados para el análisis del pH, volumen, calcio y citrato urinarios.
Al final del periodo experimental los animales fueron anestesiados con pentobarbital y desangrados mediante canulación de la arteria aorta abdominal. La sangre fue extraída (con heparina como anticoagulante) y centrifugada a 3.000 rpm durante 15 minutos para separar el plasma, que fue congelado en Nitrógeno (N) líquido y conservado a -80o. La grasa parda y blanca fue extraída y pesada. Los riñones y el hígado fueron extraídos, pesados y congelados inmediatamente en N líquido. Para analizar el efecto de las distintas intervenciones sobre la grasa y la masa muscular, que pudieran verse afectadas por el entrenamiento (posibles ganancias de masa muscular y pérdida de masa grasa) o la dieta (pérdida de grasa debida a la dieta HP), se cuantificó el peso de la carcasa del animal. La carcasa corresponde al peso del animal tras ser sacrificado y desangrado, sin piel, grasa, cabeza, extremidades ni vísceras.
Todos los experimentos fueron desarrollados de acuerdo a la Guía Europea de Alojamiento y Cuidado Animal (European Community Council, 1986)30 y todos los procedimientos que se han llevado a cabo en el presente estudio han sido aprobados por el Comité Ético de Experimentación Animal de la Universidad de Granada.
Determinaciones analíticas
Previamente al análisis de las dietas y el hidrolizado proteico empleado en las mismas, toda la materia fue llevada a peso constante en un horno a 105 ± 18o C. El contenido en N total del suplemento de hidrolizado proteico de lactosuero fue determinado mediante el método de Kjeldahl. El contenido en proteína cruda fue calculado como N x 6,25. El contenido de N insoluble y el de N soluble proteico y no proteico fueron analizados empleando la metodología descrita por Periago et al.31
El contenido de Ca urinario fue determinado, tras la dilución de las muestras, por espectrofotometría de absorción atómica (Perkin Elmer Analyst 300, PerkinElmer, Wellesley, MA, USA). Se llevó a cabo una calibración externa, evaluando la exactitud del método mediante el análisis de un material de referencia certificado de músculo bovino (NIST CRM 8414 bovine muscle powder, Gaithersburg MD, USA). Los valores medios y errores estándar de la media (EEM) de cinco mediciones independientes para cenizas y contenido en Ca fueron los siguientes: Cenizas, CRM-383 = 2,48 ± 0,006% vs valor certificado de 2,4 ± 0,1% de variación, CRM-709 = 4,29 ± 0,03% vs valor certificado de 4,2 ± 0,4% de variación; Ca, CRM-383 = 2,78 ± 0,02 mg/g vs. valor certificado de 2,9 ± 0,2 mg/g de variación).
El citrato urinario se valoró empleando un kit comercial (Boehringer Mannheim, Cat. No. 10 139 076 035), y el pH urinario usando un analizador de pH (Crison, Barcelona, España).
La extracción de la grasa del hígado se llevó a cabo mediante el método de Folch con ligeras adaptaciones32. Para la determinación del colesterol y triglicéridos hepáticos se utilizaron kits comerciales (Spinreact, S.A. Gerona, España).
La urea, bilirrubina, colesterol total y niveles de triglicéridos en plasma fueron analizados con un autoanalizador (HITACHI, Roche p800).
Dietas experimentales
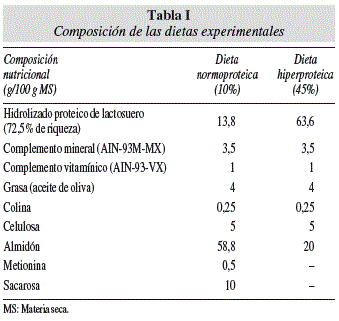
La formlación de las dietas experimentales se muestra en la tabla I. Para cumplir con los requerimientos nutricionales de la rata, todas las dietas fueron formuladas siguiendo las recomendaciones del Instituto Americano de Nutrición (AIN-93M)33. El porcentaje de riqueza proteica para las dietas HP se estableció en un 45% dado que es el valor medio empleado para dietas HP en diseños experimentales similares desarrollados en ratas2-3,9,34. Del mismo modo, la dieta NP se estableció en un 10% de riqueza. Con el fin de reproducir de la forma más real posible los hábitos nutricionales de deportistas y aficionados, se ha empleado un hidrolizado deportivo comercial de lactosuero como fuente proteica (Dymatize ISO-100, Farmers Branch, TX, USA). Previo a la elaboración de las dietas, la concentración proteica del hidrolizado comercial y su distribución (fracciones de N proteicas y no proteicas) fueron analizadas. El contenido total de N del hidrolizado comercial proteico de lactosuero fue de 11,8 ± 0,6 g/100 g de sustancia seca, lo que corresponde a un 72,5% de riqueza total. El contenido en N de dicho idrolizado estuvo distribuido de la siguiente forma: 11,7% correspondió a N insoluble, 85,4% a N soluble proteico y el 2,9% restante a N soluble no proteico.
Una vez elaborada la dieta con sus distintos componentes, la concentración de proteína tanto para las dieta HP como NP fue analizada, obteniéndose unos valores de 44,3 ± 2,4% y 11,7 ± 0,4%, respectivamente (estos niveles son adecuados para nuestro diseño experimental). Debido a la alta calidad de la proteína (alto valor biológico) del suplemento deportivo proteico empleado (proteína de lactosuero), no hemos considerado necesaria la complementación de la dieta HP con otros aminoácidos, sin embargo, en las dietas normoproteicas hemos añadido 0,5 gramos/100 g de dieta de metionina33.
Entrenamiento de fuerza
Los grupos experimentales de ejercicio llevaron a cabo un protocolo de entrenamiento de fuerza en un tapiz rodante motorizado de diseño especial para ratas (Panlab TREADMILLS con 5 calles para el entrenamiento simultáneo de 5 ratas, LE 8710R) con cargas en un saco atado a la cola. El entrenamiento se desarrolló en días alternos, a una velocidad constante de 40 cm/s durante todo el periodo experimental (12 semanas). Previamente al periodo experimental, los animales fueron adaptados al tapiz rodante mediante una sesión diaria durante una semana de adaptación en la que los primeros 3 días corrían sin carga y los 4 últimos arrastrando el 20% de su peso corporal. El protocolo de entrenamiento de fuerza empleado ha sido previamente descrito por Aparicio et al.35
Los animales sedentarios fueron manipulados de forma exacta a los grupos de entrenamiento, con la excepción del propio entrenamiento, con el fin de evitar un efecto contaminante debido al contacto humano.
Análisis estadístico
Los resultados se presentan como media y desviación estándar de la media a no ser que se indique lo contrario. Los efectos de la dieta y el entrenamiento de fuerza sobre las distintas variables incluidas en el estudio fueron analizados mediante un análisis de la varianza (ANOVA) de medidas repetidas, donde el nivel proteico y el entrenamiento de fuerza eran los tratamientos empleados. Todos los análisis se llevaron a cabo con el software estadístico SPSS, versión 16.0 para Windows (SPSS Inc., Chicago, IL), y el nivel de significación se estableció en 0,05.
Resultados
Ingestas, peso, composición corporal y perfil lipídico
Las diferencias en ingestas, peso, composición corporal y el perfil lipídico entre grupos de animales siguiendo una dieta HP o NP, sedentarios o con entrenamiento de fuerza, se muestran en la tabla II. La ingesta diaria media fue menor en los grupos HP con respecto a los NP y en los de entrenamiento comparados con los sedentarios (ambas P < 0,001). El peso finalde los animales fue menor para los grupos entrenamiento, especialmente en el grupo NP (P < 0,01), existiendo una interacción dieta x entrenamiento (P < 0,05), con una mayor reducción de peso como consecuencia del entrenamiento en los grupos NP con respecto a los HP (-7,5 vs -6,0%). El porcentaje de grasa blanca fue inferior en los grupos HP comparado con los NP (P < 0,05).
Los niveles de colesterol plasmáticos fueron inferiores para los grupos HP en comparación con los NP (P < 0,001) y en los grupos de ejercicio comparado con los sedentarios (P < 0,05). Se ha presentado una interacción dieta x entrenamiento en los niveles de triglicéridos (P < 0,05), con un efecto mayor de reducción en el grupo HP que en el NP (-41,6 vs -9,0%).
Parámetros urinarios, renales, de acidosis metabólica y hepáticos
Los efectos de la dieta y del entrenamiento sobre los niveles de urea, peso de hígado y riñón, parámetros urinarios de acidosis metabólica y perfil lipídico hepático para grupos NP e HP, con y sin entrenamiento de fuerza, se muestran en la tabla III. Tras 90 días de periodo experimental, el peso del riñón del grupo HP sedentario fue un 58% superior con respecto al NP y un 33% superior en el HP con entrenamiento (P < 0,001). Los niveles de urea plasmática fueron mayores en los grupos HP comparados con los NP y menores en los grupos de entrenamiento en comparación con los sedentarios (P < 0,001). Además, se ha presentado una interacción dieta x entrenamiento, existiendo una mayor reducción de los niveles de urea en los grupos donde el entrenamiento se combinaba con la dieta HP que con la NP (-37,6% vs -9,9%, respectivamente) (P < 0,01).
La diuresis fue mayor en los grupos HP (P < 0,001), sin diferencias atendiendo al efecto del ejercicio. El pH urinario fue menor (más ácido), para las ratas que consumieron dietas HP (P < 0,001). El citrato urinario fue inferior en los grupos HP (P < 0,001) con respecto a los NP y el Ca urinario superior (P < 0,01). En relación con el ejercicio, tanto el pH como el Ca urinario fueron ligeramente inferiores en los grupos de entrenamiento, aunque sin significación estadística.
El peso de hígado fue notablemente inferior para los grupos NP con respecto a los HP (P < 0,001) y para los grupo de entrenamiento con respecto a los sedentarios (P < 0,001). Además, se presentó una interacción dieta x entrenamiento, siendo mayor la reducción del peso del hígado en la dieta HP que en la NP (-7,8% en la NP vs -30,2% en la HP). La grasa del hígado fue menor en el grupo que consumió dieta HP pero sin llegar a la significación (P = 0,07). Las concentraciones de colesterol hepático fueron superiores para los grupos de dieta HP (P < 0,05). La concentración de triglicéridos hepáticos fue menor en los grupos HP (P < 0,001) y éstos fueron un 62% más bajos en el grupo NP con entrenamiento (P < 0,01), con interacción dieta x entrenamiento (P < 0,001). Por último, no se han encontrado diferencias significativas en los niveles plasmáticos de bilirrubina.
Parte de los resultados que se presentan en el presente artículo (variables descriptivas de peso, composición corporal y perfil lipídico plasmático de la tabla II y peso de riñón y niveles de urea plasmática de la tabla III) provienen de un amplio estudio del que parte ha sido publicado35, pero que a juicio de los autores, deben ser incluidos al ser variables descriptivas básicas para dar sentido a la globalidad del análisis que se ha llevado a cabo.
Discusión
Altas ingestas de proteína indujeron un estado de acidosis metabólica en ratas, lo que podría afectar negativamente al hígado y riñón, que presentaron hipertrofia. Por otra parte, las dietas HP mostraron un efecto positivo sobre el perfil lipídico, lo cual podría tener un efecto protector cardiovascular, renal y hepático. Los beneficios del entrenamiento de fuerza fueron generalizados, mejorando la composición corporal y el perfil lipídico y atenuando la hipertrofia de hígado y riñones y la excreción de urea plasmática, derivados del consumo de dietas HP. Hasta la fecha, no existen estudios donde la interacción dieta NP e HP y entrenamiento de fuerza haya sido analizada. Mediante el diseño experimental y análisis estadístico del presente artículo podemos comprobar qué efectos son provocados por la dieta y cuáles por el entrenamiento de fuerza, de forma tanto aislada como conjunta.
Tal y como ya ha sido descrito por otros autores, la ingesta fue menor en los grupos de dieta HP2-3, lo que pudo favorecer unas menores concentraciones de colesterol total y triglicéridos que podrían tener un efecto protector sobre enfermedades cardiovasculares, hepáticas y renales23,25,36. Este fenómeno puede generar cierta controversia, dado que a priori, dichas dietas HP podrían mejorar el perfil lipídico, pero a costa de un riesgo paralelo sobre el equilibrio nutricional, acidosis metabólica, alteraciones renales y hepáticas. Por otra parte, los grupos entrenamiento presentaron menor contenido de grasa corporal y mejor perfil lipídico general, aspecto que confirma los efectos metabólicos altamente contrastados del entrenamiento de fuerza sobre dichos parámetros21-23. Tal y como ha sido descrito anteriormente por nuestro grupo de investigación35, es especialmente reseñable la interacción observada entre dieta-ejercicio y niveles plasmáticos de triglicéridos, donde el entrenamiento de fuerza se muestra especialmente eficaz reduciendo dichas concentraciones plasmáticas cuando se combina con el consumo de dichas dietas HP.
La concentración plasmática de urea aumentó con el consumo de la dieta HP tal y como ha sido observado por otros autores37. Al ser necesario filtrar mayor urea, más urea es excretada, lo que ocasiona una hiperfiltración que podría generar problemas renales13-14,37. Los efectos hemodinámicos de la dieta HP han sido atribuidos a mecanismos como el incremento de la velocidad de filtración glomerular y el incremento de la proteinuria, que pueden derivar en glomerulosclerosis e insuficiencia renal. Los responsables de estos mecanismos pueden ser las hormonas (glucagón, insulina, somatomedina C y angiotensina II), las citoquinas (prostaglandinas) y las quininas. También puede estar implicada la regulación renal de los transportadores de sodio, ya que se ha observado que la actividad de estos transportadores está aumentada en respuesta al aumento de la filtración de aminoácidos, estimulando la retroalimentación túbulo-glomerular y aumentando la filtración glomerular38. Los riñones de los animales que consumieron una dieta HP presentaron un peso final en torno a un 45% superior. Hammond y James19 también encontraron un incremento del 30% del peso del riñón tras tan solo 2 semanas de consumo de una dieta HP del 46% de riqueza. Estos autores atribuyeron dicha hipertrofia renal al fuerte impacto metabólico de los altos niveles de urea plasmática observados y a la forzada mayor filtración de N ocasionada por el consumo de las dietas HP.
De hecho, a pesar de la evidencia acerca del potencial efecto anti-obesidad de este tipo de dietas, el impacto renal de altos consumos de proteína sigue sin esclarecerse12-16. En un reciente estudio desarrollado en cerdos (por la similitud de los riñones de estos animales con los de los humanos), tras 8 meses de periodo experimental, el volumen renal y glomerular fue entre un 60-70% superior en el grupo de dieta HP. Estos mayores riñones también presentaron daño histológico, con un 55% más de fibrosis y un 30% más de glomerulosis. Además los niveles plasmáticos de homocisteína y de MCP-1 (renal monocyte chemoattractant protein-1) fueron muy superiores (la MCP-1 es una quimiocina que es marcador de inflamación renal)13.
En nuestro estudio, tras un periodo de tiempo relativamente corto (3 meses) de exposición a una dieta HP, se produjo un incremento significativo de los niveles plasmáticos de urea, del volumen urinario y de la excreción urinaria de Ca (hipercalciuria), a la par que se produjo un descenso del pH urinario (más ácido) y una menor excreción urinaria de citrato (hipocitraturia). Tanto la hipercalciuria como la hipocitraturia son reconocidos factores de riesgo para la formación de cálculos renales de oxalato cálcico12,34, por lo que los animales alimentados con dietas HP presentarían, en principio, un mayor riesgo de padecer nefrolitiasis.
El entrenamiento de fuerza logró paliar en parte la hipertrofia renal ocasionada por la dieta HP. Entre los mecanismos que pudieran explicar este efecto protector renal del ejercicio se encuentra el hecho de que el entrenamiento de fuerza parece reducir la inflamación renal, aumentar la velocidad y fracción de filtrado glomerular y las concentraciones de albúmina plasmática24-26. De hecho, en el reciente estudio de Pinheiro-Mulder et al.26 han concluido que el ejercicio podría ser una eficaz práctica auxiliar enfocada a atenuar las alteraciones renales que se observan en personas que presentan obesidad inducida por la dieta.
El incremento del peso del hígado tras el consumo de la dieta HP fue porcentualmente ligeramente superior al del riñón, con un 68% mayor peso fresco para el grupo sedentario de dieta HP. Sin embargo, para el grupo HP con entrenamiento el incremento fue tan solo un 28% superior, consecuentemente podemos extraer una de las interacciones dieta-ejercicio más notables del presente estudio: el entrenamiento de fuerza es especialmente eficaz reduciendo la hipertrofia hepática inducida por la dieta HP.
Así como numerosos estudios han analizados los efectos hepáticos de dietas altas en grasas, son casi inexistentes aquellos que hayan analizados los efectos de dietas HP sobre dicho órgano19. En el anteriormente mencionado estudio de Hammond y Janes19 también se analizó el peso del hígado en sustancia fresca y, al igual que en nuestro estudio, detectaron un incremento del peso en sustancia fresca de en torno al 20%. Este menor incremento, con respecto al observado en el presente estudio, puede ser debido a que la exposición a la dieta HP fue de tan sólo 2 semanas, frente a los 3 meses de nuestro diseño experimental, sumado a que es posible que la hipertrofia hepática se presente a más largo plazo. Por tanto, se hacen necesarios mayor número de estudios, especialmente histológicos, que analicen el posible efecto adverso sobre la salud hepática que a largo plazo podrían tener este tipo de dietas.
El hígado humano contiene proporcionalmente más ácidos grasos saturados y poli-insaturados que el tejido adiposo subcutáneo e intra-abdominal39. Se ha demostrado que las dietas HP mejoran la esteatosis hepática (hígado graso), sin embargo, aún son pocos los estudios que hayan analizado los efectos que la proteína de lactosuero (whey) tiene sobre el contenido graso del hígado, tanto en modelos animales como humanos40. Bortolotti et al.40 analizaron el efecto que la suplementación con proteína de lactosuero tenía sobre los lípidos intra-hepáticos y los niveles plasmáticos de triglicéridos en mujeres obesas no diabéticas. Tras 4 semanas, el grupo de mujeres que consumieron la proteína de lactosuero mostraron una reducción en el contenido de lípidos intra-hepáticos (21%), y una reducción en las concentraciones de triglicéridos y colesterol plasmáticos del 15 y el 7%, respectivamente.
La reducción de la grasa corporal y plasmática observada en nuestros grupos de dieta HP ha podido ser la causa de la reducción paralela, cercana a la significación (P = 0,075), del ˜25% en el porcentaje graso del hígado. Sin embargo, por el contrario, el colesterol total hepático fue mayor para los grupos de dieta HP, lo que podría sugerir la falta de relación entre niveles grasos intra-hepáticos y plasmáticos al existir una mayor concentración de ciertos ácidos grasos en el hígado39. Así mismo, y en concordancia a lo observado en plasma, los triglicéridos hepáticos fueron menores en los grupos HP.
A destacar es la notable interacción dieta x ejercicio observada en la reducción de las concentraciones hepáticas de triglicéridos (˜60%), cuando se combina el entrenamiento de fuerza con la dieta NP. No hay mucha información acerca de los efectos del ejercicio sobre los triglicéridos hepáticos. Un estudio desarrollado en humanos concluyó que la práctica de ejercicio físico sin pérdida de peso asociada, no afectó a la composición lipídica hepática general27. Sin embargo, estudios desarrollados en animales aportan resultados contradictorios, algunos no han observado cambios41 mientras otros afirman que los triglicéridos hepáticos de los animales entrenados contienen menor cantidad de ácidos grasos saturados y más insaturados (tanto mono-insaturados como poli-insaturados) que los grupos control sin entrenamiento28,42. Investigaciones recientes parecen estar esclareciendo dicha controversia28,29,41,42. El ejercicio aeróbico, pero especialmente el de fuerza (anaeróbico), parece disminuir los niveles de grasa en hígado28, a la vez que reduce el estrés del retículo endoplasmático y la resistencia a la insulina en el tejido adiposo y hepático29. En nuestro grupo de ejercicio y dieta NP las concentraciones de colesterol y triglicéridos hepáticos disminuyeron en un 30 y 60%, respectivamente, frente al grupo NP sedentario. Esto nos hace presuponer que existe un mayor efecto sobre estas variables cuando se administra dieta NP y por lo tanto los niveles son, a priori, superiores. De esta forma, la combinación dieta NP y entrenamiento de fuerza se presentaría como la mejor opción de todas dentro de nuestro diseño experimental, al mejorar el perfil lipídico plasmático y hepático sin condicionar la salud hepática ni renal ni forzar al organismo a un estado de acidosis metabólica innecesario.
Algunas limitaciones deben ser mencionadas: 1) El presente estudio ha sido desarrollado en ratas y por lo tanto su extrapolación directa a humanos debe tomarse con cautela; 2) No hemos contado con instrumentación de alta tecnología para la valoración de la composición corporal, como puede ser la densitometría de absorción atómica. Por otra parte, una fortaleza del estudio ha sido el hecho de combinar grupos sedentarios con entrenamiento ante diferentes tipos de dieta, lo que nos ha permitido valorar el efecto aislado de la dieta o del ejercicio y la interacción de ambos, otorgando una buena oportunidad para investigar cómo diferentes estilos de vida pueden influir sobre importantes indicadores de salud.
Conclusiones
Los principales hallazgos del presente estudio fueron los siguientes: 1) Tanto los marcadores urinarios como plasmáticos analizados mostraron una acidosis metabólica inducida por el consumo de dietas HP, lo que podría explicar el importante incremento de peso de hígado y riñón observados en los grupos HP; 2) El entrenamiento de fuerza redujo significativamente los niveles de colesterol y triglicéridos plasmáticos, siendo este efecto mayor en el grupo de dieta HP; 3) El entrenamiento de fuerza mostró un efecto protector sobre la hipertrofia renal y hepática y la acidosis metabólica observada; 4) El porcentaje de grasa total y triglicéridos fue inferior en los grupos alimentados con dieta HP. No obstante, se observó una disminución más marcada de la concentración hepática de triglicéridos como consecuencia del ejercicio (60%) en el grupo de animales que consumió la dieta NP; 5) Se han presentado reseñables interacciones entre la dieta y el ejercicio, siendo notable el efecto protector del ejercicio sobre las variables de impacto metabólico (urea, peso del hígado y riñones) en el grupo de dieta HP.
Agradecimientos
Los autores agradecen su colaboración a todos los miembros del departamento de fisiología de la facultad de Farmacia, especialmente a las personas implicadas en el trabajo de campo, por su gran esfuerzo y entusiasmo.
Referencias
1. Lowery LM, Devia L. Dietary protein safety and resistance exercise: what do we really know? J Int Soc Sports Nutr 2009; 6: 3. [ Links ]
2. Lacroix M, Gaudichon C, Martin A et al. A long-term high-protein diet markedly reduces adipose tissue without major side effects in Wistar male rats. Am J Physiol Regul Integr Comp Physiol 2004; 287: R934-42. [ Links ]
3. Pichon L, Potier M, Tome D et al. High-protein diets containing different milk protein fractions differently influence energy intake and adiposity in the rat. Br J Nutr 2008; 99: 739-48. [ Links ]
4. Cribb P. Whey proteins in sports nutrition. Arlington: US Dairy Export Council. 2005. [ Links ]
5. Cribb PJ, Williams AD, Carey MF, Hayes A. The effect of whey isolate and resistance training on strength, body composition, and plasma glutamine. Int J Sport Nutr Exerc Metab 2006; 16: 494-509. [ Links ]
6. Cribb PJ, Williams AD, Stathis CG, Carey MF, Hayes A. Effects of whey isolate, creatine, and resistance training on muscle hypertrophy. Med Sci Sports Exerc 2007; 39: 298-307. [ Links ]
7. Noakes M, Keogh JB, Foster PR, Clifton PM. Effect of an energy-restricted, high-protein, low-fat diet relative to a conventional high-carbohydrate, low-fat diet on weight loss, body composition, nutritional status, and markers of cardiovascular health in obese women. Am J Clin Nutr 2005; 81: 1298-306. [ Links ]
8. Hayes A, Cribb PJ. Effect of whey protein isolate on strength, body composition and muscle hypertrophy during resistance training. Curr Opin Clin Nutr Metab Care 2008; 11: 40-4. [ Links ]
9. Belobrajdic DP, McIntosh GH, Owens JA. A high-wheyprotein diet reduces body weight gain and alters insulin sensitivity relative to red meat in wistar rats. J Nutr 2004; 134: 1454-8. [ Links ]
10. Bouthegourd JC, Roseau SM, Makarios-Lahham L, Leruyet PM, Tome DG, Even PC. A preexercise alpha-lactalbuminenriched whey protein meal preserves lipid oxidation and decreases adiposity in rats. Am J Physiol Endocrinol Metab 2002; 283: E565-72. [ Links ]
11. Belobrajdic D, McIntosh G, Owens J. The effects of dietary protein on rat growth, body composition and insulin sensitivity. Asia Pac J Clin Nutr 2003; 12 (Suppl.): S42. [ Links ]
12. Pak CY. Pharmacotherapy of kidney stones. Expert Opin Pharmacother 2008; 9: 1509-18. [ Links ]
13. Jia Y, Hwang SY, House JD et al. Long-term high intake of whole proteins results in renal damage in pigs. J Nutr 2010; 140: 1646-52. [ Links ]
14. Frank H, Graf J, Amann-Gassner U et al. Effect of short-term high-protein compared with normal-protein diets on renal hemodynamics and associated variables in healthy young men. Am J Clin Nutr 2009; 90: 1509-16. [ Links ]
15. Martin WF, Armstrong LE, Rodriguez NR. Dietary protein intake and renal function. Nutr Metab (Lond) 2005; 2: 25. [ Links ]
16. Mandayam S, Mitch WE. Dietary protein restriction benefits patients with chronic kidney disease. Nephrology (Carlton) 2006; 11: 53-7. [ Links ]
17. Brinkworth GD, Buckley JD, Noakes M, Clifton PM. Renal function following long-term weight loss in individuals with abdominal obesity on a very-low-carbohydrate diet vs high-carbohydrate diet. J Am Diet Assoc 2010; 110: 633-8. [ Links ]
18. Chevalier L, Bos C, Gryson C et al. High-protein diets differentially modulate protein content and protein synthesis in visceral and peripheral tissues in rats. Nutrition 2009; 25: 932-9. [ Links ]
19. Hammond KA, Janes DN. The effects of increased protein intake on kidney size and function. J Exp Biol 1998; 201: 2081-90. [ Links ]
20. De Salles BF, Simao R, Miranda F, Novaes Jda S, Lemos A, Willardson JM. Rest interval between sets in strength training. Sports Med 2009; 39: 765-77. [ Links ]
21. Wolfe RR. The underappreciated role of muscle in health and disease. Am J Clin Nutr 2006; 84: 475-82. [ Links ]
22. Williams MA, Haskell WL, Ades PA et al. Resistance exercise in individuals with and without cardiovascular disease: 2007 update: a scientific statement from the American Heart Association Council on Clinical Cardiology and Council on Nutrition, Physical Activity, and Metabolism. Circulation 2007; 116: 572-84. [ Links ]
23. Houston MC, Fazio S, Chilton FH et al. Nonpharmacologic treatment of dyslipidemia. Prog Cardiovasc Dis 2009; 52: 61-94. [ Links ]
24. Poortmans JR, Ouchinsky M. Glomerular filtration rate and albumin excretion after maximal exercise in aging sedentary and active men. J Gerontol A Biol Sci Med Sci 2006; 61: 1181-5. [ Links ]
25. Moinuddin I, Leehey DJ. A comparison of aerobic exercise and resistance training in patients with and without chronic kidney disease. Adv Chronic Kidney Dis 2008; 15: 83-96. [ Links ]
26. Pinheiro-Mulder A, Aguila MB, Bregman R, Mandarim-de-Lacerda CA. Exercise counters diet-induced obesity, proteinuria, and structural kidney alterations in rat. Pathol Res Pract 2010; 206: 168-73. [ Links ]
27. Johnson NA, Sachinwalla T, Walton DW et al. Aerobic exercise training reduces hepatic and visceral lipids in obese individuals without weight loss. Hepatology 2009; 50: 1105-12. [ Links ]
28. Magkos F. Exercise and fat accumulation in the human liver. Curr Opin Lipidol 2010; 21: 507-17. [ Links ]
29. Da Luz G, Frederico MJ, Da Silva S et al. Endurance exercise training ameliorates insulin resistance and reticulum stress in adipose and hepatic tissue in obese rats. Eur J Appl Physiol 2011. [ Links ]
30. Estoppey-Stojanovski L. Position of the Council of Europe on the protection of animals. Dev Biol Stand 1986; 64: 3-5. [ Links ]
31. Periago JF, Prado C, Luna A. Purge-and-trap method for the determination of styrene in urine. J Chromatogr A 1996; 719: 53-8. [ Links ]
32. Folch J, Lees M, Sloane Stanley GH. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem 1957; 226: 497-509. [ Links ]
33. Reeves PG, Nielsen FH, Fahey GC, Jr. AIN-93 purified diets for laboratory rodents: final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet. J Nutr 1993; 123: 1939-51. [ Links ]
34. Amanzadeh J, Gitomer WL, Zerwekh JE et al. Effect of high protein diet on stone-forming propensity and bone loss in rats. Kidney Int 2003; 64: 2142-9. [ Links ]
35. Aparicio VA, Nebot E, Porres JM et al. Effects of high-wheyprotein intake and resistance training on renal, bone and metabolic parameters in rats. Br J Nutr 2010: 1-10. [ Links ]
36. Bianchi C, Penno G, Romero F, Del Prato S, Miccoli R. Treating the metabolic syndrome. Expert Rev Cardiovasc Ther 2007; 5: 491-506. [ Links ]
37. Bankir L, Bouby N, Trinh-Trang-Tan MM, Ahloulay M, Promeneur D. Direct and indirect cost of urea excretion. Kidney Int 1996; 49: 1598-607. [ Links ]
38. Kalantar-Zadeh K, Mehrotra R, Fouque D, Kopple JD. Metabolic acidosis and malnutrition-inflammation complex syndrome in chronic renal failure. Semin Dial 2004; 17: 455-65. [ Links ]
39. Kotronen A, Seppanen-Laakso T, Westerbacka J et al. Comparison of lipid and fatty acid composition of the liver, subcutaneous and intra-abdominal adipose tissue, and serum. Obesity (Silver Spring) 2010; 18: 937-44. [ Links ]
40. Bortolotti M, Maiolo E, Corazza M et al. Effects of a whey protein supplementation on intrahepatocellular lipids in obese female patients. Clin Nutr 2011. [ Links ]
41. Petridou A, Nikolaidis MG, Matsakas A, Schulz T, Michna H, Mougios V. Effect of exercise training on the fatty acid composition of lipid classes in rat liver, skeletal muscle, and adipose tissue. Eur J Appl Physiol 2005; 94: 84-92. [ Links ]
42. Simko V, Ondreicka R, Chorvathova V, Bobek P. Effect of long-term physical exercise on bile sterols, fecal fat and fatty acid metabolism in rats. J Nutr 1970; 100: 1331-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Pilar Aranda Ramírez.
Departamento de Fisiología. Facultad de Farmacia.
Campus de la Cartuja, s/n.
18171 Granada. España.
E-mail: paranda@ugr.es
Recibido: 2-IV-2011.
1.a Revisión: 23-V-2011.
2.a Revisión: 15-VII-2011.
Aceptado: 19-VII-2011.