Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.27 no.4 Madrid jul./ago. 2012
https://dx.doi.org/10.3305/nh.2012.27.4.5811
REVISIÓN
Prebióticos y nucleótidos en alimentación infantil; revisión de la evidencia
Prebiotics and nucleotides in infant nutrition; review of the evidence
A. Cilla*, R. Lacomba*, G. García-Llatas y A. Alegría
Área de Nutrición y Bromatología. Facultad de Farmacia. Universidad de Valencia. Valencia. España.
*Ambos autores han colaborado de la misma forma, por lo que deben ser considerados como primer autor.
Dirección para correspondencia
RESUMEN
Introducción: Una gran mayoría de preparados infantiles de inicio y continuación comercializados en España presentan en su formulación prebióticos y/o nucleótidos, con objeto de lograr efectos beneficiosos en la prevención de diferentes patologías y protección inmunológica, similares a los de la leche materna. No obstante, atendiendo a la reglamentación vigente, su adición es opcional, ya que no existe suficiente evidencia científica que certifique la obligatoriedad de su inclusión.
Objetivo: Revisar sistemáticamente la evidencia científica proveniente de estudios clínicos aleatorizados con grupo control que permita determinar el papel beneficioso para la salud de los lactantes derivada de la adición de prebióticos y/o nucleótidos en preparados infantiles.
Metodología: Se buscaron y seleccionaron tanto artículos originales como revisiones en inglés y español de estudios clínicos aleatorizados con grupo control, publicados en las bases de datos de MEDLINE/PubMed, Scielo, Science Direct y Scopus, hasta octubre de 2011.
Resultados: Se encontraron 43 ensayos clínicos aleatorizados que cumplieron con los criterios de inclusión.
Conclusiones: Son necesarios más estudios a largo plazo, con mayor número de individuos y aleatorizados, así como estandarización de las cantidades suplementadas y demás condiciones experimentales, para poder establecer declaraciones saludables con mayor base científica respecto a la adición de la mezcla de prebióticos (GOS/FOS) y/o nucleótidos en preparados infantiles. La tendencia actual a su inclusión en preparados infantiles puede justificarse en base a las evidencias científicas disponibles hasta el momento, así como a su seguridad y a su presencia en la leche materna.
Palabras clave: Prebióticos. Nucleótidos. Nutrición infantil. Preparados infantiles.
ABSTRACT
Introduction: Most of the initiation and maintenance pediatric formulas commercialized in Spain contain prebiotics and/or nucleotides aiming at achieving beneficial effects on prevention of different pathologies and immune protection, similar to human breast milk. However, according to the current legislation, its inclusion is optional since sufficient scientific evidences supporting its mandatory inclusion is lacking.
Objective: To systematically review the scientific evidence from randomized clinical studies with a control group allowing determining the beneficial role for infant health derived from the inclusion of prebiotics and/or nucleotides in pediatric formulas.
Methodology: We looked for and selected both original papers and reviews in Spanish and English language of placebo controlled randomized clinical studies published in the databases MEDLINE/PubMed, Scielo, Science Direct, and Scopus, until October of 2011.
Results: We found 43 randomized clinical trials meeting the inclusion criteria.
Conclusions: More long-term randomized studies with higher number of patients, and standardized supplemental amounts and experimental conditions are needed to establish healthy statements with stronger scientific support regarding the addition of a mixture of prebiotics (GOS/FOS) and/or nucleotides in pediatric formulas. The current trend to include them in pediatric formulas may be justified based on the currently available evidence, as well as their safety and their presence in human breast milk.
Key words: Prebiotics. Nucleotides. Pediatric nutrition. Pediatric formulas.
Abreviaturas
AMP: Adenosina monofosfato.
AG: Ácidos grasos.
CMP: Citidina monofosfato.
ECA: Estudios clínicos aleatorizados.
EFSA: European Food Safety Authority.
ESPGHAN: European Society for Paediatric Gastroenterology, Hepatology and Nutrition.
FOS: Fructo-oligosacáridos.
GOS: Galacto-oligosacáridos.
GMP: Guanosina monofosfato.
IMP: Inosina monofosfato.
LOS: Lactulosa.
LH: Leche humana.
OF: Oligofructosa.
OS: Oligosacáridos.
PDX: Polidextrosa.
PI: Preparado infantil.
UMP: Uracilo monofosfato.
Introducción
La composición de la leche materna es la base para el desarrollo de preparados infantiles en cuanto a su contenido de macronutrientes, micronutrientes y compuestos bioactivos. Los avances en el conocimiento de la composición de la leche materna han permitido identificar un gran número de componentes bioactivos, como los prebióticos y nucleótidos, con efecto en la prevención de diferentes patologías y protección inmunológica, lo cual ha llevado a su incorporación en los preparados infantiles para lograr beneficios similares, si bien su adición es opcional, ya que no existe suficiente evidencia científica que avale la obligatoriedad de su inclusión1,2.
Los prebióticos se definen como oligosacáridos (OS) no digeribles que pueden estimular y promover el crecimiento y/o metabolismo de bifidobacterias y lactobacilos en el intestino humano3. Químicamente, se trata de carbohidratos formados por 3-10 unidades de monosacáridos como galactosa, fructosa, N-acetil-glucosamina y ácido siálico, unidos entre ellos por enlaces glucosídicos característicos tipo β 2-14,5. Entre los prebióticos se incluyen varios tipos de OS (fructo-, galacto-, isomalto-, xylo- y soja-oligosacáridos), lactulosa y lactosucrosa. Deben poseer las siguientes características: (i) no pueden ser absorbidos ni hidrolizados en el tracto gastrointestinal superior, (ii) deben ser sustrato selectivo para bacterias específicas presentes en el colon, como lactobacilos y bifidobacterias, y (iii) deben ser capaces de modificar la microbiota colónica convirtiéndola en más saludable y beneficiosa para el organismo hospedador5. Únicamente tres OS no digeribles cumplen con los criterios para poder ser considerados y clasificados como prebióticos: la inulina que engloba a los fructo-oligosacáridos (FOS) (un tipo de inulina-fructanos formados por oligómeros de cadena corta), los galacto-oligosacáridos (GOS) (un tipo de galactanos) y la lactulosa6.
Los prebióticos estimulan selectivamente el crecimiento de bifidobacterias y lactobacilos, productoras de sustancias inhibidoras del crecimiento y supervivencia de patógenos. La fermentación parcial de los OS por parte de las bifidobacterias produce ácidos grasos (AG) de cadena corta, como los ácidos butírico, propiónico, L-láctico y acético. Los tres primeros favorecen el crecimiento y la diferenciación de células epiteliales in vivo. El ácido butírico constituye una importante fuente energética para el colonocito. La acidificación del medio colónico, inhibe el crecimiento de bacteroides, clostridium y coliformes, y favorece la producción de mucina, lo que disminuye la colonización y "translocación" bacterianas. Asimismo, los prebióticos compiten con bacterias patógenas por los lugares de unión en el epitelio intestinal, y han mostrado un papel protector frente a infecciones, disminuyendo la incidencia de alergias así como un efecto positivo en el desarrollo del sistema inmune postnatal7-9.
Los OS son el tercer grupo de componentes mayoritarios de la leche materna después de la lactosa (6 g/100 mL) y los lípidos (4 g/100mL). Su concentración en calostro es de 1,5-2,3 g/100 mL, que se reduce progresivamente y estabiliza en leche materna de transición y madura, con valores comprendidos entre 0,8-1,2 g/100 mL8,10. Por su parte, la leche de vaca utilizada para elaborar preparados infantiles contiene menos de 0,1 g/100 mL de OS8. Así pues, dado el menor contenido de OS en la leche de vaca vs la leche materna y que esta última es el alimento ideal para el adecuado crecimiento, desarrollo y salud del niño, parece lógica la suplementación de preparados infantiles con este tipo de componentes, con el objeto de conseguir efectos beneficiosos para la salud y el desarrollo similares a los hallados con leche materna.
Los nucleótidos, por su parte, son bases púricas o pirimidínicas unidas a una ribosa fosforilada. Son precursores de los ácidos nucleicos, intermediarios en la biosíntesis de compuestos como glucógeno, fosfolípidos, esfingolípidos y glucoproteínas, e intermediarios energéticos como el ATP o el GTP. Asimismo, forman parte de coenzimas (NAD, NADP, FAD, coenzima A)11.
Se sabe que su aporte a través de la dieta es importante para el mantenimiento de un crecimiento adecuado y de la función celular en tejidos de proliferación rápida (como el intestino o la médula ósea) o el sistema inmunitario, y que no son capaces de satisfacer las necesidades celulares de nucleótidos exclusivamente a través de la síntesis de novo y utilizan preferentemente la vía de recuperación de nucleósidos y bases púricas y pirimidínicas de la sangre o de la dieta11. Sus principales funciones están relacionadas con la modulación del metabolismo de las lipoproteínas y de los AG poliinsaturados, la proliferación y diferenciación de los enterocitos, la modificación de la microbiota intestinal y la estimulación y modulación del sistema inmunitario12. Desde un punto de vista nutricional, se les considera nutrientes semi-esenciales o condicionalmente esenciales para lactantes, ya que su ausencia en la dieta, en un estado de salud óptimo, no induce ninguna patología13.
En la leche humana hay hasta 13 tipos de nucleótidos, siendo los mayoritarios la adenosina 5'-monofosfato, guanosina 5'-monofosfato e inosina 5'-monofosfato (nucleótidos de base púrica) y la citidina 5'-monofosfato y uridina 5'-monofosfato (nucleótidos de base pirimidínica)2. La concentración total de nucleótidos en la leche humana es superior a la de la leche bovina (5,32-14,03 vs. 1,32-6,77 μmol/dL)11. Por ello, los preparados infantiles elaborados a partir de leche de vaca presentan unos contenidos de nucleótidos inferiores a los de la leche humana.
En la tabla I se muestran los contenidos (o en su defecto, presencia o ausencia) de prebióticos y nucleótidos en leche humana y bovina y en preparados infantiles comercializados en España.
Reglamentación
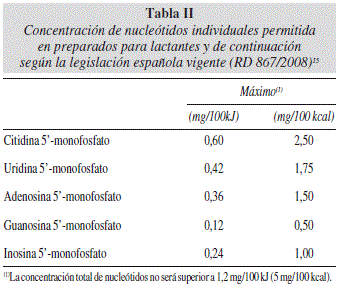
En Europa se pueden añadir FOS y GOS, y nucleótidos, a los preparados para lactantes según la Directiva 2006/141/CE14 que ha sido traspuesta a la legislación española mediante el Real Decreto (RD) 867/ 200815, de 23 de mayo, por el que se aprueba la reglamentación técnico-sanitaria específica de los preparados para lactantes y de los preparados de continuación. Su contenido no será superior a 0,8 g/100 mL según una combinación de 90% de oligogalactosil lactosa (GOS) y 10% de oligofructosil sacarosa (FOS) de elevado peso molecular. En el caso de los nucleótidos, se podrá adicionar 1,2 mg de nucleótidos totales/100 kJ (5 mg/100 kcal). Las concentraciones de nucleótidos individuales permitidas oscilan entre 0,12 y 0,6 mg/100 kJ (0,5-2,5 mg/100 kcal) y se muestran con detalle en la tabla II.
Merece especial atención, la reseña que aparece en el anexo IV del RD 867/2008, relativo a las declaraciones nutricionales y de propiedades saludables de los preparados para lactantes y condiciones de garantía de la declaración correspondiente, en la que se establece que se podrá añadir la declaración nutricional sobre la adición de FOS y GOS, y nucleótidos (considerados como ingredientes opcionales), garantizando dicha declaración la condición de que son "añadidos voluntariamente en una medida apropiada para el uso previsto por parte de los lactantes y de conformidad con las condiciones establecidas" en dicho RD.
Objetivo
El objetivo de la presente revisión sistemática ha sido analizar los diversos estudios de intervención llevados a cabo sobre el papel beneficioso derivado de la adición de prebióticos y nucleótidos en preparados infantiles en la salud de los lactantes, con el fin de determinar si existe suficiente evidencia científica que pueda justificar la obligatoriedad de su adición.
Metodología
En la presente revisión sistemática, se buscaron tanto artículos originales como revisiones en inglés y español, publicados en las bases de datos de MEDLINE/PubMed, Scielo, Science Direct y Scopus, hasta octubre de 2011. Las palabras clave en la estrategia de búsqueda fueron: "Prebiotics OR nucleotids AND infant formula". Entre los criterios de inclusión se tuvieron en cuenta que: (i) las publicaciones fueran estudios clínicos aleatorizados, (ii) que en los estudios existiese una comparación entre el preparado infantil suplementado frente a un grupo control y/o leche materna, y (iii) en el caso de los prebióticos, que los estudios únicamente evaluasen el efecto de estos compuestos sin la presencia de probióticos en la formulación de los preparados infantiles. Según estos criterios, el número final de artículos incluidos en esta revisión relativos a la evidencia científica de la suplementación de preparados infantiles con prebióticos y nucleótidos ha sido de 43.
Evidencias científicas sobre funcionalidad de prebióticos y nucleótidos en alimentación infantil
Prebióticos
En diversos estudios clínicos llevados a cabo en niños de 0-3 años16-28 se indica que la ingesta de preparados infantiles suplementados con GOS/FOS (a concentraciones en el intervalo de 0,2-1,5 g/100mL) produce un aumento significativo de bifidobacterias en las heces de los niños frente al control. Si bien, no se indica qué tipo de cepas son las responsables del efecto bifidogénico observado. Asimismo, se constata que este efecto es dosis-dependiente a concentraciones de 0,4 y 0,8 g/100 mL17,28.
El aumento significativo de lactobacilos en las heces de los niños que ingieren preparados infantiles suplementados con GOS/FOS (a un intervalo de concentraciones de 0,2-0,8 g/100mL) frente al control se constata en los estudios de Moro y cols.17, Fanaro y cols.22 y Salvani y cols.27.
Asimismo en diversos estudios16,17,19,22,25,26,28-32 se demuestra la presencia de heces más blandas y una mayor frecuencia de deposiciones en lactantes que ingieren preparados infantiles suplementados con OS (0,2-1g/100mL). Sin embargo, Agostoni y cols.10 cuestionan los efectos beneficiosos de la adición de OS a productos dietéticos para niños y la posibilidad de interacción con la biodisponibilidad de otros nutrientes.
La suplementación de preparados infantiles con OS da lugar a heces más acidas por formación de AG de cadena corta, lo que podría favorecer el desarrollo de una microbiota colónica de interés (bifidobacterias y lactobacilos)17,19,20,22,27,32 y se relaciona con un menor número de episodios de diarrea aguda en niños24,33.
Por último, señalar que se ha observado una menor necesidad de uso de antibióticos en lactantes que ingieren preparados infantiles suplementados con OS y una menor incidencia de padecer episodios infecciosos y manifestaciones alérgicas33-36, así como una menor incidencia de dermatitis atópica24,37,38. Del mismo modo, se ha indicado que los prebióticos en los preparados infantiles no se relacionan con efectos adversos en el crecimiento de los niños39-42.
En la tabla III, se recogen los ensayos clínicos aleatorizados (ECA) en lactantes alimentados con preparados infantiles suplementados con OS (principalmente GOS/FOS) indicados anteriormente.
En referencia a la evidencia científica que puedan aportar este tipo de estudios, una revisión sistemática reciente43 sobre ensayos clínicos aleatorizados, llevados a cabo en niños sanos, nacidos a término, que ingieren durante 2 semanas hasta 6 meses preparados infantiles suplementados GOS/FOS (9:1) a concentraciones comprendidas entre 0,15-0,8 g/100 expresa que:
1. La mezcla de prebióticos GOS/FOS entre 0,15-0,8 g/100 mL no interfiere en el crecimiento de los niños nacidos a término o prematuros, ni tiene efectos adversos.
2. Los efectos clínicos y seguridad de un prebiótico (o mezcla) concreto no debe extrapolarse a otros prebióticos.
3. La mezcla de prebióticos GOS/FOS favorece el crecimiento de bifidobacterias y lactobacilos de forma similar al de la leche materna.
4. La ingesta de prebióticos se asocia con heces más blandas y deposiciones más frecuentes, sin embargo la relevancia clínica de estos hechos es cuestionable.
5. Únicamente existe evidencia de un ECA (con limitaciones metodológicas)35 en el que, al administrar una fórmula hidrolizada con la mezcla de prebióticos, se observa una disminución en el riesgo de padecer algunas reacciones alérgicas e infecciones. No obstante, existe demasiada incertidumbre para extraer conclusiones de los datos disponibles.
6. Hay una carencia notable de datos sobre efectos a largo plazo tras la administración de fórmulas infantiles con prebióticos. Estos datos podrían ser de especial importancia si los efectos beneficiosos persistiesen una vez ha cesado la administración del prebiótico/s.
7. Considerando todo lo anterior, el Comité de Nutrición de la European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPG-HAN)44 no recomienda el uso continuado de fórmulas suplementadas con prebióticos en niños.
En este mismo sentido, se ha publicado una opinión científica del panel de expertos de productos dietéticos, nutrición y alergias de la European Food Safety Authority (EFSA)45 sobre la evidencia científica de declaraciones nutricionales relativas a los FOS en su relación con: la disminución de microorganismos gastrointestinales potencialmente patógenos (ID 774), cambios en la producción de AG de cadena corta y pH del tracto gastrointestinal (ID 775), cambios en la función intestinal (ID 775, 778), reducción del malestar gastrointestinal (ID 775, 778), aumento de la absorción de calcio y/o magnesio que conduce a un incremento en la retención de los mismos (ID 776, 777), mantenimiento de concentraciones normales de colesterol-LDL sanguíneo (ID 805) y mantenimiento de concentraciones normales de triglicéridos en sangre (ID 805). Destacar, que las posibles declaraciones saludables de los FOS recogidas en esta revisión van dirigidas a población adulta, excepto un estudio relativo a los cambios en la función intestinal (ID 775, 778)46. Se trata de un estudio clínico ciego, paralelo y aleatorizado en el que se suministra, a 27 niños sanos de 4-12 meses durante 28 días, una preparado infantil con cereales suplementado con FOS (0,74 ± 0,39 g/día). No se observa una relación directa causa-efecto derivada del consumo de FOS con la declaración saludable alegada.
Por otra parte, en cuanto a seguridad y efectos adversos, los OS son, en general, considerados compuestos muy seguros y bien tolerados. Niños alimentados con preparados infantiles adicionados con prebióticos inulina/GOS crecen bien, tienen un balance hídrico estable y no presentan efectos adversos indeseables. Sin embargo, si la ingesta de FOS es > 20 g/día, pueden producir flatulencia, dolor abdominal, sensación de hinchazón y diarrea5,8,21.
Destacar que si se ingiere la concentración máxima de GOS/FOS (0,8 g/100 mL) que permite la legislación vigente (RD 867/2008)15, y teniendo en cuenta un volumen máximo ingerido de preparado infantil en el período de 0-3 años de 900 mL (correspondiente a la edad de 1-6 meses, en el que la lactancia artificial aún sería la alimentación exclusiva)47, se obtendría un valor de ingesta diaria de unos 7,2 g/día, inferior al límite máximo tolerable de 20 g/día.
En una revisión reciente sobre probióticos y prebióticos de la American Academy of Pediatrics48 existe una reseña acerca de la seguridad del uso de prebióticos en nutrición infantil. Se indica que, en base al comentario emitido por el Comité de Nutrición de la ESPGHAN de 200410, se requieren más estudios para establecer la seguridad y eficacia de los prebióticos y probióticos en niños. Asimismo, cabe señalar que la tolerancia está relacionada con la naturaleza del prebiótico, factores de sensibilidad individual y adaptación al consumo crónico5. Del mismo modo, también se recomienda que, de acuerdo con la FAO/OMS, la adición de prebióticos a preparados infantiles, debería realizarse en preparados de continuación destinados a niños de más de 5 meses de edad, ya que éstos presentan una respuesta inmune más madura, así como una microbiota intestinal establecida48. Indicar que, en estas revisiones, en ningún caso se especifica el tipo de prebióticos que podrían producir efectos adversos indeseables.
Nucleótidos
Se han realizado diversos estudios de intervención para justificar la funcionalidad de los nucleótidos, utilizando preparados infantiles suplementados con éstos, a concentraciones similares a las de la leche humana (tabla IV). En los primeros trabajos realizados sobre este tema, se utilizan cantidades entre 1,2 y 3,3 mg/100 mL (contenido de nucleótidos presente en leche humana). Considerando que los nucleótidos no pueden ser absorbidos sin una hidrólisis previa de, al menos, el grupo fosfato, Leach y cols.49 proponen que la concentración que debería adicionarse es la correspondiente al contenido total de nucleótidos, de sus metabolitos (nucleósidos y bases nucléicas), y de sus precursores (ADN y ARN), presentes en la leche humana. A este conjunto de compuestos se les denomina "Total Potentially Available Nucleosides" (TPAN), y su concentración en la leche humana es de 7,2 ± 2,6 mg/100 mL. La legislación vigente (RD 867/2008)15 establece un contenido máximo de nucleótidos en preparados infantiles de 5 mg/100 kcal, es decir, alrededor de 3,3 mg/100 mL (en base al aporte calórico medio de este tipo de preparados).
En lactantes alimentados durante un mes con preparados suplementados con 1,6-2,1 mg/100 mL de nucleótidos, se ha observado un efecto positivo sobre la desaturación y elongación de los AG esenciales de los fosfolípidos presentes en las membranas de los eritrocitos, incrementándose el contenido de los AG poliinsaturados de cadena larga50-52, así como de lipoproteínas, debido al incremento de la apolipoproteína A, llegando a alcanzarse las concentraciones presentes en los lactantes alimentados con leche materna53. Sin embargo, estos efectos no se observan cuando se suplementan los preparados con una mayor concentración (3,3 mg/100 mL) y el estudio se realiza durante más tiempo (7 meses vs. 1 mes) y con más individuos54. La ausencia de efecto podría ser debido a que se determina el perfil de AG de los fosfolípidos solo a los siete meses de edad, período en el que ya se ha introducido la alimentación complementaria y, por lo tanto alimentos (carnes, pescados y vegetales) cuyo contenido en nucleótidos es superior al que pueda presentarse en los preparados infantiles11. Por ello no se detectarían las diferencias entre los lactantes que consumen el preparado enriquecido y el grupo control, a pesar de disponer de métodos sensibles para la determinación de AG eritrocitarios54.
También se ha descrito que pueden tener efectos sobre la microbiota intestinal, si bien los estudios son controvertidos. En este sentido Balmer y cols.55 no observan ninguna variación en la microbiota intestinal de niños alimentados con preparados suplementados con nucleótidos (3,4 mg/100 mL), respecto a aquellos que consumen preparados sin suplementar. Sin embargo, Singhal y cols.56 observan un aumento (43%) de bifidobacterias en el grupo de lactantes alimentados con preparados suplementados con nucleótidos (3,1 mg/100 mL), frente al grupo que ingiere un preparado estándar. Este hecho puede ser atribuido a la utilización de técnicas más sensibles (determinación de rRNA vs. recuento clásico).
Cabría esperar que en el estudio en el que encuentran un aumento de bifidobacterias atribuido a la suplementación con nucleótidos, observasen una disminución del pH intestinal, que limitaría el crecimiento de otras poblaciones bacterianas, potencialmente patogénicas y disminuiría la incidencia de diarreas11. Sin embargo, Singhal y cols.56 no observan un descenso del número de episodios diarreicos en lactantes que ingieren preparados suplementados con nucleótidos. Estos autores lo atribuyen a que el grupo de estudio, por su estatus socio-económico elevado, tiene per se una baja tendencia a padecer diarreas. En este mismo sentido, Neri-Almeida y cols.57 indican que el uso de preparados suplementados con nucleótidos (7,2 mg/100 mL) no mejora el estado de salud durante episodios diarreicos en niños hospitalizados.
Brunser y cols.58 en una población de lactantes, con una alta tendencia a padecer diarreas por su bajo estatus socio-económico, tienen observan que el grupo alimentado con preparados suplementados en nucleótidos (2,0 mg/100 mL) experimentan menos episodios de diarreas que aquellos alimentados con un preparado sin suplementar. En este mismo sentido, Yau y cols.59 observan una reducción significativa del 25% en la incidencia de diarreas desde las primeras 8 a 28 semanas de vida, y un 14% desde las 8 a las 48 semanas de vida en recién nacidos alimentados durante un año con preparados enriquecidos en nucleótidos (7,2mg/100 mL).
De los estudios anteriormente mencionados se deduce que el efecto de la suplementación de nucleótidos sobre los episodios diarreicos del lactante es controvertida.
Además de los efectos descritos hasta el momento, los nucleótidos también se han relacionado con la estimulación y modulación del sistema inmunitario. Están implicados en la proliferación, maduración y activación de los linfocitos, en la estimulación de la función fagocítica de los macrófagos y en la modulación de las respuestas a injertos, tumores, infecciones, hipersensibilidad retardada y la producción de inmunoglobulinas60.
El efecto que ejercen los nucleótidos sobre los enterocitos también contribuye al normal funcionamiento del sistema inmune, ya que el 30% de las células intestinales se consideran del sistema inmunitario. Los propios enterocitos pueden actuar como células presentadoras de antígenos, produciendo citoquinas inmunomoduladoras60. En recién nacidos, se ha demostrado que los nucleótidos presentes en la alimentación incrementan la producción de inmunoglobulinas, en particular, aumenta el contenido de IgG específica frente a α-caseína y β-lacto-globulina plasmática, en recién nacidos pre-término alimentados con una fórmula suplementada con nucleótidos (3,3 mg/100 mL)61. También se ha demostrado que la adición de nucleótidos (7,2 mg/100 mL) a preparados infantiles aumentan las IgG específicas frente a H. Influenzae tipo b y difteria en recién nacidos normales, tras la vacunación, aunque no se han observado efectos en los niveles de IgG frente a las vacunas de la poliomielitis y del tétanos62. Existe controversia en este sentido, ya que Schaller y cols.63 no observan un incremento de las IgG específicas de H. Influenzae tipo b y difteria en recién nacidos alimentados con fórmulas suplementadas (7,2 mg/100 mL), pero sí en el aumento de anticuerpos específicos del poliovirus VN1.
Los estudios de metaanálisis64,65 indican que los datos aportados hasta el momento son suficientes para justificar la adición de nucleótidos a fórmulas infantiles, especialmente en grupos de "riesgo", como los niños pre-término, los de bajo peso al nacer, que sufran retrasos en la maduración del sistema inmune o que hayan padecido daños intestinales severos, si bien se requieren más estudios.
Al respecto la EFSA, en base a la propuesta de declaración de propiedad saludable relativa a los nucleótidos como componentes activos beneficiosos para el sistema inmune y digestivo (artículo 13.1, declaración de propiedades saludables distintas de las relativas a la reducción de riesgo de enfermedad y al desarrollo y la salud de los niños, Reglamentos 1924/2006), ha informado desfavorablemente debido a la falta de estudios causa-efecto que relacionen la ingesta dietética de nucleótidos y la defensa inmunitaria frente a patógenos66. La declaración saludable solicitada indicaba: "Contribuye al funcionamiento normal del sistema inmune/da soporte a los sistemas de defensa naturales" (ID 1623) y "Los nucleótidos son nutrientes condicionalmente esenciales que proveen de elementos necesarios para el desarrollo y crecimiento de nuevas células; promueven el bienestar generalizado, aumentan la inmunidad corporal y ayudan a promover una función digestiva/intestinal adecuada/normal" (ID 1626).
Por otra parte, su adición a concentraciones y relaciones entre cada uno de ellos similares a los descritos en leche humana, se considera segura siempre y cuando no se superen los 5 mg/100 kcal, como indica la ESPG-HAN67 y la legislación vigente15. No obstante, se estima necesario controlar los procesos de producción, ya que algunos metabolitos de la adenosina generados durante la elaboración pueden presentar efectos adversos y se ha indicado nefrotoxicidad y menor aumento de peso en ratas adultas tras ingerir altos niveles de adenina68.
Conclusiones
Los estudios clínicos realizados hasta el momento, relativos a la funcionalidad de prebióticos (FOS y GOS) en lactantes alimentados con preparados suplementados con OS, parecen indicar un efecto bifidogénico similar al de la leche materna, junto con deposiciones más blandas y frecuentes y un posible efecto beneficioso relacionado con la disminución de episodios infecciosos y manifestaciones alérgicas (menor incidencia de dermatitis atópica). Sin embargo, como se ha indicado anteriormente, son necesarios más estudios a largo plazo, con mayor número de individuos y aleatorizados, para poder establecer declaraciones saludables con mayor base científica respecto a la mezcla de prebióticos (GOS/FOS) adicionada a preparados infantiles.
En el caso de los nucleótidos, también se requieren más estudios sobre sus efectos beneficiosos. Para ello deberían estandarizarse las cantidades suplementadas, y demás condiciones experimentales, para eliminar factores de confusión que se encuentran al analizar los distintos estudios realizados hasta el momento.
Si bien la legislación considera opcional la adición de prebióticos (GOS/FOS) y nucleótidos a preparados infantiles, la tendencia actual a su inclusión en la formulación de estos productos puede justificarse en base a las evidencias científicas disponibles hasta el momento, así como a su seguridad y a su presencia en la leche materna.
Referencias
1. Rivero M, Santamaría A, Rodríguez-Palmero M. La importancia de los ingredientes funcionales en las leches y cereales infantiles. Nutr Hosp 2005; 20: 135-146. [ Links ]
2. Niers L, Stasse-Wolthuis M, Rombouts FM, Rijkers GT. Nutritional support for the infant's immune system. Nutr Rev 2007; 1: 347-360. [ Links ]
3. Van Loo J, Cummings J, Delzenne N, y cols. Functional food properties of non-digestible oligosaccharides: a consensus report from the ENDO project (DGXII AIRII-CT94-1095). Br J Nutr 1999; 81: 121-132. [ Links ]
4. Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 1995; 125: 1401-1412. [ Links ]
5. Zuppa AA, Aligheri G, Scorrano A. Prebiotics and probiotics in infant nutrition. In Bioactive Foods in Promoting Health: Probiotics and Prebiotics. Ed. Elsevier. London, UK. 2010, chapter 27, pp. 441-477. [ Links ]
6. Gibson GR, Probert HM, Van Loo J, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev 2004; 17: 259-275. [ Links ]
7. Olveira-Fuster G, González-Molero I. Probióticos y prebióticos en la práctica clínica. Nutr Hosp 2007; 22: 26-34. [ Links ]
8. Moreno-Villares JM. Prebiotics in infant formulas: risks and benefits. In Bioactive Foods in Promoting Health: Probiotics and Prebiotics. Ed. Elsevier. London, UK . 2010, chapter 8, pp 117-129. [ Links ]
9. Romeo J, Nova E, Wärnberg J, Gómez-Martínez S, Díaz-Ligia LE, Marcos A. Immunomodulatory effect of fibres, probiotics and synbiotics in different life-stages. Nutr Hosp 2010; 25: 341-349. [ Links ]
10. Agostoni C, Axelsson I, Braegger C y cols. Probiotic bacteria in dietetic products for infants: a commentary by the ESPGHAN Committe on Nutrition. J Pediatr Gastroenterol Nutr 2004; 38:365-374. [ Links ]
11. Gil A, Sánchez-Pozo A. Metabolismo de los nucleótidos. En: Gil A. Tratado de nutrición. Tomo I, Bases fisológicas y bioquímicas de la nutrición. Ed. Panamericana, 2a Edición. Madrid. 2010; 379-404. [ Links ]
12. Lerner A, Shamir R. Nucleotides in infant nutrition: a must or an option. Israel Med Assoc J 2000; 2: 772-774. [ Links ]
13. Yu VYH. Scientific rationale and benefits of nucleotide supplementation of infant formula. J Paediatr Child Health. 2002; 38:543-549. [ Links ]
14. Directiva 2006/141/CE de la Comisión, de 22 de diciembre, relativa a los preparados para lactantes y preparados de continuación y por la que se modifica la Directiva 1999/21/CE. Diario Oficial de la Unión Europea. 401, 1-33. [ Links ]
15. Real Decreto 867/2008, de 23 de mayo por el que se aprueba la Reglamentación Técnico Sanitaria específica de los preparados para lactantes y de los preparados de continuación. BOE 131, 25121-25137. Corrección de errores del Real Decreto 867/2008, de 23 de mayo. BOE 187, 66598. [ Links ]
16. Boehm G, Lidestri M, Cassetta P, Jelinek J, Negretti F, Stahl B, Marini A. Supplementation of a bovine milk infant formula with an oligosaccharide mixture increases counts of faecal bifidobacteria in preterm infants. Arch Dis Child Fetal Neonatal Ed 2002; 86: 178-181. [ Links ]
17. Moro G, Minoli I, Mosca M, Fanaro S, Jelinek J, Stahl B, Boehm G. Dosage related bifidogenic effects of galacto and fructo-oligosaccharides in formula fed term infants. J Pediatr Gastroenterol Nutr 2002; 34: 291-295. [ Links ]
18. Schmelzle H, Wirth S, Skopnik H y cols. Randomized doubleblind study of the nutritional efficacy and bifidogenecity of a new infant formula containing partially hydrolyzed protein, a high beta-palmitic acid level, and nondigestible oligosaccharides. J Pediatr Gastroenterol Nutr 2003; 36: 343-351. [ Links ]
19. Ben X, Zhou X, Zhao W, Yu W, Pan W, Zhang W, Wu S, Christian M, Schaafsma A. Supplementation of milk formula with galactooligosaccharides improves intestinal micro flora and fermentation in term infants. Chin Med J 2004; 117: 927-931. [ Links ]
20. Knol J, Scholtens P, Kafka C, Steenbakkers J, Gro S, Helm K y cols. Colon microbiota in infants fed formula with galacto- and fructo-oligosaccharides: more like breast-fed infants. J Pediatr Gastroenterol Nutr 2005; 40: 36-42. [ Links ]
21. Euler AR, Mitchell DK, Kline R, Pickering LK. Prebiotic effect of fructo-oligosaccharide supplemented term infant formula at two concentrations compared with unsupplemented formula and human milk. J Pediatr Gastroenterol Nutr 2005; 40: 157-164. [ Links ]
22. Fanaro S, Jelinek J, Stahl B, Boehm G, Kock R, Vigi V. Acidic oligosaccharides from pectin hydrolisate as new component for infant formulae: effect on intestinal flora, stool characteristics, and pH. J Pediatr Gastroenterol Nutr 2005; 41: 186-190. [ Links ]
23. Brunser O, Gotteland M, Cruchet S, y cols. Effect of milk formula with prebiotics on the intestinal microbiota of infants after an antibiotic treatment. Pediatr Res 2006; 59: 451-456. [ Links ]
24. Moro G, Arslanoglu S, Stahl B, y cols. A mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age. Arch Dis Child 2006; 91: 814-819. [ Links ]
25. Kapiki A, Costalos C, Oikonomidou C, y cols. The effect of a fructo-oligosaccharide supplemented formula on gut flora of preterm infants. Early Hum Dev 2007; 83: 335-339. [ Links ]
26. Fanaro S, Marten B, Bagna R, y cols. Galacto-oligosaccharides are bifidogenic and safe at weaning: a double-blind randomized multicenter Study. J Pediatr Gastroenterol Nutr 2009; 48: 82-88. [ Links ]
27. Salvani F, Riva E, Salvatici E, Boehm G, Jelinek J, Banderali G, Giovannini M. A specific prebiotic mixture added to starting infant formula has long-lasting bifidogenic effects. J Nutr 2011; 141: 1335-1339. [ Links ]
28. Veereman-Wauters S, Staelens S, Van de Broek H, Palskie K, Wesling F, Roger LC, McCartney AL, Assam P. Physiological and bifidogenic effects of prebiotic supplements in infant formulae. J Pediatr Gastroenterol Nutr 2011; 52:763-771. [ Links ]
29. Mihatsch WA, Hoegel J, Pohlandt F. Prebiotic oligosaccharides reduce stool viscosity and accelerate gastrointestinal transport in preterm infants. Acta Paediatr 2006; 95: 843-848. [ Links ]
30. Ziegler E, Vanderhoof JA, Petschow B y cols. Term infants fed formula supplemented with selected blends of prebiotics grow normally and have soft stools similar to those reported for breastfed infants. J Pediatr Gastroenterol Nutr 2007; 44:359-364. [ Links ]
31. Costalos C, Kapiki A, Apostolou M, Papathoma E. The effect of a prebiotic supplemented formula on growth and stool microbiology of term infants. Early Hum Dev2008; 84: 45-49. [ Links ]
32. Westerbeek EAM, Hensgens RL, Mihatsch WA, Boehm G, Lafeber HN, van Helburg RM. The effect of neutral and acidic oligosaccharides on stool viscosity, stool frequency and stool pH in preterm infants. Acta Paediatr. 2011; 100: 1426-1431. [ Links ]
33. Bruzzese E, Volpicelli M, Salvani F y cols. Effect of early administration of GOS/FOS on the prevention of intestinal and extra-intestinal infections in healthy infants. J Pediatr Gastroenterol Nutr 2006; 42: E95. [ Links ]
34. Arslanoglu S, Moro GE, Boehm G. Early supplementation of prebiotics oligosaccharides protects formula-fed infants against infections during the first 6 months of life. J Nutr 2007; 137: 2420-2424. [ Links ]
35. Arslanoglu S, Moro GE, Schmitt J y cols. Early dietary intervention with a mixture of prebiotics oligosaccharides reduces incidence of allergic manifestations and infections during the first two years of life. J Nutr 2008; 138: 1091-1095. [ Links ]
36. Bruzzese E, Volpicelli M, Squeglia V, Bruzzese D, y cols. A formula containing galacto- and fructo-oligosaccharides prevents intestinal and extra-intestinal infections: An observational study. Clin Nutr 2009; 28: 156-161. [ Links ]
37. Grüber C, van Stuijvenberg M, Mosca F, Moro G, Chirico G, y cols. Reduced occurrence of early atopic dermatitis because of immunoactive prebiotics among low-atopy-risk infants. J Allergy Clin Immunol 2010; 126: 791-797. [ Links ]
38. Schouten B, Van Esch BCAM, Kormelink TG, Moro GE y cols. Non-digestible oligosaccharides reduce immunoglobulin free light-chain concentrations in infants at risk for allergy. Pediatr Allergy Immnunol 2011; 22: 537-542. [ Links ]
39. Decsi T, Arató A, Balogh M y cols. Randomised placebo controlled double blind study on the effect of prebiotic oligosac-charides on intestinal flora in healthy infants. Orv Hetil 2005; 146: 2445-2450. [ Links ]
40. Bettler J, Euler AR. An evaluation of the growth of term infants fed formula supplemented with fructo-oligosacchairde. Int J Probiotics Prebiotics 2006; 1: 19-26. [ Links ]
41. Alliet P, Scholtens P, Raes M y cols. Effect of prebiotic galacto-oligosaccharide, long-chain fructo-oligosaccharide infant formula on serum cholesterol and triacylglycerol levels. Nutrition 2007; 23: 719-723. [ Links ]
42. Nakamura N, Gaskins HR, Collier CT y cols. Molecular ecological analysis of fecal bacterial populations from term infants fed formula supplemented with selected blends of prebiotics. Appl Environ Microbiol 2009; 75: 1121-1128. [ Links ]
43. Braegger C, Chmielwska A, Decsi T, Kolacek S y cols. Supplementation of infant formula with probiotics and/or prebiotics: a systematic review and comment by the ESPGHAN Comitte on Nutrition. J Pediatr Gastroenterol Nutr 2011; 52: 238-250. [ Links ]
44. ESPGHAN Committee on Nutrition: Koletzko B y cols. Global Standard for the composition of infant formula: Recommendations of an ESPGHAN coordinated international expert group. J Pediatr Gastroenterol Nutr 2005; 41: 584-599. [ Links ]
45. EFSA Panel on dietetic products, nutrition and allergies (NDA); scientific opinion on the substantiation of health claims related to fructooligosaccharides (FOS) from sucrose and decreasing potentially pathogenic gastro-intestinal microorganisms (ID 774), changes in short chain fatty acid (SCFA) production and pH in the gastro-intestinal tract (ID 775), changes in bowel function (ID 775, 778), reduction of gastrointestinal discomfort (ID 775, 778), increase in calcium and/or magnesium absorption leading to an increase in magnesium and/or calcium retention (ID 776, 777), maintenance of normal blood LDL-cholesterol concentrations (ID 805) and maintenance of normal (fasting) blood concentrations of triglycerides (ID 805) pursuant to Article 13 (1) of Regulation (EC) No 1924/2006. EFSA Journal 2011; 9 (4) 2023, 25 pp. [ Links ]
46. Moore N, Chao CW, Yang LP, Storm H, Oliva-Hemker M, Saavedra JM. Effects of fructooligosaccharide-supplemented infant cereal: a double-blind, randomized trial. Br J Nutr 2003; 90: 581-587. [ Links ]
47. Hernández-Rodríguez M. Alimentación en la primera infancia. En Tratado de Nutrición. Ed. Díaz de Santos, Madrid. 1999, capítulo 52, pp. 809-829. [ Links ]
48. Thomas DW, Greer FR, and Committee on Nutrition: Section on Gastroenterology, Hepatology and Nutrition. Probiotics and prebiotics in pediatrics. Pediatrics 2010; 126: 1217-1231. [ Links ]
49. Leach JL, Baxter JH, Molitor BE, Ramstack MB, Masor ML. Total potential available nucleosides of human milk by stage of lactation. Am J Clin Nutr 1995; 61: 1224-1230. [ Links ]
50. Gil A, Pita ML, Martínez A, Molina JA, Sánchez-Medina F. Effect of dietary nucleotides on the plasma fatty acids in at-term neonates. Hum Nutr Clin Nutr 1986; 40: 185-195. [ Links ]
51. DeLucchi C, Pita ML, Faus MJ, Molina JA, Uauy R, Gil A. Effects of dietary nucleotides on the fatty acid composition of erythrocyte membrane lipids in term infants. J Ped Gastr Nutr 1987; 6: 568-574. [ Links ]
52. Pita ML, Fernández MR, DeLucchi C, Medina A, Martínez-Valverde A, Uauy R, Gil A. Changes in the fatty acids pattern of red blood cell phospholipids induced by type of milk, dietary nucleotide supplementation, and postnatal age in preterm infants. J Pediatr GastrNutr 1988; 7: 740-747. [ Links ]
53. Sánchez-Pozo A, Morillas J, Molto L, Robles R, Gil A. Dietary nucleotides influence lipoprotein metabolism in newborn infants. Pediatr Res 1994; 35: 112-116. [ Links ]
54. Gibson RA, Hawkes JS, Makrides M. Dietary nucleotides do not alter erythrocyte long-chain polyunsaturated fatty acids in formula-fed term infants. Lipids 2005; 631-634. [ Links ]
55. Balmer, SE, Hanvey LS, Wharton BA. Diet and faecal flora in the newborn: nucleotides. Arch Dis Child 1994; 70: F137-F140. [ Links ]
56. Singhal A, Macfarlane G, Macfarlane S, Lanigan J, Kennedy K, Elias-Jones A, Stephenson T, Dudek P, Lucas A. Dietary nucleotides and fecal microbiota in formula-fed infants: a randomized controlled trial. Am J Clin Nutr 2008; 87: 1785-1792. [ Links ]
57. Neri-Almeida D, Peixoto A, Medrado TC, Silva P, Santos S, da Costa H. Lack of effect of nucleotide-supplemented infant formula on the management of acute diarrhea in infants. Nutr Res 2009; 29: 244-247. [ Links ]
58. Brunser O, Espinoza J, Araya M, Cruchet S, Gil A. Effect of dietary nucleotide supplementation on diarrhoeal disease in infants. Acta Pediatr Chile 1994; 83: 188-191. [ Links ]
59. Yau KIT, Huang CB, Chen W. Effect of nucleotides on diarrhea and immune responses in healthy term infants in Taiwan. J Pediatr Gastroenterol Nutr 2003; 43: 37-43. [ Links ]
60. Rueda R, Gil A. Nutrición e inmunidad. En: Gil, A. Tratado de nutrición. Tomo I, Bases fisológicas y bioquímicas de la nutrición. Ed. Panamericana, 2a Edición. 2010; 1: 895-924. [ Links ]
61. Martínez-Agustín O, Boza JJ, Del Pino JI, Lucena J, Martínez-Valverde A, Gil A. Dietary nucleotides might influence the humora immune response against cow's milk proteins in pre-term neonates. Biol Neonates 1997; 71: 215-223. [ Links ]
62. Pickering LK, Granoff DM, Erickson JR. Modulation of the immune system by human milk and infant formula containing nucleotides. Pediatrics 1998; 101: 242-249. [ Links ]
63. Schaller JP, Kuchan MJ, Thomas DL. Effect of dietary ribonucleotides on infant immune status. Part 1: Humoral responses. Pediatr Res 2004; 56: 883-890. [ Links ]
64. Gutiérrez-Castrellón P, Mora-Magaña I, Díaz-García L, Jiménez-Gutiérrez C, Ramírez-Mayans J, Solomon-Santibáñez A. Immune response to nucleotide-supplemented infant formulae: systematic review and meta-analysis. Brit J Nutr 2007; 98: S64-S67. [ Links ]
65. Salvatore S, Hauser B, Devreker T, Arrigo S, Vandeplas Y. Chronic enteropathy and feeding in children: An update. Nutrition 2008; 24: 1205-1216. [ Links ]
66. EFSA Panel on Dietetic Products, Nutrition and Allergies. Scientific Opinion on the substantiation of health claims related to nucleotides and immune defense against pathogens (ID 1623, 1626) pursuant to Article 13 (1) of Regulation (EC) No 1924/2006 on request from the European Commission. EFSA Journal 2011; 9 (2066): 1-13. [ Links ]
67. Koletzko B, Baker S, Cleghorn G. Global standard for the composition of infant formula: recommendations of an ESPGHAN coordinated international expert group. J Pediatr Gastroenterol Nutr 2005; 41: 584-599. [ Links ]
68. Brulé D, Sarwar G, Savoic L, Campbell J, Van Zegglesar M. Differences in uricogenic effects of dietary purine bases, nucleosides and nucleotides in rats. J Nutr 1988; 118: 780-786. [ Links ]
69. Raes M, Scholtens PAMJ, Alliet Ph, Hensen K, y cols. Exploration of basal immune parameters in healthy infants receiving an infant milk formula supplemented with prebiotics. Pediatr Allergy Immunol 2010; 21: e377-e385. [ Links ]
70. Stam J, van Stuijvenberg M, Garssen J, Knipping K, Sauer PJJ. A mixture of three prebiotics does not affect vaccine specific antibody responses in healthy term infants in the first year of life. Vaccine 2011; 29: 7766-7772. [ Links ]
71. Singhal A, Kennedy K, Lanigan J, Clough H, y cols. Dietary nucleotides and early growth in formula-fed infants: A randomized controlled trial. Pediatrics 2010; 126: e946-e953. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Amparo Alegría Torán.
Departamento de Nutrición y Bromatología.
Facultad de Farmacia. Universidad de Valencia.
Avda. Vicente Andrés Estellés, s/n.
46100 Burjasot. Valencia. España.
E-mail: amparo.alegria@uv.es
Recibido: 21-II-2012.
Aceptado: 2-III-2012.