Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.28 no.1 Madrid ene./feb. 2013
https://dx.doi.org/10.3305/nh.2013.28.1.6177
ORIGINAL
Asociación de sobrepeso y uso de glucocorticoides con componentes del síndrome metabólico en pacientes oncológicos en quimioterapia
Association between overweight, glucocorticoids and metabolic syndrome in cancer patients under chemotherapy
Karla Sánchez-Lara, Diego Hernández, Daniel Motola y Dan Green
Centro Oncológico Integral. Hospital Médica Sur. México.
Dirección para correspondencia
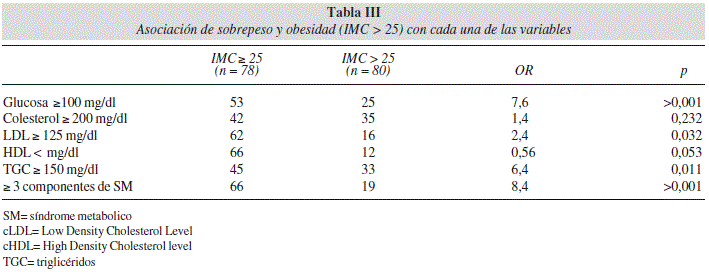
RESUMEN En pacientes con diagnostico de cáncer en tratamiento con quimioterapia es común encontrar componentes del síndrome metabólico (SM) como sobrepeso, obesidad, resistencia a la insulina e hiperglicemia. Estos componentes se han asociado a mayor recurrencia de la enfermedad. Palabras clave: Cáncer. Síndrome metabólico. Obesidad. Glucocorticoides. ABSTRACT Metabolic syndrome components like overweight, obesity, insulin resistance, and hyperglycemia are common findings in patients with cancer diagnosis under chemotherapy treatment. These factors have been associated with higher recurrence rates. This study associates Body Mass index, steroids treatment and tumor site with metabolic syndrome (MS) components in patients with cancer diagnosis under chemotherapy treatment. Key words: Cancer. Metabolic syndrome. Obesity. Glucocorticoids. Abreviaturas Introducción El Síndrome metabólico (SM) es uno de los principales problemas de salud en nuestro país. Este síndrome se caracteriza por la presencia de: resistencia a la insulina, dislipidemia, hipertensión arterial, sobrepeso y obesidad central los cuales son factores que se asocian a estados proinflamatorios y protrombóticos1. Los pacientes oncológicos, presentan alteraciones metabólicas que son derivadas de efectos adversos del padecimiento y del tratamiento como cambios de peso agudo, periodos de ayuno prolongados, alteraciones en el gasto energético, estrés metabólico, adaptaciones de respuesta inflamatoria y la utilización de algunos medicamentos como glucocorticoides2. Por lo tanto, es común encontrar en dichos pacientes componentes del SM como obesidad, hiperglicemia y alteraciones en el perfil de lípidos3. Los diversos mecanismos que intervienen en dichos cambios metabólicos aún no se comprenden del todo, las células malignas no solamente consumen nutrimentos con mayor afinidad que las de tejidos normales, sino que además, secretan sustancias como las citoquinas, que incrementan la actividad de vías anabólicas incluyendo la proteólisis, lipólisis y un excesivo funcionamiento del ciclo de Cori en el hígado por el aumento en la utilización hepática del lactato producido por el tumor4-6 ; lo que promueve la disminución en la captación y utilización de glucosa, favorece la resistencia a la insulina y el aumenta los niveles séricos de triglicéridos (TGC) 7-9. Por otro lado, el uso de glucocorticoides es muy común en estos pacientes como tratamiento especifico o como premedicación, debido a sus propiedades antiinflamatorias e inmunosupresoras10-12. Estos fármacos tienen un efecto lipolítico y estimulan la conversión de proteínas en glucosa, además su almacenamiento en glucógeno, aumentan la gluconeogénesis y disminuyen la sensibilidad a la insulina, promoviendo hiperglicemia13-14. Es importante detectar los componentes de SM en los pacientes oncológicos, debido a que la resistencia a la insulina, hiperglucemia y obesidad se asocian a una mayor incidencia, y recurrencia del cáncer15-23, y mayor edad de diagnóstico en pacientes con cáncer de mama 24. El objetivo de este estudio fue describir la frecuencia de alteraciones en los niveles séricos de glucosa y perfil de lípidos y su asociación con índice de masa corporal (IMC), uso de glucocorticoides y sitio de tumor en pacientes oncológicos atendidos en el periodo Enero 2008 a Diciembre 2010 en un Centro Oncológico de un Hospital universitario de la Ciudad de México Material y métodos Se revisaron los expedientes del Centro Oncológico Integral del Hospital Médica Sur del período enero 2008 a diciembre 2010, se seleccionaron los expedientes que tenían información completa a cerca de datos antropométricos y de laboratorio de pacientes con diagnostico histopatológico de cáncer y en tratamiento sistémico con quimioterapia. Para definir síndrome metabólico se tomaron los criterios diagnósticos definidos ATP III (Adult Treatment Panel III; National Cholesterol Education Program: 2001). El SM se definió como la presencia de 3 o mas de los siguientes criterios: Triglicéridos >150 mg/dL; Colesterol HDL < 40 mg/dl en hombres y < 50 mg/dl en mujeres, glucosa en ayuno >110mg/dl. Para el análisis estadísitico se prueba de Kolmogorov-Smirnov para ver la distribución de las variables, además se utilizó estadística descriptiva (frecuencias, media y desviación estándar) y prueba de Chi cuadrado y se consideró significancia estadística con una p < 0.05, se utilizó el programa SPSS versión 17. Resultados Se incluyeron 158 pacientes, el promedio de edad fue de 52,9 ± 9,4 años. 120 (75,9%) fueron mujeres y 38 (24,1%) hombres. El tumor más prevalente fue el cáncer de mama 88 (55.6%), seguido por cáncer gastrointestinal 49 (31%) pulmón 13 (8,2%) y otros sitios de tumor n = 8 (5,0%); el 43,6% de los pacientes recibieron como parte de su tratamiento glucocorticoesteroides (dexametasona). Los pacientes presentaron un promedio de niveles séricos de glucosa, colesterol total y triglicéridos por arriba del rango normal. Más de la mitad de los pacientes presentaron >3 componentes del SM (56,3%) (tabla I). El promedio de IMC de los pacientes fue de sobrepeso IMC = 25,3 Kg/m2. La presencia de sobrepeso y obesidad (IMC ≥ 25 Kg/m2) también mostraron una fuerte asociación con la presencia de SM (OR = 13,6). El sitio anatómico del tumor que se asoció significativamente con 3 o más componentes del SM fue el cáncer de mama (OR = 2,4) (tabla II). En la tabla III se muestra la asociación entre los componentes del SM con la presencia de sobrepeso u obesidad, siendo significativa con los niveles séricos anormales de glucosa ≥ 100, colesterol low density level (cLDL) ≥ 125, colesterol high density level (cHDL) ≤ 50 y triglycerides (TGC) ≥ 150 mg/dl. El diagnóstico de cáncer de mama se asoció significativamente con IMC ≥ 25, colesterol ≥ 200 mg/dl y con la presencia de ≥ 3 componentes del SM (tabla IV). Se realizó un análisis para determinar si la utilización de glucocorticoiodes durante el tratamiento se asociaba a la presencia de SM, como se observa en la tabla V, ninguno de los componentes del SM se asocia significativamente con la administración de glucocorticoides en los pacientes oncológicos. Discusión Es bien sabido que uno de los factores de riesgo en el desarrollo de neoplasias malignas es el sobrepeso y obesidad25-29, un IMC alto está asociado con aumento de los niveles séricos de insulina30-31, del Factor De Crecimiento Tipo Insulínico (IGF-1) y con una mayor prevalencia de SM, que a su vez, se han relacionado con aumento de riesgo de desarrollar neoplasias malignas32,33-36. Generalmente, los pacientes oncológicos presentan pérdida de peso, en la población estudiada el promedio de IMC fue de 25,3 kg/m2 (sobrepeso), lo cual hace pensar que es muy probable que dichos pacientes presentaran obesidad previa al diagnóstico. Aquellos pacientes con un IMC > 25 tuvieron significativamente niveles más altos de glucosa, cLDL, HDL, TGC y presentaron 12,6 veces más el riesgo de tener 3 o más componentes del SM. Resultados similares se han encontrado en estudios con obesos mórbidos, el 55,6% de los hombres y 42,3% de las mujeres fueron portadores de 3 o más criterios del SM37. La prevalencia de obesidad, diabetes y SM ha incrementado al igual que la incidencia de algunas neoplasias asociadas a dichos padecimientos38 como es el caso de uno de los sitios de tumor con mayor incidencia en nuestro país, el cáncer de mama; en la población estudiada fue el sitio de tumor más prevalente (25,3%), en estas pacientes, la prevalencia de SM fue de 63,6%, mayor que la reportada en un reciente estudio publicado por Porto et al39 (59,2%) en pacientes con la misma neoplasia en Brasil. De todos los sitios de tumor, el diagnóstico de cáncer de mama fue el que se asoció significativamente con sobrepeso (OR = 8,5) colesterol sérico > 200 mg/dl (OR = 6,5) y > 3 componentes del SM (OR = 4,31); se ha hipotetizado que el colesterol elevado incrementa el riesgo de padecer cáncer de mama debido a que es un precursor de hormonas esteroideas40 y la producción endógena de éstas se asocia con el incremento de riesgo de esta neoplasia 41. La relación entre los niveles de colesterol y el cáncer de mama ha sido evaluada en varios estudios42-46, la mayoría concuerdan en la asociación positiva con niveles elevados de colesterol total, LDL y disminución de HDL44, 46-49 Recientemente, un estudio de cohorte prospectivo llevado a cabo en mujeres noruegas (n = 38.823) demostró los niveles bajos de colesterol HDL como factor asociado e independiente del riesgo de cáncer de mama en mujeres posmenopáusicas con sobrepeso48. Los mecanismos aún no están bien descritos, al respecto Subbaiah y cols50, encontraron aumento en la relación colesterol libre/colesterol esterificado y disminución en la actividad de la enzima encargada de la estirificación LCAT en pacientes con cáncer de mama, los autores relacionaron la actividad reducida de la enzima con la presencia de alteraciones en la composición de las lipoproteinas, especialmente las HDL. Este mecanismo podría conducir a una inhibición en el transporte reverso del colesterol, agregado a las alteraciones metabólicas. Por otro lado, existen otros factores en dicha neoplasia asociados con la obesidad -principalmente de localización abdominal- como la hiperinsulinemia e insulino-resistencia y el aumento en la producción de estrógenos proporcional al tejido adiposo51 que estimulan la síntesis de ADN y la proliferación celular in vitro a través del receptor del factor de crecimiento insulina (IGF-1)52, sin embargo, en el presente estudio, el diagnóstico de cáncer de mama no se asoció significativamente con niveles séricos de glucosa altos como lo reportado en un metaanálisis de 23 estudios19, donde la presencia de diabetes y la incidencia de cáncer de mama tuvo un riesgo relativo de 1,2 ( p = 0,01 IC95% 1,12-1,28). Asimismo, los niveles séricos de glucosa elevados no se asociaron con el uso de glucocorticoides como parte del tratamiento oncológico, se ha descrito que su uso crónico tiene un papel clave en la incidencia y el desarrollo del síndrome metabólico; el uso de dexametasona (DEX) se ha asociado con hiperinsulinemia e hiperglucemia, tanto en modelos animales como en humanos53-54. En la población estudiada, más del 40% de los pacientes tenían uso de glucocorticoides como parte de su tratamiento y dicha variable no se asoció con niveles altos de glucosa sérica en ayuno ni con ningún otro de los componentes del SM, o con la presencia de >3 de estos. En este análisis se puede observar pues, que el factor más importante asociado a la presencia de SM en pacientes oncológicos fue el sobrepeso y obesidad. Conclusiones El sitio de tumor que se asoció significativamente a la presencia del SM fue el cáncer de mama. Los pacientes oncológicos con sobrepeso y obesidad presentan niveles séricos de glucosa, TGC y cLDL significativamente mayores que los pacientes con peso normal, y niveles de cHDL menores; asi mismo, los sujetos con IMC > 25 tienen 12,6 veces más el riesgo de padecer síndrome metabólico, independientemente del uso de glucocorticoides en el tratamiento, que no se asoció con ninguno de los componentes del SM. El mantenimiento de un peso adecuado en el paciente oncológico es importante para reducir los factores de riesgo del SM. Referencias 1. Ford ES, Giles WH, Mokdad AH. Increasing prevalence of the metabolic syndrome among u.s. Adults. Diabetes Care 2004; 27: 2444-9. [ Links ] 2. Sosa-Sanchez R, Sanchez-Lara K, Motola-Kuba D, Green-Renner D. The cachexia-anorexia syndrome among oncological patients. Gac Med Mex 2008; 144: 435-40. [ Links ] 3. Zhou JR, Blackburn GL, Walker WA. Symposium introduction: metabolic syndrome and the onset of cancer. Am J Clin Nutr 2007; 86: s817-9. [ Links ] 4. Norton JA, Stein TP, Brennan MF. Whole body protein synthesis and turnover in normal man and malnourished patients with and without known cancer. Ann Surg 1981; 194: 123-8. [ Links ] 5. Bing C, Brown M, King P, Collins P, Tisdale MJ, Williams G. Increased gene expression of brown fat uncoupling protein (UCP)1 and skeletal muscle UCP2 and UCP3 in MAC16-induced cancer cachexia. Cancer Res 2000; 60: 2405-10. [ Links ] 6. Mantovani G, Madeddu C, Maccio A, et al. Cancer-related anorexia/cachexia syndrome and oxidative stress: an innovative approach beyond current treatment. Cancer Epidemiol Biomarkers Prev 2004; 13: 1651-9. [ Links ] 7. Minchota EC, Molina GC, Povedab MD, Hernández JÁ, Martínez JJG. Nutrición basada en la evidencia en el cáncer como enfermedad caquectizante. Endocrinol Nutr 2005; 52 (Suppl. 1). [ Links ] 8. Garcia-Luna PP, Parejo Campos J, Pereira Cunill JL. Causes and impact of hyponutrition and cachexia in the oncologic patient. Nutr Hosp 2006; 21 Suppl 3: 10-6. [ Links ] 9. Langstein HN, Norton JA. Mechanisms of cancer cachexia. Hematol Oncol Clin North Am 1991; 5: 103-23. [ Links ] 10. Ettinger A, Portenoy R. The use of corticosteroids in the treatment of symptoms associated with cancer. J Pain Symptom Manage 1988; 3: 99-103. [ Links ] 11. Mercadante SL, Berchovich M, Casuccio A, Fulfaro F, Mangione S. A prospective randomized study of corticosteroids as adjuvant drugs to opioids in advanced cancer patients. Am J Hosp Palliat Care 2007; 24: 13-9. [ Links ] 12. Moutsatsou P, Papavassiliou AG. The glucocorticoid receptor signalling in breast cancer. J Cell Mol Med 2008; 12: 145-63. [ Links ] 13. Qi D, Rodrigues B. Glucocorticoids produce whole body insulin resistance with changes in cardiac metabolism. Am J Physiol Endocrinol Metab 2007; 292: E654-67. [ Links ] 14. Rafacho A, Giozzet VA, Boschero AC, Bosqueiro JR. Functional alterations in endocrine pancreas of rats with different degrees of dexamethasone-induced insulin resistance. Pancreas 2008; 36: 284-93. [ Links ] 15. Facchini FS, Hua N, Abbasi F, Reaven GM. Insulin resistance as a predictor of age-related diseases. J Clin Endocrinol Metab 2001; 86: 3574-8. [ Links ] 16. Jee SH, Ohrr H, Sull JW, Yun JE, Ji M, Samet JM. Fasting serum glucose level and cancer risk in Korean men and women. JAMA 2005; 293: 194-202. [ Links ] 17. Saydah SH, Loria CM, Eberhardt MS, Brancati FL. Abnormal glucose tolerance and the risk of cancer death in the United States. Am J Epidemiol 2003; 157: 1092-100. [ Links ] 18. Goodwin PJ, Ennis M, Pritchard KI, et al. Fasting insulin and outcome in early-stage breast cancer: results of a prospective cohort study. J Clin Oncol 2002; 20: 42-51. [ Links ] 19. Larsson SC, Mantzoros CS, Wolk A. Diabetes mellitus and risk of breast cancer: a meta-analysis. Int J Cancer 2007; 121: 856-62. [ Links ] 20. Larsson SC, Orsini N, Wolk A. Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Natl Cancer Inst 2005; 97:1679-87. [ Links ] 21. Huxley R, Ansary-Moghaddam A, Berrington de Gonzalez A, Barzi F, Woodward M. Type-II diabetes and pancreatic cancer: a meta-analysis of 36 studies. Br J Cancer 2005; 92: 2076-83. [ Links ] 22. El-Serag HB, Hampel H, Javadi F. The association between diabetes and hepatocellular carcinoma: a systematic review of epidemiologic evidence. Clin Gastroenterol Hepatol 2006; 4:369-80. [ Links ] 23. Wolf I, Sadetzki S, Catane R, Karasik A, Kaufman B. Diabetes mellitus and breast cancer. Lancet Oncol 2005; 6: 103-11. [ Links ] 24. Aguilar Cordero MJ, Gonzalez Jimenez E, Garcia Lopez AP, et al. Obesity and its implication in breast cancer. Nutr Hosp 2011; 26: 899-903. [ Links ] 25. Paz-Filho G, Lim EL, Wong ML, Licinio J. Associations between adipokines and obesity-related cancer. Front Biosci 2011; 16: 1634-50. [ Links ] 26. Basen-Engquist K, Chang M. Obesity and cancer risk: recent review and evidence. Curr Oncol Rep 2011; 13: 71-6. [ Links ] 27. Prieto-Hontoria PL, Perez-Matute P, Fernandez-Galilea M, Bustos M, Martinez JA, Moreno-Aliaga MJ. Role of obesity-associated dysfunctional adipose tissue in cancer: A molecular nutrition approach. Biochim Biophys Acta 2010. [ Links ] 28. Campbell PT, Jacobs ET, Ulrich CM, et al. Case-control study of overweight, obesity, and colorectal cancer risk, overall and by tumor microsatellite instability status. J Natl Cancer Inst 2010; 102: 391-400. [ Links ] 29. Moore LL, Bradlee ML, Singer MR, et al. BMI and waist circumference as predictors of lifetime colon cancer risk in Framingham Study adults. Int J Obes Relat Metab Disord 2004; 28: 559-67. [ Links ] 30. Hillon P, Guiu B, Vincent J, Petit JM. Obesity, type 2 diabetes and risk of digestive cancer. Gastroenterol Clin Biol 2010; 34:529-33. [ Links ] 31. Gallagher EJ, Fierz Y, Ferguson RD, Leroith D. The pathway from diabetes and obesity to cancer, on the route to targeted therapy. Endocr Pract 2010: 1-30. [ Links ] 32. LeRoith D, Baserga R, Helman L, Roberts CT, Jr. Insulin-like growth factors and cancer. Ann Intern Med 1995; 122: 54-9. [ Links ] 33. Dossus L, Rinaldi S, Becker S, et al. Obesity, inflammatory markers, and endometrial cancer risk: a prospective case-control study. Endocr Relat Cancer 2010; 17: 1007-19. [ Links ] 34. Renehan AG, Soerjomataram I, Leitzmann MF. Interpreting the epidemiological evidence linking obesity and cancer: A framework for population-attributable risk estimations in Europe. Eur J Cancer 2010; 46: 2581-92. [ Links ] 35. Wang Y, Sun Y. Insulin-like growth factor receptor-1 as an anti-cancer target: blocking transformation and inducing apoptosis. Curr Cancer Drug Targets 2002; 2: 191-207. [ Links ] 36. Gallagher EJ, LeRoith D. The proliferating role of insulin and insulin-like growth factors in cancer. Trends Endocrinol Metab 2010; 21: 610-8. [ Links ] 37. Ruano Gil M, Silvestre Teruel V, Aguirregoicoa Garcia E, Criado Gomez L, Duque Lopez Y, Garcia-Blanch G. Nutrition, metabolic syndrome and morbid obesity. Nutr Hosp 2011; 26: 759-64. [ Links ] 38. Stoll BA. Western nutrition and the insulin resistance syndrome: a link to breast cancer. Eur J Clin Nutr 1999; 53: 83-7. [ Links ] 39. Porto LA, Lora KJ, Soares JC, Costa LO. Metabolic syndrome is an independent risk factor for breast cancer. Arch Gynecol Obstet 2011. [ Links ] 40. Vatten LJ, Foss OP. Total serum cholesterol and triglycerides and risk of breast cancer: a prospective study of 24,329 Norwegian women. Cancer Res 1990; 50: 2341-6. [ Links ] 41. Key T, Appleby P, Barnes I, Reeves G. Endogenous sex hormones and breast cancer in postmenopausal women: reanalysis of nine prospective studies. J Natl Cancer Inst 2002; 94: 606-16. [ Links ] 42. Alexopoulos CG, Blatsios B, Avgerinos A. Serum lipids and lipoprotein disorders in cancer patients. Cancer 1987; 60: 3065-70. [ Links ] 43. Gerber M, Cavallo F, Marubini E, et al. Liposoluble vitamins and lipid parameters in breast cancer. A joint study in northern Italy and southern France. Int J Cancer 1988; 42: 489-94. [ Links ] 44. Kumar K, Sachdanandam P, Arivazhagan R. Studies on the changes in plasma lipids and lipoproteins in patients with benign and malignant breast cancer. Biochem Int 1991; 23: 581-9. [ Links ] 45. Potischman N, McCulloch CE, Byers T, et al. Associations between breast cancer, plasma triglycerides, and cholesterol. Nutr Cancer 1991; 15: 205-15. [ Links ] 46. Kaye JA, Meier CR, Walker AM, Jick H. Statin use, hyperlipidaemia, and the risk of breast cancer. Br J Cancer 2002; 86: 1436-9. [ Links ] 47. Hoyer AP, Engholm G. Serum lipids and breast cancer risk: a cohort study of 5,207 Danish women. Cancer Causes Control 1992; 3: 403-8. [ Links ] 48. Furberg AS, Veierod MB, Wilsgaard T, Bernstein L, Thune I. Serum high-density lipoprotein cholesterol, metabolic profile, and breast cancer risk. J Natl Cancer Inst 2004; 96: 1152-60. [ Links ] 49. Schreier LE, Berg GA, Basilio FM, Lopez GI, Etkin AE, Wikinski RL. Lipoprotein alterations, abdominal fat distribution and breast cancer. Biochem Mol Biol Int 1999; 47: 681-90. [ Links ] 50. Subbaiah PV, Liu M, Witt TR. Impaired cholesterol esterification in the plasma in patients with breast cancer. Lipids 1997; 32: 157-62. [ Links ] 51. Sanchez-Lara K, Morales-Graf L, Green D, Sosa-Sanchez R, Mendez-Sanchez N. Cancer and obesity. Gac MedMex 2010; 146: 326-31. [ Links ] 52. Singletary SE. Rating the risk factors for breast cancer. Ann Surg 2003; 237: 474-82. [ Links ] 53. Binnert C SR, N Nicod, Tappy L. Dexametasona-resistencia a la insulina inducida por no muestra diferencias de género en los seres humanos sanos. Diabetes Metab 2004; 30: 321-6. [ Links ] 54. Ruzzin J, Wagman AS, Jensen J. Glucocorticoid-induced insulin resistance in skeletal muscles: defects in insulin signalling and the effects of a selective glycogen synthase kinase-3 inhibitor. Diabetologia 2005; 48: 2119-30. [ Links ] Recibido: 17-IX-2012.
Objetivos: describir la relación entre el IMC, el uso de glucocorticoides y el sitio de tumor con los factores del SM en pacientes tratados con quimioterapia de un centro hospitalario universitario.
Métodos: Estudio retrospectivo donde se revisaron expedientes de pacientes tratados en el centro oncológico del 2008 al 2010, con diagnóstico de cáncer y en tratamiento con quimioterapia sistémica. Se recopilo información acerca de datos antropométricos y criterios de SM definidos por ATP III.
Resultados: Se incluyeron 158 pacientes, 75,9% genero femenino, los tumores mas comunes fueron mama, gastrointestinal y pulmón. Más de la mitad de los pacientes presentaron >3 componentes del SM (56,3%); El 43,6% de pacientes recibieron dexametasona como parte del tratamiento. El IMC promedio fue de 25,3 Kg/m2. El diagnostico de cáncer de mama en tratamiento con quimioterapia se asoció con la presencia de 3 o más componentes del SM. La administración de glucocorticoides no se asoció a la presencia de SM.
Conclusiones: los sujetos con IMC>25 tienen 12,6 veces más el riesgo de padecer SM, independientemente del uso de glucocorticoides en el tratamiento. El mantenimiento de un peso adecuado en el paciente oncológico es importante para reducir los factores de riesgo del SM.
Methods: In this retrospective study, files from patients under chemotherapy treatment treated in a university oncology center from 2008 to 2010 where reviewed. Anthropometric data and ATP III MS criteria were reviewed.
Results: 158 patients were included, 75.9% female. Most common tumors were breast, gastrointestinal and lung cancer. 56.3% presented >3 component of MS; 43.6% of patients received Dexametasone as part of chemotherapy treatment. Mean BMI was 25.3 Kg/m2. Breast cancer diagnosis was associated with presence of 3 or more components of metabolic syndrome. Glococorticoid treatment was not significantly associated with MS diagnosis.
Conclusions: patients with IMC>25 presented 12.6 more risk of MS, independently of glucocorticoids treatment. Weight maintenance is important to reduce MS.
CaGI: Cáncer gastrointestinal.
GC: Glucocorticoides.
SM: Síndrome metabólico.
TGC: Triglicéridos.
IMC: Índice de masa corporal.
IGF-1: Factor de crecimiento insulínico.
cHDL: Colesterol de alta densidad.
cLDL: Colesterol de baja densidad.
OR: Odss ratio.![]() Dirección para correspondencia:
Dirección para correspondencia:
Karla Sánchez-Lara.
Hospital Medica Sur.
Puente de Piedra 150
14050 Tialpan (DF México).
E-mail: kpao82@hotmail.com
Aceptado: 23-X-2012.