Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.28 no.2 Madrid mar./abr. 2013
https://dx.doi.org/10.3305/nh.2013.28.2.6306
REVISIÓN
Valores del ángulo de fase por bioimpedancia eléctrica; estado nutricional y valor pronóstico
Values of the phase angle by bioelectrical impedance: nutritional status and prognostic value
L. Llames, V. Baldomero, M. L. Iglesias y L. P. Rodota
Lic. en Nutrición. Hospital Italiano de Buenos Aires. Buenos Aires. Argentina.
Dirección para correspondencia
RESUMEN
El ángulo de fase (AF) es el parámetro de la bioimpedancia (BIA) mayormente establecido para el diagnóstico de la desnutrición y el pronóstico clínico, ambos asociados con cambios en la integridad de la membrana celular y las alteraciones en el balance de líquido. El AF expresa cambios en la cantidad y la calidad de la masa de los tejidos blandos (es decir, permeabilidad de la membrana celular e hidratación).
Una gran cantidad de ensayos clínicos proponen el AF como un marcador pronóstico útil en condiciones clínicas, como en cirrosis hepática, en cáncer de mama, colon, páncreas, pulmón, también se observó en pacientes con VIH-positivos, y quirúrgicos una asociación positiva entre el AF y la supervivencia. Varios autores sugieren que el AF puede ser una herramienta importante para evaluar el resultado clínico o para evaluar la progresión de la enfermedad y este puede ser superior a otros indicadores nutricionales, bioquímicos o antropométricos.
La falta de valores de referencia ha limitado su uso en situaciones clínicas y epidemiológicas. El objetivo de esta revisión es describir los valores de referencia de ángulo de fase según diferentes condiciones clínicas propuestos en los trabajos científicos publicados.
Palabras clave: Bioimpedancia eléctrica. Ángulo de fase. Pronóstico nutricional.
ABSTRACT
Phase angle (PA) is the most established parameter from bioelectrical impedance analysis (BIA) for diagnosis of malnutrition and clinical prognosis, both associated with changes on cellular membrane integrity and alterations on fluids balance. PA expresses changes in quantity and quality of soft tissue mass (ie, cell membrane permeability and soft tissue hydration).
A large body of clinical trials propose PA as a useful prognostic marker in clinical conditions like liver cirrhosis and breast, colon, pancreatic and lung cancer; positive association between PA and survival was also observed in surgical and HIV infected patients. Several authors suggest that PA can be an important tool in the evaluation of the clinical result or of the progression of the disease, and it can even be superior to other nutritional, biochemical or anthropometric indicators.
Lack of reference values has limited its use in clinical and epidemiological situations. The purpose of this review is to describe PA reference values according to different clinical conditions as proposed in published scientific works.
Key words: Bioelectrical impedance. Phase angle. Prognostic value.
Abreviaturas
AF: Ángulo de fase.
MCC: Masa celular corporal.
VIH: Virus de Inmunodeficiencia Humana.
BIA: Bioimpedancia.
IMC: Índice de masa corporal.
DE: Desvío estandar.
Z: Impedancia.
R: Resistencia.
Xc: Reactancia.
EGS: Evaluación Global Subjetiva.
AFE: Ángulo de fase estandarizado.
RR: Riesgo relativo.
NRS-2002: Nutritional Risk Screening 2002.
%PP: Porcentaje de perdida de peso.
PT: Pliegue tricipital.
CMB: Circunferencia muscular del brazo.
RLT: Recuento total de linfocitos.
HIV: Virus de inmunodeficiencia humana.
HAART: Terapia anti retro viral altamente activa.
%MG: Porcentaje de masa grasa.
VHC: Virus de hepatitis C.
AEC: Agua extracelular.
ICC: Insuficiencia cardíaca congestiva.
CF: Clase funcional.
TAE: Tejido adiposo epicárdico.
RMN: Resonancia magnética computarizada.
T3: Triyodotironina.
SV: Sobrecarga de volumen.
Introducción
El uso de la bioimpedancia (BIA) ha ganado popularidad en la evaluación y el monitoreo del estado nutricional. La impedancia (Z), medida en ohmios, es la raíz cuadrada de la suma de los cuadrados de la resistencia (R) y la reactancia (Xc) y es dependiente de la frecuencia. La R es la oposición pura de un conductor biológico al flujo de una corriente eléctrica alterna, mientras que la Xc es el efecto de la resistencia debido a la capacitancia, almacenamiento de carga eléctrica en un condensador, producida por las interfaces de los tejidos y las membranas celulares. La capacitancia hace que la corriente deje atrás la tensión, creando un cambio de fase. Este cambio se cuantifica geométricamente como la transformación angular de la relación de la Xc a la R, o el ángulo de fase1.
El AF se puede calcular directamente de la R y la Xc como el arco tangente (Xc/R) x 180o/π. Por lo tanto, el ángulo de fase, por una parte es dependiente de la capacitancia de los tejidos (Xc) asociado con la celularidad, tamaño de la célula, e integridad de la membrana celular, y por otro lado del comportamiento de la R, que depende principalmente de la hidratación de los tejidos2-3.
El AF también se ha utilizado para predecir la masa celular corporal (MCC), por esta razón, también se ha utilizado como un indicador nutricional en adultos y niños. Se ha estudiado el papel del AF, como un indicador de pronóstico y este puede variar en diferentes condiciones clínicas2-3.
En la actualidad existe una gran cantidad de ensayos clínicos que proponen el AF como un marcador pronóstico útil en condiciones clínicas, como en cirrosis hepática4, varios tipos de cáncer5-6-7, esclerosis sistémica8, también se observó una asociación positiva entre el AF y la supervivencia en pacientes con VIH-positivos9, y quirúrgicos10. Varios autores sugieren que el AF puede ser una herramienta importante para evaluar el resultado clínico o para evaluar la progresión de la enfermedad y este puede ser superior a otros indicadores nutricionales, bioquímicos o antropométricos.
Algunos autores proponen valores de referencia para evaluar adecuadamente las desviaciones individuales en relación con la población promedio y otros proponen puntos de corte específicos por patología como indicadores de pronóstico clínico-nutricional.
El objetivo de esta revisión es describir los valores de referencia de ángulo de fase según diferentes condiciones clínicas propuestos en los trabajos científicos publicados. Se realizo búsqueda en la base de datos de pubmed utilizando las palabras claves: bioimpedancia eléctrica, ángulo de fase y pronóstico nutricional, utilizando como límites de búsqueda estudios en humanos, adultos mayores de 18 años, y que las palabras claves se encuentren en título y abstrac, se excluyeron aquellos artículos específicos de ángulo de fase y patología renal.
Las publicaciones fueron agrupadas según el tipo de población estudiada, población general, ancianos o patologías específicas.
Valor de referencia del ángulo de fase en la población general
Los valores de referencia son importantes para la evaluación de las desviaciones individuales en relación con la media de la población.
Hay varios trabajos en población saludable que indican un AF promedio, y el rango considerando 2 desvíos estandar (DE):
En el trabajo de Baumgartner et al.(1988)1 el AF promedio para hombres (n: 29) fue 7o (5,3o-8,8o) y en mujeres (n: 44) fue 6,3o (4,9o-7,7o).
En una publicación de Selberg (2002)4 el AF promedio en 50 personas (20 hombres y 30 mujeres) fue de 6,6o (5,4o-7,8o). En los hombres el AF fue de 6,8o (6,1o-8,5o) y no fue significativamente diferente al de las mujeres con un promedio de 6,5o (5,3o -7,3o) (P = 0,1). En el mismo trabajo evaluaron el AF en un grupo heterogéneo de 1.035 pacientes hospitalizados (589 hombres) con una media de AF de 4.9o. Este valor fue significativamente menor que en los sujetos sanos descripto [4,9o vs 6,6o, P < 0,001]11.
Sin embargo en los valores publicados de adultos, divididos por sexo y edad hay considerables diferencias2 que no están claras. Se planteó que el índice de masa corporal (IMC) al tener un efecto independiente de la impedancia en las medidas de R, Xc, y por lo tanto en el AF, las diferencias podrían deberse a los distintos IMC entre las poblaciones de referencia. Barbosa-Silva et al.3 estudiaron 1967 adultos Americanos de 18-94 años y describieron el AF según edad, sexo, raza, IMC y porcentaje de grasa, Bosy y cols.2 buscaron establecer valores de AF de referencia específicos según sexo, la edad y el IMC en una gran población alemana sana (214.732 adultos), y establecieron percentiles. En estas publicaciones se observó que el AF fue mayor en hombres que en mujeres, excepto para los mayores de 70 años. Los grupos por edad y sexo tendían a aumentar el AF a medida que aumentaba el IMC hasta el valor de 35 kg/m2, y disminuía en los grupos de mayores IMC. El AF tiene correlación negativa con la edad, y hubo correlación positiva entre el IMC y el ángulo de fase en los sujetos con bajo peso y de peso normal. Estas correlaciones se perdieron en los grupos de mayor IMC, 30-40 kg/m2, y en el rango de IMC > 40 kg/m2, hubo una relación inversa entre el AF y el IMC a partir de 30 kg/m2. Según los autores2-3 esto podría deberse a un aumento de la hidratación de los tejidos con una relación fisiológica mayor de agua extracelular que intracelular del tejido adiposo o debido a una sobrecarga de líquidos en la obesidad mórbida, también observada en otro estudio con mujeres obesasxi donde el promedio del AF bajo un 19% en las mujeres con un IMC entre 40 y 64 kg/m2, y sólo el 5% en el grupo de IMC 30-35 kg/m2. Por otro lado la pérdida en el estado funcional de las membranas celulares en la obesidad severa podría haber contribuido a un menor AF, esto puede deberse a la secreción de citoquinas inflamatorias.
Barbosa-Silva3 también observaron diferencias por raza, se mostró una significativa diferencia en el análisis crudo (p < 0,001): 6,55o ± 1.10 para Asiaticos, 6,82o ± 1,13 para blancos, 7,0o ±1,01 para sujetos multiraciales, 7,21o ± 1,19 para africanos americanos, 7,33o ± 1,13 para hispanos, y 7,45o ± 0,98 para otras razas.
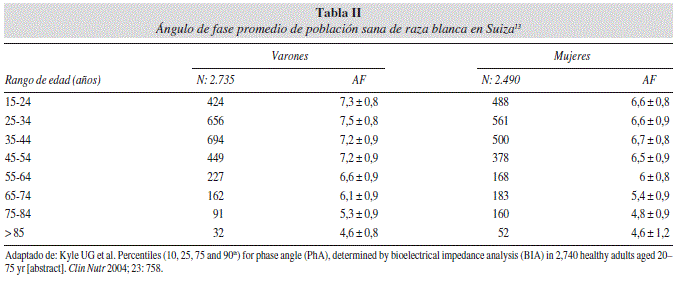
Kyle UG y cols.3, en Suiza evaluaron a 5225 personas de raza blanca sanas entre 15 a 98 años y encontraron que los valores de AF en comparación con la población americana3 fueron 10,5% más bajos en los hombres y 7,7% en las mujeres. En la población Alemana2 el promedio de AF fue 7,5% y 12,5% más baja en mujeres y 8,4% y 16,0% más bajo en hombres cuando se compararon con la población Suiza y Americana respectivamente. Por lo que se podría concluir que puede haber diferencias reales en el AF entre distintas poblaciones (tablas I y II).
Cambios del ángulo de fase en el adulto mayor
Como se observa en las tablas I y II, a medida que aumenta la edad disminuye el AF, esto también fue publicado en otros trabajos. Buffa et al.14 evaluaron a 201 adultos de 60 a 89 años y determinaron los cambios de los parámetros de la BIA con la edad. La migración del vector de la BIA, R y XC fue evidente en ambos sexos y acelerado el grupo de los 70 a 79 años y en el de 80 a 89 años, esta tendencia fue debido principalmente a la reducción de la capacitancia y la consecuente disminución del ángulo de fase (tabla III).
Resultados similares fueron encontrados en 405 pacientes mayores de 64 y se observó que el AF, el peso y la talla disminuyeron significativamente con la edad y el género, el AF es menor en las mujeres con respecto a varones15.
En otro trabajo en ancianos se evaluó la correlación del AF y el estado nutricional según el Mini Nutricional Assesment (MNA) en 112 ancianos institucionalizados. El AF fue significativamente menor en los pacientes en riesgo de desnutrición; 3,7o (3,34,3) que en los bien nutridos; 4o (3,8-4,7) y se redujo aún más en los desnutridos; 2,9o (2,6-3,5). También se obtuvieron correlaciones significativas entre el AF y la fuerza muscular de empuñadura (r: 0,411; P < 0,00001)16.
Otro trabajo de Buffa y cols.17 evaluaron a 170 pacientes ambulatorios entre 70 a 99 años, utilizaron el MNA para determinar el estado nutricional, y lo compararon con el AF. Mostraron una clara asociación entre desnutrición y menor AF que los sujetos normonutridos (hombres; 5,2o ± 1,3 versus 5,7o ± 1,0, P = 0.027; mujeres 5o ± 1,0 versus 5,4o ± 0,9, P = 0,065). La misma tendencia fue observada en pacientes ancianos con enfermedad de Alzheimer's evaluada por el mismo grupo de investigadores18. Se observa valores de AF menores en pacientes institucionalizados que en adultos mayores ambulatorios.
Ángulo de fase en pacientes quirúrgicos
La asociación entre malnutrición y complicaciones hace que comiencen a ser usados indicadores del estado nutricional como indicadores de pronóstico en pacientes quirurgicos. En el primer estudio de Barbosa-Silva y cols.19 en Brasil para establecer el valor de referencia de AF para diagnosticar desnutrición en 279 pacientes prequirúrgicos realizando el diagnostico con la Evaluación Global Subjetiva (EGS), no pudieron establecer un óptimo punto de corte. El valor de AF de 5o para varones y mujeres presentó un sensibilidad del 31% (95% IC: 1847) y 47% (34-60) y especificidad del 97% (87-100) y 94% (88-97) respectivamente. El valor 6,3o para varones y 5,9o para mujeres fueron los que presentaron mejor balance entre la sensibilidad y la especificidad (figs. 1 y 2).
En otros estudios Brasileros1020-21, proponen utilizar el AF estandarizado (AFE) antes que el uso de un solo valor de referencia para identificar personas en riesgo nutricional. Barbosa-Silva y cols.21 analizaron el rol prónostico de diferentes métodos de evaluación nutricional, EGS o BIA y su habilidad para predecir complicaciones post operatorias en pacientes que iban a ser sometidos a cirugía electiva del aparato digestivo (n: 225). El AF se estandarizó usando el promedio y la desviación estándar de valores de referencia generados por el mismo grupo pero en población americana3 utilizando la siguiente fórmula:

El AF en el 73,8% de los casos fue debajo del valor promedio. Pacientes con valores del AFE entre -0,8 y 0 tenían un riesgo relativo (RR): 3,2 (95% CI: 1,1-9,1) de desarrollar complicaciones postoperatorias mientras que valores debajo de -0,8 tenían un RR: 4,3 (95% CI: 1,6-11,8). De todas las variables nutricionales sólo el AF fue significativo después de ajustarse con otras variables, edad, sexo, infecciones pre operatorias y presencia de neoplasias.
En el trabajo de Cardinal y cols.20 en 125 pacientes y en el de Scheunemann y cols.10 en 98 pacientes antes de cirugía electiva gastrointestinal, la concordancia según el coeficiente Kappa entre el AFE -0,8, NRS-2002 y EGS fue moderada y baja para el porcentaje de perdida de peso (%PP), pliegue tricipital (PT), circunferencia muscular del brazo (CMB), recuento total de linfocitos (RTL) e IMC. Por lo que cuando se estudió el AFE como indicador del estado nutricional en pacientes prequirúrgicos10-20, este presentó una concordancia débil con los métodos de evaluación nutricional, así como una baja especificidad y no pudo ser recomendado como un indicador del estado nutricional, a pesar de que los valores más bajos del AF fueron encontrados en pacientes desnutridos. El AFE se calculo con los valores de referencia de la población Suiza13.
En el trabajo de Cardinal20 en la totalidad de pacientes examinados, los valores medios de AFE fueron significativamente menores en desnutrición o en pacientes diagnosticados en riesgo nutricional por CMB, IMC, %PP, NRS 2002, EGS en comparación con los bien nutridos.
Cuando Scheunemann y cols.10 consideraron un punto de corte de AFE 0,8, no encontraron valores de sensibilidad y especificidad compatibles, 82,6% y 40,6% respectivamente. El punto de corte que mostró el mejor resultado fue 0,63 (72,4% sensibilidad y 68,1% especificidad).
En pacientes pre quirúrgicos el AFE podría ser utilizado para predecir riesgo de desarrollar complicaciones postoperatorias, pero no como indicador de estado nutricional, aunque bajos valores de AF se encontraron en pacientes desnutridos.
Ángulo de fase en pacientes oncológicos
Digant Gupta y cols.22 evaluaron el rol del AF en el pronostico en pacientes con cancer colorectal avanzado (n: 52) Estimaron la sobrevida con el método Kaplan-Meier, y observarón que los pacientes con AF ≤ 5,7o tenían una media de sobrevida de 8 meses (95% IC: 4,8, 12,4; n: 26), mientras que aquellos con AF > 5,57o tenían un promedio de sobrevida de 40,4 meses (95% IC: 21,9, 58,8; n: 26; P < 0,0001).
El mismo grupo6 ha estudiado la relación del AF y el estado nutricional con la EGS en cáncer colorrectal avanzado, calcularon la sensibilidad, especificidad y la supervivencia. La distribución de las puntuaciones del AF encontró que en los pacientes bien nutridos había una diferencia estadísticamente significativamente mayor (p = 0,005) de la media del AF (6,12o) en comparación con aquellos que estaban desnutridos (5,18o). El coeficiente de correlación de Spearman entre el AF y la EGS fue de 0,33 (P = 0,004), lo que sugiere un mejor estado nutricional con puntuaciones más altas del AF. Un AF de 5,2o fue de 51,7% sensible y es 79,5% específico, mientras que un punto de corte de 6,0 fue 82,8% sensible y 54,5% específico para malnutrición. Curiosamente, un AF de 5,9o ha demostrado una alta exactitud en el diagnóstico en los hombres que habían fracasado al tratamiento primario para cáncer colorrectal avanzado. Este estudio sugiere que el AF es un potencial indicador nutricional en el cáncer colorrectal avanzado. Se necesitan más investigaciones para aclarar el punto de corte de ángulo de fase óptimo que puede ser incorporado en la clínica oncológica para una mejor evaluación y manejo nutricional.
Un estudio realizado en pacientes con cáncer de pulmón avanzado23 el promedio del AF fue 5,3o (2,9-8). Los pacientes con un valor ≤ 5,3o tuvieron un promedio de superviviencia de 7,6 meses (95% CI: 4,7 a 9,5; n = 81), mientras que aquellos con valores > 5,3o fue 12,4 meses (95% CI: 10,5 to 18,7; n = 84); (p = 0,02). Después de ajustar por edad, estadio de la enfermedad al diagnóstico e historia previa de tratamiento, el aumento de cada grado del AF fue asociado con un RR de 0,79 (95% CI: 0,64 a 0,97, P = 0,02).
Cuando se evaluó el AF como indicador pronostico en cáncer de mama24 observó que las pacientes con ángulo de fase ≤ 5,6o tuvieron una supervivencia promedio de 23,1 meses (95% IC: 14,2 a 31,9, n = 129), mientras que con valores > 5,6o la supervivencia fue de 49,9 meses (95% IC: 35,6 a 77,8, n = 130), (p = 0,031). Este estudio demuestra que el AF es un indicador independiente del pronóstico en los pacientes con cáncer de mama. Intervenciones nutricionales dirigidas a mejorar el AF podrían llevar a una mejora de la supervivencia en pacientes con cáncer de mama.
Cuando se evaluó el AF y la sobrevida en pacientes con cancer de pancreas estadio IV25 (n = 58), se observó que pacientes con AF de 5,0o tenían un promedio de sobrevida de 6,3 meses (95% CI 3,5, 9,2; n = 29), mientras que aquellos con valores > 5,0o tenian una sobrevida de 10,2 meses (95% CI 9,6, 10,8; n = 29) (P = 0,02). Por lo que demostró que el AF es un fuerte indicador pronostico en el cancer de pancreas.
En un estudio alemán prospectivo en 399 pacientes con diferentes tipos de cáncer26, tomando los valores de referencia de AF el trabajo de Bosy2 mostró que los pacientes con un AF por debajo del percentil quinto tenían deterioro del estado nutricional y funcional, disminución de la calidad de vida y aumento de la morbilidad y mortalidad. El quinto percentil resultó un indicador clínicamente relevante de la caquexia por cáncer. Por otra parte también tomaron el AFE (< -1 DS) y fue un predictor independiente para la disminución de la fuerza muscular, desnutrición y mortalidad.
Paiva y cols.27 en Brasil estudiaron el AFE en pacientes oncológicos después de su primera sesión de quimioterapia. Tomaron como punto de corte el AFE < -1,65 DS. El promedio de supervivencia de los pacientes con AFE < -1,65 fue de 12 meses, mientras que en el grupo con AFE ≥ -1,65, la supervivencia fue al menos de 3 años. Cuando se analizó el estadío tumoral I/II y III/IV, la diferencia significativa en la supervivencia sólo se encontró en los pacientes con AFE < -1,65 en el grupo de enfermedad más avanzada. Este estudio y otros28 ha demostrado que el AFE, es un indicador válido e independiente de supervivencia para los pacientes con cáncer que reciben quimioterapia en estadio III y IV de la enfermedad.
Se observo que un mayor AF medido antes de iniciar la hidratación en pacientes con cáncer avanzado se correlaciona positivamente con una mejor supervivencia, al igual que el aumento de peso durante la hidratación, aunque observaron que el incremento del AF durante la hidratación predice una peor supervivencia29.
Ángulo de fase en pacientes con HIV
Unos pocos estudios transversales han examinado el impacto de la infección por el virus de Inmunodeficiencia humana (HIV) sobre el AF. El primero en describir el AF como indicador de sobrevida en HIV fue el grupo de Ott30 en 1995, en 75 hombres infectados con HIV en diferentes estadíos. Los investigadores tomaron como punto de corte el AF de 5.6o (promedio de -1 DS de 340 varones controles), y este resulto ser el parámetro mas relevantes para predecir sobrevida y ser superior al recuento celular CD4+, (p < 0,0001) y a otros parámetros nutricionales evaluados (peso, IMC, albúmina, colesterol, triglicéridos, etc.). En el 2000 se publico otro trabajo31 con el objetivo de evaluar la capacidad de pronóstico del AF en pacientes infectados por HIV con terapia anti retro viral altamente activa (HAART), en dos estudios de cohorte en 1996 y 1997. Un AF > a 5,3o se asoció con un bajo riesgo relativo de mortalidad, ajustada por la carga viral y recuento de CD4+, de 0,49 (95% IC: 0,30-0,81) por cada grado en 1996 y de 0,33 (IC del 95% IC: 0,18 a 0,61) en 1997. Estos resultados muestran una fuerte capacidad del AF para predecir supervivencia y progresión clínica de los pacientes infectados con HIV, independientemente del grado de inmunodeficiencia y viremia. La introducción de la HAART no eliminó el papel pronóstico del AF.
Araujo y cols.32 publicaron el primer estudio que cuantificó la dispersión de los valores de AF en pacientes hospitalizados con HIV en comparación con la distribución de valores en una población saludable3 en términos de puntuación z (AFE)20-21 y en relación con los parámetros que se utilizan en la evaluación nutricional. Los pacientes presentaron un AF promedio de 5,2o ± 1,3, y mostraron un DE del AF de -2,6 ± 1,5, el 23,7% de ellos tenían un valor superior a -1,65 y sólo el 6,6% un valor positivo. Los valores del AFE se correlacionaron con el %PP (r = -0,51; p < 0,0001), la albúmina (r = 0,49; p < 0,0001), el IMC (r = 0,58; p < 0,0001), la CMB (r = 0,41; p < 0,0001), el PT (r = 0,47; p < 0,001) y el %MG (r = 0,48, p < 0,0001). En el análisis múltiple, el %PP (p = 0,008), la albúmina (p = 0,01), la CMB (p < 0,0001) y el %MG (p = 0,0003) seguían asociándose con la puntuación z.
Dos trabajos evaluaron el AF en coinfección de HIV y tuberculosis33-34, el primer trabajo en Uganda comparó el AF en 163 hombres adultos seropositivos y 199 HIV-negativos, y este fue de 5,42o ± 1,05 y 5,76o ± 1,30 (P = 0,009), y en 98 mujeres seropositivos y 79 HIV-negativas, el AF fue 5,35o ± 1,27 y 5,43o ± 0,93 (P = 0,61), respectivamente. No hubo diferencias significativas en el grupo de las mujeres. Cuando se evaluaron los paciente HIV positivos según el recuento celular CD4+, el AF fue significativamente menor entre aquellos con CD4+ ≤ 200/ L, siendo el AF en hombres con CD4+ ≤ 200/ L de 5,12o ± 1,15 y en aquellos con CD4+ > 200/ L de 5,70o ± 0,89 (p = 0,0005) y en la mujeres de 4,87o ± 0,73 y 5,75o ± 1,46 (p = 0,0006) respectivamente. Tomaron como punto de corte el AF < 5,3o, representando en los pacientes con CD4+ ≤ 200/L el 63,3% de los hombres y el 70,6% de las mujeres (p = 0,002). Ambos trabajos llegaron a la conclusión que a menor CD4+, menor AF.
También se estudio la influencia hormonal y de la ingesta alimentaria en el AF en 100 hombres infectados con HIV35, tomaron como punto de corte de AF el valor > 8,2o, y observaron que la somatomedina C y la ingesta proteica se relacionaban con mayor AF, en comparación con los estudios anteriores se tomo un AF mayor por ser el valor promedio de este grupo de pacientes (8,21o ± 0,88). También se observo que el tratamiento con hormona se crecimiento en pacientes con HIV mejoró los parámetro de la bioimpedancia36.
Ángulo de fase en pacientes con enfermedad hepática
Hay pocos trabajos sobre el AF en enfermedades hepáticas, y estos tienen diferentes objetivos de evaluación del AF.
Selberg-Selberg11 realizaron la evaluación del AF en 305 pacientes con cirrosis (162 hombres) y evaluaron prospectivamente el tiempo de supervivencia. La media del AF fue de 5,4o. El AF no varió entre los pacientes con distintas clases de Child-Pugh, pero si se correlacionó positivamente con la masa muscular (r = 0,53) y la fuerza muscular (r = 0,53) (p < 0,01). Las curvas de supervivencia demostraron que los pacientes con AF < 5,4o tuvieron menor tiempo de supervivencia y los pacientes con AF < a 4,4o se asociaron con supervivencia incluso más corta (p < 0,01), por lo que el AF resulto ser predictor del tiempo de supervivencia en pacientes cirróticos (P < 0,01) (fig. 3).
En un trabajo37 en 20 pacientes con fibrosis hepática por virus de hepatitis C (VHC) sin complicaciones, el AF promedio en este grupo fue de 7,0o, pero este estudio presento varias limitaciones.
Kahraman et al.38 evaluaron en forma prospectiva con BIA la respuesta a la terapia antirretroviral en 37 pacientes con VHC compensados; 15 con genotipo 1; 48 semanas de tratamiento y 22 con genotipo 3; 24 semanas de tratamiento. Se observo que con la terapia antirretroviral los pacientes presentaron una disminución significativa de la masa grasa (MG), la masa celular corporal (MCC) y el agua corporal total (ACT).
El AF en pacientes con genotipo 3 fue significativamente mas bajo después del tratamiento comparado con la medida inicial (5,9 ± 0,7o vs 5,4 ± 0,8o; p < 0,001), no difiriendo en los pacientes con genotipo 1 (5,3 ± 0,7o vs 5,4 ± 0,7o; p > 0,05). La reducción del AF se asoció con un aumento en los efectos adversos de la terapia (cefalea, fatiga y síntomas gripales).
Wagner et al.39 evaluaron herramientas nutricionales para evaluar malnutrición en el post trasplante hepático en 71 pacientes, divididos en 3 grupos según el tiempo del trasplante sin diferencia entre los grupos: menos de 5 años: 11 pacientes (AF: 4,1o); ente 5 y 10 años, 19 pacientes (AF: 4,9o) y mayor a 10 años, 41 pacientes (AF: 4,9o). Tomaron como punto de corte de AF < 5o para clasificar como desnutrición, siendo los resultados en los grupos 9/11 (81,2%), 6/19 (31,6%) y 13/41 (31,7%) respectivamente (p = 0,008). El AF mostró una prevalencia mayor de malnutrición en los primeros años después del trasplante de hígado que en el mediano y en el largo plazo.
Ángulo de fase en mujeres con bajo peso corporal
Es discutible el uso de la BIA en pacientes con IMC < 17 kg/m2, ya que no hay ecuaciones validadas para adultos con IMC extremos (< 17 kg/m2 y > de 33,8 kg/m2)40. Sin embargo se observó que el AF es un predictor del gasto energético basal (GEB) en 86 mujeres con anorexia nerviosa (edad 20,8 ± 4,7 años, peso 39,3 ± 5,2 kg, IMC 15,4 ± 1,6 kg/m2). En este grupo el AF fue entre 2,54o y 6,49o, y se asoció mayor AF con mayor GEB. No obstante, son necesarios más estudios para confirmar este hallazgo en otras formas de malnutrición energética proteico41.
Cuando se comparó el AF en 55 mujeres con bajo peso (IMC < 18,5 kg/m2), 30 pacientes con anorexia nerviosa (19,0 ± 2,0 años, peso 44,2 ± 3,5 kg, IMC 16,7 ± 0,5 kg/m2), 15 bailarinas de ballet (18,9 ± 1,7 años, 44,5 ± 2,7 kg, IMC 17,4 ± 0,6 kg/m2) y 10 pacientes delgadas constitucionales (19,4 ± 2,4 años, 42,4 ± 4,1 kg, IMC 16,8 ± 1 kg/m2) y 30 mujeres controles (20,0 ± 2,1 años, 59,2 ± 8,0 kg, IMC 22,5 ± 2,8 kg/m2). El AF fue significativamente mayor en las bailarinas clásicas (AF 6,40o ± 0,51); p < 0,001, menores en las pacientes anoréxicas (AF 5,09o ± 0,52o); p < 0,001 y no difirió en pacientes constitucionalmente delgadas (AF 5,94 ± 0,93o) en comparación con los controles (AF 5,84 ± 0,55o)42. Se ha observado en pacientes con anorexia que por la subalimentación crónica presentan un bajo AF probablemente debido a un aumento del Agua extra celular (AEC) y disminución de la MCC. Por el contrario, a pesar de un IMC similar las mujeres jóvenes constitucionalmente magras tienen AF similares a los controles. Y las bailarinas de ballet se caracterizan por un AF mayor, por lo que concluyen que el AF es capaz de discriminar entre estas tres formas de bajo peso.
Ángulo de fase y cardipatías
Hay evidencia creciente de que la composición corporal se debe considerar como un marcador de gravedad en la insuficiencia cardíaca congestiva (ICC). Castillo43 evaluó el AF y la capacidad funcional (CF) en 243 pacientes con ICC, 140 (58.6%) con disfunción sistólica, de los hombres, 59 tenían CF I-II con un AF 5,7o ± 1,2, y 23 CF III-IV y el AF fue de 4,9o ± 0,9, y en las mujeres con CF I-II (n: 42) el AF fue 5,1o ± 0,7 y en las que tenían CF III-IV (n: 16) fue de 4,2o ± 1,9 (p = 0,04) y 103 pacientes (42,3%) tenían disfunción diastólica, en los hombres con CF I-II el AF fue 5,8o ± 1,1 (n: 37), y con CF III-IV fue 4,8o 1,1 (n: 14), en las mujeres con CF I-II el AF fue 4,9o ± 1,3 (n: 30) y con CF III-IV 4,2o ± 1,0 (n: 22); P = 0,0143. Se observó que el AF es más bajos en pacientes con ICC clase funcional (CF) III-IV en comparación con aquellos con CF I-II.
En un trabajo se investigó la asociación entre los parámetros de BIA y el tejido adiposo epicárdico (TAE) evaluados por resonancia magnética computarizada (RMC) en 41 pacientes con ICC y en 16 controles, los pacientes con ICC mostraron una disminución del AF (5,5o frente a 6,4o, P < 0,02) en comparación con los controles sanos. El análisis de regresión lineal mostró una correlación significativa del índice de TAE con el AF (r = 0,31, P = 0,01), el análisis de curva ROC indica buen valor predictivo del AF y TAE (área bajo la curva (AUC) = 0,86 y 0,82, respectivamente) con respecto a la muerte cardíaca. Después de un período de seguimiento de 5 años, 8/41 (19,5%) pacientes sufrieron muerte cardíaca. El AF podría servir como indicador pronóstico adicional de supervivencia en estos pacientes44.
En un trabajo multicéntrico se partió con la premisa que valores plasmáticos bajos de triyodotironina (T3) se consideran un factor de predicción de muerte en la ICC. Se comparó a pacientes con T3 en el tertil mas bajo con los dos tertiles superiores y se observo que el tercil más bajo de T3 se asoció con ICC más avanzada y presentaron valores de AF más bajos (< 5,5o en la mujer y 6,5o en el hombre) (OR: 3,18, IC 95% 1,506,71, P = 0,04). Las posibilidades de pertenecer a el grupo de T3 baja, aumentó casi tres veces cuando el ángulo de fase era bajo45. En otro trabajo también fue observado un menor AF después de 6 meses de seguimiento en los pacientes con ICC que desarrollaron alguna alteración en el perfil tiroideo (AF 5,0 ± 0,7o) cuando se compara con el resto de la cohorte (AF 6,2 ± 1,0); p = 0,00246.
Se estudiaron 132 pacientes con IC, 59,1% con IC sistólica y 40,9% con IC diastólica bajo la inferencia que los pacientes con anemia hemodilucional tienen peor pronóstico que aquellos con anemia verdadera. Cuando los pacientes fueron divididos en 4 subgrupos de acuerdo con la presencia de anemia y/o sobrecarga de volumen (SV), los pacientes con IC sistólica sin anemia con y sin SV presentaron un AF de 4,75o ± 1,55 y 5,69o ± 0,95, y aquellos con anemia con y sin SV el AF fue 4,39o ± 0,92 y 4,76o ± 1,39; p < 0,05 respectivamente. El AF en los pacientes con IC diastólica sin anemia con y SV fue 4,70o ± 1,25 y 5,43o ± 0,95, y con anemia con y sin SV fue 4,17o ± 1,17 y 5,73o ± 0,31; p < 0,05. Los pacientes con SV presentaron menor AF independientemente de la presencia de anemia, y la SV se relacionó con deterioro de la composición corporal y anormalidades ecocardiográficas, así como con una disminución de la calidad de vida, implicando una peor evolución47.
Conclusión
La consideración de un punto de corte único de AF en una población específica parece ser suficiente para su interpretación como un factor pronóstico, pero no en todas las poblaciones evaluadas el AF demostró ser un parámetro para evaluar estado nutricional. En pacientes pre quirúrgicos el AFE podría ser utilizado para predecir riesgo de desarrollar complicaciones postoperatorias, pero no como indicador de estado nutricional. La interpretación de los valores del AF en la práctica clínica se ha limitado a la consideración de un solo punto de corte, sin distinción entre los géneros y la edad de los pacientes. La mayoría de los autores generan puntos de cortes del AF dentro de la población en estudio utilizando principalmente el promedio o el cuartil más bajo o creando puntos de corte en comparación con un grupo control sano. Según lo revisado estos puntos de corte no son necesariamente transferibles a otras poblaciones y no podrían por lo tanto ser aplicables en el uso clínico general. Utilizar el AFE permite evaluar las desviaciones de un paciente en relación con el promedio de la población sana y los percentilos podrían ser utilizados como puntos de corte en la clínica general para una identificación precoz de pacientes con riesgo nutricional, con deterioro del estado funcional y mayor mortalidad.
Varios valores de referencia se han publicado, pero en los estudios poblacionales se observó que el AF fue mayor en hombres que en mujeres, excepto para los mayores de 70 años. Los grupos por edad y sexo tendían a aumentar el AF a medida que aumenta el IMC hasta el valor de 35 kg/m2, y disminuía en los grupos de mayores IMC. El AF tiene correlación negativa con la edad. También se observó diferencia en el AF según la población sana estudiada, por lo que deberían realizarse trabajos poblacionales con los valores de AF nacionales para poder realizar la interpretación por DE y percentilos.
Referencias
1. Baumgartner RN, Chumlea WC, Roche AF. Bioelectric impedance phase angle and body composition. Am J Clin Nutr 1988; 48 (1): 16-23. PubMed PMID: 3389323. [ Links ]
2. Bosy-Westphal A, Danielzik S, Dörhöfer RP, Later W, Wiese S, Müller MJ. Phase angle from bioelectrical impedance analysis: population reference values by age, sex, and body mass index. JPEN J Parenter Enteral Nutr 2006; 30 (4): 309-16. PubMed PMID: 16804128. [ Links ]
3. Barbosa-Silva MC, Barros AJ, Wang J, Heymsfield SB, Pierson RN Jr. Bioelectrical impedance analysis: population reference values for phase angle by age and sex. Am J Clin Nutr 2005; 82 (1): 49-52. PubMed PMID: 16002799. [ Links ]
4. Selberg O, Selberg D. Norms and correlates of bioimpedance phase angle in healthy human subjects, hospitalized patients, and patients with liver cirrhosis. Eur J Appl Physiol 2002; 86 (6): 509-16. Epub 2002 Jan 31. PubMed PMID: 11944099. [ Links ]
5. Gupta D, Lammersfeld CA, Vashi PG, King J, Dahlk SL, Grutsch JF, Lis CG. Bioelectrical impedance phase angle as a prognostic indicator in breast cancer. BMC Cancer 2008; 8: 249. PubMed PMID: 18727837; PubMed Central PMCID: PMC2527613. [ Links ]
6. Gupta D, Lis CG, Dahlk SL, King J, Vashi PG, Grutsch JF, Lammersfeld CA. The relationship between bioelectrical impedance phase angle and subjective global assessment in advanced colorectal cancer. Nutr J 2008; 7: 19. PubMed PMID: 18590554; PubMed Central PMCID: PMC2483715. [ Links ]
7. Gupta D, Lis CG, Dahlk SL, Vashi PG, Grutsch JF, Lammersfeld CA. Bioelectrical impedance phase angle as a prognostic indicator in advanced pancreatic cancer. Br J Nutr 2004; 92 (6): 957-62. PubMed PMID: 15613258. [ Links ]
8. Krause L, Becker MO, Brueckner CS, Bellinghausen CJ, Becker C, Schneider U, Haeupl T, Hanke K, Hensel-Wiegel K, Ebert H, Ziemer S, Ladner UM, Pirlich M, Burmester GR, Riemekasten G. Nutritional status as marker for disease activity and severity predicting mortality in patients with systemic sclerosis. Ann Rheum Dis 2010; 69 (11):1951-7. Epub 2010 May 28. PubMed PMID: 20511612. [ Links ]
9. Schwenk A, Beisenherz A, Römer K, Kremer G, Salzberger B, Elia M. Phase angle from bioelectrical impedance analysis remains an independent predictive marker in HIV-infected patients in the era of highly active antiretroviral treatment. Am J Clin Nutr 2000; 72 (2): 496-501. PubMed PMID: 10919947. [ Links ]
10. Scheunemann L, Wazlawik E, Bastos JL, Ristow Cardinal T, Mayumi Nakazora L. Agreement and association between the phase angle and parameters of nutritional status assessment in surgical patients. Nutr Hosp 2011; 26 (3): 480-7. PubMed PMID: 21892564. [ Links ]
11. Selberg O, Selberg D. Norms and correlates of bioimpedance phase angle in healthy human subjects, hospitalized patients, and patients with liver cirrhosis. Eur J Appl Physiol 2002; 86 (6): 509-16. Epub 2002 Jan 31. PubMed PMID: 11944099. [ Links ]
12. Guida B, Trio R, Pecoraro P, Gerardi MC, Laccetti R, Nastasi A, Falconi C. Impedance vector distribution by body mass index and conventional bioelectrical impedance analysis in obese women. Nutr Metab Cardiovasc Dis 2003; 13 (2): 72-9. PubMed PMID: 12929619. [ Links ]
13. Kyle UG, Genon L, Karsegard VL, Raguso CA, Dupertuis YM, Pichard C. Percentiles (10, 25, 75 and 90th) for phase angle (PhA), determined by bioelectrical impedance analysis (BIA) in 2740 healthy adults aged 20-75 yr (abstract). Clin Nutr 2004; 23: 758. [ Links ]
14. Buffa R, Floris G, Marini E. Migration of the bioelectrical impedance vector in healthy elderly subjects. Nutrition 2003; 19 (11-12): 917-21. PubMed PMID: 14624938. [ Links ]
15. Santomauro F, Baggiani L, Mantero S, Olimpi N, Comodo N, Bonaccorsi G. Assessment of nutritional status in institutionalized elderly individuals through body impedance analysis. Ig Sanita Pubbl 2008; 64 (1): 67-78. Italian. PubMed PMID: 18379607. [ Links ]
16. Norman K, Smoliner C, Valentini L, Lochs H, Pirlich M. Is bioelectrical impedance vector analysis of value in the elderly with malnutrition and impaired functionality? Nutrition 2007; 23 (7-8): 564-9. PubMed PMID: 17616343. [ Links ]
17. Buffa R, Floris G, Marini E. Assessment of nutritional status in free-living elderly individuals by bioelectrical impedance vector analysis. Nutrition 2009; 25 (1): 3-5. Epub 2008 Oct 11. PubMed PMID: 1884914729. [ Links ]
18. Buffa R, Mereu RM, Putzu PF, Floris G, Marini E. Bioelectrical impedance vector analysis detects low body cell mass and dehydration in patients with Alzheimer's disease. J Nutr Health Aging 2010; 14 (10): 823-7. PubMed PMID: 21125199. [ Links ]
19. Barbosa-Silva MC, Barros AJ, Cora L. Waitzberg D, Heymsfield S. Can Bioelectrical Impedance Analysis Identify Malnutrition in Preoperative Nutrition Assessment? Nutrition 2003; 19: 422-426. [ Links ]
20. Cardinal TR, Wazlawik E, Bastos JL, Nakazora LM, Scheunemann L. Standardized phase angle indicates nutritional status in hospitalized preoperative patients. Nutr Res 2010; 30 (9): 594-600. PubMed PMID: 20934600. [ Links ]
21. Barbosa-Silva MC, Barros AJ. Bioelectric impedance and individual characteristics as prognostic factors for post-operative complications. Clin Nutr 2005; 24: 830-8. [ Links ]
22. Gupta D, Lammersfeld CA, Burrows JL, Dahlk SL, Vashi PG, Grutsch JF, Hoffman S, Lis CG. Bioelectrical impedance phase angle in clinical practice: implications for prognosis in advanced colorectal cancer. Am J Clin Nutr 2004; 80 (6): 1634-8. PubMed PMID: 15585779 [ Links ]
23. Gupta D, Lammersfeld CA, Vashi PG, King J, Dahlk SL, Grutsch JF, Lis CG. Bioelectrical impedance phase angle in clinical practice: implications for prognosis in stage IIIB and IV non-small cell lung cancer. BMC Cancer 2009; 9: 37. PubMed PMID: 19175932; PubMed Central PMCID: PMC2637288. [ Links ]
24. Gupta D, Lammersfeld CA, Vashi PG, King J, Dahlk SL, Grutsch JF, Lis CG. Bioelectrical impedance phase angle as a prognostic indicator in breast cancer. BMC Cancer 2008 27; 8: 249. PubMed PMID: 18727837; PubMed Central PMCID: PMC2527613. [ Links ]
25. Gupta D, Lis CG, Dahlk SL, Vashi PG, Grutsch JF, Lammersfeld CA. Bioelectrical impedance phase angle as a prognostic indicator in advanced pancreatic cancer. Br J Nutr 2004; 92 (6): 957-62. PubMed PMID: 15613258. [ Links ]
26. Norman K, Stobäus N, Zocher D, Bosy-Westphal A, Szramek A, Scheufele R, Smoliner C, Pirlich M. Cutoff percentiles of bioelectrical phase angle predict functionality, quality of life, and mortality in patients with cancer. Am J Clin Nutr 2010; 92 (3): 612-9. Epub 2010 Jul 14. PubMed PMID: 20631202. [ Links ]
27. Paiva SI, Borges LR, Halpern-Silveira D, Assunçâo MC, Barros AJ, Gonzalez MC. Standardized phase angle from bioelectrical impedance analysis as prognostic factor for survival in patients with cancer. Support Care Cancer 2010; 19 (2): 187-92. Epub 2009 Dec 29. PubMed PMID: 20039074. [ Links ]
28. Santarpia L, Marra M, Montagnese C, Alfonsi L, Pasanisi F, Contaldo F. Prognostic significance of bioelectrical impedance phase angle in advanced cancer: preliminary observations. Nutrition 2009; 25 (9): 930-1. Epub 2009 Jun 4. PubMed PMID: 19500944. [ Links ]
29. Davis MP, Yavuzsen T, Khoshknabi D, Kirkova J, Walsh D, Lasheen W, Lagman R, Karafa MT. Bioelectrical impedance phase angle changes during hydration and prognosis in advanced cancer. Am J Hosp Palliat Care 2009; 26 (3): 180-7. Epub 2009 Jan 30. PubMed PMID: 19182217. [ Links ]
30. Ott M, Fischer H, Polat H, Helm EB, Frenz M, Caspary WF, Lembcke B. Bioelectrical impedance analysis as a predictor of survival in patients with human immunodeficiency virus infection. J Acquir Immune Defic Syndr Hum Retrovirol 1995; 9 (1): 20-5. PubMed PMID: 7712230. [ Links ]
31. Schwenk A, Beisenherz A, Römer K, Kremer G, Salzberger B, Elia M. Phase angle from bioelectrical impedance analysis remains an independent predictive marker in HIV-infected patients in the era of highly active antiretroviral treatment. Am J Clin Nutr 2000; 72 (2): 496-501. PubMed PMID: 10919947. [ Links ]
32. Araujo Antunes, Alves Pereira Rodrigues, Geraix, Vaz de Arruda Silveira, Câmara Marques Pereira and Barros Leite Carvalhaes. Nutritional assessment of hospitalized HIV-infected patients by the phase angle z-score measurement. Nutr Hosp 2012; 27 (3): 771-774. [ Links ]
33. Shah S, Whalen C, Kotler DP, Mayanja H, Namale A, Melikian G, Mugerwa R, Semba RD. Severity of human immunodeficiency virus infection is associated with decreased phase angle, fat mass and body cell mass in adults with pulmonary tuberculosis infection in Uganda. J Nutr 2001; 131 (11): 2843-7. PubMed PMID: 11694606. [ Links ]
34. Villamor E, Saathoff E, Mugusi F, Bosch RJ, Urassa W, Fawzi WW. Wasting and body composition of adults with pulmonary tuberculosis in relation to HIV-1 coinfection, socioeconomic status, and severity of tuberculosis. Eur J Clin Nutr 2006; 60 (2): 163-71. PubMed PMID: 16234841. [ Links ]
35. Luis DA, Aller R, Bachiller P, Gonzalez Sagrado M, Martin J, Izaola O. Influence of hormonal status and oral intake on phase angle in HIV-infected men. Nutrition 2004; 20 (9): 731-4. PubMed PMID: 15325677. 60. [ Links ]
36. Jäger H, Knechten H, Moll A, Weitner L, Fischer H, Schmitt-Rau K. Treatment of HIV-associated wasting with recombinant human growth hormone: monitoring of body composition changes by bioelectrical impedance analysis (BIA). Eur J Med Res 2002; 7 (3): 103-8. PubMed PMID: 11953280. (Abstract) [ Links ]
37. Antaki F, French MM, Moonka DK, Gordon SC. Bioelectrical impedance analysis for the evaluation of hepatic fibrosis in patients with chronic hepatitis C infection. Dig Dis Sci 2008; 53 (7): 1957-60. Epub 2007 Nov 13. PubMed PMID: 17999186. [ Links ]
38. Kahraman A, Hilsenbeck J, Nyga M, Ertle J, Wree A, Plauth M, Gerken G, Canbay AE. Bioelectrical impedance analysis in clinical practice: implications for hepatitis C therapy BIA and hepatitis C. Virol J 2010; 7: 191. PubMed PMID: 20712878; PubMed Central PMCID: PMC2930625. [ Links ]
39. Wagner D, Adunka C, Kniepeiss D, Jakoby E, Schaffellner S, Kandlbauer M, Fahrleitner-Pammer A, Roller RE, Kornprat P, Müller H, Iberer F, Tscheliessnigg KH. Serum albumin, subjective global assessment, body mass index and the bioimpedance analysis in the assessment of malnutrition in patients up to 15 years after liver Transplantation. Clin Transplant 2011; 25 (4): E396-400. doi: 10.1111/j.1399-0012.2011.01442.x. Epub 2011 Apr 3. PubMed PMID: 21457329. L. Llames y cols. [ Links ]
40. Thibault et al. The Evaluation of Body Composition: A Useful Tool for Clinical Practice. Ann Nutr Metab 2012; 60: 6-16. [ Links ]
41. Marra M, De Filippo E, Signorini A, Silvestri E, Pasanisi F, Contaldo F, Scalfi L. Phase angle is a predictor of basal metabolic rate in female patients with anorexia nervosa. Physiol Meas 2005; 26 (2): S145-52. Epub 2005 Mar 29. PubMed PMID: 15798227. [ Links ]
42. Marra M, Caldara A, Montagnese C, De Filippo E, Pasanisi F, Contaldo F, Scalfi L. Bioelectrical impedance phase angle in constitutionally lean females, ballet dancers and patients with anorexia nervosa. Eur J Clin Nutr 2009; 63 (7): 905-8. Epub 2008 Nov 12. PubMed PMID: 19002201. [ Links ]
43. Castillo Martínez L, Colín Ramírez E, Orea Tejeda A, Asensio Lafuente E, Bernal Rosales LP, Rebollar González V, Narváez David R, Dorantes García J. Bioelectrical impedance and strength measurements in patients with heart failure: comparison with functional class. Nutrition 2007; 23 (5): 412-8. PubMed PMID: 17483008. [ Links ]
44. Doesch C, Suselbeck T, Leweling H, Fluechter S, Haghi D, Schoenberg SO, Borggrefe M, Papavassiliu T. Bioimpedance analysis parameters and epicardial adipose tissue assessed by cardiac magnetic resonance imaging in patients with heart failure. Obesity (Silver Spring) 2010; 18 (12): 2326-32. Epub 2010 Mar 25. PubMed PMID: 20339358. [ Links ]
45. Brenta G, Thierer J, Sutton M, Acosta A, Vainstein N, Brites F, Boero L, Gómez Rosso L, Anker S. Low plasma tri-iodothyronine levels in heart failure are associated with a reduced anabolic state and membrane damage. Eur J Endocrinol 2011; 164 (6): 937-42. Epub 2011 Mar 31. PubMed PMID: 21454442. [ Links ]
46. Silva-Tinoco R, Castillo-Martínez L, Orea-Tejeda A, Orozco-Gutiérrez JJ, Vázquez-Díaz O, Montaño-Hernández P, Flores-Rebollar A, Reza-Albarrán A. Developing thyroid disorders is associated with poor prognosis factors in patient with stable chronic heart failure. Int J Cardiol 2011; 147 (2): e24-5. Epub 2009 Feb 8. PubMed PMID: 19201498. [ Links ]
47. Colín-Ramírez E, Castillo-Martínez L, Orea-Tejeda A, Asensio Lafuente E, Torres Villanueva F, Rebollar González V, Narváez David R, Dorantes García J. Body composition and echocardiographic abnormalities associated to anemia and volume overload in heart failure patients. Clin Nutr 2006; 25 (5): 746-57. Epub 2006 May 15. PubMed PMID: 16698139. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Lucía Llames.
Hospital Italiano de Buenos Aires.
Gascón, 450.
Ciudad Autónoma de Buenos aires (C.A.B.A.). Argentina.
E-mail: lucia.llames@hospitalitaliano.org.ar
Recibido: 7-XI-2012.
Aceptado: 22-XII-2012.