Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.28 no.4 Madrid jul./ago. 2013
https://dx.doi.org/10.3305/nh.2013.28.4.6556
ORIGINAL / Otros
Densidad mineral ósea y adecuación de la dieta en pacientes con enfermedad renal crónica en hemodiálisis
Bone mineral density and adequacy of dietary pattern of patients with chronic kidney disease in hemodialysis
Fernando Carrasco1, Marcelo Cano2, Jean Camousseigt1, Pamela Rojas1, Jorge Inostroza1 y Rubén Torres3
1Departamento de Nutrición, Facultad de Medicina. Universidad de Chile.
2Laboratorio de Ciencias de la Actividad Física. Facultad de Medicina. Universidad de Chile.
3Sección Nefrologia. Departamento de Medicina. Hospital Clínico. Universidad de Chile. Chile.
Dirección para correspondencia
RESUMEN
Introducción: La desnutrición es común en la enfermedad renal crónica (ERC), junto a una menor masa muscular y densidad mineral ósea (DMO), aumentando el riesgo de morbilidad.
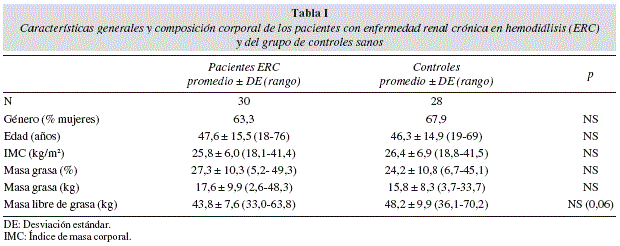
Objetivo: Comparar la composición corporal (CC), DMO y el contenido mineral óseo (CMO) entre pacientes con ERC y sujetos sanos, relacionándolos con ingesta energética, de macro y micronutrientes. Métodos: Se evaluó CC en 30 pacientes en hemodiálisis y 28 voluntarios sanos con DEXA. Los pacientes llenaron tres registros de 24 horas de ingesta alimentaria.
Resultados: Los pacientes con ERC presentaron una menor DMO (p < 0,01) y CMO (p < 0,0l) y una tendencia a tener menos masa libre de grasa (MLG) que los controles (p = 0,06). En los hombres, las diferencias en la DMO y CMO pierden significación al ajustar por masa grasa (%) y MLG (kg). En los pacientes con ERC, un 34,5% y 27,6% tuvo una ingesta adecuada de energía y proteínas, respectivamente. Sin embargo, se observó un déficit de la ingesta de energía y proteínas en 31,0% y 44,8% de los pacientes, respectivamente. No se encontró correlación en los pacientes con ERC entre la ingesta de macronutrientes y de calcio y DMO o CMO.
Conclusiones: Los pacientes con ERC tienen menor DMO y CMO que los voluntarios sanos. Estas diferencias pierden su importancia en los hombres, después de ajustar por parámetros de composición corporal. Se observó una pobre adecuación de la dieta en la mayoría de los pacientes con ERC, no observándose asociación entre estas variables y la composición corporal o densidad mineral ósea.
Palabras clave: Enfermedad renal crónica. Hemodiálisis. Composición corporal. Densidad mineral ósea.
ABSTRACT
Background: In chronic kidney disease (CKD) patients, malnutrition is common with loss of muscle mass and decreased bone mineral density (BMD), increasing the risk of morbidity.
Objective: To compare body composition, bone mineral density (BMD) and bone mineral content (BMC) between CKD patients and healthy subjects, and relate these parameters with energy, macronutrients and micronutrients intake.
Methods: Body composition was assessed 30 haemodialysis patients and compared with 28 healthy volunteers with DEXA. In patients, three 24 hours records of dietary intake were filled.
Results: A significantly lower BMD (p < 0.01) and BMC (p < 0.0) were found in CKD patients. There was a trend for patients to have lower fat free mass (FFM) than controls (p = 0.06). In men, differences in BMD and BMC lost significance when adjusting for fat mass FM (%) and FFM (kg). In CKD, 34.5% and 27.6% of patients had an adequate intake of energy and protein, respectively. However, it was observed a deficit of energy and protein intake in 31.0% and 44.8% of patients, respectively. No significant correlation was found in CKD patients between macronutrient and calcium intake and BMD or BMC.
Conclusions: CKD have lower BMD and BMC than healthy volunteers. These differences lost significance in men, after adjusting for body composition parameters. A poor dietary adequacy was found in most patients with CKD, but no association was observed between these variables and body composition or bone mineral density.
Key words: Chronic kidney disease. Haemodialysis. Body composition. Bone mineral density.
Abreviaturas
ERC: Enfermedad renal crónica.
DEXA: Absorciometría dual de rayos X.
DMO: Densidad mineral ósea.
CMO: Contenido mineral óseo.
PTH: Paratohormona.
MLG: Masa libre de grasa.
MG: Masa grasa.
Introducción
La enfermedad renal crónica (ERC) corresponde a la situación clínica derivada de la pérdida de función renal permanente y con carácter progresivo a la que puede llegarse por múltiples etiologías, tanto de carácter hereditario como adquiridas. En su etapa terminal requiere tratamiento de sustitución de la función renal por diálisis o trasplante renal1. La ERC es un problema de salud pública mundial, con una incidencia y prevalencia crecientes debido al envejecimiento de la población2.
Los pacientes con ERC tienen una expectativa de vida, ajustada por edad y sexo, significativamente reducida y en Estados Unidos se calcula que la esperanza de vida es 20-25 años menor en comparación con la población general3. Por otra parte los adultos mayores con diagnóstico de enfermedad renal crónica tienen trece veces más posibilidades de morir de cualquier causa, y seis veces más posibilidad de morir de una patología cardiovascular, que progresar a una fase terminal de la enfermedad renal4.
Uno de los grandes problemas de los pacientes con enfermedad renal, y en especial los que están en diálisis, es la desnutrición calórico-proteica, la que fluctúa entre 16% y 54%5,6. Ésta es un importante predictor de morbilidad y mortalidad, especialmente en estos pacientes3,6-8. Además es de suma importancia puesto que se trata de una condición potencialmente reversible9 y que al corregirse disminuiría la mortalidad6. Aún más, diversos estudios han encontrado que los pacientes en hemodiálisis con IMC elevado presentan una mayor supervivencia10,11, e incluso se ha encontrado una correlación positiva entre supervivencia y masa grasa12.
La etiología de la desnutrición en esta población es multifactorial. El factor más importante es la ingesta nutricional insuficiente6,13,14, siendo la anorexia la causa más importante, la que sumada a una prescripción dietética inadecuada contribuyen a la génesis de la desnutrición8, 15, 16.
En los pacientes con ERC, es frecuente la desnutrición con pérdida de masa muscular, siendo el DEXA el método más confiable para evaluar este deterioro8, 17. Además el DEXA es el método de referencia para evaluar la densidad mineral ósea (DMO) en pacientes con ERC18,19. La utilidad de la determinación regular de la DMO en los pacientes con ERC aún no genera un consenso a pesar que se ha demostrado su relación con la supervivencia de estos pacientes19-23.
La disminución en la DMO de los pacientes con ERC produce un aumento en el riesgo de fractura24,25, habiéndose establecido además una relación entre fracturas costales y mal estado nutricional26.
Una propuesta terapéutica para los pacientes con ERC apunta al manejo nutricional, proponiéndose una restricción en la suplementación de fosfatos como una medida que permitiría contrarrestar la osteopenia, incluso después de haber recibido un trasplante27-30.
El objetivo del presente estudio fue evaluar el estado nutricional y la densidad mineral ósea en pacientes portadores de ERC sometidos a hemodiálisis periódica, comparándolos con una población sana de referencia, y relacionar estos parámetros con la ingesta de energía, y de macronutrientes y micronutrientes.
Material y método
En este trabajo, aprobado por los Comités de Bioética del Hospital Clínico de la Universidad de Chile y de la Facultad de Medicina de la Universidad de Chile, se evaluaron 30 pacientes con ERC y 28 voluntarios sanos todos mayores de 18 años conformando dos grupos similares en sexo, edad e IMC. Los criterios de inclusión fueron cumplir con las características mencionadas anteriormente y no presentar cualquier patología aguda o crónica que pudiese alterar la composición corporal. A todos ellos se les explicó el propósito de la investigación y se les describió los procedimientos a los que serían sometidos, su duración, los eventuales beneficios y riesgos, el modo como se enfrentarían posibles complicaciones, la voluntariedad de la participación y la confidencialidad, con el fin de obtener un consentimiento informado. Las características generales y de composición corporal de los grupos estudiados se presentan en la tabla I. La etiología de la ERC fue: nefropatía diabética (n = 5; 16,7%); hipertensión arterial (n = 3; 10%); pielonefritis crónica (n = 4; 13,3%); enfermedad poliquística (n = 2; 6,7%); lupus eritematoso sistémico (n = 2; 6,7%); vasculitis (n = 1; 3,3%); síndrome hemolítico urémico (n = 1; 3,3%); causa desconocida (n = 12; 40%). Los sujetos presentaban la siguiente distribución según IMC: 3 pacientes bajo peso (10%), 14 con peso normal (46,7%), 7 con sobrepeso (23,3%), 5 obesos (16,7%) y 1 paciente con obesidad mórbida (3,3%).
Se excluyeron del trabajo aquellos pacientes con extremidades amputadas, hospitalizados recientes (1 mes), portadores de marcapasos, portadores de prótesis metálicas, embarazadas, y los pacientes con diagnósticos concomitantes de insuficiencia cardiaca congestiva, cirrosis hepática o cáncer terminal.
Determinaciones
• Antropometría básica: Se registró el peso inmediatamente post-diálisis, con balanza digital SECA modelo 767 (precisión 0,1 kg). La talla se determinó con un estadiómetro adosado a la balanza (con precisión de 0,5 cm). Las mediciones fueron hechas sin calzado y con ropa ligera.
• Absorciometría de rayos X de doble energía (DEXA) de cuerpo entero: las mediciones se hicieron 1 hora post-diálisis, con equipo Lunar DPX-L (Lunar Corporation, Madison, WI, USA). Se midió porcentaje de masa grasa, tejido libre de grasa y masa mineral ósea. Además se registró el contenido mineral óseo (CMO) y la densidad mineral ósea (DMO) total, en columna lumbar y en pelvis. La información entregada fue analizada con el software del fabricante versión 4.7e para todas las determinaciones. Las mediciones se realizaron dentro del periodo de 1 hora post-diálisis para lograr una mayor aproximación al peso corporal libre de edema31.
• Encuestas alimentarias: Se realizaron encuestas de registro de 24 horas. Se efectuó el registro de 3 días por paciente, un día de fin de semana (sin diálisis), un día en el que el paciente asistía a diálisis y uno interdiálisis, según el esquema recomendado por la National Kidney Foundation Kidney Disease Outcomes Quality Initiative (K/DOQI)31. Posteriormente las encuestas fueron revisadas con el paciente para precisar la información. Estas encuestas fueron analizadas con un programa computacional (Food processor 2 versión 3.13) para evaluar y cuantificar la ingesta calórica, de macronutrientes y de micronutrientes de estos pacientes. La adecuación de macro y micronutrientes se realizó considerando las recomendaciones de la K/DOQI31.
• Además se consignaron los siguientes datos:
- Exámenes de laboratorio: albúmina sérica, hemoglobina, hematocrito, nitrógeno ureico plasmático pre y post diálisis, calcemia, fosfemia, PTH y dosis de diálisis (Kt/V).
- Antecedentes mórbidos: diabetes mellitus, hipertensión arterial, enfermedad hepática, tabaquismo, fecha de inicio de la diálisis, tipo de acceso vascular, medicamentos y suplementos vitamínicos y de minerales consumidos.
Análisis estadístico
Se determinó la distribución normal de los datos mediante el test de Kolmogorov-Smirnov. Los parámetros con distribución normal se analizaron con test t de Student de muestras independientes (para análisis entre grupos) y para análisis de submuestras según género se utilizó el test de Mann-Whitney. Se aplicó el modelo de regresión lineal univariado para establecer diferencias entre grupos ajustando por variables de composición corporal. Para evaluar los principales factores determinantes del estado nutricional se realizó análisis de regresión lineal simple y múltiple según método stepwise. Se ocupó el coeficiente de correlación de Pearson para evaluar la correlación entre variables. Para analizar diferencias entre proporciones se aplicó test de Chi-cuadrado. Para todas las pruebas anteriores, se consideró significativo un valor de p < 0,05. El análisis estadístico fue realizado con el programa computacional SPSS 15.0 (SPSS Inc., Chicago Illinois).
Resultados
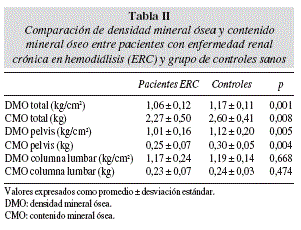
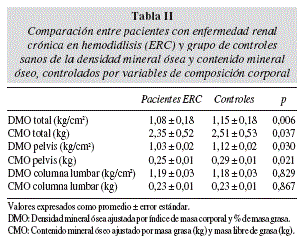
Todas las variables presentaron una distribución normal. Los resultados de DMO y CMO obtenidos con DEXA se muestran en la tabla II. Al comparar ambos grupos, se encontró una DMO y CMO significativamente menor en los pacientes hemodializados tanto en esqueleto total como en pelvis. Hubo una tendencia en los pacientes a presentar menor MLG que los controles (p = 0,06). Al evaluar la diferencia entre grupos en el CMO ajustado por kg de MLG y de MG se mantuvo la significación tanto en esqueleto total como en pelvis (tabla III). También se mantuvo una DMO significativamente menor en los pacientes hemodializados al ajustar por índice de masa corporal y % de masa grasa (tabla III).
En el sub-grupo de mujeres los valores de DEXA fueron significativamente menores en los pacientes para DMO total (p = 0,022), CMO total (p = 0,025) y CMO de pelvis (p = 0,034). Los pacientes de sexo masculino presentaron menor DMO (total: p = 0,001; pelvis: p = 0,003), menor CMO (total: p = 0,001; pelvis: p = 0,001), menor MLG (p = 0,003) y mayor porcentaje de masa grasa (p = 0,046) que los controles. En hombres, pero no en mujeres, las diferencias en DMO y CMO pierden significación al ajustar las variables por kilos de MLG y % de masa grasa.
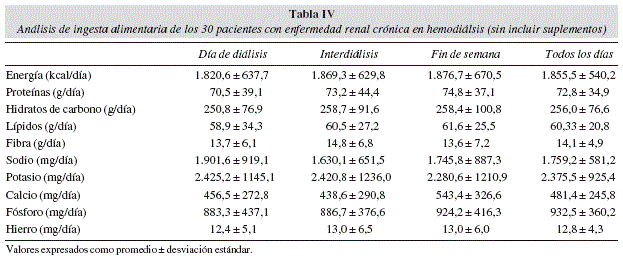
Se analizaron las encuestas alimentarias de los 30 pacientes, estimando la ingesta de energía, proteínas, carbohidratos, lípidos (totales, grasas saturadas y colesterol), fibra, sodio, potasio, calcio (de la dieta y de suplementos), fósforo y hierro (tabla IV). Se analizó si existían diferencias de ingesta entre los distintos días evaluados (día de diálisis, interdiálisis y fin de semana) no observándose diferencias significativas en ninguna de las variables analizadas.
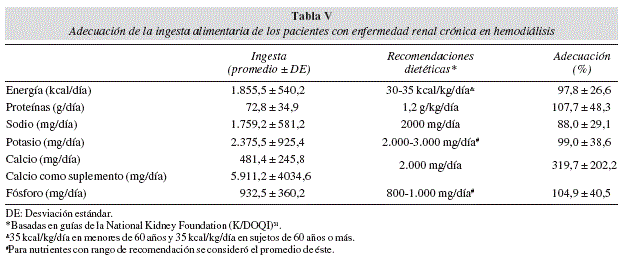
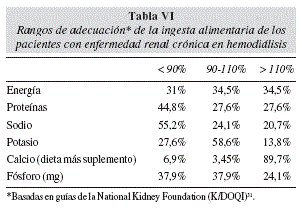
Se calculó el porcentaje promedio de adecuación de la dieta de los pacientes con las recomendaciones (NKF 2000) para energía, proteínas, sodio, potasio, calcio y fósforo (tabla V), en el que destaca un 97,8% promedio de adecuación para energía y un 107,7% promedio de adecuación para ingesta proteica. Se estratificó a la población según su rango de adecuación (< 90%, 90-110% y >110%) (tabla VI), donde destaca que para ingesta energética un 34,5% tiene una buena adecuación y un 27,6% tiene una buena adecuación para ingesta proteica.
Se realizó un análisis de regresión lineal para buscar las características (sexo, edad, variables antropométricas, exámenes de laboratorio, dosis y tiempo de diálisis) que pudiesen tener correlación con la ingesta. No se encontró correlación con ninguna de las variables estudiadas para ingesta calórica. Para ingesta proteica sólo se encontró una baja correlación con nitrógeno ureico post-diálisis (p = 0,03; r2 = 0,16).
Se realizó además la correlación entre ingesta de calcio, densidad mineral ósea y contenido mineral óseo, no encontrándose correlaciones estadísticamente significativas entre estas variables como tampoco entre la ingesta calórica, IMC y porcentaje de masa grasa corporal.
Discusión
Una de las características de la insuficiencia renal crónica es la aparición precoz de modificaciones de la composición corporal. Estas están asociadas a una malnutrición responsable de un aumento de la morbimortalidad, por lo que la evaluación del estado nutricional y el análisis de la composición corporal son una ayuda importante para prevenir y hacer un diagnóstico precoz en este grupo de pacientes.
En el presente trabajo destaca que sólo un 10% de los pacientes presentó bajo peso, lo que contrasta con la mayoría de los estudios que muestran una mayor prevalencia de desnutrición5,6. Sin embargo, en un reciente estudio realizado en población hispánica la prevalencia de desnutrición es similar (7%) a la encontrada en nuestra serie32. Asimismo, las principales etiologías de la ERC son similares que en dicho estudio32.
Al comparar el grupo de pacientes y controles, se encontró una menor densidad mineral ósea y contenido mineral óseo en los pacientes hemodializados, en esqueleto total y en pelvis, hallazgo similar a estudios previos26,33,34. Además hubo una tendencia (p = 0,06) en el grupo control a presentar mayor MLG.
Al realizar la comparación casos/controles separados por sexo, hubo una menor DMO y un menor CMO en los pacientes en ambos géneros. Sin embargo, en hombres las diferencias en DMO y CMO, pierden su significación al ajustar por MLG (mayor en los controles) y %MG (mayor en los pacientes).
En la literatura se encontró un estudio con un diseño similar pero con 15 pacientes en IRC no hemodializados comparados con 15 controles sanos, pareados por sexo, edad, peso y talla, con resultados similares a los de esta investigación, encontrándose un menor contenido mineral óseo y menor masa magra en los pacientes de sexo masculino33. Este hallazgo podría explicarse dado el mayor catabolismo proteico presente en la ERC13,33,35, y la reducción espontánea en la ingesta proteica que se produce durante la progresión de la enfermedad renal 13,33,36. Además, en esta muestra, la mayor actividad física de los sujetos de sexo masculino sanos, y en consecuencia un aumento en la masa magra de estos, podría influir en los resultados encontrados.
Los resultados ponen de manifiesto el riesgo de los pacientes con ERC en hemodiálisis de, por un lado, tener una mayor probabilidad de osteopenia y osteoporosis, y los riesgos asociados a estas patologías, y por otra parte de tener una mayor morbimortalidad relacionada con una menor masa magra y reserva proteica13,37.
De este modo, se hace relevante la necesidad de realizar un análisis de la composición corporal de estos pacientes ya que, incluso presentando las mismas características antropométricas del grupo control, presentan diferencias en su composición corporal que nos podrían permitir realizar un diagnóstico precoz de una desnutrición proteica, sarcopenia subclínica, osteopenia u otras patologías que pudiesen modificar la morbimortalidad o la calidad de vida de estos pacientes.
En las encuestas alimentarias por registro de 24 horas, no se encontró diferencia en ingesta energética, proteica ni de micronutrientes entre los distintos días evaluados (fin de semana sin diálisis, día de diálisis y día interdiálisis). Esto contrasta con lo encontrado en la literatura en que en el periodo más largo interdiálisis las ingestas de energía y proteínas son significativamente menores38. Esto se debería a la anorexia causada por la acumulación de toxinas urémicas6,13,38. En otro estudio se observó que la ingesta fue significativamente menor los días de diálisis39 Si bien hubo una tendencia a haber una menor ingesta el día de diálisis, ésta no fue estadísticamente significativa.
El porcentaje promedio de adecuación de la dieta de los pacientes con las recomendaciones31 es de alrededor de un 98% para energía y 108% para ingesta proteica. Sin embargo, al clasificar la muestra según su rango de adecuación, considerando 90-110% como aceptable, > 110% ingesta excesiva y < 90% como adecuación insuficiente, se puede evidenciar que para ingesta energética sólo un 35% tiene una buena adecuación y un 31% presenta una ingesta insuficiente. Para ingesta proteica sólo un 28% tiene una buena adecuación y un 45% presenta una ingesta insuficiente. Este hallazgo coincide con lo encontrado en estudios publicados en que se encuentra una ingesta calórica y proteica insuficiente39-41. Al analizar las variables que pudieran tener relación con la ingesta calórica, tales como sexo, edad, variables antropométricas y de composición corporal, exámenes de laboratorio, dosis y tiempo de diálisis, no se encontró ninguna correlación. En la literatura se puede encontrar correlación de la ingesta calórica con sexo, edad39,40 y con dosis de diálisis13,42,43. Para la ingesta proteica sólo se encontró correlación con nitrógeno ureico post-diálisis (p = 0,03, r = 0,40). Este hecho difiere con lo que se puede encontrar en la literatura, en que la ingesta proteica tiene una estrecha correlación con el nitrógeno ureico pre-diálisis5.
Se evaluó además la asociación entre la ingesta de calcio en la dieta, densidad mineral ósea y contenido mineral óseo, no encontrándose correlaciones significativas entre estas variables, lo que coincide con estudios previos34. En el presente estudio, un 98% de los pacientes tenía un consumo de calcio proveniente de la dieta menor a 500 mg/día. La explicación de este hallazgo en nuestra serie, es probablemente la misma que en el trabajo citado, que es el hecho que del calcio total ingerido, la menor parte viene de la dieta: alrededor de un 66% de los pacientes tenía una ingesta < 500 mg/día34.
Para un adecuado manejo nutricional en pacientes con ERC, es necesario hacer una evaluación del estado nutricional y para ello, se deben conocer y utilizar los métodos de evaluación de la composición corporal, ya que éstos han demostrado ser los mejores predictores de morbilidad, días de hospitalización y supervivencia en esta población. De estos métodos, DEXA ha sido validado como herramienta de evaluación de la composición corporal en el grupo específico de pacientes con ERC en hemodiálisis8,17, con la ventaja de ser menos influido por anormalidades en el estado de hidratación que otras técnicas como la antropometría o la impedancia bioeléctrica31, además de ser el único método que evalúa la masa mineral ósea. Sin embargo, no se ha determinado aún si DEXA puede ser considerado como un marcador intermedio en estudios de intervención nutricional, como tampoco se ha estudiado la correlación entre la composición corporal evaluada con esta técnica y la morbilidad o mortalidad de pacientes con ERC en hemodiálisis. Aunque la medición de impedancia bioeléctrica ha sido usada como método para evaluar la composición corporal en pacientes con ERC en hemodiálisis, su baja exactitud para medir masa grasa y masa libre de grasa, dependiente del estado de hidratación y de la distribución del agua corporal, ha limitado su aplicación en clínica aún con el uso de ecuaciones de predicción específicas44. No obstante, el uso de componentes específicos de la impedancia bioeléctrica como la reactancia y el ángulo de fase, los que reflejan integridad de membranas celulares y masa celular corporal, han mostrado buena correlación con marcadores antropométricos y bioquímicos3,45,46, y el ángulo de fase en particular se ha correlacionado positivamente con supervivencia en pacientes con ERC en hemodiálisis46,47.
Conclusiones
Los pacientes hemodializados presentaron una menor densidad mineral ósea y un menor contenido mineral óseo. Los pacientes de sexo masculino mostraron además un menor porcentaje de masa libre de grasa no ósea y un mayor % de masa grasa, variables que explican en parte la menor densidad y contenido mineral óseo en relación a los controles sanos.
No se encontraron diferencias en la composición corporal para los distintos grados de estado nutricional entre pacientes hemodializados y controles.
No hubo diferencias de ingesta energética, proteica ni de micronutrientes entre los distintos días evaluados, pero se registró una proporción importante de pacientes hemodializados con una ingesta energética insuficiente o excesiva, y con ingesta proteica insuficiente.
La ingesta calórica no se asoció a sexo, edad, variables antropométricas, exámenes de laboratorio, dosis ni tiempo de diálisis.
Con los resultados obtenidos es posible plantear la necesidad de evaluar y ajustar la ingesta de los pacientes hemodializados, dada la alta proporción de pacientes con ingesta inadecuada de calorías y/o proteínas.
References
1. Kramann R, Floege J, Ketteler M, Marx N, Brandenburg V. Medical options to fight mortality in end-stage renal disease: a review of the literature. Nephrol Dial Transplant 2012; 27: 4298-307. [ Links ]
2. Eggers P. Has the incidence of end-stage renal disease in the USA and other countries stabilized? Curr Opin Nephrol Hypertens 2011; 20 (3): 241-5. [ Links ]
3. Ikizler TA, Wingard RL, Harvell J, Shyr Y, Hakim RM. Association of morbidity with markers of nutrition and inflammation in chronic hemodialysis patients: a prospective study. Kidney Int 1999; 55 (5): 1945-51. [ Links ]
4. Dalrymple L, Katz R, Kestenbaum B, Shlipak M, Sarnak M, Stehman-Breen C, et al. Chronic Kidney Disease and the Risk of End-Stage Renal Disease versus Death. J Gen Intern Med 2010; 26 (4): 379-85. [ Links ]
5. Alvestrand A, Gutierrez A. Relationship between nitrogen balance, protein, and energy intake in haemodialysis patients. Nephrol Dial Transplant 1996; 11 (Suppl. 2): 130-3. [ Links ]
6. Kopple JD; McCollum Award Lecture, 1996: Protein-energy malnutrition in maintenance dialysis patients. Am J Clin Nutr 1997; 65: 1544-57. [ Links ]
7. Kato A, Odamaki M, Yamamoto T, Yonemura K, Maruyama Y. Influence of body composition on 5 year mortality in patients on regular haemodialysis. Nephrol Dial Transplant 2003; 18 (2): 333-40. [ Links ]
8. Locatelli F, Fouque D, Heimburger O, Drueke TB, Cannata-Andia JB, Horl WH, et al. Nutritional status in dialysis patients: European consensus. Nephrol Dial Transplant 2002; 17 (4): 563-72. [ Links ]
9. Flakoll PJ, Kent P, Neyra R, Levenhagen D, Chen KY, Ikizler TA. Bioelectrical impedance vs air displacement plethysmography and dual-energy X-ray absorptiometry to determine body composition in patients with end-stage renal disease. JPEN 2004; 28: 13-21. [ Links ]
10. Johansen KL, Young B, Kaysen GA, Chertow GM. Association of body size with outcomes among patients beginning dialysis. Am J Clin Nutr 2004; 80 (2): 324-32. [ Links ]
11. Beddhu S, Pappas LM, Ramkumar N, Samore M. Effects of body size and body composition on survival in hemodialysis patients. J Am Soc Nephrol 2003; 14 (9): 2366-72. [ Links ]
12. Kalantar-Zadeh K, Kuwae N, Wu DY, Shantouf RS, Fouque D, Anker SD, et al. Associations of body fat and its changes over time with quality of life and prospective mortality in hemodialysis patients. Am J Clin Nutr 2006; 83 (2): 202-10. [ Links ]
13. Bergstrom J. Nutrition and mortality in hemodialysis. J Am Soc Nephrol 1995; 6 (5): 1329-41. [ Links ]
14. Guarnieri G, Barazzoni R. Fighting Protein-Energy Wasting in Chronic Kidney Disease: A Challenge of Complexity. J Renal Nutrition 2011; 21 (1): 2-6. [ Links ]
15. Ruperto M, Sanz P, Barril P. Hipertrigliceridemia secundaria a suplementación nutricional en enfermedad renal crónica avanzada. Nutr Hosp Suplementos 2011; 4 (2): 37-41. [ Links ]
16. Castro M, Maafs A, Galindo C. La dieta del paciente renal. ¿Se puede incluir pescado? Nutr Hosp 2012; 27 (5): 1489-95. [ Links ]
17. Abrahamsen B, Hansen TB, Hogsberg IM, Pedersen FB, BeckNielsen H. Impact of hemodialysis on dual X-ray absorptiometry, bioelectrical impedance measurements, and anthropometry. Am J Clin Nutr 1996; 63 (1): 80-6. [ Links ]
18. Toussaint N, Elder G, Kerr P. A Rational Guide to Reducing Fracture Risk in Dialysis Patients. Seminars in Dialysis 2010; 23 (1): 43-54. [ Links ]
19. Ambrus C, Marton A, Nemeth Z, Mucsi I. Bone mineral density in patients on maintenance dialysis. Int Urol Nephrol 2010; 42 (3): 723-39. [ Links ]
20. Taal M, Roe S, Masud T, Green D, Porter C, Cassidy M. Total hip bone mass predicts survival in chronic hemodialysis patients. Kidney International 2003; 63:1116-20. [ Links ]
21. Matsubara K, Suliman N, Qureshi A, Axelsson J, Martola L, Heimburger O, et al. Bone Mineral Density in End-Stage Renal Disease Patients: Association with Wasting, Cardiovascular Disease and Mortality. Blood Purif 2008; 26:284-90. [ Links ]
22. Kiattisunthorn K, Moe S. Chronic Kidney Disease-Mineral Bone Disorder: Definitions and Rationale for a Systemic Disorder. Clinic Rev Bone Miner Metab 2012; 10: 119-27. [ Links ]
23. Heymann E, Jenkins M, Goldsmith D. Clinical Features and Manifestations of CKD-MBD. Clinic Rev Bone Miner Metab 2012; 10: 142-8. [ Links ]
24. Nickolas T, McMahon D, Shane E. Relationship between Moderate to Severe Kidney Disease and Hip Fracture in the United States. J Am Soc Nephrol 2006; 17: 3223-32. [ Links ]
25. Trombetti A, Stoermann C, Chevalley T, Van Rietbergen B, Herrmann F, Martin P, et al. Alterations of bone microstructure and strength in end-stage renal failure. Osteoporos Int 2012; DOI 10.1007/s00198-012-2133-4. [ Links ]
26. Ureña P, Bernard O, Ostertag A, Baudoin C, Cohen M, Cantor T, et al. Bone mineral density, biochemical markers and skeletal fractures in haemodialysis patients. Nephrol Dial Transplant 2003; 18: 2325-31. [ Links ]
27. Martin K, González E. Metabolic Bone Disease in Chronic Kidney Disease. J Am Soc Nephrol 2007; 18:875-85. [ Links ]
28. Danzinger J. The bone-renal axis in early chronic kidney disease: an emerging paradigm. Nephrol Dial Transplant 2008; 23 (9): 2733-7. [ Links ]
29. Hruska K, Mathew S, Memon I, Saab, G. The pathogenesis of vascular calcification in the chronic kidney disease mineral bone disorder (CKDMBD): The Links Between Bone and the Vasculature. Semin Nephrol 2009; 29 (2): 156-65. [ Links ]
30. Chadban S, Chan M, Ry K, Patwardhan A, Ryan C, Trevillian P, et al. Nutritional interventions for the prevention of bone disease in kidney transplant recipients. Nephrology 2010; 15: S43-7. [ Links ]
31. National Kidney Foundation. K/DOQI, Clinical practice guidelines for nutrition in chronic renal failure. Am J Kidney Dis 2000; 35 (6 Suppl. 2): S1-140. [ Links ]
32. Pérez-García R, Martín-Malo A, Fort J, Cuevas X, Lladós F, Lozano J, et al; ANSWER study. Baseline characteristics of an incident haemodialysis population in Spain: results from ANSWER-a multicentre, prospective, observational cohort study. Nephrol Dial Transplant 2009; 24 (2): 578-88. [ Links ]
33. O'Sullivan AJ, Lawson JA, Chan M, Kelly JJ. Body composition and energy metabolism in chronic renal insufficiency. Am J Kidney Dis 2002; 39 (2): 369-75. [ Links ]
34. Taal MW, Masud T, Green D, Cassidy MJ. Risk factors for reduced bone density in haemodialysis patient. Nephrol Dial Transplant 1999; 14 (8): 1922-8. [ Links ]
35. Reaich D, Price SR, England BK, Mitch WE: Mechanisms causing muscle loss in chronic renal failure. Am J Kidney Dis 1995; 26: 242-7. [ Links ]
36. Ikizler TA, Greene JH, Wingard RL. Spontaneous dietary protein intake during progression of chronic renal failure. J Am Soc Nephrol 1995; 6: 1386-91. [ Links ]
37. Kakiya R, Shoji T, Tsujimoto Y, Tatsumi N, Hatsuda S, Shinohara K, et al. Body fat mass and lean mass as predictors of survival in hemodialysis patients. Kidney Int 2006; 70: 549-56. [ Links ]
38. Bellizzi V, Di Iorio BR, Zamboli P. Daily nutrient intake in hemodialysis. G Ital Nefrol 2003; 20 (6): 592-601. [ Links ]
39. Sharma M, Rao M, Jacob S. A dietary survey in Indian hemodialysis patients. J Ren Nutr 1999; 9 (1): 21-5. [ Links ]
40. Loerenzo V, de Bonis E, Rufino M, et al. Caloric rather than protein deficiency predominates in stable chronic haemodialysis patients. Nephrol Dial Transplant 1995; 10 (10): 1885-9. [ Links ]
41. Kalantar-Zadeh K, Kopple JD, Deepak S. Food intake characteristics of hemodialysis patients as obtained by food frequency questionnaire. J Ren Nutr 2002; 12 (1): 17-31. [ Links ]
42. Guarnieri G, Faccini L, Lipartiti T, et al. Simple methods for nutritional assessment in hemodialyzed patients. Am J Clin Nutr 1980; 33 (7): 1598-607. [ Links ]
43. Lindsay RM, Spanner E, Heidenheim P, et al. PCR, Kt/V and membrane. Kidney Int Suppl 1993; 41: S268-73. [ Links ]
44. Cano M, Camousseigt J, Carrasco F, Rojas P, Inostroza J, Pardo A, Faundez V, Loncon P, Pacheco A, Sanhueza ME. Evaluación de la composición corporal en pacientes con insuficiencia renal crónica. Nutr Hosp 2010; 25 (4): 682-7. [ Links ]
45. Chertow GM, Lazarus JM, Lew NL, Ma L, Lowrie EG. Development of a population-specific regression equation to estimate total body water in hemodialysis patients. Kidney Int 1997; 51 (5): 1578-82. [ Links ]
46. Maggiore Q, Nigrelli S, Ciccarelli C, Grimaldi C, Rossi GA, Michelassi C. Nutritional and prognostic correlates of bioimpedance indexes in hemodialysis patients. Kidney Int 1996; 50 (6): 2103-8. [ Links ]
47. Abad S, Sotomayor G, Vega A, Pérez de José A, Verdalles U, Jofré R, López-Gómez JM. The phase angle of the electrical impedance is a predictor of long-term survival in dialysis patients. Nefrologia 2011; 31 (6): 670-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Marcelo Cano.
Laboratorio de Ciencias de la Actividad Física.
Facultad de Medicina. Universidad de Chile.
Chile.
E-mail: mcano@med.uchile.cl
Recibido: 5-III-2013.
Aceptado: 28-V-2013.