My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.28 n.4 Madrid Jul./Aug. 2013
https://dx.doi.org/10.3305/nh.2013.28.4.6470
ORIGINAL / Otros
Porcentaje de adiposidad y su relación con el índice de inmunorreactividad de los receptores hormonales en mujeres mexicanas con cáncer de mama
Adiposity percentage relationship with hormone receptors immunoreactive score in breast cancer Mexican women
Luz Mª Adriana Balderas-Peña1,6, Daniel Sat-Muñoz2, Juan Manuel Castro Cervantes3, Ricardo-Ernesto Ramírez-Orozco4, Wenceslao-Guillermo Ángeles-Bueno3, María-Rosa Flores-Márquez5, Griselda-Guadalupe Macías-López6, Sandra-Luz Ruiz-Quezada6, Ana-Leticia Salcedo-Rocha7, Javier-Eduardo García de Alba-García7 y Pedro Solano-Murillo8, 9
1Unidad de Investigación Médica en Epidemiología Clínica. Unidad Médica de Alta Especialidad. Hospital de Especialidades. Centro Médico Nacional de Occidente. Instituto Mexicano del Seguro Social.
2Unidad Médica de Alta Especialidad. Hospital de Gineco-Obstetricia. Centro Médico Nacional de Occidente. Insituto Mexicano del Seguro Social. Departamento de Morfología. Centro Universitario de Ciencias de la Salud. Universidad de Guadalajara.
3Departamento Clínico de Oncología Quirúrgica. División de Oncología Hematología. Servicio Nacional de Radioneurocirugía. Unidad Médica de Alta Especialidad. Hospital de Especialidades. Centro Médico Nacional de Occidente. Instituto Mexicano del Seguro Social.
4Licenciatura en Nutrición. Facultad de Medicina. Universidad de Guanajuato.
5Departamento de Anatomía Patológica. Unidad Médica de Alta Especialidad. Hospital de Especialidades. Centro Médico Nacional de Occidente. Instituto Mexicano del Seguro Social.
6Laboratorio de Biología Molecular. Departamento de Farmacobiología. División de Ciencias Básicas. Centro Universitario de Ciencias Exactas e Ingenierías. Universidad de Guadalajara.
7Unidad de Investigación Social, Epidemiológica y en Servicios de Salud. Delegación Jalisco. Instituto Mexicano del Seguro Social.
8Departamento Clínico de Oncología Médica. División de Oncología Hematología. Servicio Nacional de Radioneurocirugía. Unidad Médica de Alta Especialidad. Hospital de Especialidades. Centro Médico Nacional de Occidente. Instituto Mexicano del Seguro Social.
9Coordinación de la Especialidad en Oncología Médica. Coordinación de Especialidades Médicas. Coordinación de Posgrado. Departamento de Clínicas Médicas. División de Disciplinas Clínicas. Centro Universitario de Ciencias de la Salud. Universidad de Guadalajara. México.
Dirección para correspondencia
RESUMEN
Introducción: El tejido adiposo es una importante fuente de estrógenos, los cuales se encuentran implicados en el desarrollo de cáncer de mama.
Objetivo: Establecer la relación entre el porcentaje de adiposidad y el índice de inmunorreactividad de los receptores a estrógenos y a progesterona en mujeres mexicanas con cáncer de mama.
Métodos: Estudio transversal analítico en pacientes con cáncer de mama confirmado con estudio histopatológico. Se estimó el % de adiposidad, y el índice de inmunorreactividad. Se realizó el análisis de correlación entre el porcentaje de adiposidad, el IMC, la presencia de DM2 e hipertensión arterial con la expresión de receptores a estrógeno y progesterona y regresión logística con cálculo de Odds Ratio.
Resultados: Se estudiaron 43 pacientes con cáncer de mama y se observó asociación entre el porcentaje de adiposidad y el índice de inmunoreactividad para los RE y RP (rP 0,470; p 0,003 y rP 0,328; p 0,042 respectivamente). El factor de riesgo más importante en cáncer positivo a receptores estrogénicos fue la obesidad (OR 19,1, IC 95% 2,1 a 169,1, p 0,008) y obesidad previa en cáncer positivo a receptores a progesterona (OR 20,7, IC 95% 2,3 a 185,9, p 0,007).
Conclusión: El porcentaje de adiposidad es un factor de riesgo importante para desarrollar cáncer de mama positivo a receptores hormonales.
Palabras clave: Porcentaje de adiposidad. Cáncer de mama. Receptores a estrógeno. Receptores a progesterona.
ABSTRACT
Introduction: Adipose tissue is an important estrogen resource and they are involved in breast cancer development.
Objective: To establish the relationship between adiposity percentage and the estrogen and progesterone receptors immunoreactive score in Mexican women with breast cancer.
Methods: This is a transversal and analytical study. We identified breast cancer women with cancer histologic diagnosis. We calculated: adiposity percentage and immunoreactive score. We performed correlation analysis between adiposity percentage, body mass index, diabetes mellitus and arterial hypertension, with estrogen and progesterone receptors in breast cancer samples. We perform logistic regression and Odds Ratio estimations.
Results: We studied 43 patients with breast cancer and we observed association between adiposity percentage and estrogen and progesterone immnunoreactive score (rP 0.470; p 0.003 and rP 0.328; p 0.042, respectively). The most important risk factor in breast cancer positive to estrogen receptors was obesity (OR 19.1, IC95% 2.1 a 169.1, p 0.008), and previous obesity in breast cancer positive to progesterone receptors (OR 20.7, IC95% 2.3 a 185.9, p 0.007).
Discussion: Adiposity percentage is an important risk factor to develop breast cancer positive to hormone receptors related with the risk of breast cancer positive to hormonal receptors.
Key words: Adiposity percentage. Breast cancer. Estrogen receptors. Progesterone receptors.
Introducción
El cáncer está condicionado por diversos factores etiológicos, algunos aún no identificados1. Los cánceres en conjunto son una de las principales causas de mortalidad en todo el mundo, y en los países económicamente desarrollados sólo son superados por las enfermedades cardiovasculares. Se calcula que en el año 2000 hubo unos 10 millones de casos nuevos y más de 6 millones de defunciones por cáncer2.
Los factores alimentarios explican aproximadamente el 30% de los cánceres en los países industrializados3, lo que hace de la dieta el segundo factor después del tabaco como causa teóricamente previsible de cáncer. Se cree que esa proporción es de un 20% en los países con economías emergentes4, pero los cambios experimentados por la dieta podrían hacerla aumentar. En conjunto, se calcula que el peso corporal y la inactividad física son responsables de entre la quinta y la tercera parte de varios de los cánceres más comunes, concretamente los cánceres de mama (posmenopáusicos), colon, endometrio, riñón y esófago (adenocarcinoma)5.
El cáncer de mama es el segundo más común en el mundo y el más frecuente entre las mujeres, con mayor incidencia en los países desarrollados en comparación con las economías emergentes6, si bien estas diferencias pudiesen estar relacionadas con factores de riesgo reproductivo, existen cada vez más evidencias de que el estilo de vida, la dieta y la obesidad condicionan estas diferencias7,8.
Se ha demostrado que la obesidad y el alcohol incrementan el riesgo de desarrollar cáncer de mama. La obesidad aumenta aproximadamente en 50% el riesgo de cáncer de mama en las mujeres posmenopáusicas9, 10. No se ha encontrado evidencia de que la obesidad aumente el riesgo de cáncer de mama en mujeres premenopáusicas, pero ser obesa, antes de la menopausia, probablemente condicione la obesidad durante el resto de la vida y por consiguiente, con el tiempo, un mayor riesgo de cáncer de mama.
La epidemia de obesidad y su relación con enfermedades metabólicas podría ser atribuida a cambios dramáticos en los factores ambientales y nutricionales de las últimas décadas11. El incremento en la ingesta calórica y la disminución de la actividad física se han postulado como una de las causas más importantes de este incremento, sin embargo, algunas evidencias se han centrado en el papel potencial de obesógenos ambientales (factores productores de obesidad de tipo ambiental), como los xenobióticos químicos que pueden alterar el desarrollo normal y el control homeostático sobre la adipogénesis y el balance de energía.
Estas evidencias señalan el papel de los receptores a estrógenos alfa (ERα) y beta (Erβ) que regulan las vías metabólicas de los estrógenosy que se relacionan con las alteraciones de las vías metabólicas conjuntas estradiol (E2)/receptores estrogénicos por los obesógenos ambientales.
Los estrógenos, por su parte, actúan a través de estos receptores en el aparato reproductor, el tejido óseo, el aparato cardiovascular, la hematopoyesis, así como en el sistema nervioso central y periférico12. Los estrógenos se encuentran implicados en el desarrollo de cáncer de mama y los factores de riesgo asociados con él reflejan en muchos casos la exposición acumulada del epitelio mamario a los estrógenos13.
Existen dos hipótesis concurrentes para explicar la relación entre los esteroides sexuales (cuya molécula precursora es el colesterol), particularmente los estrógenos y el cáncer de mama; la primera postula que la unión de los estrógenos a los receptores de estrógenos estimula la proliferación del epitelio mamario, con lo que se estimula el número de células blanco en éste tejido y se incrementa la división celular y la síntesis de DNA, con lo que se eleva el riesgo de errores de replicación, lo que puede resultar en la aparición de mutaciones de novo que alteran procesos celulares normales como la apoptosis, la proliferación celular o la reparación de DNA14-16. La segunda hipótesis postula que el metabolismo de los estrógenos lleva a la producción de sustancias genotóxicas que producen daño directo al DNA, con mutaciones puntuales. Existe evidencia de que los estrógenos pueden actuar a través de ambos mecanismos para iniciar y/o promover el cáncer de mama. Los mecanismos a través de los cuales los receptores estrogénicos y sus coreguladores modulan el desarrollo y la progresión tumoral han empezado a entenderse, así como los mecanismos a través de los cuales se regula el crecimiento celular y la transcripción dependiente de estrógenos14-16.
La obesidad resulta en exceso de tejido adiposo blanco, considerado un órgano endócrino por su capacidad para almacenar y metabolizar hormonas esteroideas, por su parte, los estrógenos regulan el metabolismo y la localización del tejido adiposo blanco, al tiempo que juegan un papel en la adipogénesis, los depósitos de tejido adiposo, la lipogénesis, la lipólisis y la proliferación de adipocitos14-16.
En las mujeres posmenopáusicas la disminución de los niveles de estrógenos se asocia a un aumento de los depósitos de tejido adiposo de localización central, donde se da la aromatización de los esteroides sexuales.
Los RNA mensajeros y las proteínas de ER y PR se expresan en el tejido adiposo humano. En los adipocitos humanos maduros la isoforma ER es la que tiene mayor expresión, también se ha observado una mayor expresión del ER en el tejido adiposo de las mujeres, con respecto a los varones, ninguno de ellos se expresa en los preadipocitos14-16.
A pesar de que los mecanismos responsables de la regulación de la adipogénesis mediada por estrógenos permanecen inciertos, éstos pueden estar involucrados en la supresión de estrógenos de lipoproteín-proteasa, una enzima lipogénica que regula la conversión metabólica de los triglicéridos plasmáticos a ácidos grasos libres y el aumento de los depósitos de lípidos en los adipocitos14-16.
El gen de la lipoproteinproteasa es un blanco transcripcional directo de los estrógenos. En las mujeres el nivel de la enzima se incrementa después de la menopausia. Adicionalmente para inhibir la lipogénesis (recaptura de ácidos grasos), los estrógenos también incrementan la lipólisis (liberación de ácidos grasos y glicerol), por aumento en la expresión de lipasas hormono-sensibles, las cuales catalizan lisis de los depósitos triacilglicerol y la liberación de ácidos grasos. Sin embargo, los estrógenos también han mostrado la capacidad de inhibir la lipólisis14-16.
En las mujeres posmenopáusicas los estrógenos incrementan la expresión de los receptores α-2-adrenérgicos en el tejido adiposo subcutáneo, la cual inhibe la lipólisis. Este incremento sugiere un papel directo de los receptores de estrógenos en la regulación de la lipólisis14-16.
Estos antecedentes brindan las bases teóricas para la observación clínica de la mayor frecuencia de cáncer de mama hormonodependiente en mujeres obesas y de la posibilidad de establecer estrategias de prevención relacionadas con el mantenimiento de un estilo de vida saludable y tratamiento de la obesidad, como parte de la estrategias para lograr una disminución en el número de casos de cáncer de mama con receptores hormonales positivos, con un probable impacto en la reducción en el número total de casos nuevos de cáncer de mama.
Objetivo
Establecer la relación entre el porcentaje de adiposidad y el índice de inmunorreactividad de los receptores a estrógenos y a progesterona en mujeres mexicanas con cáncer de mama.
Métodos
Estudio transversal analítico de asociación en un grupo de 43 mujeres con cáncer de mama en diferentes etapas clínicas a través de un muestreo consecutivo. Estudio aprobado por el Comité Local de Investigación en Salud 1301 del Instituto Mexicano del Seguro Social y se obtuvo el consentimiento bajo información de cada una de las pacientes para participar en el estudio. Las pacientes se reclutaron en la consulta externa de la División de Oncología al cubrir con los siguientes criterios de selección: diagnóstico histológico de cáncer de mama en cualquiera de sus etapas clínicas, mujeres mayores de 18 años, se les midió: índice de masa corporal y porcentaje de adiposidad. No se integraron al estudio las pacientes que hubiesen iniciado manejo para cáncer de mama en otra institución. Se excluyeron aquellas pacientes en quienes por razones técnicas no se realizó la tinción de inmunohistoquímica para evaluar la expresión de receptores a estrógeno y a progesterona.
Valoración nutricia de las pacientes
Las pacientes incluidas en el estudio se evaluaron siguiendo como guía un cuestionario estructurado y validado, donde se incluyeron: datos generales, antecedentes personales patológicos como la presencia de diabetes mellitus 2 e hipertensión arterial, también se integraron los datos de la antropometría: talla medida con un estadímetro portátil SECA 208 con escala hasta 220 cm de acuerdo a la técnica estándar; el peso y el porcentaje de grasa corporal se evaluaron con báscula de bioimpedancia eléctrica TANITA BF-680W. La interpretación del porcentaje de grasa se realizó acorde a los valores sugeridos por Durnin JGVA y finalmente se tomaron medidas tanto de la cintura como de la cadera para determinar el índice cintura/cadera y circunferencia abdominal. Para calcular el índice de masa corporal, el índice cintura/cadera y la adiposidad, así como para definir obesidad se tomaron en cuenta las siguientes consideraciones: Índice de masa corporal (IMC): masa (kg)/talla (m)2, de acuerdo al cual se clasificó a las pacientes como de peso normal (> 18,5 a 24,99), con sobrepeso (25 a 29,99) u obesas (> 30), de acuerdo a la OMS (Global Database on Body Mass Index, adapted from WHO, 1995, WHO, 2000 and WHO 2004). Índice Cintura/Cadera (ICC): Obtenido de la medición del perímetro de la cintura a la altura de la última costilla flotante, y el perímetro máximo de la cadera a nivel de los glúteos, aplicando posteriormente la siguiente fórmula: cintura (cm)/cadera (cm), considerando normal un índice de 0,71 a 0,85 en las mujeres, de acuerdo a la OMS (Global Database on Index Waist-Hip, adapted from WHO, 1996, WHO, 2000 and WHO 2004). Una circunferencia de cintura mayor a 88 cm se consideró como indicador de riesgo cardiovascular asociado a obesidad. Un porcentaje de masa grasa > 30% en las mujeres se considera excesivo14-16.
La biopsia del tejido tumoral se envió para ser procesado en el departamento de patología donde se fijó en formaldehído al 0,4%, posteriormente se incluyó en bloques de parafina, los cuales fueron cortados con un grosor de 5 micras y montados en portaobjetos silanizados.
Expresión de RE y RP en el tejido mamario
Las laminillas fueron desparafinadas por calor 50' a 60o C y posteriormente sumergidas dos veces en xilol (5'). Se rehidrataron en alcohol al 100% (2 veces), 96%, 70%, 30% y agua destilada, (5' en cada uno). El desenmascaramiento antigénico se realizó con búfer de citrato 10 mM pH 6,0 (2.1 g de ácido cítrico, aforado a 1 L con agua destilada, pH 6,0 con NaOH) durante 30 min en vaporera eléctrica. Se lavaron con TBS (pH 7,4) por 5 minutos.
Tinción inmunohistoquímica
Se utilizó el ensayo Envision System (K1393, Dako Corp, Carpintería, USA). Se bloqueó la peroxidasa endógena con el reactivo bloqueador de peroxidasa (Dako Corp, USA) 5' a temperatura ambiente y se lavaron con TBS (pH 7.4) durante 5 minutos. Las laminillas se incubaron con el anticuerpo específico (Dako ER/PR pharmDx™ Kit, Code K4071, USA). Enseguida, se incubaron con anticuerpo secundario conjugado con HRP (horseradish peroxidase) durante 30'. Se lavaron con TBS 5'. Se incubaron con cromógeno: 3-aminoetilcarbazol (AEC) por 15'. Se lavaron con agua bidestilada y luego se contratiñeron con la hematoxilina de Mayer con modificación de Lillie (S3309 DAKO cytomation, USA); fueron sumergidas en agua de amonio (NH4OH 0.08% en agua desionizada) y por último se enjuagaron en agua corriente y se montaron los cubreobjetos con solución de montaje (gelatina 1 g, H2O 6 mL, glicerina 7 mL, fenol 100 mL). Como control negativo, el proceso se siguió de la misma manera omitiendo el anticuerpo primario. Se tomaron fotomicrografías de cortes representativos con un microscopio Olympus CX31 y la cámara Sony Cybershot DSC-W1 con 5.1 megapixeles de resolución.
Evaluación de la tinción de inmunohistoquímica para la expresión de receptores a estrógeno y progesterona
El estudio histológico y la evaluación de la inmunohistoquímica fueron realizados por dos patólogos independientes. Las laminillas con evaluaciones discrepantes fueron revaloradas por ambos hasta alcanzar un consenso. Para cada muestra, se evaluaron al menos 3.000 células para la expresión de los receptores a estrógeno y a progesterona. Para calcular el índice de inmunorreactividad se tomaron en cuenta la intensidad de la tinción y el porcentaje de células positivas de acuerdo a la descripción de Remmele y Stegner (1987), con la siguiente fórmula: (Porcentaje de células positivas) x (intensidad de la tinción) = Índice de inmunorreactividad (IRS por sus siglas en inglés immunoreactive score, tabla I)17,18.
Análisis estadístico
Se calcularon promedios y desviaciones estándar para la edad, el peso, el índice de masa corporal (IMC) y el porcentaje de expresión de receptores de estrógeno y progesterona, posteriormente se realizó el análisis de correlación entre el porcentaje de masa corporal, el IMC, la presencia de DM2 e hipertensión arterial y el porcentaje de expresión de receptores a estrógeno y progesterona, seleccionando aquellas variables con una p menor de 0,05 en el análisis de correlación; se realizó la regresión logística con el cálculo de Odds Ratio como estimadores de riesgo para desarrollar cáncer de mama con receptores de estrógeno y/o progesterona positivos.
Resultados
Se estudiaron 43 pacientes con cáncer de mama en diferentes etapas clínicas, confirmado con estudio histopatológico y con inmunohistoquímica para receptores a estrógeno y a progesterona. La edad promedio fue de 52 (± 12,2) años, peso de 69,4 (± 13,15) kg, porcentaje de adiposidad de 36,5 (± 5,23) %, con cintura de 89,4 (±11,32) cm, con cadera de 105,24 (± 10,73) con un índice cintura/cadera (ICC) de 0,85 (± 0,082), un índice de masa corporal (IMC) 27,7 (± 5,13), los tejidos neoplásicos de 18 pacientes (41,86%) tuvieron una expresión de receptores a estrógenos > 10%, y de 20 pacientes (46,51%) receptores a progesterona, el promedio del IRS del receptor a estrógenos fue de 3,31 (± 4,17), el IRS del receptor a progesterona fue 2,69 (± 3,88) en promedio. La media del porcentaje de expresión del receptor a estrógenos fue 43,10 (± 43,81%) y del receptor a progesterona de 31,36 (± 39,12). Las pacientes con peso normal expresaron un porcentaje promedio de positividad del receptor a estrógenos de 30,77 % (± 42,12), con sobrepeso de 33,21% (± 42,81), y las mujeres obesas de 83% (± 23,24) con una diferencia estadísticamente significativa (p 0,002). En las pacientes con peso normal, sobrepeso y obesidad el promedio del porcentaje de positividad fue 25% (± 38,29), 19,21% (± 34) y 63,45% (± 35,08) con diferencia significativa (p 0,006).
Cuando se agruparon a las pacientes por etapa clínica y se calculó el promedio del porcentaje de expresión del receptor a estrógenos se encontraron los siguientes resultados: etapa clínica I: 76 (42,63%), etapa clínica IIA: 51,25 (47,9%), etapa clínica IIB: 39,3 (42,4%), etapa clínica IIIA: 35,71 (44,67%), etapa clínica IIIB: 0,00 (0,00%), etapa clínica IV: 45 (35,3%), sin encontrar diferencias (p 0,479). En cuanto al promedio del porcentaje de expresión del receptor a progesterona los resultados fueron: etapa clínica I: 55,6 (51,35%)%, etapa clínica IIA: 40,62 (48,8%) etapa clínica IIB: 28,50 (35,2%), etapa clínica IIIA: 17,86 (33,65%), etapa clínica IIIB: 0,00 (0,00%), etapa clínica IV: 45 (35,3%), sin diferencias estadísticamente significativas (p 0,548).
Las pacientes clasificadas con un peso normal tuvieron menos del 33% de grasa corporal y las pacientes con sobrepeso se encuentran con valores similares las mujeres con obesidad alcanzan porcentajes de adiposidad que fluctúan del 42% al 50% de grasa corporal. Los resultados de la antropometría se muestran por etapa clínica en la tabla II. No se observaron diferencias significativas entre etapas clínicas.
Al realizar el análisis de correlación entre el porcentaje de masa grasa y el índice de inmunoreactividad para los receptores a estrógeno y a progesterona en la biopsia de tejido mamario maligno se obtuvo un coeficiente de correlación de Pearson de 0,470 (p 0,003) y 0,328 (p 0,042) respectivamente.
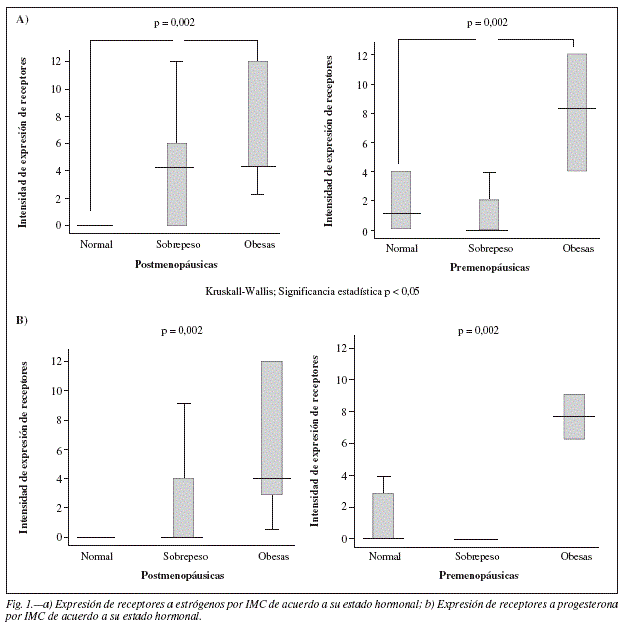
Se observó una diferencia estadísticamente significativa (p 0,002) en la expresión de receptores a estrógeno de acuerdo a la composición corporal tanto en el grupo de mujeres premenopáusicas, como en las posmenopáusicas (fig. 1). El mismo patrón fue observado en la expresión de los receptores a progesterona (fig. 1).
Se encontró una diferencia estadísticamente significativa en el número de mujeres obesas en la posmenopausia con respecto a las premenopáusicas (p 0,005), así como en el número de pacientes hipertensas y con obesidad (p 0,002) (tabla III). Estas diferencias no se observan al agrupar a las pacientes por etapa clínica (tabla IV).
Al realizar el cálculo de las estimaciones de riesgo (riesgos crudos) para presentar cáncer de mama positivo a receptores hormonales se observó que la obesidad representa el factor de riesgo más elevado para presentar cáncer de mama positivo a receptores de estrógeno (OR 19,1, IC 95% 2,1 a 169,1, p 0,008), en cuanto a los riesgos ajustados, la estimación más alta correspondió a la obesidad con hipertensión arterial (OR 12,7, IC 95% 1,3 a 128,1, p 0,031). Con respecto a la estimación del riesgo para presentar cáncer de mama positivo a receptores a progesterona, el factor de riesgo más importante en los riesgos crudos fue el antecedente de obesidad previa (OR 20,7, IC 95% 2,3 a 185,9, p 0,007); mientras al estimar los riesgos ajustados, la presencia de obesidad previa con hipertensión arterial actual mostró ser el factor de riesgo más importante (OR 17,5, IC 95% 1,5 a 206,2, p 0,023) como se muestra en la tabla V.
Discusión
La relación estrecha entre la obesidad y el cáncer se ha descrito no solo para el cáncer de mama, también se ha señalado su relación estrecha con los cánceres de próstata, endometrio, colon y vesícula biliar, todos ellos con uno o varios componentes hormonales relacionados con éstos y con el estilo de vida de los pacientes. En las mujeres el exceso de tejido graso en la pre y la posmenopausia es un factor de riesgo independiente no sólo para el desarrollo de la enfermedad, sino también se ha relacionado con su detección en etapas clínicas avanzadas y con un mal pronóstico en cuanto a período libre de enfermedad y supervivencia global19. Éstos hallazgos han sido confirmados al igual que en nuestros resultados por autores como Kwan ML et al.20 quienes encontraron que el sobrepeso y la obesidad como factores de riesgo en el desarrollo de cáncer de mama; así mismo el estudio de Yang XR et al.21 encontraron una clara asociación entre un índice de masa corporal elevado y el cáncer de mama positivo a receptores hormonales, sin que esta relación se observe en tumores triple negativos por histología, lo que sugiere una etiología y una biología, diferentes para otros tipos tumorales, mismos que coincidieron con lo observado por Li CI22 y su grupo, así como por Esfahlan RJ23 y Oh SW y cols.24.
Se ha postulado que los efectos de la obesidad sobre el aumento del riesgo de cáncer de mama en la pre y la posmenopausia y un pronóstico más adverso, sean el reflejo de que el tejido adiposo secreta diferentes factores que interactúan con el epitelio mamario, de hecho, el tejido adiposo es una de las mayores fuentes de estrógenos (tanto en la premeopausia en mujeres con enfermedad de ovario poliquístico, como en la posmenopausia), los cuales son un factor biológico importante en la génesis de los cánceres positivos a receptores de estrógenos, los cuales se medían los efectos biológicos de esta hormona25. En nuestros resultados clínicos se confirman estas observaciones cuando al estimar los riesgos de cáncer de mama positivo a estrógenos y/o a progesterona, asociados con la obesidad (cáncer positivo a RE: OR 19,1, IC 95% 2.1 a 159,1, p 0,008; cáncer positivo a RP: OR 9,9, IC 95% 1,8 a 54,4, p 0,008) o el antecedente de la misma (cáncer positivo a RE: OR 15,7, IC 95% 1,8 a 140, p 0,013; cáncer positivo a RP: OR 20,7, IC 95% 2,3 185,9, p 0,007), encontramos que estas dos condiciones se comportan como importantes factores de riesgo.
El tejido adiposo como órgano endocrino es una fuente importante de leptina, la cual no sólo controla el mecanismo de la saciedad, el metabolismo de los carbohidratos y los lípidos, dentro de sus acciones fisiológicas también juega un papel en el desarrollo de la hematopoyesis y los sistemas reproductivo e inmune26.
No sólo la ingesta calórica y la obesidad favorecen el inicio de alteraciones cardiovasculares, en el tejido adiposo la androstenediona se aromatiza y se transforma en estrona lo que hace que al menos en las mujeres posmenopáusicas el tejido adiposo se convierta en la mayor fuente de estrógenos. El receptor a estrógenos a regula la supervivencia, migración, diferenciación, supervivencia y proliferación de las células de cáncer de mama. Los receptores a estrógenos y a progesterona se expresan de forma extensa en los tejidos sensibles a los esteroides sexuales femeninos. Los niveles de estradiol, progesterona y leptina también se incrementan en la sangre de las mujeres con cáncer de mama y se ha observado que la secreción de leptina ejerce una mayor regulación en la producción de éstas hormonas que sobre las variaciones en el peso corporal; por ello la leptina parece ser un factor muy importante derivado del tejido adiposo que regula el crecimiento celular en el cáncer de mama, muy probablemente a través de la interacción con segundos mensajeros intracelulares como MAP kinasas y las proteínas STAT involucradas en la proliferación y supervivencia celular, de ésta familia la molécula STAT3 representa una vía común a través de la cual la señalización mediada por estrógenos y leptina induce un microambiente inflamatorio crónico y llevar a un incremento en el riesgo de cáncer en los pacientes obesos27,28. Los niveles de leptina en pacientes manejadas con terapia antiestrogénica compite por los RE α y puede mediar la resistencia del cáncer de mama positivo a receptores hormonales ante la hormonoterapia29; por lo que la obesidad debe considerarse no sólo un factor de riesgo para el desarrollo de cáncer de mama con receptores hormonales positivos, sino también un indicador de mal pronóstico en las pacientes obesas, por ser una fuente rica de leptina.
Aún está pendiente de discusión el papel que juegan los factores relacionados con la dieta con el riesgo de cáncer de mama30,31. De acuerdo a Lajous M y cols. se pudo confirmar una asociación directa entre la ingesta de carbohidratos, la carga glucémica y el riesgo de cáncer de mama negativo a receptores hormonales, lo cual de acuerdo a nuestras observaciones no apoyaría los hallazgos encontrados en esta población específica, sin embargo sus hallazgos también confirman la asociación entre el sobrepeso y una circunferencia de cintura mayor de 88 cm y el riesgo de cáncer en mujeres francesas posmenopáusicas30.
Desde el punto de vista epidemiológico en el estudio multiétnico de Setiawan VW y cols. se pudo observar que además de las diferencias raciales en la expresión de los receptores hormonales, la obesidad y un índice de masa corporal de 25 a 30 (mujeres con sobrepeso RR 1,27, IC 95% 1,1 a 1,46, p < 0,001) y uno > 30 (mujeres obesas (RR 1,53 IC 95% 1,29 a 1,81, p < 0,001), son los factores de riesgo más importantes en relación a la presencia de cáncer de mama hormono-dependiente, de forma similar a lo observado en nuestro trabajo30.
En la población latinoamericana múltiples estudios32 han asociado el cáncer de mama y la obesidad, encontrando porcentajes de pacientes obesas tan altos como del 62,4%33 al 89%34 y el consumo de grasas de origen animal35.
Conclusión
El porcentaje de adiposidad se encuentra directamente relacionado con el riesgo de desarrollar cáncer de mama positivo a receptores hormonales, lo que hace de la obesidad uno de los pocos factores de riesgo modificables en la génesis de un cáncer. Por ello es importante establecer acciones encaminadas a lograr modificaciones en la composición corporal y en el estilo de vida que coadyuven en el mediano y largo plazo a una reducción en la incidencia del cáncer de mama y a lograr un mejor pronóstico en aquellas mujeres supervivientes de cáncer de mama con receptores hormonales positivos.
Referencias
1. OMS, Serie de Informes Técnicos 916. Dieta, nutrición y prevención de enfermedades crónicas. Organización Mundial de la Salud. Ginebra 2003. [ Links ]
2. Parkin DM. Global cancer statistics in the year 2000. Lancet Oncology 2001; 2: 533-43. [ Links ]
3. Doll R, Peto R. Epidemiology of cancer. In: Weatherall DJ, Ledingham JGG, Warrell DA, eds. Oxford textbook of medicine. Oxford, Oxford University Press, 1996: 197-221. [ Links ]
4. Willet MC. Diet, nutrition, and avoidable cancer. Environmental Health Perspectives 1995; 103 (Suppl. 8): S165-S170. [ Links ]
5. Weight control and physical activity. Lyon (Francia), Centro Internacional de Investigaciones sobre el Cáncer, 2002 (IARC Handbooks of Cancer Prevention, Vol. 6). [ Links ]
6. Ferlay J, et al. Globocan 2000: cancer incidence, mortality and prevalence worldwide. Version 1.0. Lyon (Francia), Centro Internacional de Investigaciones sobre el Cáncer, 2001 (IARC CancerBase No 5; disponible en http://www-dep.iarc.fr/globocan/globocan.html. [ Links ]
7. Key TJ, Verkasalo PK, Banks E. Epidemiology of breast cancer. Lancet Oncology 2001; 2: 133-40. [ Links ]
8. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50 302 women with breast cancer and 96,973 women without the disease. Lancet 2002, 360: 187-95. [ Links ]
9. Smith-Warner SA, et al. Alcohol and breast cancer in women: a pooled analysis of cohort studies. Journal of the American Medical Association 1998; 279: 535-40. [ Links ]
10. Dorgan JF, et al. Serum hormones and the alcohol-breast cancer association in postmenopausal women. Journal of the National Cancer Institute 2001; 93: 710-5. [ Links ]
11. Chen JQ, Brown TR, Russo J. Regulation of Energy Metabolism Pathways by Estrogens and Estrogenic Chemicals and Potential Implications in Obesity Associated with Increased Exposure to Endocrine Disruptors. Biochim Biophys Acta 2009; 1793 (7): 1128-43. [ Links ]
12. Imamov O, Shim GJ, Warner M, Gustafsson JA. Estrogen Receptor beta in Health and Disease. Biology of Reproduction 2005; 73: 866-71. [ Links ]
13. Deroo BJ, Korach KS. Estrogen receptors and human disease. J Clin Invest 2006; 116 (3): 561-70. [ Links ]
14. Calle EE, Kaaks R. Overweight, obesity and cancer: epidemiological evidence and proposed mechanisms. Nat Rev Cancer 2004; 4: 579-91. [ Links ]
15. Calle EE, Thun MJ. Obesity and cancer. Oncogene 2004; 23: 6365-78. [ Links ]
16. Heindel JJ. Endocrine disruptors and the obesity epidemic. Toxicol Sci 2003; 76: 247-49. [ Links ]
17. Remmele W, Stegner HE. Recommendation for uniform definition of an immunoreactive score (IRS) for immunohistochemical estrogen receptor detection (ER-ICA) in breast cancer tissue. Pathologe 1987; 8 (3): 138-40. [ Links ]
18. Kaemmerer D, Peter L, Lupp A, Schulz S, Sänger J, Baum RP, Prasad V, Hommann M. Comparing of IRS and Her2 as immunohistochemical scoring schemes in gastroenteropancreatic neuroendocrine tumors. Int J Clin Exp Pathol 2012; 5 (3): 187-94. [ Links ]
19. Wang Y, Lam KSL, Xu A. Adiponectin as a negative regulator in obesity-related mammary carcinogenesis. Cell Research 2007; 17: 280-2. [ Links ]
20. Kwan ML, Kushi LH, Weltzien E, Maring B, Kutner SE, Fulton RS, Lee MM, Ambrosone CB, Caan BJ. Epidemiology of breast cancer subtypes in two prospective cohort studies of breast cancer survivors. Breast Cancer Res2009; 11 (3): R31. [ Links ]
21. Yang XR, Chang-Claude J, Goode EL, Couch FJ, Nevanlinna H, Milne RL, et al. Associations of breast cancer risk factors with tumor subtypes: a pooled analysis from the Breast Cancer Association Consortium studies. J Natl Cancer Inst 2011; 103 (3): 250-63. [ Links ]
22. Li CI, Daling JR, Porter PL, Tang MT, Malone KE. Relationship between potentially modifiable lifestyle factors and risk of second primary contralateral breast cancer among women diagnosed with estrogen receptor-positive invasive breast cancer. J Clin Oncol 2009; 27 (32): 5312-8. doi: 10.1200/JCO.2009. 23.1597. Epub 2009 Sep 8. [ Links ]
23. Esfahlan RJ, Zarghami N, Esfahlan AJ, Mollazadeh M, Nejati K, Nasiri M. The Possible Impact of Obesity on Androgen, Progesterone and Estrogen Receptors (ER and ER ) Gene Expression in Breast Cancer Patients. Breast Cancer (Auckl) 2011;5:227-37. [ Links ]
24. Oh SW, Park CY, Lee ES, Yoon YS, Lee ES, Park SS, Kim Y, Sung NJ, Yun YH, Lee KS, Kang HS, Kwon Y, Ro J. Adipokines, insulin resistance, metabolic syndrome, and breast cancer recurrence: a cohort study. Breast Cancer Res 2011; 13 (2): R34. [ Links ]
25. Grossman ME, Nkhata KJ, Mizuno NK, Ray A, Cleary MP. Effects of adiponectin on breast cáncer cel growth and signaling. British Journal of Cancer 2008; 98: 370-9. [ Links ]
26. Sulkowska M, Golaszewska J, Wincewicz A, Koda M, Baltaziak M, Sulkowski S. Leptin - From Regulation of Fat Metabolism to Stimulation of Breast Cancer Growth. Pathology Oncology Research 2006; 12 (2): 69-72. [ Links ]
27. Fusco R, Galgani M, Procaccini c, Franco R, Pirozzi G, Fucci L, Laccetti P, Matarese G. Cellular and molecular cosstalk between leptin receptor and estrogen receptor in breast cáncer: molecular basis for a novel therapeutic setting. Endocrine-Related Cancer 2010; 17: 373-82. [ Links ]
28. Lajous M, Boutron-Ruault MC, Fabre A, Clavel-Chapelon F, Romieu I. Carbohydrate intake, glycemic index, glycemic load, and risk of postmenopausal breast cáncer in a prospective study of French women. Am J Clin Nutr 2008; 87: 1384-91. [ Links ]
29. Loria-Kohen V, Gómez-Candela C, Fernández-Fernández C, Zurita-Rosa L, Palma-Milla S, Urbieta M, Bermejo-López LM. Parámetros hormonales e inflamatorios en un grupo de mujeres con sobrepeso/obesidad. Nutr Hosp 2011; 26 (4): 884-9. [ Links ]
30. Setiawan VW, Monroe KR, Wilkens LR, Kolonel LN, Pike MC, Henderson BE. Breast Cancer Risk Factors Defined by Estrogen and Progesterone Receptor Status. The Multiethnic Cohort Study. Am J Epidemiol 2009; 169: 1251-9. [ Links ]
31. Vieira FGK, Di Pietro PF, Boaventura BCB, Ambrosi C, Rockenbach G, Fausto MA, Crippa CG, Da Silva EL. Factors associated with oxidative stree in women with breast cancer. Nutr Hosp 2011; 26 (3): 528-36. [ Links ]
32. Rockenbach G, Di Pietro PF, Ambrosi C, Boaventura BCB, Vieira FGK, Crippa CG, Da Silva EL, Fausto MA. Dietary intake and oxidative stress in breast cancer: before and after treatments. Nutr Hosp 2011; 26 (4): 737-44. [ Links ]
33. Zorlini R, Abe-Cairo AA, Costa-Gurgel SC. Nutritional status of patients with gynecologic and breast cáncer. Nutr Hosp 2008; 23: 577-83. [ Links ]
34. Amaral P, Miguel R, Mehdad A, Cruz C, Monteiro-Grillo I, Camilo M, Ravasco P. Body fat and por diet in breast cáncer women. Nutr Hosp 2010; 25 (3): 456-61. [ Links ]
35. Di Pietro PF, Medeiros NI, Vieira FGK, Fausto MA, Belló-Klein A. Breast cancer in southern Brazil: association with past dietary intake. Nutr Hosp 2007; 22 (5): 565-72. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luz-M.a-Adriana Balderas-Peña.
UMAE Hospital de Especialidades.
Centro Médico Nacional de Occidente IMSS.
Belisario Domínguez 1000.
CP: 44340 Jalisco. México.
E-mail: luz.ma.adriana@gmail.com
Recibido: 1-II-2013.
Aceptado: 13-V-2013.