My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.28 n.6 Madrid Nov./Dec. 2013
https://dx.doi.org/10.3305/nh.2013.28.6.6981
REVISIÓN
Influencia del peso corporal en el pronóstico de las supervivientes de cáncer de mama; abordaje nutricional tras el diagnóstico
Influence of body weight on the prognosis of breast cancer survivors; nutritional approach after diagnosis
María Jesús Rodríguez San Felipe1, Alicia Aguilar Martínez1 y Begoña Manuel-y-Keenoy1,2
1Departamento de Ciencias de la Salud. Universitat Oberta de Cataluña. Barcelona. España.
2Laboratory of Nutrition and Functional Food Science,Faculty of Pharmacy, Biomedical & Veterinary Sciences, University of Antwerp. Paises Bajos.
Dirección para correspondencia
RESUMEN
La obesidad combinada con el cáncer de mama constituye un problema de salud pública dada la gran incidencia y prevalencia de ambas enfermedades.
El objetivo de esta revisión es conocer el estado actual de las investigaciones sobre la relación entre el peso de las pacientes con cáncer de mama y su pronóstico.
El sobrepeso y la obesidad en el momento del diagnóstico se asocian con un peor pronóstico en las mujeres supervivientes de cáncer de mama. Estudios observacionales muestran un aumento del 33% de la mortalidad entre las supervivientes obesas en comparación con las no obesas. Además, el aumento de peso en estas pacientes es común tras del diagnóstico y es mayor aún en las que reciben quimioterapia. Se observan ganancias de 2-8 kg de peso en el 68% de las pacientes a los tres años del diagnóstico. Cada aumento de 5 kg de peso se relaciona con un aumento del 13% en la mortalidad por cáncer de mama.
Se desconocen los mecanismos que producen este aumento de peso, pero sí se observa que cuanto mayor es éste, mayor es el riesgo de padecer enfermedades cardio-metabólicas asociadas lo que conduce a una peor calidad de vida y menor supervivencia global.
Por otro lado, el exceso de tejido adiposo actúa como promotor indirecto de la proliferación celular tumoral y del aumento de los estrógenos circulantes. De ahí la importancia de prevenir un exceso de peso en estas pacientes.
Ante las limitaciones que supone la poca cantidad de estudios controlados aleatorios que estudien específicamente la dieta a aplicar en casos de cáncer de mama, los estudios actuales señalan que una dieta saludable, baja en grasa y azúcares simples, con alta proporción de frutas, vegetales y productos integrales tiene el potencial de reducir significativamente la morbilidad y el riesgo de recurrencia, mejorando por tanto, el pronóstico y la calidad de vida a largo plazo.
Palabras clave: Cáncer de mama. Obesidad. Tejido adiposo. Pérdida de peso. Dieta.
ABSTRACT
Obesity combined with breast cancer is a public health problem, given the high incidence and prevalence of both diseases.
The aim of this review is to determine the current status of research on the relationship between the body weight of breast cancer patients and their prognosis.
Overweight and obesity at the time of diagnosis are associated with a worse prognosis in breast cancer survivors. Observational studies show that breast cancer mortality is 33% higher in obese than in non-obese survivors. Furthermore, weight gain after diagnosis is common in these patients and is even greater in those receiving chemotherapy. Weight gains of 2-8 kg are observed in 68% of patients 3 years after diagnosis. Each 5 kg increase in body weight is associated with a 13% increase in breast cancer specific mortality.
The mechanisms that cause this weight gain are not totally known. A higher weight gain is also associated with higher the risk of co-morbid cardiometabolic diseases, which worsen the quality of life and shorten overall survival.
On the other hand, excess adipose tissue is an indirect promoter of tumor cell proliferation and releases circulating estrogens. Hence, preventing excess weight is important in these patients.
An important limitation is the small number of randomised controlled trials investigating the type of diet that could be recommended specifically to breast cancer survivors. The evidence from current studies suggests that a healthy diet, low in fat and simple sugars and with a high proportion of fruit, vegetables and wholegrain products, has the potential to reduce morbidity and the risk of recurrence significantly, thus improving prognosis and quality of life in the long term.
Key words: Breast cancer. Obesity. Adipose tissue. Weight loss. Diet.
Abreviaturas
ACS: American Cáncer Society (Sociedad Americana de Cáncer).
CM: Cáncer de mama.
CDC: Centers for Disease Control and Prevention (Centros para el Control y la Prevención de Enfermedades).
ER+: Estrogen receptor positive (Receptor de Estrògeno positivo).
EPIC: European Prospective Investigation into Cancer and Nutrition (Investigación Prospectiva Europea sobre Cáncer y Nutrición).
FACT-B: Functional Assessment of Cancer Therapy-Breast (Evaluación Funcional del Cáncer de Mama).
GHO: Global Health Observatory (Observatorio de Salud Global).
GI: Glycemic Index (Índice Glicémico).
GL: Glycemic Load (Carga Glicémica).
IGF-1: Insulin-like growth factor 1 (Factor de crecimiento tipo 1 semejante a la insulina).
ICC: Índice cintura/cadera.
IMC: Índice de Masa Corporal.
LACE: Life After Cancer Epidemiology (Epidemiologia de la Vida Después del Cáncer).
NCSI: National Cancer Survivorship Initiative (Iniciativa Nacional de Supervivencia del cáncer ).
NHS: Nurses'Health Study (Estudio de Salud de las Enfermeras).
OMS: Organización Mundial de la Salud.
RCT: Randomized Contol Trial (Estudios controlados aleatorios).
SEOM: Sociedad Española de Oncologia Médica.
TNF-α: Tumor Necrosis Factor-alpha (Factor alfa de necrosis tumoral).
WCRF/AICR: World Cancer Research Fund/ American Institute for Cancer Research (Fundación para la Investigación Mundial del Cáncer/Instituto Americano para la Investigación del Cáncer).
WHEL: Women's Healthy Eating and Living (Alimentación y estilo de vida saludable de las mujeres).
WINS: Women's Intervention Nutrition Study (Estudio de Intervención de Nutrición de las Mujeres).
Introducción
La incidencia del cáncer está aumentando como consecuencia de la mayor esperanza de vida de la población y, por otro lado, los recientes avances científicos en el cribado, diagnóstico y tratamiento del cáncer están reduciendo la mortalidad. Ambos factores, el incremento del número de casos nuevos y la menor mortalidad, se traducen en una mayor prevalencia del cáncer y en un aumento del número de supervivientes1-4.
En este trabajo nos referiremos al término "superviviente de cáncer" -tal como lo define en 2011 la CDC (Centers for Disease Control and Prevention)- como aquella persona que ha sido diagnosticada de cáncer, desde el momento del diagnóstico hasta el resto de su vida3. Incluimos también en este concepto (National Cancer Survivorship Initiative -NCSI, 2010) a aquellos que están en su primer tratamiento, en remisión después del tratamiento, libres de enfermedad, enfermedad estable y aquellos con enfermedad activa o avanzada4.
Uno de los factores que parecen tener el potencial de reducir significativamente la morbilidad y mortalidad en los supervivientes de cualquier tipo de cáncer es el mantenimiento del peso corporal adecuado5-7.
En el caso del cáncer de mama, parece haber alguna evidencia, pero no concluyente, de que el pronóstico para las mujeres con sobrepeso y obesidad es peor que para las mujeres con normopeso, aun teniendo el mismo diagnóstico6-8.
Además, hay que tener en cuenta que muchas mujeres diagnosticadas de cáncer de mama, independientemente del estado de la menopausia, ganan peso después del diagnóstico y que este aumento de peso se asocia a su vez con un mayor riesgo para padecer comorbilidades6 como diabetes tipo II, enfermedades cardiovasculares, linfedema, asma, dolor de espalda crónico, osteoartritis, mayor fatiga, deterioro funcional general y, en resumen, peor calidad de vida y una amenaza potencial para su supervivencia.
Ante esta situación, Organizaciones como la American Cancer Society (ACS)7 , la World Cancer Research Fund/American Institute for Cancer Research (WCRF/AICR) o la SEOM (Sociedad Española de Oncología Médica)5, en base a los resultados de los estudios de los últimos veinte años6, buscan datos que avalen estrategias nutricionales a seguir para mantener el peso adecuado en las mujeres con cáncer de mama de peso normal y conseguir, al menos, una pérdida de peso moderada en mujeres obesas o con sobrepeso.
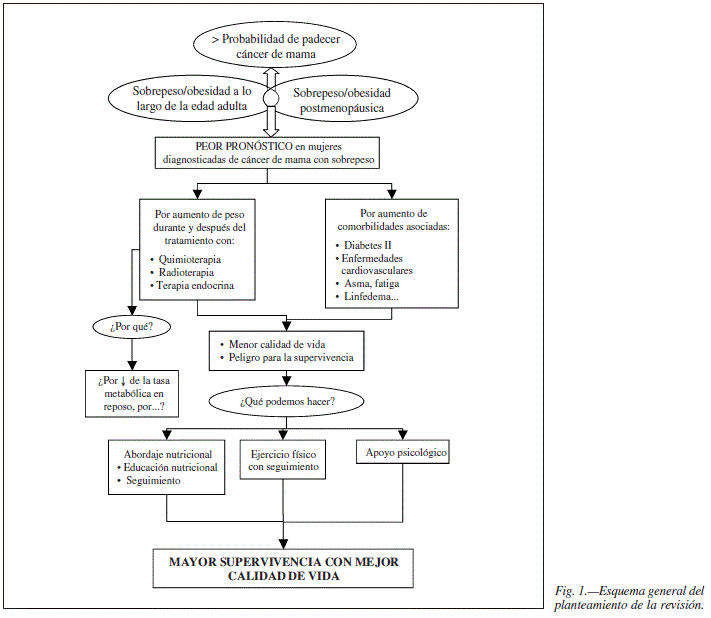
El objetivo de este trabajo es por tanto revisar la relación entre el peso inicial en el momento del diagnóstico de cáncer de mama y los cambios de peso posteriores al mismo, con el pronóstico de supervivencia, así como recoger las orientaciones dietéticas que ayuden a mantener un peso que reduzca los efectos de los tratamientos antineoplásicos y las comorbilidades asociadas para conseguir mejor calidad de vida y mayor supervivencia (Fig. 1).
Metodología
Se realizó una búsqueda bibliográfica de artículos originales y de revisión que investigaran el control de peso y el pronóstico en cáncer de mama en las principales bases de datos: MEDLINE, IME-Biomedicina (CSCI), Cochrane Library Plus, Informa Healthcare y SpringerLink. La búsqueda se limitó a estudios publicados hasta abril de 2013 en inglés y castellano y se utilizaron diferentes combinaciones de las siguientes palabras clave o términos MeSH: "breast neoplasms", "survivors", "prognosis", "body weight changes, control", "weight loss diet", "adiposity", "insulin" , "chemotherapy", "hormone", "lifestyle" Así mismo, se utilizaron algunas referencias bibliográficas incluidas en los artículos consultados para su revisión.
Al tratarse de una revisión bibliográfica pero no sistemática, se incluyeron estudios observacionales epidemiológicos, retrospectivos, prospectivos, de cohorte y de intervención dietética, además de estudios que tratasen de explicar los mecanismos celulares, metabólicos y hormonales implicados en el impacto de la adiposidad sobre la progresión tumoral.
Después de analizar más de 115 artículos, un total de 67 se han utilizado en la redacción de esta revisión por incluir los datos más destacados para poder establecer la relación entre la mejora de la supervivencia con el control del peso a través de los diferentes tipos de dieta y la modificación del estilo de vida.
Resultados
¿Cómo influye en el pronóstico el exceso de peso en el momento del diagnóstico?
Algunos estudios indican que el sobrepeso y la obesidad son factores de riesgo bien establecidos para la aparición de cáncer de mama, especialmente en la mujer postmenopáusica2. Si en el momento del diagnóstico existe sobrepeso u obesidad, hay alguna evidencia, pero no concluyente, de que el pronóstico para estas mujeres es peor que para las mujeres con normopeso aun teniendo el mismo diagnóstico, ya que aumenta el riesgo de recurrencia, disminuye la supervivencia global libre de enfermedad y la calidad de vida6-8. No obstante, no se tiene una definición clara de los umbrales de peso o IMC (Índice de Masa Corporal) a partir de los cuales aumenta el riesgo.
Los resultados de un estudio de más de 80.000 enfermeras a lo largo de 26 años, encontró que, en comparación con las mujeres que mantuvieron su peso, las que aumentaron 25 kg o más después de la edad de 18 años tenían un riesgo casi 50% mayor de padecer cáncer de mama. Una ganancia de 10 kg o más después de la menopausia, también se asoció con un aumento del riesgo. Otro hallazgo importante de este estudio es que la pérdida de peso puede reducir el riesgo de cáncer de mama, incluso si el peso no se pierde hasta después de la menopausia9.
Según datos del Observatorio Mundial de la Salud (GHO) de la OMS, en 2008, a nivel mundial, el 35% de las mujeres mayores de 20 años tenían sobrepeso (IMC > 25 kg/m2) y el 14% eran obesas (IMC > 30 kg/m2), es decir, que más de 297 millones de mujeres mayores de 20 años eran obesas en 2008 en todo el mundo10.
Teniendo en cuenta los datos anteriores, no es de extrañar que más de una de cada dos mujeres tengan sobrepeso o sean obesas en el momento de ser diagnosticadas de cáncer de mama.
Uno de los estudios que confirma el papel pronóstico de la obesidad en el momento del diagnóstico es el realizado con una cohorte de más de 14.000 mujeres, en el que se constató que un IMC > 30 kg/m2 antes del diagnóstico de cáncer de mama estaba asociado a una menor supervivencia que la de las mujeres de peso normal, con sobrepeso o las moderadamente obesas, las cuales no tenían mayor riesgo de mortalidad11.
En el estudio de cohorte danés de Ewertz y cols.12 con más de 50.000 mujeres, las pacientes con cáncer de mama que tenían un IMC > 25 kg/m2 en el momento del diagnóstico, ya presentaban características de peor pronóstico, como tumor en estadío más avanzado, en comparación con las de menor IMC. Se observó también que en las pacientes con un IMC > 30 kg/m2 el riesgo de desarrollar metástasis después de 10 años, aumentaba en un 46%, y el riesgo de morir a causa de cáncer de mama después de 30 años, aumentaba en un 38%. Estas observaciones resaltan que tanto la quimioterapia como la terapia endocrina, parecen ser menos efectivas para mejorar la supervivencia a largo plazo (después de diez años) en las pacientes con un IMC > 30 kg/m2.
Existen datos convincentes de que la obesidad está asociada a un mayor riesgo de recurrencia y de mortalidad debida al cáncer de mama7. En la revisión sistemática de Protani y cols.13 se revisaron 43 estudios que incluyeron mujeres con diagnóstico de cáncer de mama entre 1963 y 2005. El meta-análisis mostró un aumento en un 33% de la mortalidad global o de mortalidad debida al cáncer de mama entre las mujeres obesas en comparación con las no obesas con cáncer de mama. También en la revisión de Patterson y cols.14 sobre el estilo de vida de las mujeres con cáncer de mama, el resultado más consistente de los estudios fue que la adiposidad se asoció con un riesgo 30% mayor de mortalidad general.
¿Cómo influye en el pronóstico el cambio de peso después del diagnóstico?
Uno de los problemas frecuentes y persistentes para muchas supervivientes de cáncer de mama es el aumento de peso. Se ha observado que el aumento de peso después del diagnóstico y tratamiento es común tanto en mujeres pre- como posmenopáusicas15.
En el estudio LACE (Life After Cancer Epidemiology) se observó que el 36% de las mujeres de < 50 años y el 23% de las > 70 años ganaban entre 2-8 kg; se observaron también ganancias > 8 kg en el 20% de las mujeres menores de 50 años, pero solo en el 6% de las mujeres > 70 años16.
Nichols y cols.17, al seguir una cohorte de casi 4.000 mujeres con diagnóstico de cáncer de mama invasivo durante un promedio de 6,3 años, encontraron que entre las mujeres que aumentaron de peso después del diagnóstico, cada aumento de 5 kg se asoció con un aumento del 13% en la mortalidad por cáncer de mama y un aumento del 12% en la mortalidad por todas las causas.
Sin embargo, otros estudios menos numerosos, parecen dar resultados contradictorios con los anteriores. En el de Caan y cols.18, con 3.215 mujeres diagnosticadas con cáncer de mama temprano concluyeron que ni un aumento moderado de peso (5-10% del peso que tenían en el momento del diagnóstico) ni grande (del 19%), después del diagnóstico de cáncer de mama estaba asociado con un aumento en el riesgo de recurrencia del cáncer de mama en los primeros años después del diagnóstico. Esta investigación sugiere que el aumento de peso en los primeros 5-7 años tras el diagnóstico de cáncer de mama, no aumenta el riesgo de recurrencia del mismo. En este mismo estudio incluso se observó que una pérdida de peso involuntaria superior al 10% doblaba la mortalidad y las recurrencias.
Estas observaciones resaltan que el impacto en el pronóstico que pueda tener un cambio de peso después del diagnóstico es variable y depende de las alteraciones metabólicas y patológicas que subyacen tras estos cambios.
¿Por qué se produce el aumento de peso en estas pacientes durante y después del tratamiento antineoplásico?
En la revisón de Vance y cols.15 la ganancia de peso aparece en el 50-96% de las mujeres durante el tratamiento, e incluso en las mujeres que permanecieron con peso estable durante el mismo, fueron aumentando progresivamente de peso en los meses y años tras el diagnóstico. En los estudios de Makari19 el cambio de peso medio en todas las mujeres fue de 1,5 kg al primer año de tratamiento, 2,7 kg a los dos años y 2,8 kg a los tres años, lo que sugiere que la ganancia de peso es persistente después del diagnóstico y a lo largo del tratamiento. Irwin y cols.8 encontraron que en el tercer año después del diagnóstico, el 68% de las mujeres con estadio I-IIIA de cáncer de mama ganaron una media de 3,8 kg.
Dentro de éstos, la ganancia de peso es más común en las mujeres que recibieron quimioterapia en lugar de otros tratamientos adyuvantes, tales como el tamoxifeno o radioterapia20 y es mayor aún en las mujeres que tuvieron tratamientos más largos de duración y eran premenopáusicas15. Según numerosos estudios se habla de una ganancia superior a 2,5 kg, 5 kg o hasta el 5% del peso inicial21. En el estudio WHEL (Women's Healthy Eating and Living) se concluyó que la quimioterapia se asocia con un aumento de peso clínicamente significativo (> 5% del peso inicial en el momento del diagnóstico) y que las mujeres tratadas con quimioterapia tienen un riesgo 65% mayor de aumentar de peso durante el tratamiento en comparación con las mujeres sin este tratamiento sistémico22.
En relación con el aumento de peso en las pacientes que reciben terapia hormonal (tamoxifeno o inhibidores de la aromatasa para pacientes cuyas células tumorales son ER+) no hay resultados concluyentes. En el estudio de Malinovszky23 llevado a cabo con 524 mujeres premenopáusicas tratadas con tamoxifeno se observó que el aumento de peso es un problema común en estas pacientes. Sin embargo Saquib y cols.22 no encontraron asociación alguna.
Es importante destacar que no sólo se produce la ganancia de peso, aumentando el IMC, sino que se originan cambios en la composición corporal que resultan adversos, como son el aumento de masa grasa abdominal y la disminución de la masa muscular, lo que origina la denominada obesidad sarcopénica7,8,24-26.
El por qué se produce el aumento de peso aún está poco claro. Diversos estudios tratan de explicar los mecanismos que lo producen: disminución del gasto total de energía, menor tasa metabólica en reposo27, menor actividad física, cambios en la dieta ,... que se describen en la siguiente sección (Fig. 2)
¿Qué cambios metabólicos induce la quimioterapia?
Algunos estudios realizados hasta el momento han descrito casos en los que la quimioterapia puede aumentar el apetito y modificar la preferencia por determinados alimentos. Rockenbach y cols.25 encontraron un aumento significativo en el consumo de determinados alimentos: carne roja y huevos, leche y productos lácteos ricos en grasa, aceites y grasas, frutas ricas en vitamina C y granos después de los tratamientos (quimioterapia, radioterapia y terapia hormonal). Se encontró también un aumento significativo en el peso corporal y en el IMC, así como un aumento de los marcadores de estrés oxidativo. Estos aspectos nutricionales y clínicos son factores conocidos de riesgo de recurrencia del cáncer de mama.
Por otro lado, la obesidad sarcopénica origina a su vez la disminución de la masa muscular, la movilidad y la actividad física, con el consiguiente aumento del peso corporal28. La pérdida de músculo reduce la tolerancia al tratamiento y la recuperación del sistema inmunitario después de completar la quimioterapia, lo que podría explicar el efecto adverso sobre la supervivencia21.
La alteración de la función tiroidea puede ser otra posible causa del cambio de peso durante la quimioterapia para pacientes con cáncer de mama. Se ha encontrado una reducción significativa de los niveles séricos de triyodotironina además de un aumento significativo de la globulina fijadora de tiroxina desde el inicio hasta el final de la quimioterapia. Estos resultados sugieren que esta disfunción tiroidea podría estar implicada en la ganancia de peso a largo plazo29.
Como causa indirecta, el tratamiento de quimioterapia se relaciona a menudo con trastornos del sueño que se han encontrado en el 25% de los pacientes con cáncer de mama30. Algunas investigaciones han sugerido que la restricción del sueño modifica el metabolismo de la glucosa, favoreciendo la ingesta excesiva de alimentos y por lo tanto el aumento de peso31.
El balance energético positivo debido a la reducción del gasto de energía en reposo (REE)26,32 y a la reducción del ejercicio durante el tratamiento podrían ocasionar también un aumento de la masa grasa, en particular de la masa grasa central26,32,33, y por tanto, producir una ganancia de peso. Sin embargo, otros investigadores no han encontrado una variación significativa de REE durante la quimioterapia34.
¿Por qué empeora el pronóstico de cáncer de mama si aumenta la masa corporal grasa? Mecanismos de acción del tejido adiposo
El tejido adiposo es un tejido activo que puede secretar numerosos péptidos llamados adipoquinas, como la leptina, adiponectinas, interleucinas o el factor de necrosis tumoral (TNF-α), que intervienen en procesos inflamatorios y metabólicos favorecedores del crecimiento celular. Hay evidencia experimental de que algunas adipoquinas puede actuar directamente sobre las células de cáncer de mama para estimular su proliferación y capacidad invasiva35. También se sabe que el aumento del tejido adiposo, especialmente en el abdomen, induce trastornos metabólicos como la resistencia a la insulina, a través de diversas vías que implican a las adipoquinas21.
La insulina, además de regular el metabolismo de la glucosa, promueve la división, diferenciación y crecimiento celular y podría regular también las concentraciones de IGF-1 (factor de crecimiento tipo 1 semejante a la insulina) presentes en la circulación general, estableciendo con éste un efecto sinérgico que finalmente promovería la proliferación celular e inhibirá la muerte celular programada, favoreciendo el crecimiento tumoral36. De hecho, se ha observado que en mujeres posmenopáusicas el síndrome metabólico (obesidad + resistencia a la insulina) está asociado con los tumores más agresivos37.
Por otro lado, el tejido adiposo juega un papel importante en la síntesis de estrógenos y de esta manera se asocia con el desarrollo de cáncer de mama38,39. En numerosos estudios se ha observado que las concentraciones de estrógenos son más altas en las mujeres obesas (IMC > 30 kg/m2) que en las mujeres delgadas (IMC < 22,5 kg/ m2). Entre las mujeres posmenopáusicas hay evidencia convincente de que el riesgo de desarrollar un cáncer de mama es más alto si son obesas y está asociado de manera consistente al aumento de estrógenos biodisponibles39,40. Por el contrario, entre las pre menopáusicas los resultados apuntan a un menor riesgo, en caso de obesidad, aunque el nivel de evidencia es solo probable41.
La fuente principal de estrógenos en las mujeres pre-menopáusicas son los ovarios, mientras que en las mujeres postmenopáusicas la mayoría de los estrógenos son producidos en el tejido adiposo. La biosíntesis de los estrógenos fuera de los ovarios ocurre gracias a la enzima aromatasa localizada en el tejido adiposo. La aromatasa produce la conversión de los andrógenos circulantes en estrógenos. Un aumento de tejido adiposo origina, por tanto, un aumento de los estrógenos circulantes. Hay tumores de mama que son receptores de estrógeno positivo (ER+). Cuando los estrógenos se unen con sus receptores se activa una vía de señales hacia el núcleo de la célula, donde la activación de genes impulsa la división celular, aumentando el potencial de mutaciones en el ADN y favoreciendo el crecimiento de tumores dependientes de estrógenos15. Por tanto, un aumento en las reservas de grasa en el tejido adiposo aumentará la biosíntesis de estrógenos y sus niveles circulantes lo que favorecería el desarrollo de las células tumorales dependientes de estrógenos (Fig. 2)
¿El exceso de peso es un factor de riesgo de comorbilidades en las pacientes supervivientes?
Desde hace décadas es conocido que tanto el sobrepeso como la obesidad aumentan el riesgo de múltiples enfermedades tales como la diabetes tipo II, el cáncer y las enfermedades cardiovasculares en la población general42.
En el caso de las supervivientes de cáncer, el sobrepeso o la obesidad elevan hasta cuatro veces el riesgo de desarrollar enfermedades asociadas43, tales como enfermedades cardiovasculares17, diabetes tipo II37,44, mayor riesgo quirúrgico45, linfedema46-48, fatiga49,50, dolor de espalda crónico y osteoartritis51 y mayor frecuencia e intensidad de sofocos52,53. Además, este riesgo puede ser más elevado como consecuencia de recibir el tratamiento antineoplásico. Es interesante destacar que las mujeres con cáncer de mama tienen la misma probabilidad, si no más, de morir como consecuencia de enfermedades cardiovasculares que por su cáncer de mama54.
Esto es preocupante porque la mayoría de las mujeres diagnosticadas en las primeras etapas de la enfermedad será curada de cáncer de mama, pero posteriormente se exponen a un mayor riesgo de enfermedades crónicas después del tratamiento15 disminuyendo su calidad de vida y supervivencia.
¿Podemos mejorar la supervivencia y calidad de vida en las pacientes con cáncer de mama que tienen un exceso de peso? Abordaje nutricional
Hemos visto cómo el exceso de peso está asociado con un peor pronóstico en la mayoría de los estudios que han examinado esta relación. ¿Qué se puede hacer? ¿Podemos mejorar el pronóstico mediante un abordaje nutricional específico para conseguir una pérdida de peso?
En las dos últimas décadas se han llevado a cabo estudios que han examinado la relación entre los factores nutricionales y la supervivencia, la recurrencia y la mejora de la calidad de vida después del diagnóstico de cáncer de mama. En general, los estudios de intervención tenían como objetivo el disminuir o evitar el aumento del peso corporal mediante diversos cambios dietéticos (solos o acompañados de actividad física y apoyo psicológico).
A continuación y en la tabla I se presentan algunas estrategias abordadas en los diferentes estudios.
Reducción de grasa en la dieta
En el estudio WINS (Women's Intervention Nutrition Study)55 se observó que las mujeres del grupo que recibió asesoramiento dietético intensivo disminuyeron significativamente su consumo de calorías, grasas, aceites y dulces (aproximadamente en un 10%) y mejoraron su perfil de ácidos grasos, con una ingesta menor de grasas saturadas y mayor de grasas poliinsaturadas. Además, el grupo intervención perdió 2,7 kg más que lo que perdió el grupo control. Cuando se analizaron los casos de recaída (recidiva del cáncer de mama local, regional, a distancia o nuevo cáncer de mama contralateral), la supervivencia sin recaída a los 5 años fue un 24% mayor en el grupo de intervención que en el grupo control56.
Los resultados sugieren que una disminución de la ingesta de grasas en la dieta mejora la supervivencia libre de enfermedad. Estos resultados apoyan la hipótesis inicial de que la reducción de grasa en la dieta, aun con una influencia modesta en el peso corporal, mejora la supervivencia libre de recaída en mujeres posmenopáusicas con CM en primeros estadios (especialmente aquellas con receptores de estrógenos [ER]-negativo). Es importante señalar que el cambio de peso, y no sólo la reducción de la grasa de la dieta, posiblemente juegue también un papel importante en los resultados de WINS. Aunque no haya pruebas concluyentes de que el consumo total de grasa influye en los resultados de la supervivencia del CM, las dietas altas en grasas tienden a ser altas en calorías y pueden contribuir a la obesidad, que a su a su vez se asocia con un aumento de la incidencia de cáncer en general, un mayor riesgo de recurrencia y una menor probabilidad de supervivencia para muchos tipos de cáncer. Además, el exceso de ingesta de grasa saturada es un factor de riesgo conocido para las enfermedades cardiovasculares, que son una causa importante de morbilidad y mortalidad en todas las poblaciones, incluidos los supervivientes de cáncer7.
Reducción de hidratos de carbono en la dieta
Aún no se ha demostrado la influencia de los hidratos de carbono en la progresión y supervivencia una vez diagnosticado el cáncer de mama, pero se han hecho estudios sobre el impacto de los hidratos de carbono en la incidencia del CM. En este sentido es interesante el estudio de Romieu y cols.57 cuyo objetivo fue investigar la relación entre el índice glucémico (GI), la carga glicémica (GL) y la ingesta total de carbohidratos con el riesgo de padecer cáncer de mama, mediante el uso de datos de más de 300.000 mujeres de la Investigación Prospectiva Europea sobre Cáncer y Nutrición (EPIC) . Se observó que solo en el grupo de mujeres posmenopáusicas, el índice glucémico (GI), la carga glicémica (GL) y la ingesta total de carbohidratos en la dieta están positivamente asociados con un mayor riesgo de desarrollar cáncer de mama, especialmente con los que son receptor de estrógeno negativo (ER-). Es sabido que el potencial glucémico de una dieta está asociado con la elevación crónica de insulina, lo que, junto con el factor de crecimiento (IGF-I), podría favorecer la proliferación tumoral y aumentar el riesgo de cáncer de mama.
Aunque aún queda mucho por investigar, los resultados apuntan a que una dieta baja en hidratos de carbono también podría ser beneficiosa en las pacientes supervivientes.
La ACS (American Cancer Society) recomienda la limitación del consumo de azúcar (incluyendo miel, azúcar en bruto, azúcar moreno) y bebidas azucaradas que son las principales fuentes de estos azúcares (como los refrescos y muchas bebidas con sabor a frutas) ya que añaden grandes cantidades de calorías a la dieta y por lo tanto pueden favorecer el aumento de peso en estas pacientes y a menudo reemplazan la elección de alimentos más nutritivos7.
Dietas ricas en vegetales
Otros estudios buscaron patrones de dietas ricas en vegetales. Kroenke y cols.58 analizaron los resultados del Nurses 'Health Study (NHS) y concluyeron que los patrones dietéticos "prudent" (rica en frutas, verduras, granos enteros, legumbres, pollo y pescado) y "western" (alto consumo de cereales refinados, carnes rojas y procesadas, dulces, productos lácteos ricos en grasa y patatas fritas) no tenían relación con la mortalidad por cáncer de mama. El estudio concluyó que una mayor ingesta del patrón prudent y un menor consumo del patrón western pueden proteger contra la mortalidad por causas no relacionadas con el cáncer de mama.
Semejante al estudio anterior, con 2.280 mujeres diagnosticadas con cáncer de mama invasivo entre 1997 y 2000 y siguiendo los mismos patrones dietéticos, concluyó que el patrón prudent se asociaba con una reducción del 43% en la mortalidad general y que las supervivientes de cáncer de mama que informaron comer al menos 5 porciones de verduras y frutas al día y tener actividad física semanal equivalente a 30 minutos de caminata 6 días a la semana, tuvieron una tasa de supervivencia más alta59.
El estudio de intervención WHEL (Women's Healthy Eating and Living)60 se realizó para investigar el efecto de una dieta muy alta en verduras, frutas y fibra en el riesgo de recurrencia y la supervivencia global en estas supervivientes.
Aproximadamente la mitad de las mujeres (grupo de "intervención intensiva") siguieron una dieta estricta muy rica en vegetales, fruta, fibra y sólo un 15-20% de grasa. El resto de las mujeres (grupo control) siguieron una dieta menos rica en vegetales, fruta y fibra, y casi el 30% de consumo diario de grasas. Al cabo de cuatro años las mujeres del grupo intervención comían un 65% más verduras, 25% más frutas, 30% más de fibra y 13% menos grasa que las mujeres del grupo control. Sin embargo, después de una mediana de 7,3 años de seguimiento, no hubo diferencias estadísticamente significativas en cuanto a los objetivos del estudio, puesto que alrededor del 17% de las mujeres en cada grupo tuvieron una recurrencia del cáncer de mama o cáncer de mama primario nuevo y las muertes por CM fueron semejantes (10% en cada grupo). Tampoco se observaron diferencias en la evolución del peso.
Estos resultados contrastan con los resultados del estudio WINS, en el cual se vio que las supervivientes perdieron peso, cosa que no ocurrió en el estudio WHEL.
En el estudio de intervención realizado por Villarini y cols.61, las recomendaciones dietéticas que se dieron al grupo de intervención se basaron en una combinación de recetas de las dietas mediterránea y macrobiótica y en la eliminación de alimentos muy calóricos con el objetivo de bajar los niveles de insulina.
La dieta mediterránea recomienda el consumo diario de cereales (principalmente pastas a base de trigo, pan) y varios tipos de legumbres, frutas y hortalizas, aceite de oliva, pequeñas cantidades de vino, pescado y ocasionalmente queso, yogur, huevos y carne. La dieta macrobiótica se basa principalmente en los cereales integrales (arroz, mijo, cebada y maíz), legumbres y verduras seleccionadas, productos de soja tradicionales y, ocasionalmente, pescado y postres preparados sin azúcar ni grasas saturadas.
En las mujeres del grupo de intervención con dieta mediterránea y macrobiótica, los principales resultados del estudio fueron la reducción significativa de peso y masa grasa, la disminución en los valores de la circunferencia de cintura y cadera y pliegues cutáneos, la mejora de la sensibilidad a la insulina y la reducción de la biodisponibilidad de las hormonas sexuales y factores de crecimiento que están relacionados con el riesgo de recurrencia de cáncer de mama y el pronóstico.
Dieta hipocalórica y ejercicio
Los estudios demuestran que a partir del diagnóstico y durante el tratamiento las mujeres reducen drásticamente sus actividades físicas. Es sabido que el ejercicio es fundamental para evitar el aumento de peso en cualquier población, pero en las supervivientes de CM, cobra aún más importancia. De hecho, el ejercicio físico se ha identificado como una intervención efectiva para mejorar la calidad de vida en estas mujeres.
Así lo ponen en evidencia dos meta-análisis, uno de ellos con 717 supervivientes de cáncer de mama donde se observó que el ejercicio físico aumenta el consumo máximo de oxígeno y el funcionamiento físico y reduce los síntomas de la fatiga, lo que en conjunto representó una mejoría clínicamente significativa en la calidad de vida62.
El otro meta-análisis incluyó a más de 12.000 supervivientes de CM y mostró que la actividad física después del diagnóstico se asocia con una reducción del 24 % en la tasa de recurrencia de cáncer de mama y un 34% menos respecto a la tasa de mortalidad, así como una disminución del 41% en todas las causas de mortalidad. Así mismo, se ha constatado que la actividad física moderada, especialmente los ejercicios de fuerza, durante y después del tratamiento puede ayudar a las supervivientes a mantener la masa muscular y evitar exceso de grasa corporal63.
Cabe esperar, por tanto, que si se combina una dieta adecuada para mantener o perder peso, como las mencionadas anteriormente, con ejercicios aeróbicos y de fuerza (para quemar energía y evitar la sarcopenia), se pueda mejorar la calidad de vida y la supervivencia.
El reciente estudio de Scott y cols.64 ha investigado los efectos de una intervención en el estilo de vida sobre el peso corporal y otros parámetros fisiológicos, mediante una dieta saludable hipocalórica (reducción de unas 600 kcal diarias por debajo de los requerimientos energéticos) combinada con ejercicio. Los resultados sugieren que un programa individualizado de ejercicio y dieta hipocalórica pueden repercutir positivamente en los resultados de salud a largo plazo que influyen en el pronóstico de las mujeres con sobrepeso que se recuperan en las primeras etapas del cáncer de mama.
Una dieta con restricción de grasas saturadas (<10%) y aumento del consumo de frutas y verduras (7 porciones/día) combinada con ejercicios de fuerza y de resistencia con una meta de pérdida de peso del 10% durante un período de 12 meses, fueron las intervenciones realizadas en el estudio con supervivientes de cáncer de mama, colorrectal y próstata, todos obesos de edad avanzada (65-91 años). Los grupos de intervención aumentaron la media de ingesta de frutas y verduras y redujeron el consumo de grasa saturada informando finalmente una pérdida de peso superior al doble de lo observado en los grupos control. A largo plazo, también se observó que redujeron el índice de percepción de deterioro de la función física y mejoraron significativamente su calidad de vida en comparación con los grupos control65.
Resultados semejantes, aunque menos evidentes, se obtuvieron en el trabajo anterior de Demark y cols.66 que combina dieta y ejercicio, donde 90 pacientes pre-menopáusicas con CM con tratamiento de quimioterapia adyuvante, se sometieron a distintas intervenciones según los grupos, con dieta rica en calcio (Ca), o dieta con frutas y vegetales y baja en grasas. Además, realizaron actividad física (ejercicios aeróbicos y entrenamiento de fuerza) y tuvieron un seguimiento controlado. Los resultaron pusieron en evidencia la mejora de la masa corporal magra y la disminución de la adiposidad, lo que sugiere también que las intervenciones en las que se unen dieta y ejercicio pueden prevenir el aumento de peso y cambios adversos en la composición corporal.
Limitaciones
Una de las limitaciones más importantes de esta revisión es la falta de suficientes estudios de intervención aleatorios y controlados que investiguen específicamente cómo y qué cambios en la dieta que incidan sobre el peso corporal, pueden afectar la recurrencia y mortalidad en pacientes de cáncer de mama. Otra dificultad importante es la gran variedad de estrategias dietéticas que se proponen hoy en día para perder peso. Los estudios de intervención que se están llevando a cabo actualmente, como por ejemplo en The German SUCCESS C Study67 en el caso de Europa, proponen cambios en el estilo de vida que afecten al balance energético combinando diferentes tipos de dietas hipocalóricas con la realización de ejercicio físico. A la espera de los resultados de estos nuevos estudios, las recomendaciones nutricionales generales para supervivientes de cáncer de mama siguen apoyándose en los resultados de los estudios prospectivos de cohorte y de intervención que se han presentado en esta revisión.
La tabla II resume las recomendaciones nutricionales generales para supervivientes de cáncer.
Conclusiones
• El exceso de peso es un factor de mal pronóstico para el cáncer de mama.
• Dado que el exceso de peso afecta a la supervivencia y calidad de vida, se hace patente la necesidad real de educar a las mujeres acerca de los posibles efectos adversos del exceso de peso en el momento del diagnóstico y del aumento de peso durante y después del tratamiento.
• La evidencia sugiere que el control de peso es la clave para el control de enfermedades comórbidas frecuentes en esta población de pacientes. Por tanto, todas las mujeres, independientemente de su IMC inicial, deben ser informadas de dichos riesgos y deben conocer las estrategias de control para evitar la ganancia de peso durante y después del tratamiento.
• A pesar de que los estudios de intervención dan resultados contradictorios, la mayoría de ellos ponen en evidencia que una dieta hipocalórica, con limitación de grasas y azúcares simples, rica en vegetales, frutas y cereales integrales, acompañada de ejercicio físico así como de apoyo psicológico, componen las pautas fundamentales para mejorar el pronóstico.
• Puesto que el número de mujeres supervivientes de cáncer de mama es cada vez mayor, se hace imprescindible un seguimiento prospectivo del control del peso de todas las pacientes por parte de los profesionales de la salud, para limitar las morbilidades asociadas y mejorar su calidad de vida.
• Se necesitan más estudios para conocer los mecanismos fisiopatológicos exactos involucrados en los cambios en la composición corporal, la reducción del gasto energético y la aparición de la obesidad sarcopénica. Así mismo, se ha de seguir investigando y mejorando el diseño de los estudios para determinar cuál sería el mejor abordaje nutricional para controlar el aumento de peso e identificar las supervivientes más susceptibles a los efectos adversos del exceso de peso, pues serían las mejores candidatas a beneficiarse de estas medidas.
Referencias
1. Howlader N, Noone AM, Krapcho M, Garshell J, Neyman N, Altekruse SF, Kosary CL, Yu M, Ruhl J, Tatalovich Z, Cho H, Mariotto A, Lewis DR, Chen HS, Feuer EJ, Cronin KA (eds). SEER Cancer Statistics Review, 1975-2010 (Internet). Natl Cancer Inst Natl Institutes Heal 2013 Apr (cited 2013 Jun 24); Available from: http://seer.cancer.gov/csr/1975_2010/. [ Links ]
2. Atlanta: American Cancer Society. American Cancer Society. Breast Cancer Facts & Figures 2011-2012 (Internet). 2011; Available from: http://www.cancer.org/acs/groups/content/@epidemiologysurveilance/documents/document/acspc-030975.pdf. [ Links ]
3. AECC. Asociación Española Contra el Cáncer. Incidencia del cáncer de mama (Internet). Aecc Asoc. Española Contra El Cáncer. 2012 Sep 27 (cited 2013 Jun 24); Available from: http://www.aecc.es/SobreElCancer/CancerPorLocalizacion/CancerMama/Paginas/incidencia.aspx. [ Links ]
4. Malvezzi M, Bertuccio P, Levi F, Vecchia CL, Negri E. European cancer mortality predictions for the year 2013. Ann Oncol 2013 Mar 1; 24 (3): 792-800. [ Links ]
5. SEOM. Monográfico SEOM de Largos Supervivientes en cáncer-II Parte (Internet). 2012 Oct 22; Available from: http://www.seom.org/seomcms/images/stories/recursos/infopublico/publicaciones/dossier2_supervivientes.pdf. [ Links ]
6. Demark-Wahnefried W, Campbell KL, Hayes SC. Weight management and its role in breast cancer rehabilitation. Cancer 2012 Apr 15; 118 (8 Suppl): 2277-87. [ Links ]
7. Rock CL, Doyle C, Demark-Wahnefried W, Meyerhardt J, Courneya KS, Schwartz AL, et al. Nutrition and physical activity guidelines for cancer survivors. CA Cancer J Clin 2012; 62 (4): 242-74. [ Links ]
8. Irwin ML, McTiernan A, Baumgartner RN, Baumgartner KB, Bernstein L, Gilliland FD, et al. Changes in Body Fat and Weight After a Breast Cancer Diagnosis: Influence of Demographic, Prognostic, and Lifestyle Factors. J Clin Oncol 2005 Feb 1; 23 (4): 774-82. [ Links ]
9. Eliassen AH, Colditz GA, Rosner B, Willett WC, Hankinson SE. Adult weight change and risk of postmenopausal breast cancer. Jama J Am Med Assoc 2006 Jul 12; 296 (2): 193-201. [ Links ]
10. WHO / Obesity (Internet). WHO. (cited 2013 Feb 3); Available from: http://www.seom.org/seomcms/images/stories/recursos/infopublico/publicaciones/dossier2_supervivientes.pdf. [ Links ]
11. Kwan ML, Chen WY, Kroenke CH, Weltzien EK, Beasley JM, Nechuta SJ, et al. Pre-diagnosis body mass index and survival after breast cancer in the After Breast Cancer Pooling Project. Breast Cancer Res Treat 2011 Dec 21; 132 (2): 729-39. [ Links ]
12. Ewertz M, Jensen M-B, Gunnarsdóttir KÁ, Højris I, Jakobsen EH, Nielsen D, et al. Effect of obesity on prognosis after early-stage breast cancer. J Clin Oncol Off J Am Soc Clin Oncol 2011 Jan 1; 29 (1): 25-31. [ Links ]
13. Protani M, Coory M, Martin JH. Effect of obesity on survival of women with breast cancer: systematic review and meta-analysis. Breast Cancer Res Treat 2010 Oct; 123 (3): 627-35. [ Links ]
14. Patterson RE, Cadmus LA, Emond JA, Pierce JP. Physical activity, diet, adiposity and female breast cancer prognosis: a review of the epidemiologic literature. Maturitas 2010 May; 66 (1): 5-15. [ Links ]
15. Vance V, Mourtzakis M, McCargar L, Hanning R. Weight gain in breast cancer survivors: prevalence, pattern and health consequences. Obes Rev Off J Int Assoc Study Obes 2011 Apr; 12 (4): 282-94. [ Links ]
16. Caan B, Sternfeld B, Gunderson E, Coates A, Quesenberry C, Slattery ML. Life After Cancer Epidemiology (LACE) Study: a cohort of early stage breast cancer survivors (United States). Cancer Causes Control Ccc 2005 Jun; 16 (5): 545-56. [ Links ]
17. Nichols HB, Trentham-Dietz A, Egan KM, Titus-Ernstoff L, Holmes MD, Bersch AJ, et al. Body mass index before and after breast cancer diagnosis: associations with all-cause, breast cancer, and cardiovascular disease mortality. Cancer Epidemiol Biomarkers Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 2009 May; 18 (5): 1403-9. [ Links ]
18. Caan BJ, Emond JA, Natarajan L, Castillo A, Gunderson EP, Habel L, et al. Post-diagnosis weight gain and breast cancer recurrence in women with early stage breast cancer. Breast Cancer Res Treat 2006 Sep; 99 (1): 47-57. [ Links ]
19. Makari-Judson G, Judson CH, Mertens WC. Longitudinal Patterns of Weight Gain after Breast Cancer Diagnosis: Observations beyond the First Year. Breast J 2007 May; 13 (3): 258-65. [ Links ]
20. Heideman WH, Russell NS, Gundy C, Rookus MA, Voskuil DW. The frequency, magnitude and timing of post-diagnosis body weight gain in Dutch breast cancer survivors. Eur J Cancer Oxf Engl 1990 2009 Jan; 45(1): 119-26. [ Links ]
21. Gadéa E, Thivat E, Planchat E, Morio B, Durando X. Importance of metabolic changes induced by chemotherapy on prognosis of early-stage breast cancer patients: a review of potential mechanisms. Obes Rev 2012; 13 (4): 368-80. [ Links ]
22. Saquib N, Flatt SW, Natarajan L, Thomson CA, Bardwell WA, Caan B, et al. Weight gain and recovery of pre-cancer weight after breast cancer treatments: evidence from the women's healthy eating and living (WHEL) study. Breast Cancer Res Treat 2007 Oct; 105 (2): 177-86. [ Links ]
23. Malinovszky KM, Cameron D, Douglas S, Love C, Leonard T, Dixon JM, et al. Breast cancer patients' experiences on endocrine therapy: monitoring with a checklist for patients on endocrine therapy (C-PET). The Breast 2004 Oct; 13 (5): 363-8. [ Links ]
24. Demark-Wahnefried W, Winer EP, Rimer BK. Why women gain weight with adjuvant chemotherapy for breast cancer. J Clin Oncol Off J Am Soc Clin Oncol 1993 Jul; 11 (7): 1418-29. [ Links ]
25. Rockenbach G, Di Pietro PF, Ambrosi C, Boaventura BCB, Vieira FGK, Crippa CG, et al. Dietary intake and oxidative stress in breast cancer: before and after treatments. Nutr Hosp Organo Of Soc Española Nutr Parenter Enter 2011 Aug; 26 (4): 737-44. [ Links ]
26. Harvie MN, Campbell IT, Baildam A, Howell A. Energy balance in early breast cancer patients receiving adjuvant chemotherapy. Breast Cancer Res Treat 2004 Feb; 83 (3): 201-10. [ Links ]
27. Campbell KL, Lane K, Martin AD, Gelmon KA, McKenzie DC. Resting energy expenditure and body mass changes in women during adjuvant chemotherapy for breast cancer. Cancer Nurs 2007 Apr; 30 (2): 95-100. [ Links ]
28. Visovsky C. Muscle strength, body composition, and physical activity in women receiving chemotherapy for breast cancer. Integr Cancer Ther 2006 Sep; 5 (3): 183-91. [ Links ]
29. Kumar N, Allen KA, Riccardi D, Bercu BB, Cantor A, Minton S, et al. Fatigue, weight gain, lethargy and amenorrhea in breast cancer patients on chemotherapy: is subclinical hypothyroidism the culprit? Breast Cancer Res Treat 2004 Jan; 83 (2): 149-59. [ Links ]
30. Alfano CM, Lichstein KL, Vander Wal GS, Smith AW, Reeve BB, McTiernan A, et al. Sleep duration change across breast cancer survivorship: associations with symptoms and health-related quality of life. Breast Cancer Res Treat. 2011 Nov; 130 (1): 243-54. [ Links ]
31. Hanlon EC, Van Cauter E. Quantification of sleep behavior and of its impact on the cross-talk between the brain and peripheral metabolism. Proc Natl Acad Sci USA. 2011 Sep 13; 108 Suppl 3: 15609-16. [ Links ]
32. Demark-Wahnefried W, Hars V, Conaway MR, Havlin K, Rimer BK, McElveen G, et al. Reduced rates of metabolism and decreased physical activity in breast cancer patients receiving adjuvant chemotherapy. Am J Clin Nutr 1997 May; 65 (5): 1495-1501. [ Links ]
33. Campbell KL, Lane K, Martin AD, Gelmon KA, McKenzie DC. Resting energy expenditure and body mass changes in women during adjuvant chemotherapy for breast cancer. Cancer Nurs 2007 Apr; 30 (2): 95-100. [ Links ]
34. Del Rio G, Zironi S, Valeriani L, Menozzi R, Bondi M, Bertolini M, et al. Weight gain in women with breast cancer treated with adjuvant cyclophosphomide, methotrexate and 5-fluorouracil. Analysis of resting energy expenditure and body composition. Breast Cancer Res Treat 2002 Jun; 73 (3): 267-73. [ Links ]
35. Rose DP, Komninou D, Stephenson GD. Obesity, adipocytokines, and insulin resistance in breast cancer. Obes Rev Off J Int Assoc Study Obes 2004 Aug; 5 (3): 153-65. [ Links ]
36. Lima MM, Velásquez E, Unshelm G, Christopher T, Francisco R, Lanza P. Asociación de la insulina y el factor de crecimiento semejante a la insulina tipo 1 (IGF-1) en el cáncer de mama. Gac Médica Caracas 2009 Sep; 117 (3): 226-31. [ Links ]
37. Healy LA, Ryan AM, Carroll P, Ennis D, Crowley V, Boyle T, et al. Metabolic syndrome, central obesity and insulin resistance are associated with adverse pathological features in post-menopausal breast cancer. Clin Oncol R Coll Radiol Gt Br 2010 May; 22 (4): 281-8. [ Links ]
38. Aguilar Cordero MaJ, González Jiménez E, García López P, Álvarez Ferre J, Padilla López CA. Obesidad y niveles séricos de estrógenos: importancia en el desarrollo precoz del cáncer de mama. Nutr Hosp 2012 Aug; 27 (4): 1156-9. [ Links ]
39. Campbell KL, Foster-Schubert KE, Alfano CM, Wang C-C, Wang C-Y, Duggan CR, et al. Reduced-calorie dietary weight loss, exercise, and sex hormones in postmenopausal women: randomized controlled trial. J Clin Oncol Off J Am Soc Clin Oncol 2012 Jul 1; 30 (19): 2314-26. [ Links ]
40. Group TEH and BCC. Endogenous Sex Hormones and Breast Cancer in Postmenopausal Women: Reanalysis of Nine Prospective Studies. J Natl Cancer Inst 2002 Apr 17; 94 (8): 606-16. [ Links ]
41. World Cancer Research Fund International (WCRF International). Breast cancer. Latest evidence (Internet). (cited 2013 Jun 24); Available from: http://www.dietandcancerreport.org/cup/current_progress/breast_cancer.php. [ Links ]
42. Guh DP, Zhang W, Bansback N, Amarsi Z, Birmingham CL, Anis AH. The incidence of comorbidities related to obesity and overweight: A systematic review and meta-analysis. BMC Public Health 2009 Mar 25; 9: 88. [ Links ]
43. Doyle C, Kushi LH, Byers T, Courneya KS, Demark-Wahnefried W, Grant B, et al. Nutrition and Physical Activity During and After Cancer Treatment: An American Cancer Society Guide for Informed Choices. CA Cancer J Clin 2006 Nov 1; 56 (6): 323-53. [ Links ]
44. Suzuki R, Saji S, Toi M. Impact of body mass index on breast cancer in accordance with the life-stage of women. Front Oncol 2012; 2: 123. [ Links ]
45. Chen CL, Shore AD, Johns R, Clark JM, Manahan M, Makary MA. The impact of obesity on breast surgery complications. Plast Reconstr Surg 2011 Nov; 128 (5): 395e-402e. [ Links ]
46. Helyer LK, Varnic M, Le LW, Leong W, McCready D. Obesity is a Risk Factor for Developing Postoperative Lymphedema in Breast Cancer Patients. Breast J 2010; 16 (1): 48-54. [ Links ]
47. Ridner SH, Dietrich MS, Stewart BR, Armer JM. Body mass index and breast cancer treatment-related lymphedema. Support Care Cancer Off J Multinatl Assoc Support Care Cancer 2011 Jun; 19 (6): 853-7. [ Links ]
48. Shaw C, Mortimer P, Judd PA. A randomized controlled trial of weight reduction as a treatment for breast cancer-related lymphedema. Cancer 2007; 110 (8): 1868-74. [ Links ]
49. Reinertsen KV, Cvancarova M, Loge JH, Edvardsen H, Wist E, Fosså SD. Predictors and course of chronic fatigue in long-term breast cancer survivors. J Cancer Surviv 2010 Dec 1; 4 (4):405-14. [ Links ]
50. Andrykowski MA, Donovan KA, Laronga C, Jacobsen PB. Prevalence, predictors, and characteristics of off-treatment fatigue in breast cancer survivors. Cancer 2010; 116 (24): 5740-8. [ Links ]
51. Sestak I, Cuzick J, Sapunar F, Eastell R, Forbes JF, Bianco AR, et al. Risk factors for joint symptoms in patients enrolled in the ATAC trial: a retrospective, exploratory analysis. Lancet Oncol 2008 Sep; 9 (9): 866-72. [ Links ]
52. Caan BJ, Emond JA, Su HI, Patterson RE, Flatt SW, Gold EB, et al. Effect of postdiagnosis weight change on hot flash status among early-stage breast cancer survivors. J Clin Oncol Off J Am Soc Clin Oncol 2012 May 1; 30 (13): 1492-7. [ Links ]
53. Su HI, Sammel MD, Springer E, Freeman EW, DeMichele A, Mao JJ. Weight gain is associated with increased risk of hot flashes in breast cancer survivors on aromatase inhibitors. Breast Cancer Res Treat 2010 Nov 1; 124 (1): 205-11. [ Links ]
54. Hanrahan EO, Gonzalez-Angulo AM, Giordano SH, Rouzier R, Broglio KR, Hortobagyi GN, et al. Overall survival and cause-specific mortality of patients with stage T1a,bN0M0 breast carcinoma. J Clin Oncol Off J Am Soc Clin Oncol 2007 Nov 1; 25(31): 4952-60. [ Links ]
55. Blackburn GL, Wang KA. Dietary fat reduction and breast cancer outcome: results from the Women's Intervention Nutrition Study (WINS). Am J Clin Nutr 2007 Sep 1; 86 (3): 878S-881S. [ Links ]
56. Chlebowski RT, Blackburn GL, Thomson CA, Nixon DW, Shapiro A, Hoy MK, et al. Dietary Fat Reduction and Breast Cancer Outcome: Interim Efficacy Results From the Women's Intervention Nutrition Study. Jnci J Natl Cancer Inst 2006 Dec 19; 98 (24): 1767-76. [ Links ]
57. Romieu I, Ferrari P, Rinaldi S, Slimani N, Jenab M, Olsen A, et al. Dietary glycemic index and glycemic load and breast cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC). Am J Clin Nutr 2012 Aug; 96 (2): 345-55. [ Links ]
58. Kroenke CH, Fung TT, Hu FB, Holmes MD. Dietary patterns and survival after breast cancer diagnosis. J Clin Oncol Off J Am Soc Clin Oncol 2005 Dec 20; 23 (36): 9295-303. [ Links ]
59. Kwan ML, Weltzien E, Kushi LH, Castillo A, Slattery ML, Caan BJ. Dietary patterns and breast cancer recurrence and survival among women with early-stage breast cancer. J Clin Oncol Off J Am Soc Clin Oncol 2009 Feb 20; 27 (6): 919-26. [ Links ]
60. Pierce JP, Faerber S, Wright FA, Rock CL, Newman V, Flatt SW, et al. A randomized trial of the effect of a plant-based dietary pattern on additional breast cancer events and survival: the Women's Healthy Eating and Living (WHEL) Study. Control Clin Trials 2002 Dec; 23 (6): 728-56. [ Links ]
61. Villarini A, Pasanisi P, Raimondi M, Gargano G, Bruno E, Morelli D, et al. Preventing weight gain during adjuvant chemotherapy for breast cancer: a dietary intervention study. Breast Cancer Res Treat 2012 Aug 8; 135 (2): 581-9. [ Links ]
62. McNeely ML, Campbell KL, Rowe BH, Klassen TP, Mackey JR, Courneya KS. Effects of exercise on breast cancer patients and survivors: a systematic review and meta-analysis. Cmaj Can Med Assoc J 2006 Jul 4; 175 (1): 34-41. [ Links ]
63. Schmitz KH, Ahmed RL, Hannan PJ, Yee D. Safety and efficacy of weight training in recent breast cancer survivors to alter body composition, insulin, and insulin-like growth factor axis proteins. Cancer Epidemiol Biomarkers Prev Publ Am Assoc Cancer Res Cosponsored Am Soc Prev Oncol 2005 Jul; 14 (7): 1672-80. [ Links ]
64. Scott E, Daley AJ, Doll H, Woodroofe N, Coleman RE, Mutrie N, et al. Effects of an exercise and hypocaloric healthy eating program on biomarkers associated with long-term prognosis after early-stage breast cancer: a randomized controlled trial. Cancer Causes Control Ccc 2013 Jan; 24 (1): 181-91. [ Links ]
65. Morey MC, Snyder DC, Sloane R, Cohen HJ, Peterson B, Hartman TJ, et al. Effects of home-based diet and exercise on functional outcomes among older, overweight long-term cancer survivors: RENEW: a randomized controlled trial. Jama J Am Med Assoc 2009 May 13; 301 (18): 1883-91. [ Links ]
66. Demark-Wahnefried W, Case LD, Blackwell K, Marcom PK, Kraus W, Aziz N, et al. Results of a diet/exercise feasibility trial to prevent adverse body composition change in breast cancer patients on adjuvant chemotherapy. Clin Breast Cancer 2008 Feb; 8 (1): 70-9. [ Links ]
67. Rack B, Andergassen U, Neugebauer J, Salmen J, Hepp P, Sommer H, et al. The German SUCCESS C Study - The First European Lifestyle Study on Breast Cancer. Breast Care (Basel). 2010 Dec; 5 (6): 395-400. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Jesús Rodríguez San Felipe.
E-mail: mjesusrod@yahoo.es
Recibido: 25-VII-2013.
1.a Revisión: 17-IX-2013
Aceptado: 18-IX-2013.