Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.28 no.6 Madrid nov./dic. 2013
https://dx.doi.org/10.3305/nh.2013.28.6.6946
ORIGINAL / Obesidad
Peroxidación de lípidos y la respuesta del sistema de defensa antioxidante en el diabético tipo 2 obeso en comparación al diabético tipo 2 sin obesidad
Lipid peroxidation and the response of the antioxidant defense system in the obese type 2 diabetic compared with the non-obese type 2 diabetic
Ramón Gaxiola-Robles1,2, Oscar Kurt Bitzer-Quintero3, Lía Celina Méndez-Rodríguez1, Vanessa Labrada-Martagón1, Adolfo García-González2, Luis Javier Ramírez-Jirano3, Marcela Veléz-Alavez1 y Tania Zenteno-Savín1
1Centro de Investigaciones Biológicas del Noroeste (CIBNOR). Planeación Ambiental y Conservación. La Paz. Baja California Sur. México.
2Hospital General de Zona N.o 1. Instituto Mexicano del Seguro Social. La Paz. Baja California Sur. México.
3Centro de Investigación Biomédica de Occidente (CIBO). Instituto Mexicano del Seguro Social. Guadalajara. Jalisco. México.
Este trabajo fue patrocinado por CIBNOR (PC2.0, PC2.1, PC2.6). Se agradece el apoyo de CONACYT por la beca posdoctoral (43114) a GRR.
Dirección para correspondencia
RESUMEN
Introducción: La diabetes se asocia a un incremento en la peroxidación de lípidos, cuantificada a partir del nivel de sustancias reactivas al ácido tiobarbitúrico (TBARS). En paralelo, se activa el sistema de defensa antioxidante (SDA) para delimitar el daño.
Objetivo: Determinar el grado de peroxidación de lípidos en individuos obesos diabéticos tipo 2 (DM2) y la respuesta del SDA en comparación con individuos con DM2 sin obesidad.
Método: Se evaluó el daño a lípidos a través de la medición de las TBARS en dos grupos de 30 individuos. Se evaluó la respuesta del SDA por medio de la medición de la actividad de las enzimas catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx).
Resultados: El grupo de DM2 obesos presentó un índice de masa corporal (IMC) promedio de 38,6 ± 3,5 kg m2 en comparación con el grupo control 24,7 ± 3,6 kg m2 (p < 0,01). Los niveles de TBARS en el grupo en estudio fueron más altos en comparación al grupo control (p < 0.01). En un análisis de regresión lineal múltiple la actividad de SOD y CAT explicó los niveles de TBARS en el obeso con DM2.
Conclusión: Los niveles de TBARS sugieren mayor daño por estrés oxidativo en DM2 obesos por un exceso en la producción de radicales libres (RL), así como incapacidad del SDA para delimitar el daño.
Palabras clave: Diabetes mellitus tipo 2. Estrés oxidativo. Obesidad. Peroxidación de lípidos. Sistema de defensa antioxidante.
ABSTRACT
Introduction: Diabetes is associated with increased lipid peroxidation, quantified as the levels of thiobarbituric acid reactive substances (TBARS). In parallel, the antioxidant defense system (ADS) reacts to diminish the oxidative damage.
Objective: To determine the levels of lipid peroxidation and the activity of antioxidant enzymes in obese type 2 diabetic (DM2) individuals compared to non-obese DM2 individuals.
Methods: Lipid peroxidation was quantified by measuring TBARS and the ADS response by measuring the activity of superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPx).
Results: Two groups of 30 subjects were studied. The obese DM2 group had a mean body mass index (BMI) 38.6 ± 3.5 kg m-2 compared to the control group 24.7 ± 3.6 kg m-2 (p<0.01). TBARS levels in the study group were higher compared to the control group (p <0.01). Multiple linear regression analysis suggested that activities of SOD and CAT adjusted to lipid peroxidation (TBARS) in the obese DM2 individuals.
Conclusion: TBARS levels suggest greater oxidative damage in obese DM2 subjects with a diminished response of ADS.
Key words: Diabetes mellitus type 2. Oxidative stress. Obesity. Lipid peroxides. Antioxidants.
Abreviaturas
DM2: Diabetes mellitus tipo 2.
TBARS: Sustancias reactivas al ácido tiobarbitúrico.
CAT: Catalasa.
SOD: Superóxido dismutasa.
GPx: Glutatión peroxidasa.
IMC: Índice de masa corporal.
EO: Estrés oxidativo.
RL: Radicales libres.
O2-: Radical superóxido.
H2O2: Peróxido de hidrogeno.
SDA: Sistema de defensa antioxidante.
ERO: Especies reactivas de oxígeno.
FNT-alfa: Factor de necrosis tumoral alfa.
Kg: Kilogramo.
m2: Metro cuadrado.
mg dL-1: Miligramo por decilitro.
U g-1 prot: Unidades por gramo de proteína.
mU g-1 prot: Miliunidades por gramo de proteína.
nmol g-1 prot: Nanomoles por gramo de proteína.
LDL: Lipoproteína de baja densidad.
HDL: Lipoproteína de alta densidad.
HBA1C: Hemoglobina glucosilada A1c.
Introducción
La obesidad y la diabetes tipo 2 (DM2) son dos patologías íntimamente relacionadas con múltiples afectaciones sistémicas, como cáncer, procesos inflamatorios crónicos y enfermedades neurodegenerativas, entre otros1. La obesidad es una enfermedad a nivel mundial que ha llegado a magnitud de pandemia2. Numerosas investigaciones han demostrado un incremento en la morbilidad y la mortalidad asociadas a la obesidad3. Así, el riesgo de padecer diabetes, dislipidemias, resistencia a la insulina, y patologías similares es tres veces mayor en los individuos obesos4. La obesidad y la diabetes han sido relacionadas con el estrés oxidativo (EO)5 causado por un desequilibrio entre la producción de radicales libres (RL) y el sistema de defensa antioxidante (SDA). Las especies reactivas de oxigeno (ERO), entre las que se encuentran los RL, son moléculas altamente reactivas que interactúan con sustratos como proteínas, carbohidratos y lípidos pudiendo generar daño a la estructura y función celular6.
La peroxidación de lípidos causada por ERO es una de las causas más importantes del daño a las células del endotelio7. El daño al endotelio en el individuo con DM2 genera micro- y macroangiopatías, las cuales no pueden ser prevenidas solamente por el control de la glucemia, ya que las ERO juegan un papel determinante8. La retinopatía y nefropatía diabética se desarrollan a la par y son las responsables del mayor número de cegueras y nefropatías crónicas9,10. El incremento de las ERO acelera el proceso de ateroesclerosis dando como resultado un aumento del riesgo de eventos coronarios agudos y accidentes vasculares cerebrales10.
Uno de los principales mecanismos de producción de ERO en el individuo con DM2 es la autoxidación de la glucosa11. La desnaturalización de esta molécula da lugar a la formación del radical superóxido (O2.-), el cual es precursor del peróxido de hidrogeno (H2O2) entre otras ERO12. En el individuo con DM2 obeso, los niveles de ácidos grasos libres son otra fuente de O2.-, debido a que son fácilmente oxidados6,13. El IMC de los pacientes obesos, traducido en volumen de tejido a oxigenar, es un factor adicional en la generación de ERO, que demanda mayor esfuerzo del miocardio, tanto metabólico como mecánico14. Como consecuencia de esta demanda se incrementa el estallido respiratorio mitocondrial, con aumento de la producción de O2.-15. El incremento en la presión intraabdominal pudiera ser otra fuente de ERO. Ésta ocasiona mayor compresión intracelular en los adipocitos, resultando en la liberación de citocinas y del factor de necrosis tumoral alfa (FNT-alfa), lo que incrementa la producción de O2.-2,16.
La evidencia científica relaciona al EO con DM2 y obesidad, pero hasta la fecha no se conocen los valores del daño oxidativo que permitan predecir o señalar en qué momento se pueda considerar como patológico. El objetivo del presente estudio fue determinar el grado de daño oxidativo y las defensas antioxidantes como biomarcadores en individuos obesos con DM2 en comparación con individuos con DM2 no obesos. Para ello, se evaluó la peroxidación de lípidos, expresada como los niveles de las sustancias reactivas al ácido tiobarbitúrico (TBARS), y la actividad de las enzimas del SDA catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx).
Método
Se estudiaron dos grupos de 30 pacientes cada uno. El grupo de obesos con DM2 y el grupo de referencia, DM2 sin obesidad. Se clasificaron como obesos aquellos sujetos con IMC mayor de 30 [kg m-2]3,14. La clasificación de DM2 fue realizada con base en los criterios de la "Guía para la práctica clínica para el diagnóstico y tratamiento de la diabetes mellitus"17. Los sujetos obesos con DM2, así como los del grupo de referencia, fueron reclutados del Programa de Educación en Diabetes del Instituto Mexicano del Seguro Social (DIABETIMSS). Con la finalidad de eliminar posibles factores de confusión se excluyeron sujetos que presentaran las siguientes circunstancias un mes antes de la toma de muestra: ingesta de suplementos con antioxidantes, tratamiento contra dislipidemias, infecciones recientes, afecciones hepáticas y renales, procesos neoplásicos, accidente cerebrovascular, infarto agudo al miocardio y accidente traumático14. El protocolo de estudio y el consentimiento informado fueron registrados ante el comité local de investigación en salud del Hospital General de Zona Núm.1, folio: R-2010-301-1. A cada uno de los pacientes se le explicó el estudio y se le dió a leer el consentimiento informado. Todos los pacientes seleccionados aceptaron participar en la investigación.
Las muestras de sangre venosa (aproximadamente 7 mL) fueron obtenidas después de 10 horas de ayuno y procesadas en el laboratorio de Estrés Oxidativo del Centro de Investigaciones Biológicas del Noroeste S.C. Se utilizaron métodos espectrofotométricos para cuantificar el daño oxidativo y la actividad de las enzimas del SDA. Como producto de la peroxidación de lípidos se midieron los niveles de TBARS según técnica descrita por Zenteno-Savín et al. (2002)18.Como parte de las enzimas del SDA se determinó la actividad de SOD de acuerdo al protocolo de Susuki (2000)19, de CAT según Aebi (1984)20 y de GPx de acuerdo a Flohé y Günzler (1984)21. Los niveles de glucosa, hemoglobina glucosilada A1c (HBA1C), colesterol total, triglicéridos, lipoproteína de baja densidad (LDL) y lipoproteína de alta densidad (HDL) se determinaron en un sistema integrado automatizado (Dimension RxL Max, Siemens).
Se utilizó el programa SPSS V13.0 para el análisis estadístico. En todos los parámetros evaluados se realizó análisis de normalidad Kolmogorv-Smirnov, y se utilizó t de Student para la comparación entre grupos6. Dichas variables se presentan como medias ± error estándar. En cuanto la variable sexo, se presenta en frecuencia absoluta y relativa. Para evaluar la actividad enzimática SOD, GPx y CAT (variables independientes) con relación a los niveles de TBARS (variable dependiente) se utilizó análisis de regresión lineal múltiple. Los modelos de regresión fueron construidos usando el análisis por pasos (stepwise) para seleccionar las variables predictoras que significativamente maximizaron el modelo r2 (coeficiente de determinación)22. El nivel de significación α fue < 0,05. Por último se realizó un análisis de la distribución de los residuales para evaluar la homocedasticidad, el ajuste del modelo y detectar observaciones atípicas de los datos22.
Resultados
La edad promedio del grupo de obesos con DM2 fue de 39 ± 4 años, de los cuales el 70% fueron mujeres, con un IMC promedio de 38,6 ± 3,5 kg m-2. La edad promedio del grupo de referencia DM2 no obesos fue de 39 ± 3 años, en donde el 60% fueron mujeres, con un IMC promedio de 24,7 ± 3,6 kg m-2 significativamente menor que en obesos DM2 (media -13,88, t=-15,64 df 29 p<0,01).
En la tabla I se presentan los valores de bioquímica sanguínea. Los niveles de triglicéridos fueron significativamente mayores en los individuos obesos con DM2 (188 ± 18,5 mg dL-1) en comparación con los individuos con DM2 no obesos (132 ± 9,3 mg dL-1) (media -55,50 t=-2,53 df 29 p=0,02). Los promedios de HDL fueron significativamente menores en los obesos con DM2 (37 ± 1,5 mg dL-1) en comparación a los DM2 no obesos (45 ± 2,7 mg dL-1) (media 7,801=2,67 df 29 p=0,01). No se observaron diferencias entre los grupos en los niveles de glucosa, colesterol, LDL o HBA1C (p>0,05) (Tabla I).
Los niveles de TBARS fueron mayores en los obesos con DM2 (153,30 ± 11,9 nmol g-1 prot) que en el grupo de referencia (74,48 ± 3,6 nmol g-1 prot) (media - 78,82 t=-6,14 df 29 p<0,01) (Tabla II). El mismo patrón se observó en la actividad de las enzimas CAT, SOD y GPx, las cuales mostraron un incremento (p<0.01) en el grupo de individuos obesos con DM2 en comparación al grupo de referencia (Tabla II).
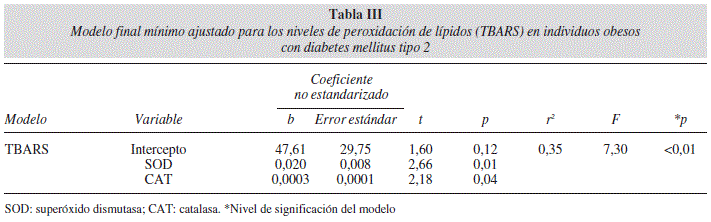
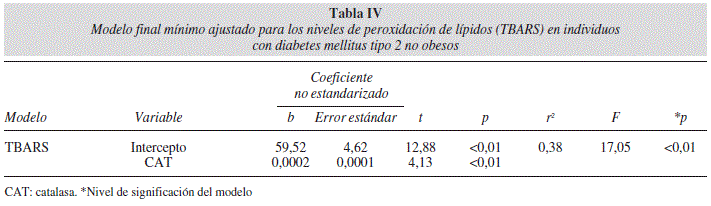
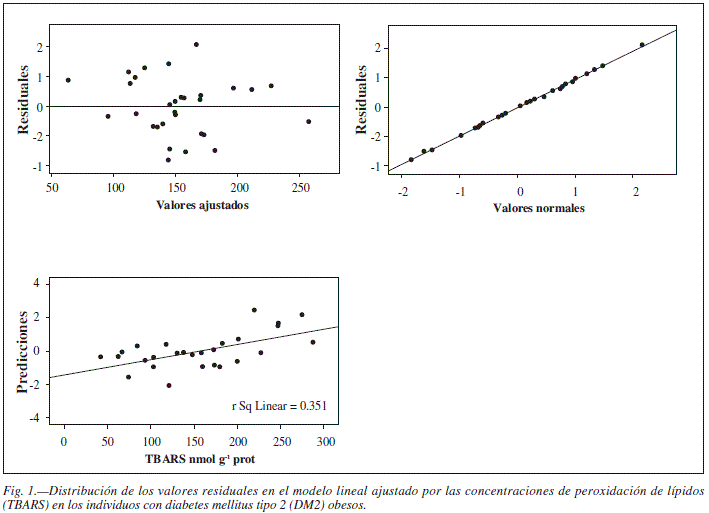
Se generaron dos modelos de regresión lineal múltiple para evaluar el efecto de la actividad del SDA sobre los niveles de TBARS. En la tabla III se muestra el modelo final para la correlación de la actividad de las enzimas SOD y CAT con los niveles de TBARS en los sujetos obesos con DM2 (r2 = 0,35 p = 0,01). El modelo de regresión final creado para los sujetos con DM2 no obesos (Tabla IV) mostró que solamente la actividad de CAT se correlacionó con los niveles de TBARS (r2 = 0,38 p < 0,01). La varianza constante y la distribución normal de los residuales no sugieren ninguna tendencia, confirmando la suficiencia de los modelos ajustados (Figs. 1 y 2).
Discusión
Los TBARS son el producto de la peroxidación de lípidos frecuentemente utilizado en la determinación del balance oxidación/anti-oxidación en los individuos diabéticos7. Nuestros datos muestran niveles altos de las concentraciones de TBARS para ambos grupos de diabéticos al comprarlo con lo reportado por Stefanovic et al. (2008) en su grupo control de no diabéticos1. Los datos de dichos autores concuerdan con los resultados del presente estudio al reportar mayor concentración de TBARS en individuos DM2 obesos en comparación a DM2 sin obesidad11. Diversos autores reportan incrementos similares en los niveles de TBARS en los individuos diabéticos en comparación a los individuos no diabéticos7,23.
Fisiológicamente, un aumento en la producción de H2O2 puede inducir un incremento en los niveles de TBARS24.En el presente trabajo, la mayor actividad de SOD y los mayores niveles de TBARS en los individuos con DM2 obesos en comparación con el grupo de referencia, podrían sugerir un incremento en la producción de O2.- y su transformación en H2O2. Stefanovic et al. (2008) reportan una diferencia estadísticamente significativa en el incremento de la actividad de SOD en los diabéticos obesos en comparación a los diabéticos no obesos1.
Ante el incremento de los niveles de H2O2 existe un mecanismo de autoregulación entre las enzimas CAT y GPx, a niveles bajos de peroxidación la actividad de detoxificación se encuentra dada por GPx. Cuando los niveles de H2O2 son altos el mecanismo de respuesta está mediado por CAT7. Este proceso de activación enzimática se puede observar en el modelo de regresión lineal múltiple para ambos grupos estudiados.
La actividad las enzimas antioxidantes SOD y CAT con los niveles elevados de TBARS sugiere que los sujetos obesos con DM2 están sometidos a un mayor nivel de EO en comparación a los individuos con DM2 no obesos. Resultados de otros trabajos de la actividad del sistema de defensa antioxidante son controversiales en cuanto a la actividad de SOD y CAT ante la peroxidación de lípidos. Olzyck et al. (1994) no encuentran diferencias entre la actividad de SOD y CAT con los niveles de TBARS en el grupo control vs el grupo de diabeticos25. Turk et al. (2002) reportan un incremento de la actividad de SOD en individuos diabéticos vs no diabéticos. La actividad de CAT se reportan menor en los diabéticos en comparación a los controles7. En nuestro trabajo se aprecia que la actividad de CAT se correlaciona positivamente con las concentraciones de TBARS en ambos modelos presentados.
Se ha sugerido como probable explicación de la diferencia encontrada en los individuos con DM2 obesos vs no obesos la autoxidación de la glucosa, la cual incrementa los niveles O2.- y otras ERO, causando daño a lípidos11. Otro mecanismo de producción de ERO es el incremento del estallido respiratorio mitocondrial resultante del aumento en la carga mecánica y metabólica, y por ende en el consumo de oxígeno del miocardio en el individuo obeso14,15. Una propuesta para explicar el aumento en la producción de ERO asociada a la obesidad involucra al IMC, el cual origina compresión del lipocito en la grasa intraabdominal; esto causa la liberación de citocinas y de FNT-alfa, con la generación de O2.- y otras ERO que favorecen los procesos de peroxidación de lípidos16. Por último, otra posibilidad es a través de la dieta rica en ácidos grasos. En los individuos con DM2 obesos, los niveles de triglicéridos fueron 42% mayores que en el grupo de referencia. Estos ácidos grasos son altamente vulnerables a la oxidación, lo que se refleja como mayores niveles de peroxidación de lípidos13.
A pesar de las limitaciones de nuestro estudio al no poder controlar muchos otros factores, como son los genéticos, ambientales, toxicológicos, metabólicos y nutricionales que pueden estar actuando como confusores, con esta serie de resultados se sugiere que el individuo con DM2 obeso se encuentra en mayor riesgo de presentar estados comórbidos relacionados con una elevada producción de ERO. Esto se verá reflejado en una probable progresión acelerada del daño a las membranas celulares, que potencialmente desencadenará ateroesclerosis, eventos coronarios agudos, retinopatía proliferativa, daño renal, entre otros problemas en etapas tempranas. La aparición de estas complicaciones asociadas a la DM2 pudiera ser retardada con un control adecuado de la dieta y el peso (IMC). Otra limitación del estudio fue el no contar con un tercer grupo de comparación que sería individuos obesos sin diabetes. Pero la intención del estudio fue delimitar lo más posible al factor obesidad en los individuos diabéticos y cómo éste participa en el estrés oxidativo.
Conclusión
Aparentemente, los individuos con DM2 presentan estados activos de EO. Especialmente, en los DM2 obesos se observaron mayores valores de TBARS a pesar de una mayor actividad del SDA en comparación con el grupo de referencia. Ello sugiere que, a diferencia de los DM2 no obesos, el SDA en DM2 obesos no es suficiente para evitar el daño oxidativo, y que quizá los niveles de TBARS en este grupo se pueden considerar patológicos. Un factor determinante y primordial en el manejo integral de los individuos con DM2 obesos es el control de peso (IMC). Así, es posible retardar la aparición de los comórbidos más comunes y devastadores de esta entidad nosológica.
Agradecimientos
Los autores agradecen a G Buelna-Sepulveda, laboratorio clínico del Hospital General de Zona Núm. 1 del IMSS BCS, por su ayuda en la recolección de las muestras; a O Lugo Lugo y NO Olguín Monroy por su participación en el procesamiento de las muestras. El proyecto se registró ante el comité local de investigación del HGZ No1 bajo el folio R-2010-301-1.
Referencias
1. Stefanovic A, Kotur-Stevuljevic J, Spasic S, Bogavac-Stanojevic N, Bujisic N. The influence of obesity on the oxidative stress status and the concentration of leptin in type 2 diabetes mellitus patients. Diabetes Res Clin Pract 2008; 79: 156-63. [ Links ]
2. Chaia Kaippert V, Kimi Uehara S, Lima D'Andrea C, et al. Influence of the body mass and visceral adiposity on glucose metabolism in obese women with Pro12Pro genotype in PPAR-gamma2 gene. Nutrición Hospitalaria 2013; 28: 694-700. [ Links ]
3. Berrington de Gonzalez A, Hartge P, Cerhan JR, et al. Body-mass index and mortality among 1.46 million white adults. N Engl J Med 2010; 363: 2211-9. [ Links ]
4. Valdecantos MO, Perez-Matute P, Martinez JA. Obesidad y estrés oxidativo: papel de la suplementación con antioxidantes de la dieta. Rev Inv Clinica 2012; 61: 127-139. [ Links ]
5. Lau YS, Tian XY, Huang Y, Murugan D, Achike FI, Mustafa MR. Boldine protects endothelial function in hyperglycemia-induced oxidative stress through an antioxidant mechanism. Biochem Pharmacol 2013; 85: 367-75. [ Links ]
6. De Tursi Ríspoli L, Vazquez Tarragón A, Vazquez Prado A, Sáez Tormo G, Mahmoud Ismail A, Gumbau Puchol V. Estrés oxidativo; estudio comparativo entre un grupo de población normal y un grupo de población obesa mórbida. Nutricion Hospitalaria 2013; 28: 671-5. [ Links ]
7. Turk HM, Sevinc A, Camci C, et al. Plasma lipid peroxidation products and antioxidant enzyme activities in patients with type 2 diabetes mellitus. Acta Diabetol 2002; 39: 117-22. [ Links ]
8. Abraira C, Emanuele N, Colwell J, et al. Glycemic control and complications in type II diabetes. Design of a feasibility trial. VA CS Group (CSDM). Diabetes Care 1992; 15: 1560-71. [ Links ]
9. Reddy SC, Kihn YM, Nurjahan MI, Ramil A. Retinopathy in type 2 diabetic patients with microalbuminuria. Nepal J Ophthalmol 2013; 5: 69-74. [ Links ]
10. Vinik AI, Vinik E. Prevention of the complications of diabetes. Am J Manag Care 2003; 9: S63-80; quiz S81-4. [ Links ]
11. Baynes JW. Role of oxidative stress in development of complications in diabetes. Diabetes 1991; 40: 405-12. [ Links ]
12. Díaz Arce D. Hiperglicemia y estrés oxidativo en el paciente diabético. Rev Cubana Invest Bioméd 2006; 25. [ Links ]
13. Tucci S, Flogel U, Sturm M, Borsch E, Spiekerkoetter U. Disrupted fat distribution and composition due to medium-chain triglycerides in mice with a beta-oxidation defect. Am J Clin Nutr 2011; 94:439-49. [ Links ]
14. Olusi SO. Obesity is an independent risk factor for plasma lipid peroxidation and depletion of erythrocyte cytoprotectic enzymes in humans. Int J Obes Relat Metab Disord 2002; 26: 1159-64. [ Links ]
15. Murphy MP. How mitochondria produce reactive oxygen species. Biochem J 2009; 417: 1-13. [ Links ]
16. Tang J, Yan H, Zhuang S. Inflammation and oxidative stress in obesity-related glomerulopathy. Int J Nephrol 2012; 2012: 608397. [ Links ]
17. Oviedo-Mota MA, Espinosa-Larrañaga F, Reyes-Morales H, Trejo-Pérez JA, Gil Velázquez E. Guía clínica para el diagnóstico y tratamiento de la diabetes mellitus tipo 2. Rev Med IMSS 2003; 41:S27-S46. Disponible en: http://www.medigraphic.com/pdfs/imss/im-2003/ims031d.pdf. [ Links ]
18. Zenteno-Savin T, Clayton-Hernandez E, Elsner R. Diving seals: are they a model for coping with oxidative stress? Comp Biochem Physiol C Toxicol Pharmacol 2002; 133: 527-36. [ Links ]
19. Suzuki K. Measurement Of Mn-Sod And Cu, Zn-Sod. In: Taniguchi N. Gutteridge J. (Eds.) Experimental Protocols For Reactive Oxygen And Nitrogen Species. Oxford University Press. U. K. 2000. pp. 91-5. [ Links ]
20. Aebi H. Catalase in vitro. Methods Enzymol 1984; 105: 121-6. [ Links ]
21. Flohe L, Gunzler WA. Assays of glutathione peroxidase. Methods Enzymol 1984; 105: 114-21. [ Links ]
22. Katz MH. Applied regression analysis and other multivariable methods. Cambridge University press. Second edition, United States of America 2006. [ Links ]
23. Varashree BS, Bhat GP. Correlation of Lipid Peroxidation with Glycated Haemoglobin Levels in Diabetes Mellitus. Online Journal of Health and Allied Sciences, 2011, vol. 10, no 2. http://cogprints.org/7968/. [ Links ]
24. Codoner-Franch P, Valls-Belles V, Arilla-Codoner A, Alonso-Iglesias E. Oxidant mechanisms in childhood obesity: the link between inflammation and oxidative stress. Transl Res 2011; 158: 369-84. [ Links ]
25. Olczyk K, Koscielniak-Kocurek E, Sonecki P, Zdenkowski W. The lipid peroxidation products and the enzymes of antioxidant system in patients with diabetes mellitus. Rocz Akad Med Bialymst 1994; 39: 93-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Tania Zenteno-Savín.
Centro de Investigaciones Biológicas del Noroeste, S. C.
Programa de Planeación Ambiental y Conservación.
Instituto Politécnico Nacional 195.
Playa Palo de Santa Rita Sur.
23096 La Paz. Baja California Sur. México.
E-mail: tzenteno04@cibnor.mx
Recibido: 7-VI-2013.
1.a Revisión: 4-IX-2013.
Aceptado: 12-IX-2013.