My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.28 n.6 Madrid Nov./Dec. 2013
https://dx.doi.org/10.3305/nh.2013.28.6.6901
ORIGINAL / Alimentos funcionales
Probióticos y enterocolitis necrotizante del prematuro; to NEC or not to NEC?, ésta es la pregunta*
Probiotics and necrotizing enterocolitis in preterm infants; to NEC or not to NEC?, this is the question
Javier González de Dios1 y María González Muñoz2
1Servicio de Pediatría. Unidad de Cuidados Intensivos Neonatales. Hospital General Universitario de Alicante. Departamento de Pediatría. Universidad Miguel Hernández. Alicante.
2Facultad de Medicina y Odontología. Universidad de Valencia. Valencia. España.
* Este tema fue presentado parcialmente en el IV WORK-SHOP "Probióticos, Prebióticos y Salud: Evidencia científica" que tuvo lugar en Madrid el 31 de enero de 2013.
Dirección para correspondencia
RESUMEN
Introducción: La enterocolitis necrotizante (NEC) es la urgencia abdominal adquirida más frecuente en el recién nacido y ocasiona importante morbi-mortalidad. Una estrategia preventiva es la administración de probióticos orales para la prevención de NEC en prematuros. El objetivo de este estudio es analizar la eficacia y seguridad de los probióticos orales en prematuros para intentar responder a la pregunta: probióticos orales en Neonatología, ¿sí o no?
Material y métodos: Se planteó un esquema de trabajo en base a los cinco pasos característicos de la Medicina basada en la evidencia o en pruebas científicas (MBE): 1) pregunta, 2) búsqueda, 3) valoración, 4) aplicabilidad y 5) adecuación. Las búsquedas electrónicas se realizaron en bases de datos internacionales (Tripdatabase, Cochrane Collaboration, National Guideline Clearinghouse, Guia-Salud, INHATA, Medline, SciELO) y nacionales (índice Médico Español, índice Bibliográfico Español en Ciencias de la Salud y MEDES).
Resultados: Se seleccionaron 8 revisiones sistemáticas (RS) que respondían a la pregunta clínica, publicadas entre los años 2007 y 2012, y que incluyen la mejor información disponible (como ensayos clínicos). El riesgo de muerte disminuía significativamente en los grupos de administración de probióticos en todas las RS, con un riesgo relativo (RR) entre 0,40 y 0,56. El riesgo de NEC disminuía significativamente en los grupos de administración de probióticos en todas las RS, con un RR entre 0,32 y 0,36. El riesgo de sepsis no difería significativamente entre grupos.
Conclusión: Los hallazgos de las 8 RS muestran, de forma consistente, que los probióticos orales ofrecen una prevención potencial en la morbi-mortalidad secundaria a NEC. Sin embargo, estos datos deben interpretarse con cautela dado que los efectos beneficiosos de los probióticos son específicos de cepa, por lo que, agrupar datos de diferentes cepas puede conllevar a conclusiones erróneas. Encontramos dos grupos de investigación en este campo ("yes, of course" y "no, be careful") y disponemos de pruebas suficientes que justifican la realización de un ensayo clínico definitivo que analice la eficacia y seguridad de probióticos específicos en circunstancias locales de alta incidencia de NEC grave.
Palabras clave: Eficacia. Enterocolitis necrotizante. Medicina basada en la evidencia. Prematuro. Recién nacido de bajo peso. Revisión sistemática. Seguridad.
ABSTRACT
Introduction: Necrotizing enterocolitis (NEC) is the most commonly acquired neonatal intraabdominal emergency and causes significant morbidity and mortality. A proposed strategy for the prevention of NEC in preterm infants is the administration of oral probiotics. The objective of the study is to analyze the efficacy and safety of oral probiotics in preterm infants to try to answer the following question: oral probiotics in Neonatology, yes or no?
Methodology: A scheme of work based on the five standard steps of medicine based on scientific evidence (EBM) was used: 1) question, 2) search, 3) valuation, 4) applicability and 5) adequacy. Electronic searches were performed on international (Tripdatabase, Cochrane Collaboration, National Guideline Clearinghouse, Guia-Salud, INHATA, Medline, SciELO) and national (índice Médico Español, índice Bibliográfico Español en Ciencias de la Salud y MEDES) database.
Results: we selected 8 systematic reviews (SR) that answered our clinical question, published between 2007 and 2012, and which included the best available information (randomised clinical trials). Risk of death was significantly reduced in probiotic groups in all SR, with relative risk (RR) 0,40 to 0,56. Risk of NEC was significantly reduced in probiotic groups in all SR, with RR 0,32 to 0,36. Risk of sepsis did not differ significantly between groups.
Conclusions: The findings of the 8 SR show potential prevention of oral probiotics in mortality and morbidity secondary to NEC. However, they must be interpreted with caution because the beneficial effects of probiotics seem to be strain specific, thus, pooling data from different strains may result in misleading conclusions. We found two groups of investigation in this field ("yes, of course" and "no, be careful") and there is encouraging data which justifies further and definitive clinical trial regarding the efficacy and safety of specific probiotics in circumstances of high local incidence of severe NEC.
Key words: Low birth weight. Necrotizing enterocolitis. Preterm infant. Probiotic agents. Effectiveness. Security. Systematic reviews. Evidence-based medicine.
Introducción
La microbiótica autóctona está constituida por el conjunto de microorganismos que colonizan establemente la superficie epidémica y la de las mucosas (bien del aparto genitourinario o, principalmente, del aparato digestivo)1. La microbiótica intestinal desempeña un papel clave en las salud de los individuos, con funciones como la de proteger frente a la colonización de gérmenes patógenos, regular el tránsito intestinal, conjugar los ácidos biliares y promover la circulación enterohepática, fermentar los carbohidratos no digeridos, producir vitaminas y factores de crecimiento y, por último, la maduración del sistema inmunitario2.
En la actualidad se da gran importancia a la modulación de la microbiótica intestinal mediante los alimentos funcionales. Algunos de estos alimentos tienen como constituyentes los probióticos (microorganismos vivos que administrados en cantidades adecuadas producen un efecto beneficioso en la salud y el bienestar del huésped), los prebióticos (carbohidratos no digeribles cuya ingestión induce el crecimiento de microorganismos beneficiosos) y los simbióticos (asociación de los dos anteriores)2.
Las principales especies de probióticos que se integran en alimentos son bacterias capaces de producir ácido láctico y que pertenecen a dos géneros principalmente (Lactobacillus y Bifidobacterium), pero también se emplean microorganismos no bacterianos (Saccharomyces boulardii, Streptococccus termophilus, etc.). La nomenclatura considera el género, la especie y la cepa (código alfa numérico)2. Los mecanismos de acción implicados son potenciales beneficios inmuno-lógicos y no inmunológicos en la interacción entre la microbiótica del intestino y el huésped, teniendo presente que los efectos son específicos de cepa. La comercialización de los probióticos se hace principalmente como fortificación de alimentos y dentro del Marco de la Normativa Europea sobre alimentos funcionales y condiciones de etiquetado mínimo.
Los probióticos se han utilizado en gran número de patologías pediátricas, principalmente en problemas gastrointestinales2 (Tabla I). La mayor evidencia sobre la eficacia de los probióticos ha sido descrita en el tratamiento de la diarrea infecciosa, siendo más significativo en las diarreas producidas por rotavirus y con beneficios más notables cuanto más precozmente se administraron; los probióticos con mejor resultado han sido Lactobacillus rhamnosus GG, Lactobacillus reuteri y Saccharomyces boulardii. Otras indicaciones tienen un menor nivel de evidencia o están pendientes de futuros estudios. Una de estas indicaciones es el papel de los probióticos en la enterocolitis necrotizante (NEC) del prematuro. Se constata, en un primer análisis de revisiones narrativas, que hay un gran interés en la función del sistema defensivo de la mucosas intestinal en el recién nacido3,4 y que, no está claro el papel de los probióticos en la NEC del prematuro. Aunque se constata la existencia de muchos ensayos clínicos aleatorizados (ECA) y revisiones sistemáticas (RS) con metanálisis (MA) sobre el papel favorable de los probióticos en la morbi-mortalidad en la NEC del prematuro, sigue predominando la actitud cautelosa en la introducción de probióticos en el prematuro de manera rutinaria hasta determinar mejor la seguridad, calidad, dosis y duración óptimas del tratamiento, comparación con la leche materna exclusiva y evaluar los efectos a largo plazo2,4.
Por ello, en este artículo hemos planteado los siguientes objetivos: 1) como objetivo general, Intentar ofrecer niveles de evidencia y grados de recomendación a la pregunta clínica: ¿son útiles los probióticos en la NEC del prematuro? y ¿se emplean los probióticos que han demostrados su eficacia y de modo adecuado?; y 2) como objetivos específicos, intentar ofrecer recomendaciones para la práctica clínica y para la investigación. Para ello, utilizamos la sistemática de trabajo de la medicina basada en la evidencia, entendiendo como tal el paradigma científico que intenta resolver de la mejor forma posible la ecuación entre lo "deseable, lo posible y lo apropiado" en un entorno sembrado de incertidumbre, variabilidad en la práctica clínica, sobrecarga de información, aumento de demanda y limitación de recursos.
Material y métodos
Se planteó un esquema de trabajo en base a los cinco pasos característicos de la Medicina basada en la evidencia o en pruebas científicas (MBE): 1) pregunta, 2) búsqueda, 3) valoración, 4) aplicabilidad y 5) adecuación.
1. Pregunta clínica estructurada: los componentes PEcOt (Paciente-Exposición-comparación-Out-come-tiempo), incluyen tres componentes fundamentales (P, E y O) y dos secundarios (c y t). En el tema que nos corresponde, los componentes se han desgranado con las siguientes peculiaridades en la literatura científica:
- Pacientes: prematuro menor de 1.500 gramos y/o menor de 32 semanas de gestación. Dentro de este grupo de prematuridad cabe considerar dos grupos diferenciales: los menores de 1.500 gramos y los menores de 1.000 gramos.
- Exposición o intervención a evaluar: probióticos. En este apartado de los probióticos cabe considerar tres preguntas de potencial interés: ¿qué tipo?, ¿a qué dosis? y ¿cuándo y cuánto tiempo?
- Comparación: no probióticos.
- Outcome o variable de medición de resultado: muerte y NEC grave como variables principales "fuertes" dentro de la consideración de GRADE (Grading of Recommendations Assessment, Development and Evaluation)5; también se consideraron otras variables como sepsis y tolerancia digestiva. En cualquier caso, las variables se pueden considerar a corto plazo (muerte -de forma global o por NEC-, NEC -no grave o grave-, tolerancia digestiva, sepsis) o a largo plazo (alteraciones inmunológicas o alteraciones del neuro-desarrollo en el seguimiento tras el alta).
- Tiempo: la valoración puede ser a corto plazo (durante su ingreso en la Unidad de Cuidados Intensivos Neonatales) o a medio-largo plazo (en la etapa de lactante y escolar, y posterior).
Con estos componentes, la pregunta clínica estructurada fue: "¿En prematuros con riesgo de NEC, los pro-bióticos son efectivos y seguros para mejorar el pronóstico en términos de morbi-mortalidad?".
2. Búsqueda sistemática de la literatura: para responder a la pregunta se utilizaron las palabras clave de la pregunta clínica estructurada (P, E y O), así como el diseño de los estudios. Los diseños principales fueron ensayos clínicos (aleatorizados y casi aleatorizados) y RS con o sin MA, aunque también se consideraron otros tipos de estudios de potencial interés (editoriales, artículos de opinión, etc.).
Se realizó la revisión de la literatura en fuentes de información terciarias (TRIPdatabase, Cochrane Database of Systematic Reviews, National Guideline Clearinghouse, GuiaSalud, INHATA), secundarias (las bases de datos PubMed, SciELO, Índice Médico Español, Índice Bibliográfico Español en Ciencias de la Salud y MEDES) y primarias (búsqueda inversa a partir de las referencias bibliográficas de los estudios identificados o de estudios conocidos por los miembros del grupo) durante el mes de enero de 2013, sin restricción idiomática ni temporal (aunque dimos especial valor a las publicaciones de los últimos 5 años). Utilizamos las siguientes palabras clave para paciente (infant, preterm OR infant, low birthweight), exposición (probiotics) y variable de medición de resultado (death OR enterocolitis, necrotizing OR sepsis), combinados con los correspondientes términos booleanos y adaptado a cada base de datos.
3. Lectura y valoración crítica de los artículos seleccionados: en esta valoración hemos analizado las características principales de los estudios (población, intervención, comparación, variables de interés y resultados principales), su validez científica y su importancia clínica.
Para ello utilizamos cinco tipos de recursos: 1) los fundamentos metodológicos del Grupo de Trabajo de Pediatría Basada en la Evidencia (GT-PBE) de la Asociación Española de Pediatría6; 2) las plantillas de lectura crítica del Critical Appraisal Skills Programme Español (CASPe)7; 3) las listas de comprobación de EQUATOR8 (principalmente para ensayos clínicos -CONSORT9 -, para RS con o sin MA -PRISMA10 - y para estudios observacionales -STROBE11-); 4) las herramientas de valoración del Generic Appraisal Tool for Epidemiology (GATE)12; y 5) el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) para clasificar los niveles de evidencia y grados de recomendación5.
4. Aplicabilidad en la práctica clínica: aspecto clave y final de la valoración crítica. La aplicabilidad de cada estudio está condicionado por sus elementos básicos: población, exposición, comparación, outcomes (efectos o resultados) y tiempo de seguimiento (PEcOt).
El interés principal de la lectura crítica se fundamenta en tres puntos: 1) estudiar las fortalezas y limitaciones de los estudios, así como detectar los errores aleatorios (por azar) y sistemáticos (o sesgos), para conocer mejor la validez interna y externa de los estudios; 2) analizar la importancia clínica de los resultados, más que su significación estadística. La importancia clínica se relaciona con el balance entre beneficios, riesgos y costes, así como por la aceptabilidad de la población (niños prematuros y padres); 3) clasificar los niveles de evidencias y los grados de recomendación según GRADE.
5. Adecuación de la evidencia científica a la práctica clínica: es el objetivo final de la actividad médica, en este caso aplicado al uso de probióticos en los niños prematuros con riesgo de NEC (principalmente los menores de 1.500 gramos). Y esto implica el camino de pasar del conocimiento a la acción, lo que conlleva filtrar del conocimiento accesible, aquél encontrado y, tras aplicar el método de la MBE, conservar el conocimiento válido, importante, aplicable, aceptado y útil.
Resultados
La revisión sistemática de la literatura nos permitió localizar dos grupos de investigación principales en el tema que plantea la pregunta clínica estructurada:
- El grupo de Perth (Australia) liderado por G. Deshpande y colaboradores: realizaron una revisión sistemática específica publicada en Lancet en el año 200713, y una actualización en el año 2010 publicada en Pediatrics14.
- El grupo de Riyadh (Arabia Saudí) liderado por K AlFaleh y colaboradores: la revisión sistemática publicada en el año 2008 en Colaboración Cochrane15 y su actualización en el año 201116.
Pero, además de estas cuatro RS (con MA) pudimos localizar otras 4 RS más: las publicadas por Barclay y colaboradores en el año 2007 en Journal of Pediatric Gastroenterology and Nutrition17, Szajewska y colaboradores en el año 2010 en Journal of Pediatric Gastro-enterology and Nutrition18, Mihatsch y colaboradores en el año 2012 en Clinical Nutrition19 y Wang y colaboradores en el año 2012 en Journal of Pediatric Surgery20.
Es decir, en estas 8 RS (con MA) se localiza la esencia de la mejor literatura científica (ECA) para responder a una pregunta clínica sobre intervenciones terapéuticas, y, además, es una información actualizada que se concentra en los últimos 5 años.
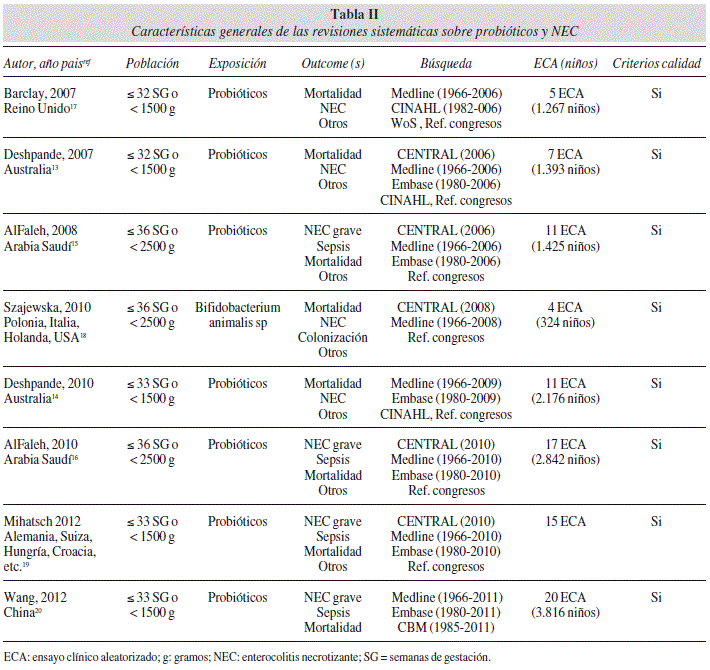
En la tabla II se describen las características principales de estas RS: autor, año, población, intervención, variables de interés, número y tipos de artículo, criterios de búsqueda y extracción de datos y resultados principales.
Las RS fueron realizadas por autores de Australia13,14, Arabia Saudí15,16, Reino Unido17, China20, y otras dos fueron estudios multinacionales18,19.
La población de estudio de los RN prematuros oscilaban entre ≤ 32-33 semanas13,14,17,19,20 y < 36 semanas de gestación15,16,18, y con peso que oscilaba entre < 1.500 gramos13,14,17,19,20 y < 2.500 gramos15,16,18. En todos los estudios la exposición se realizaba con probióticos diversos (distinto género, especie y cepa), salvo la RS de Szajewska y cols que se plantea sólo con Bifidobacterium animalis subsp lactis18. Como variables principales de interés en todos las RS se incluyeron mortalidad y NEC (en la mayoría especificada como NEC grave); otras variables de estudio fueron consideradas en algunas RS, principalmente sepsis15,16,17,19,20.
La búsqueda de información se especificó muy correctamente en todas las RS. En la mayoría de los casos las bases bibliográficas revisadas fueron Medline, Embase y Cochrane Library (a través de CENTRAL), si bien en algún caso se amplió la búsqueda a CINHAL, Web of Science y a referencias de congresos. El periodo de búsqueda comprendía desde los inicios de las bases de datos (1966 en Medline, 1980 en Embase, etc.) hasta el momento del estudio en sí, que por orden cronológico se limitaba hasta 2006 en la RS de Barclay y cols.17 y hasta 2011 en la RS de Wang y cols.20.
Los tipos de estudios incluidos en las RS fueron ECA en todas ellas, apreciando un aumento del número de ECA (y de niños prematuros de los estudios) a medida que se incrementaban los años de publicación: la primera RS17 incorpora 5 ECA (con 1.267 pretérminos) y la última RS20 incorpora 20 ECA (con 3.816 prematuros). Se especificó o describió la calidad de los ECA incluidos en todas las RS.
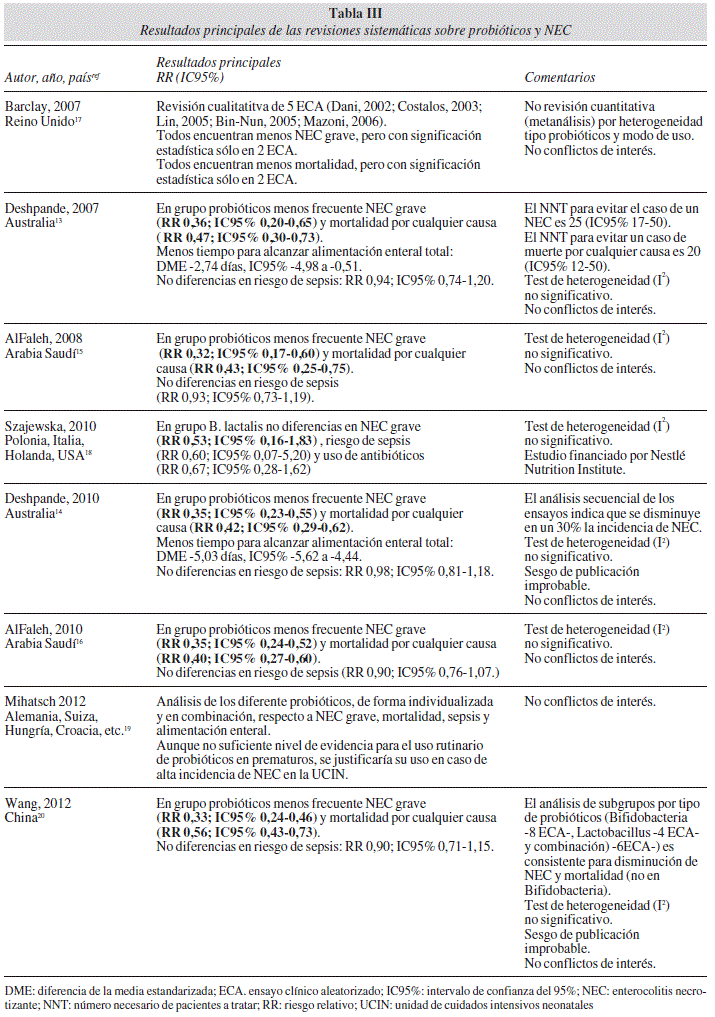
En la tabla III se expresan los resultados principales de eficacia y efectividad (con sus intervalos de confianza al 95%) de estas 8 RS, destacando los datos que se refieren a mortalidad y NEC grave, con algunos comentarios asociados. Cabe destacar que en todas las RS los resultados son consistentes y homogéneos en cuanto a la reducción significativa de mortalidad y de NEC grave en prematuros con el uso de probióticos, salvo la RS inicial de Barclay y cols.17 que sólo planteó una revisión cualitativa (y en el que los 5 ECA incluidos encuentran menos mortalidad y NEC grave, pero con significación estadística sólo en dos).
En las RS en que se estudia la mortalidad, la reducción de la misma presenta un riesgo relativo (RR) que oscila en un estrecho margen entre 0,4016 y 0,5620, con un intervalo de confianza (IC95%) que se va estrechando, como corresponde a la mayor precisión que se obtiene al sumar ECA al conjunto del MA: entre 0,300,73 en la RS inicial de Desphande y cols.13 y entre 0,43-0,73 en la RS final de Wang y cols20.
En las RS con probióticos varios la reducción de NEC grave presenta un RR que oscila en un estrecho margen entre 0,3215 y 0,3613, con un IC95% que se va estrechando entre 0,20-0,65 en la RS inicial de Desp-hande y cols.13 y entre 0,24-0,46 en la RS final de Wang y cols.20. En la RS de Szajewska y cols.18, solo con Bifidobacterium animalis subsp lactis no encuentran diferencias en NEC grave (RR 0,53; IC95% 0,16-1,83).
En el estudio cualitativo de todas las RS se considera que la prueba de heterogeneidad (medida por I2) es no significativa, que el sesgo de publicación es improbable y que no existe ningún potencial conflicto de interés. Y en la última RS que disponemos20, se realiza un análisis de subgrupos por tipo de probióticos (Bifidobacterium -8 ECA-, Lactobacillus -4 ECA- y combinación -6 ECA-) con resultados consistentes, tanto para disminución de NEC grave como en mortalidad (en este último caso, no en Bifidobacterium).
Discusión
Aunque todas las RS siguen los principios de la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) y metodología de Cochrane Collaboration para este tipo de estudios, es posible identificar en ellas fortalezas y limitaciones. Y de estas fortalezas y limitaciones surgen dos grupos principales de opiniones respecto al estado actual del uso de probióticos en prematuros para la prevención de la morbi-mortalidad por NEC: los grupos de Desphane y cols.13,14,21 y AlFaleh y cols.15,16,22 apoyan el planteamiento de su uso (sería el grupo "yes, of course") y otros autores, como Mihatsch y cols.2,23 y Millar y cols.24 no apoyan su uso rutinario de momento (sería el grupo "no, be careful").
Las fortalezas de las actuales RS (que sintetizan las mejores pruebas científicas para responder a la pregunta clínica de nuestro estudio, en forma de ECA) son:
- Toda la literatura es consistente en que los probióticos disminuyen la incidencia de NEC grave y de mortalidad en prematuros (< 1.500 gramos o < 2.500 gramos).
- Se ofrecen resultados estadísticamente significativos y clínicamente importantes (disminución de mortalidad alrededor de la mitad y disminución de NEC grave alrededor de dos tercios), lo que implica considerar fuertemente la recomendación de su uso habitual de probiótico en las UCI neonatales.
- Las RS son de buena calidad y rigurosas, sin heterogeneidad significativa, con improbable sesgo de publicación y sin ningún potencial conflicto de interés.
- Existen preocupaciones sensatas (principalmente en relación con infecciones asociadas al uso de probióticos), aunque con escasas pruebas que lo soporten, sobre la seguridad y efectos a largo plazo de los probióticos.
- El uso "rutinario" de probióticos no significa el uso "ciego" de los mismos, sino que se debe monitorizar (práctica ya realizada en algún país).
Las limitaciones de las actuales RS son:
- El tratamiento con probióticos no es una intervención homogénea, y es conocido que se debe considerar un efecto dependiente del tipo de género, especie y cepa. Por tanto, los MA actuales podrían sobreestimar el efecto particular de cada cepa de probiótico particular.
- No existe un control claro del tipo de alimentación del prematuro. Y, dado que la leche materna contiene probióticos, pero no así la leche humana donada ni la mayoría de fórmulas para prematuros, este puede considerarse un factor de confusión de interés si no se tiene en cuenta.
- Los datos actuales deben ser confirmados con un ECA multicéntrico de calidad con diseño adecuado para un tipo concreto de probiótico, dosis, intervalo y duración del tratamiento.
Y, en base a estas conclusiones, y en el tema y pregunta planteada sobre la evidencia científica del uso de probióticos en prematuros, cabe plantear las siguientes recomendaciones:
1) Recomendaciones para la práctica clínica:
- El uso de probióticos debería considerarse fuertemente en el cuidado del prematuro < 32 semanas de gestación y/o < 1500 gramos.
- Aunque el balance beneficios-riesgos-costes es claramente favorable con los datos actuales, el uso rutinario de probióticos implicaría una estrecha monitorización.
- En base a los ECA realizados hasta la fecha, es posible dar las siguientes recomendaciones en cuanto a tipo de cepa, dosis, inicio y duración:
• ¿Qué cepa?: preferible una combinación de Bifidobacterium y Lactobacillus.
• ¿Qué dosis?: 3 x109 UFC/día, preferible en dosis única. En < 1000 gramos comenzar con 1,5x108 UFC/día hasta alcanzar enteral de 50 ml/kg/día.
• ¿Cuándo comenzar?: cuando pueda iniciar alimentación enteral, preferible en los primeros 7 días de vida.
• ¿Hasta cuándo continuar?: hasta las 35 semanas de edad postconcepcional o hasta el alta.
• ¿Alguna precaución?: no ofrecer el suplemento con probióticos si enfermedad aguda tipo sepsis, NEC o asfixia perinatal.
2) Recomendaciones para la investigación:
- Se debe plantear un ECA multicéntrico con suficiente poder estadístico: para una incidencia de NEC de un 5%, en un ensayo doble ciego controlado (α = 5%, β = 20%), se requerirían 317 prematuros en cada rama para demostrar que los probióticos disminuyen incidencia de NEC al menos un 50%.
- Para ese ECA, se debe seleccionar una cepa de probiótico, dosis, comienzo y duración de ECA previamente realizados y con buen resultado en prematuros < 1.500 gramos. También es importante considera el tipo de alimentación del prematuro: leche materna, leche materna donada o fórmula para prematuros.
- En estos momentos en que todos los MA son consistentes en la buena relación beneficios-riesgos de los probióticos en prematuros, es necesario un ECA independiente y de calidad que confirme los resultados y evite los potenciales sesgos de los MA actuales. A la clásica pregunta en MBE de que qué es mejor, una RS con MA o un gran ECA, en el momento actual y con los datos actuales la respuesta es clara: un ECA como el que exponemos y que resuelva las dudas que van a seguir repitiéndose si se realizan nuevas RS.
A la luz de estos resultados y en base al paradigma de la MBE, en el modelo actual de toma de decisiones también hay que considerar el estado clínico del paciente y otras circunstancias, las preferencias y acciones de los pacientes y, especialmente, la experiencia clínica. A esto hay que añadir la bioética aplicada a la asistencia, cuyos principios son: no maleficiencia, justicia, beneficencia y autonomía. Para responder a la pregunta sobre el uso de probióticos en prematuros debemos considerar, además, un doble triángulo en nuestra decisión: el triángulo beneficios-riesgos-costes y el triángulo médico-pacientes industria farmacéutica. No es de extrañar que, con la prudencia en que se toman decisiones en Neonatología, y pese a las pruebas científicas analizadas, siga el debate entre los dos grupos (que hemos denominado como "Yes, of course" y "No, be careful").
Sin embargo, en nuestra opinión, los resultados de esta revisión sistemática de la literatura aportan una calidad de evidencia moderada a alta, con un resultado importante de reducción del riesgo tanto para NEC como para muerte por cualquier causa en recién nacidos prematuros. Existen preocupaciones válidas, aunque con escasa evidencia que las soporte, de seguridad y efectos a largo plazo. En cualquier caso, comparando el uso de probióticos con otras intervenciones comunes en Neonatología con balances beneficio-riesgo-costes menos favorables (por ejemplo, palivizumab para prevención de bronquiolitis25, hipotermia para encefalopatía hipóxicaisquémica26) el cambio en la práctica debe considerarse. Aún se necesitan más estudios para determinar dosis, formulación más efectiva y efecto en la población de prematuros con extremo bajo peso al nacer (< 1.000 g), así como estudios económicos para determinar su coste-efectividad en los sistemas de salud. No obstante, con la evidencia actual, consideramos que se deber considerar fuertemente el uso habitual de probióticos en cualquier Unidad de Cuidados Intensivos Neonatales.
Y finalizamos con una triple reflexión, ya expuesta en el IV Workshop "Probióticos, Prebióticos y Salud: Evidencia científica" que tuvo lugar en Madrid el 31 de enero de 2013:
1) Probióticos y prematuros: to NEC or not to NEC? Nos viene a indicar la especial diatriba que se establece entre los partidarios ("yes, of course") y los no partidarios ("no, be careful") al uso sistemático de probióticos orales en el prematuro (principalmente en menores de 1.500 gramos).
2) ¿Y si en lugar de "probiótico" se llamará "probiotico zumab"? Hace alusión a lo comentado previamente sobre que intervenciones con menor fuerza de la recomendación (con pocos ensayos clínicos y con resultados con menos importancia clínica) se usan de forma generalizada. Y es que, aunque parezca una paradoja, lo peor que le puede pasar a un producto, en ocasiones, es que sea barato. Posiblemente si en lugar de un probiótico estuviéramos hablando de un anticuerpo monoclonal, de otra reflexión hablaríamos, pues es conocido el aforismo de que "la evidencia es más evidente cuando interesa a la industria farmacéutica que al paciente".
3) ¿Cuántas pruebas científicas más son necesarias para salvar vidas?. La historia de la Neonatología está llena de errores por acción (precipitada), pero también por errores por omisión (y retraso en aplicación de intervenciones beneficiosas).
Así pues, y como otros autores ya han expuesto sobre el tema de probióticos en el prematuro, cabe preguntarse "where are we?, where are we going?"27.
Agradecimiento
Al Dr. José Manuel Moreno Villares, gastroenterólogo del Hospital 12 de Octubre (Madrid) por la lectura crítica y comentarios vertidos a nuestro artículo.
Referencias
1. Suárez J. Microbiota autóctona, probióticos y prebióticos. Nutr Hosp 2013; 28 (Supl. 1): 38-41. [ Links ]
2. Román Riechmann E, Álvarez Calatayud G. Empleo de probióticos y prebióticos en pediatría. Nutr Hosp 2013; 28 (Supl. 1): 42-5. [ Links ]
3. Neu J, Mihatsch WA, Zegarra J, Supapannnachrt S, Ding ZY, Murguía-Peniche T. Intestinal mucosa defense system, Part 1. Consensus recommendations for immunonutrients. J Pediatr 2013; 162 (Supl.1): S56-S63. [ Links ]
4. Murguía-Peniche T, Mihatsch WA, Zegarra J, Supapannnachrt S, Ding ZY, Neu J. Intestinal mucosa defense system, Part21. Probiotics and prebiotics. J Pediatr 2013; 162 (Supl.1): S64-S71. [ Links ]
5. Martín Muñoz M, González de Dios J. Valoración de la calidad de la evidencia y fuerza de las recomendaciones (I). El sistema GRADE. Evid Pediatr 2010; 6: 63. [ Links ]
6. Buñuel Álavrez, González de Dios J, González Rodríguez P. Bienvenidos a Evidencias en Pediatría. Evid Pediatr 2005; 1: 1. [ Links ]
7. González de Dios J, Buñuel Álvarez JC, Ochoa Sangrador C. La valoración crítica de documentos científicos y su aplicabilidad a la práctica clínica: aspecto clave en la toma de decisiones basada en las mejores pruebas científicas. Evid Pediatr. 2006; 2: 37. [ Links ]
8. González de Dios J, Buñuel Álvarez JC, González Rodríguez P. Listas guía de comprobación de artículos científicos y la red EQUATOR. Evid Pediatr 2011; 7: 47. [ Links ]
9. González de Dios J, Buñuel Álvarez JC, González Rodríguez P. Listas guía de comprobación de ensayos clínicos: declaración CONSORT. Evid Pediatr 2011; 7: 72. [ Links ]
10. González de Dios J, Buñuel Álvarez JC, Aparicio Rodrigo M. Listas guía de comprobación de revisiones sistemáticas y meta-análisis: declaración PRISMA. Evid Pediatr 2011; 7: 97. [ Links ]
11. González de Dios J, Buñuel Álvarez JC, González Rodríguez P. Lista de comprobación de estudios observacionales: declaración STROBE. Evid Pediatr 2012; 8: 65. [ Links ]
12. Jackson R, Ameratunga S, Broad J, Connor J, Lethaby A, Robb G, et al. The GATE frame: critical appraisal with pictures. Evid Based Med 2006; 11: 35-8. [ Links ]
13. Deshpande G, Rao S, Patole S. Probiotics for prevention of necrotising enterocolitis in preterm neonates with very low birthweight: a systematic review of randomised controlled trials. Lancet 2007; 369: 1614-20. [ Links ]
14. Deshpande G, Rao S, Patole S, Bulsara M. Updated meta-analysis of probiotics for preventing necrotizing enterocolitis in preterm neonates. Pediatrics 2010; 125: 921-30. [ Links ]
15. Alfaleh K, Bassler D. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev 2008; (1): CD005496. [ Links ]
16. Alfaleh K, Anabrees J, Bassler D, Al-Kharfi T. Probiotics for prevention of necrotizing enterocolitis in preterm infants. Cochrane Database Syst Rev 2011; (3): CD005496. [ Links ]
17. Barclay AR, Stenson B, Simpson JH, Weaver LT, Wilson DC. Probiotics for necrotizing enterocolitis: a systematic review. J Pediatr Gastroenterol Nutr 2007; 45: 569-76. [ Links ]
18. Szajewska H, Guandalini S, Morelli L, Van Goudoever JB, Walker A. Effect of Bifidobacterium animalis subsp lactis supplementation in preterm infants: a systematic review of randomized controlled trials. J Pediatr Gastroenterol Nutr 2010; 51: 203-9. [ Links ]
19. Mihatsch WA, Braegger CP, Decsi T, Kolacek S, Lanzinger H, Mayer B, et al. Critical systematic review of the level of evidence for routine use of probiotics for reduction of mortality and prevention of necrotizing enterocolitis and sepsis in pre-term infants. Clin Nutr 2012; 31: 6-15. [ Links ]
20. Wang Q, Dong J, Zhu Y. Probiotic supplement reduces risk of necrotizing enterocolitis and mortality in preterm very low-birth-weight infants: an updated meta-analysis of 20 randomized, controlled trials. J Pediatr Surg 2012; 47: 241-8. [ Links ]
21. Deshpande GC, Rao SC, Keil AD, Patole SK. Evidence-based guidelines for use of probiotics in preterm neonates. BMC Med 2011; 9: 92. [ Links ]
22. Alfaleh K, Anabrees J, Bassler D. Probiotics reduce the risk of necrotizing enterocolitis in preterm infants: a meta-analysis. Neonatology 2010; 97: 93-9. [ Links ]
23. Mihatsch WA.What is the power of evidence recommending routine probiotics for necrotizing enterocolitis prevention in preterm infants? Curr Opin Clin Nutr Metab Care 2011; 14: 302-6. [ Links ]
24. Millar M, Wilks M, Fleming P, Costeloe K. Should the use of probiotics in the preterm be routine? Arch Dis Child Fetal Neonatal Ed 2012; 97: F70-4. [ Links ]
25. González de Dios J, Ochoa Sangrador C. Palivizumab y bronquiolitis: necesidad de aplicar la eficiencia para adecuar la práctica clínica a las pruebas científicas. Med Clin (Barc) 2005; 124: 478-9. [ Links ]
26. García-Alix A, González de Dios J. La encefalopatía hipóxicoisquémica en el recién nacido a término ha dejado de ser una entidad huérfana de intervención terapéutica. Implicaciones para la práctica y necesidad de un "código hipotermia". Evid Pediatr 2009; 6: 27. [ Links ]
27. Szajewska H. Probiotics and prebiotics in preterm infants: Where are we? Where are we going? Early Hum Dev 2010; 86 (Supl. 1): 81-6. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Javier González de Dios.
Prof. Manuel Sala, 6 - 3.o A.
03000 Alicante.
E-mail: javier.gonzalezdedios@gmail.com
Recibido: 14-VIII-2013.
Aceptado: 18-IX-2013.