My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.30 n.2 Madrid Aug. 2014
https://dx.doi.org/10.3305/nh.2014.30.2.7604
ORIGINAL / Alimentos funcionales
Efecto sobre el neurodesarrollo y neuroprotección en pez cebra de un extracto polifenólico de huesos de aceituna
Effect on zebrafish neurodevelopment and neuroprotection of a polyphenolic extract olive seeds
Ernesto Cortés Castell1, C. Veciana Galindo2, L. Torro Montell2, E. Sirvent Segura2, M. M. Rizo Baeza3 y V. Gil Guillén4
1Departamento de Farmacología, Pediatría y Q. Orgánica. Universidad Miguel Hernández. Campus de San Juan. Alicante. España.
2Laboratorio de Biotecnología y Proyectos. Biopartner S.L.
3Departamento de Enfermería y Nutrición. Universidad de Alicante.
4Departamento de Medicina Clínica. Universidad Miguel Hernández. España.
Dirección para correspondencia
RESUMEN
Objetivo: Determinar el efecto de un extracto polifenólico de hueso de oliva en el desarrollo del sistema nervioso y frente al daño inducido mediante la neurotoxina ácido kaínico, utilizando como modelo animal el pez cebra.
Material y métodos: Se analiza el efecto del extracto a la máxima dosis tolerada (100 mg/ml de polifenoles) sobre la actividad colinèrgica en larvas de pez cebra (72 horas post-fertilización). Se utilizan únicamente huevos fecundados sin anomalías. Se incuban 6 huevos/pocillo en microplaca de 24 pocillos en 2 ml de agua con DMSO (0,1%) a 26 ± 1o C: a) neurodesarrollo: agua (control) y con 100 mg/ml de extracto, como ensayo; b) neuroprotección: agua y ácido kaínico (100 μM) (control) y con 100 mg/ml de extracto (ensayo). Todas las incubaciones por triplicado. A las 72 h se examinan y verifica ausencia de anomalías. Las larvas se homogeneizan y en los sobrenadantes se cuantifica actividad acetilnolinesterasa y concentración proteínas.
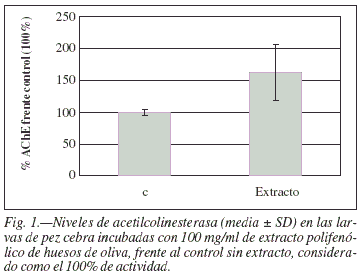
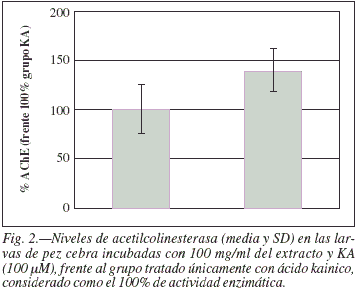
Resultados: La cantidad de proteína y apreciación morfológica es análoga en todos los ensayos, indicando mismo desarrollo. La acetilcolinesterasa en las larvas de pez, con el extracto polifenólico es del 162,2%(SD 44,2) respecto a controles (100% de actividad) (p < 0,01). Las larvas de pez tratadas con ácido kaínico y extracto polifenólico presentan el 140,1% (SD 22,0) de actividad, respecto a las incubadas únicamente con la neurotoxina (100%) (p < 0,05).
Conclusión: Los polifenoles extraídos de los huesos de aceituna producen incremento de actividad colinèrgica durante el neurodesarrollo larvario en el pez cebra y protección frente a la neurotoxina ácido kaínico.
Palabras clave: Polifenoles. Hueso oliva. Acetilcolinesterasa. Ácido kaínico. Pez cebra.
ABSTRACT
Objective: To determine the effect of a polyphenolic extract from olive pit on the development of the nervous system as well as its effect on pain induced by the neurotoxin kainic acid, taking the zebrafish as the animal model.
Material and methods: We analyse the effect of the extract at the maximum tolerated dose (100 mg/ml of polyphenols) on the cholinergic activity in zebrafish larvae (72 hours post-fertilization). Only fecundated eggs with no abnormalities are used. 6 eggs/bowl are incubated in a 24 bowls microplate in 2 ml of water with DMSO (0.1%) at 26 ± 1o C: a) neurodevelopment: water (control) and 100 mg/ml of extract, as an essay; b) neuroprotection: water and kainic acid (100 μM) (control) and 100 mg/ml of extract (essay). All incubations are in triplicate. After 72 h, incubations are examined and checked for any abnormalities. Larvae are homogenized and acetyl cholinesterase activity and protein concentration in supernatants is quantified.
Results: The quantity of protein and the morphologic appreciation is similar in all the essays, showing a standard development. Acetyl cholinesterase in fish larvae, with the polyphenolic extract is 162.2% (SD 44.2) compared to controls (100% of activity) (p < 0.01). Fish larvae treated with kainic acid and polyphenolic acid show 140.1% (SD 22.0) of activity, compared to those only incubated with the neurotoxin (100%) (p < 0.05).
Conclusion: Polyphenols extracted from olive pit produce an increase in the cholinergic activity during the larvae neurodevelopment in the zebrafish as well as protection against the neurotoxin kainic acid.
Key words: Polyphenols. Olive pit. Acetyl cholinesterase. Kainic acid. Zebrafish.
Introducción
Hace tiempo que se conoce que la ingesta de determinados nutrientes puede influir sobre determinadas funciones cerebrales, de forma decisiva durante el desarrollo perinatal, pero también en otras etapas de la vida, como en la etapa adulta y la tercera edad. De hecho, recientemente se ha demostrado la existencia de una programación fetal o neonatal de la salud en la etapa adulta, lo que implica que nunca se deben considerar las distintas etapas fisiológicas de forma aislada, sino relacionadas. Entre estos nutrientes están los ácidos grasos poliinsaturados n-3 (DHA) y compuestos antioxidantes naturales como los polifenoles, siendo importantes para la formación y desarrollo de las neuronas y otras células del SNC, pero también son claves en los adultos para la prevención de enfermedades neurodegenerativas. Diversos estudios realizados in vitro, en modelos animales y en humanos han demostrado que la suplementación con estos nutrientes se asocia a una mejora de la función cognitiva, que se refleja en una mejora del proceso de aprendizaje o la memoria en niños o a una prevención del declive en personas de la tercera edad.
Estos conocimientos han despertado un creciente interés por nuevos alimentos ricos en sustancias con capacidad neuroprotectora, que puedan contribuir a prevenir la incidencia de factores degenerativos desde la infancia y mitigar el impacto de enfermedades de carácter neurodegenerativo, que presentan un creciente índice de prevalencia en la edad madura.
Diversos mecanismos de acción se han propuesto para explicar la capacidad neuroprotectora de estas sustancias, entre ellos la acción antiinflamatoria, la modulación de vías de señalización intracelular, la modulación de la expresión de proteínas, la inhibición de las vías apoptóticas o la acción antioxidante1.
Los antioxidantes pueden anular los efectos perjudiciales de los radicales libres en las células2, así una dieta abundante en frutas y vegetales ricos en polifenoles y antocianinas proporciona un riesgo más bajo de contraer cáncer, enfermedades cardíacas y algunas enfermedades neurológicas3. Sugiriéndose que los compuestos presentes en estos alimentos pueden prevenir la neurodegeneración causada por el estrés oxidativo4.
Los estudios realizados sobre el desarrollo del SNC del pez cebra5 indican que a las 24 horas ya se aprecia la segmentación del cerebro y se han formado estructuras como el tubo neural, la notocorda y los somitos (precursores de músculo y esqueleto). A los cinco días de desarrollo se han formado órganos sensoriales como los ojos y los oídos. Asimismo, ha aparecido el corazón, el hígado, los riñones y el páncreas, además de que los sistemas circulatorio, digestivo y nervioso son perfectamente funcionales. En este momento el pez es capaz de responder a estímulos visuales, olfativos y mecánicos y comienza a nadar buscando alimento.
El objetivo es determinar el efecto de la suplementación de un extracto polifenólico de hueso de oliva en fenómenos de neuroprotección frente a daño inducido mediante la neurotoxina ácido kaínico (KA) y su influencia en el desarrollo del sistema nervioso central (SNC), utilizando como modelo animal el pez cebra.
Material y métodos
Se ha utilizado como modelo experimental la larva de pez cebra (Danio rerio), analizando el efecto de la suplementación del extracto a la máxima dosis tolerada (MTD)de 100 mg/ml de polifenoles en larvas de 72 horas post-fertilización (hpf)6. El efecto sobre el neurodesarrollo se realiza mediante el cultivo de los huevos en presencia del extracto. El efecto neuroprotector del extracto se determina frente a una pérdida controlada de neuronas colinérgicas. Como marcador del estado general del sistema nerviosos central, en ambos casos, se utiliza la actividad colinérgica.
Para la realización de los ensayos fueron utilizados únicamente aquellos huevos fecundados que no presentaron ningún tipo de anomalía externa (asimetrías, vesículas,..) o cuya membrana estaba dañada. Se transfirieron 6 huevos/pocillo a una microplaca de 24 pocillos en un volumen de 2 ml con los siguientes tratamientos:
Neurodesarrollo: Para analizar el posible efecto sobre el neurodesarrollo se incubaron los huevos en agua con DMSO (0,1%)(Sigma-Aldrich) y en este mismo medio adicionado con 100 mg/ml del extracto de polifenoles, a 26 ± 1o C durante 72 h.
Neuroprotección: Se utilizó el ácido kaínico como neurotoxina inductora de daño neuronal. Se incubaron los huevos en agua con DMSO (0,1%) y ácido kaínico (100 μM) y el mismo medio con KA y 100 mg/ml del extracto, a 26 ± 1o C durante 72 h. Transcurrido este tiempo, se examinaron las larvas determinando que el estado general de las mismas era correcto, sin ningún tipo de anomalías externas visibles. Todas las incubaciones se realizaron por triplicado.
Una vez finalizada la incubación y su control se cuantifico la actividad de acetilcolinesterasa (AchE) mediante el método Ellman modificado7. Se homogeneizaron mecánicamente las larvas, se centrifugo a 12.000 rpm durante 10 minutos y se midieron los niveles de AChE en cada muestra. El método está basado en la hidrólisis enzimática del sustrato acetiltiocolina ATCh, y la tiocolina liberada reacciona con el ácido 5,5'-ditiobis-2-nitrobenzoico (DNTB), dando lugar al ácido 5-tio-2-nitrobenzoico, compuesto de color amarillo con máximo de absorbancia entre 405 y 420 nm. de onda. La reacción se llevo a cabo añadiendo a cada pocillo de la microplaca 280 l de DTNB en buffer PBS 0.1M (pH 7,8), 10 μl del extracto enzimático (homogeneizado), iniciándose la reacción al agregar 10 μl de cloruro de acetiltiocolina. Inmediatamente, en un lector de microplacas se hicieron las lecturas de absorbancia. Se realizaron tres replicados y como blancos se utilizaron 3 pocillos por microplaca sustituyendo el homogeneizado por buffer. Se realizó la recta de calibrado con 7 patrones entre 0-400 mU/ml de AChE, rindiendo una recta de r2 = 0,9735 y de ecuación: AChe (mU/ml) = 116 x Abs420nm.
Adicionalmente, se llevó a cabo la determinación de proteína total de cada grupo experimental con BCA8, para normalizar el efecto de los niveles de AchE con los niveles de proteína. El método de BCA emplea el ácido bicinconínico capaz de formar un complejo púrpura intenso con los iones Cu+ en medio alcalino que tiene lectura de absorbancia a 562 nm. Se añaden 100 μl de BCA a 10μl de muestra, se incuban 10 minutos a 60o C y se lee la absorbancia a 562nm. Se realizó la recta de calibrado con 10 patrones entre 0-1600 μg/ml, dando una recta de r2 = 0,9942 y de ecuación: proteína (μg/ml) = 749 x Abs562nm.
Resultados
La cantidad de proteína es análoga en todos los homogeneizados de las larvas de pez, siendo una buena medida del tamaño de las mismas y no constatándose diferencias ni efectos en los distintos medios de cultivo, al igual que la apreciación visual, sin alteraciones morfológicas visibles ni por acción del extracto de huesos de oliva, ni por el ácido kaínico.
a) Neurodesarrollo: Los niveles de acetilcolinesterasa en las larvas de pez cebra a las 72 hpf, en el medio de incubación con extracto de huesos de oliva ha sido del 162,2% (SD 44,2) frente a los controles únicamente con el agua con DMSO considerados el 100% de actividad, diferencia que es significativa según el test de Dunnett (p < 0,01). Esta diferencia se ilustra en la figura 1.
b) Neuroprotección: La actividad de acetilcolinesterasa en las larvas de pez cebra a las 72 hpf tratadas durante ese periodo con ácido kaínico en presencia del extracto de polifenoles es de 140,1% (SD 22,0) frente a la actividad de las que han sido incubadas únicamente con la neurotóxina que ha sido considerada el 100%, con una diferencia que es significativa según el test de Dunnet (p < 0,05). Está diferencia está ilustrada en la figura 2.
Discusión
El síndrome excitotóxico se ha descrito como una importante causa de daño y muerte neuronal en enfermedades neuropatológicas como la hipoxia, isquemia, epilepsia y la enfermedad de Alzheimer. Este fenómeno ha sido inducido en experimentos con roedores mediante la inyección de agonistas de glutamato como es el caso del ácido kaínico (KA), el cual causa status epilepticus junto con neurodegeneración posterior en la corteza y el hipocampo9,10,11.
El modelo de pez cebra se ha utilizado en ensayos de excitotoxicidad5, observándose el mismo fenómeno que el descrito en el modelo murínico. A este respecto, el pez cebra (Danio rerio) se ha convertido en una buena herramienta para estudios neuroconductuales, ya que muestra neuropatológias y fenotipos conductuales que son cuantificables12,13 y propuesto como modelo experimental válido para estudio de la enfermedad de Alzheimer14. El pez cebra ofrece un compromiso razonable entre complejidad fisiológica y el rendimiento al tener un genoma caracterizado completamente, y mostrar homología fisiológica significativa a los mamíferos15, más estrechamente relacionado con los humanos que otros modelos como levaduras, gusanos o moscas, y el diseño y la conectividad en el centro de su sistema nervioso central (SNC) se correlaciona con la humana16. Su dualidad larva-adulto y disponibilidad de ambas formas es beneficiosa y permite la investigación de un espectro más amplio de fenómenos neurodegenerativos relacionados en la ontogénesis. Los embriones son transparentes y desarrollados externamente, hechos que permiten la observación directa de la embriogénesis y el desarrollo del sistema nervioso central. Los embriones son también fácilmente susceptibles a métodos para manipular los genes y la actividad de la proteína tales como la inyección de oligonucleótidos17, ARNm o cADN (transgenes), y para el cribado de bibliotecas de drogas están dispuestos en placas de microtitulación18. El desarrollo temprano del pez cebra permite analizar procesos y anormalidades del sistema nervioso central, con una ventaja significativa en el análisis de las funciones cerebrales complejas características de los vertebrados19, con comportamientos de orden superior, incluyendo la memoria, respuestas condicionadas y comportamientos sociales como el aprender conductas20 que lo hacen un modelo ideal para el estudio de trastornos del SNC21 y modelo para el estudio de efectos de agentes bioactivos, como el caso del presente estudio.
En el presente estudio se ha utilizado el ácido kaínico como neurotoxina inductora de daño neuronal en larvas de pez cebra, con el objetivo de estudiar las propiedades neuroprotectoras del extracto a estudio mediante la determinación de los niveles de acetilcolinesterasa (AChE) como marcador del estado general del sistema nervioso central. Para ello se ha analizado el efecto de la suplementación del extracto de polifenoles de huesos de oliva frente al daño neurotóxico en larvas de 72 horas post-fertilización (hpf) utilizando la máxima dosis tolerada del extracto6. El efecto neuro-protector se determinó frente a la pérdida controlada de neuronas colinérgicas, utilizado como marcador del estado general del sistema nervioso central. Los datos obtenidos muestran que el extracto incrementó los niveles de Acetilcolinesterasa de las larvas de pez cebra comparados con la actividad colinérgica en presencia de la neurotoxina, indicando un efecto protector de aproximadamente el 40%. Del mismo modo se constata un efecto beneficioso en el desarrollo del SNC del animal, al inducir un aumento en los niveles de la enzima, alcanzando un incremento del 62,2% respecto a los niveles observados en los controles.
Los polifenoles contenidos en los extractos procedentes del olivo presentan propiedades antioxidantes que hacen que sean candidatos para la investigación de enfermedades neurodegenerativas y reguladoras de la obesidad22. Además tienen otras actividades biológicas que le confieren importancia dentro de la "Dieta mediterránea"23. Se ha demostrado, además de otros efectos beneficiosos, el poder protector de la ingesta de flavonoides, compuestas fenólicos contenidos en vinos, vegetales y frutas frente a la demencia24.
Recientes estudios sugieren que los extractos del olivo inhiben la inflamación y reducen el estrés oxidativo, observado en ratas con una isquemia cerebral provocada25. Su administración oral reduce el volumen de infarto, edema cerebral, la permeabilidad de la barrera sangre-cerebro, y mejora las puntuaciones de déficit neurológico después de la oclusión transitoria de la arteria cerebral media en ratas.
En otros estudios, se evaluó el posible efecto neuro-protector de extracto de hoja de olivo seco en la isquemia cerebral global transitoria en gerbos de Mongolia26, valorando diferentes parámetros de estrés oxidativo y daño neuronal en el hipocampo y comparando con los efectos de la quercetina, un flavonoide conocido como neuroprotector. El pretratamiento con extracto (100 mg/kg de peso del animal) inhibió significativamente la producción de superóxido y de óxido nítrico, disminuyó la peroxidación lipídica y aumento de actividad de la superóxido dismutasa, en todos los tiempos examinados. Además, ofreció mejoría histológica, observada por la disminución de daño neuronal en la región CA1 del hipocampo. Los efectos del extracto fueron significativamente mayores que los efectos de la quercetina (100 mg/kg peso del gerbo), indicando que ejerce una potente actividad neuroprotectora contra el daño neuronal en el hipocampo después de isquemia cerebral global transitoria, que puede atribuirse a sus propiedades antioxidantes.
Con este mismo extracto de polifenoles, se ha mostrado actividad antiinflamatoria en cultivo de monocitos humanos27.
La mayoría de los estudios sobre los efectos de los polifenoles procedentes de extractos del olivo apuntan que su acción beneficiosa se debe a su capacidad antioxidante, causada por la capacidad de eliminar las especies reactivas de oxigeno y de nitrógeno implicadas en las enfermedades humanas1.
Se concluye que los polifenoles extraídos de los huesos de aceituna producen un incremento de la actividad colinérgica durante el neurodesarrollo larvario en el pez cebra. así como una protección frente a la neurotoxina ácido kaínico.
Referencias
1. de la Puerta R, Martinez Dominguez ME, Ruiz-Gutierrez V. Effects of virgin olive oil phenolics on scavenging of reactive nitrogen species and upon nitergic neurotransmission. Life Sci 2001; 69 (10): 1213-22. [ Links ]
2. Sies H. Oxidative stress: oxidants and antioxidants. Exp Physiol 1997; (2): 291-5. [ Links ]
3. Bartlett H, Eperjesi F. Age-related macular degeneration and nutritional supplementation: a review of randomised controlled trials. Ophthalmic Physiol Opt 2003; 23 (5): 383-99. [ Links ]
4. Bleys J, Miller E, Pastor-Barriuso R, Appel L, Guallar E. Vitamin-mineral supplementation and the progression of atherosclerosis: a meta-analysis of randomized controlled trials. Am J Clin Nutr 2006; 84 (4): 880-7. [ Links ]
5. Kimmel CB, Ballard WW, Kimmel SR, Ullman B, Schilling TF. Stages of embryonic development of the zebrafish. Develop Dyn 1995; 203: 255-310. [ Links ]
6. Veciana C, Cortés E, Torro L, Sirvent E, Rizo MM, Gil V. Evaluación de la citotoxicidad y bioseguridad de un extracto de polifenoles de huesos de aceitunas. Nutr Hosp 2014; 29 (6): 1388-93. [ Links ]
7. Ellman GL, Courtney KD, Andres VJr, Feather Stone RM. A new and rapid colorimetric determination of acetylcholinesterase activity. Biochem Pharmacol 1961; 7: 88-95. [ Links ]
8. Smith, et al. Measurement of protein using bicinchonici acid. Anal Biochem 1985; 150: 765. [ Links ]
9. Velísková J, Velísek L, Mares P. Epileptic phenomena produced by kainic acid in laboratory rats during ontogenesis. Physiol Bohemoslov 1988; 37: 395-405. [ Links ]
10. Ben-Ari Y, Tremblay E, Riche D, Ghilini G, Naquet R. Electrographic, clinical and pathological alterations following systemic administration of kainic acid, bicuculline or pentetrazole: Metabolic mapping using the deoxyglucose method with special reference to the pathology of epilepsy. Neuroscience 1981; 6: 1361-91. [ Links ]
11. Reddy DS, Kuruba R. Experimental models of status epilepticus and neuronal injury for evaluation of therapeutic interventions. Int J Mol Sci 2013; 14 (9): 18284-318. [ Links ]
12. Bowman TV, Zon LI. Swimming into the future of drug discovery: in vivo chemical screens in zebrafish. ACS Chem Biol 2010;5:159-61. [ Links ]
13. Rico EP, Rosemberg DB, Seibt KJ, Capiotti KM, Da Silva RS, Bonan CD. Zebrafish neurotransmitter systems as potential pharmacological and toxicological targets. Neurotoxicol Teratol 2011; 33: 608-17. [ Links ]
14. Newman M, Verdile G, Martins RN, Lardelli M. Zebrafish as a tool in Alzheimer's disease research. Biochim Biophys Acta 2011; 1812: 346-52. [ Links ]
15. Barbazuk WB, Korf I, Kadavi C, Heyen J, Tate S, et al. The syntemic relationship of the zebrafish and human genomes. Genome Res 2000; 10: 1351-8. [ Links ]
16. Gao M, Zhang WC, Liu QS, Hu JJ, Liu GT, Du GH. Pinocembrin prevents glutamate-induced apoptosis in SH-SY5Y neuronal cells via decrease of bax/bcl-2 ratio. Eur J Pharmacol 2008; 591: 73-9. [ Links ]
17. Nasevicius A, Ekker SC. Effective targeted gene "knockdown" in zebrafish. Nat Genet 2000; 26: 216-20. [ Links ]
18. Zon LI, Peterson RT. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov 2005; 4: 35-44. [ Links ]
19. Panula P, Sallinen V, Sundvik M, Kolehmainen J, Torkko V, et al. Modulatory neurotransmitter systems and behavior: towards zebrafish models of neurodegenerative diseases. Zebrafish 2006; 3: 235-47. [ Links ]
20. Lieschke GJ, Currie PD. Animal models of human disease: zebrafish swim into view. Nat Rev Genet 2007; 8: 353-67. [ Links ]
21. Grunwald DJ, Eisen JS. Headwaters of the zebrafish - emergence of a new model vertebrate. Nat Rev Genet 2002; 3: 717-24. [ Links ]
22. Sears B, Ricordi C. Role of fatty acids and polyphenols in inflammatory gene transcription and their impact on obesity, metabolic syndrome and diabetes. Eur Rev Med Pharmacol Sci 2012; 16 (9): 1137-54. [ Links ]
23. Visoli F. Antioxidant and aother biological activities of phenols from olives and olives oil. Med Res Rev 2001; 22: 65-75. [ Links ]
24. Commenges D. Intake of flavonoids and risk of dementia. Eur J Epidemiol 2000; 16: 357-63. [ Links ]
25. Mohagheghi F, Bigdeli MR, Rasoulian B, Hashemi P, Pour MR. The neuroprotective effect of olive leaf extract is related to improved blood-brain barrier permeability and brain edema in rat with experimental focal cerebral ischemia. Phytomed 2011; 18: 170-5. [ Links ]
26. Dekanski D, Selakovi V, Piperski V, Radulovi Z, Koreni A, Radenovi L. Protective effect of olive leaf extract on hippocampal injury induced by transient global cerebral ischemia and reperfusion in Mongolian gerbils. Phytomed 2011; 18 (13): 1137-43. [ Links ]
27. Cortés E, Veciana C, Torro L, Sirvent E, Rizo MM, Gil V. Anti-inflammatory activity of olive seed polyphenolic extract in the THP1-XBlue-CD14 Human monocytes cell line. Nutr Hosp 2014; 30 (1): 113-7. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ernesto Cortés Castell.
Universidad Miguel Hernández. España.
E-mail: ernesto.cortes@umh.es
Recibido: 16-V-2014.
Aceptado: 19-VI-2014.