Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.30 no.3 Madrid Set. 2014
https://dx.doi.org/10.3305/nh.2014.30.3.7623
Defensas antioxidantes en leche materna en relación al número de gestas y a la edad de las madres
Antioxidant defences in breast milk in relation to number of pregnancies and age of mothers
Patricia Carolina Castillo-Castañeda1, Ramón Gaxiola-Robles1, 2, Lía Celina Méndez-Rodríguez1 y Tania Zenteno-Savín1
1 Centro de Investigaciones Biológicas del Noroeste, S.C. Instituto Politécnico Nacional 195, Playa Palo de Santa Rita Sur, La Paz, Baja California Sur, C.P. 23096. México.
2 Hospital General de Zona No.1. Instituto Mexicano del Seguro Social. 5 de febrero y Héroes de la Independencia, Centro, La Paz Baja California Sur, C.P. 23000. México.
El trabajo se desarrolló con apoyo del Consejo Nacional de Ciencia y Tecnología (CONACYT) (SALUD 2010-C01-140272) y del Centro de Investigaciones Biológicas del Noroeste (CIBNOR) (PC2.0, PC0.10, PC0.5). El proyecto se registró ante la Comisión Federal para la Protección contra Riesgos Sanitarios (CO-FEPRIS) en 2009.
Dirección para correspondencia
RESUMEN
Introducción: La leche materna es una combinación específica de nutrientes y factores inmunológicos; sin embargo, sus componentes pueden estar expuestos a procesos de oxidación, mismos que pueden ser contrarrestados por moléculas antioxidantes como vitaminas y enzimas, entre otros. Tanto las defensas antioxidantes como el daño oxidativo pueden ser afectados por la edad, número de gestas y otros factores.
Objetivo: Comparar el contenido de antioxidantes e indicadores de daño oxidativo en leche materna de acuerdo a la edad de las mujeres y el número de gestas.
Metodología: Se midió la actividad de las principales enzimas antioxidantes, la concentración de glutatión, el daño oxidativo a lípidos (sustancias reactivas al ácido tiobarbitúrico, TBARS) y daño a proteínas (carbonilos proteicos) en leche materna utilizando técnicas espectrofotométricas. Se agruparon los datos de acuerdo al número de gestas (1, 2 y 3 o más) y se correlacionó con la edad de las madres.
Resultados: Se encontraron diferencias significativas en los niveles de TBARS (p = 0.04) y la actividad de glutatión S-transferasa (GST, p < 0.01) entre los grupos de acuerdo al número de gestas. Así mismo, se encontraron correlaciones lineales entre la edad, el daño oxidativo a lípidos y la actividad de GST.
Conclusión: La edad y el número de gestas al parecer incrementan la oxidación de los lípidos presentes en leche materna debido al aumento en el metabolismo y la producción de especies reactivas de oxígeno. Sin embargo, los niveles de TBARS se mantienen relativamente bajos posiblemente debido a las defensas antioxidantes, particularmente GST, de la madre.
Palabras clave: Leche materna. Edad. Número de gestas. Estrés oxidativo. Enzimas antioxidantes.
ABSTRACT
Introduction: Breast milk is a specific combination of nutrients and immunologic factors; however, milk components may be exposed to oxidation processes, which can in turn be counteracted by antioxidant molecules such as vitamins and antioxidant enzymes, amongst others. Both antioxidant defences and oxidative damage can be affected by age, number of pregnancies and other factors.
Objective: To compare antioxidant defences and oxidative damage indicators in breast milk, according to age of women and number of pregnancies.
Method: Activity of the main antioxidant enzymes, glutathione concentration, oxidative damage to lipids (thio-barbituric acid reactive substances, TBARS) and oxidative damage to proteins (protein carbonyls) was measured in breast milk using spectrophotometric techniques. Data were grouped according to number of pregnancies (1, 2 and 3 or more) and were related to the age of mothers.
Results: Significant differences among groups according to number of pregnancies were found in TBARS levels (p = 0.04) and GST activity (p < 0.01). Also linear correlations between age, lipid peroxidation and GST activity were found.
Conclusion: The age and number of pregnancies apparently increase lipid oxidation in milk due to increased metabolism and production of reactive oxygen species. However, TBARS levels remain relatively low probably because of the mother's antioxidant defenses, particularly GST.
Key words: Breast milk. Age. Number of pregnancies. Oxidative stress. Antioxidant enzymes.
Abreviaturas
ERO: Especies reactivas de oxígeno.
O2•- : Radical anión superóxido.
.OH: Radical hidroxilo.
H2O2: Peróxido de hidrógeno.
CAT: Catalasa.
SOD: Superóxido dismutasa.
GPx: Glutatión peroxidasa.
GSH: Glutatión reducido.
MDA: Malondialdehído.
mL: Mililitros.
PMSF: Fenil-metil-sulfonilfluoruro.
mM: Milimolar.
nm: Nanometros.
NBT: Nitroazul de tetrazolio.
GR: Glutatión reductasa.
GST: Glutatión S-transferasa.
CNDB: 1-cloro 2,4-dinitrobenceno.
NADPH: Nicotinamida adenina dinucleótido fosfato reducido.
NADP+: Nicotinamida adenina dinucleótido fosfato oxidado.
GSSG: Glutatión oxidado.
DTNB: Ácido 5'5-ditiobis-(2-nitrobenzoico).
GSH-Eq: Equivalentes de glutatión.
TBARS: Sustancias reactivas al ácido tiobarbitúrico.
TBA: Ácido tiobarbitúrico.
DNPH: 2,4 -dinitrofenil hidracina.
K-W: Kruskall - Wallis.
U mg-1 proteína: Unidades por miligramo de proteína.
nmol mg-1 proteína: Nanomoles por miligramo de proteína.
μmol mg-1 proteína: Micromoles por miligramo de proteína.
U mL-1: Unidades por litro.
U mL-1: Unidades por mililitro.
Se: Selenio.
HD: Capacidad donante de hidrógeno.
-SH: Grupo tiol.
H2O: Agua.
Introducción
Durante la lactancia se realiza la síntesis y el transporte de proteínas, grasas, carbohidratos, sales, anticuerpos y agua desde el plasma hacia las glándulas productoras de leche1,2. El producto, sin importar la condición social, económica o el estado de salud de la madre lactante, es una combinación única y específica de nutrientes y factores inmunológicos3,4. En este proceso se liberan reservas corporales de la madre que cubren las demandas energéticas del infante5, proteínas que cumplen funciones estructurales e inmunológicas, así como una variedad de moléculas antioxidantes (vitaminas, proteínas y enzimas) que contribuyen a evitar procesos de oxidación en la leche materna3.
La oxidación de moléculas como lípidos, proteínas y ácidos nucleicos puede provocar un estado de estrés oxidativo, resultado de un desbalance entre la acción de los agentes pro-oxidantes y antioxidantes, generando daño molecular y celular6. Los agentes oxidantes pueden ser exógenos, es decir provenientes del ambiente externo, o endógenos, producidos por el propio organismo, como es el caso de las especies reactivas de oxígeno (ERO)7. El término ERO abarca tanto a radicales libres (como el radical anión superóxido, O2•- y el radical hidroxilo, .OH), como a moléculas reactivas (como el peróxido de hidrógeno, H2O2), que intervienen en múltiples procesos fisiológicos necesarios para el organismo, por ejemplo, mecanismos de defensa contra microorganismos. La leche materna contiene un gran número de antioxidantes, incluyendo las vitaminas A, C y E, y enzimas antioxidantes, tales como catalasa (CAT), superóxido dismutasa (SOD) y glutatión peroxidasa (GPx)3.
Uno de los factores que puede afectar el balance antioxidante-prooxidante en mamíferos, es el número de gestas, ya que tanto en el embarazo como en la lactancia se puede incrementar el daño oxidativo y las defensas antioxidantes8-10. Así mismo, el incremento en la edad se ha relacionado con una mayor producción de especies reactivas y una disminución de los antioxidantes endógenos11. Otros factores que pueden afectar las defensas antioxidantes presentes en la leche incluyen el lugar de residencia, medicamentos, y el estilo de vida de la madre12. Por lo anterior, el objetivo del presente estudio fue comparar las defensas antioxidantes y los indicadores de daño oxidativo en leche materna de acuerdo al número de gestas y a la edad de las mujeres lactantes.
Materiales y métodos
Grupo de estudio
El grupo de estudio incluyó 108 mujeres lactantes en periodo de puerperio (7-10 días postparto), provenientes de diversas instituciones de salud de la ciudad de La Paz, Baja California Sur, todas ellas sudcalifornianas de nacimiento y con residencia durante toda su vida en este Estado. Las muestras de leche (aproximadamente 60 mL) se tomaron en el domicilio de las voluntarias por una enfermera especialista en el área materno-infantil. Las muestras fueron recolectadas en las mismas condiciones con el fin de reducir al máximo las posibles variaciones entre ellas. Las leches obtenidas se refrigeraron inmediatamente, se transportaron al laboratorio en hielo, y se almacenaron en congelación (-80oC) hasta su análisis. Se agruparon según el número de gestas (una, dos y tres o más gestas, n=36 en cada grupo). Se recolectó el consentimiento informado, así como un cuestionario estructurado para recabar información sobre las principales variables antropométricas. El proyecto, así como la carta de consentimiento informado fueron aprobados por el Capítulo Baja California Sur de la Academia Nacional de Bioética, A.C.
Análisis de laboratorio
Previo al análisis de los indicadores de estrés oxidativo, se homogenizó cada muestra (500 μL) de leche entera. Se centrifugaron las muestras a 905.6 x g por 10 minutos a 4oC en una centrífuga Sorvall® (RT, Massachusetts, E.U.A), se recuperó el sobrenadante y se le agregó fenil-metil-sulfonil fluoruro (PMSF, 1 mM) como inhibidor de proteasas.
Enzimas antioxidantes
La actividad de la SOD se determinó como la inhibición de la reducción de nitroazul de tetrazolio (NBT) a formazán13. Para cuantificar la actividad antioxidante de la CAT se registró por espectrofotometría la desaparición del H2O2 a 240 nm14. La actividad de GPx se determinó usando H2O2 como sustrato de la enzima dependiente de Se, y se midió el decremento de la concentración de nicotinamida adenina dinucleótido fosfato reducido (NADPH) en un ensayo acoplado con glutatión reductasa (GR) que cataliza la oxidación de NADPH a 240 nm15,16. Para medir la actividad de la glutatión S-transferasa (GST) se midió la aparición del complejo tioeter glutatión dinitrobenceno a partir de la conjugación de GSH y 1-cloro 2,4-dinitrobenceno (CDNB)17. La actividad de la glutatión reductasa (GR) se midió mediante la disminución en la absorbancia observada durante la oxidación de NADPH a nicotinamida adenina dinucleótido fosfato oxidado (NADP+) por glutatión oxidado (GSSG)15,18. Los resultados de la actividad de las enzimas antioxidantes se expresaron en unidades por miligramo de proteína soluble.
Glutatión
Para cuantificar la concentración de GSH se utilizó el método de Griffith (1980)19 con las modificaciones descritas por Hermes-Lima y Storey (1994)13. Este método se basa en la reacción de GSH con ácido 5'5-ditiobis-(2-nitrobenzoico) (DTNB) que da como producto una coloración amarilla que puede detectarse por espectrofotometría a 412 nm. La concentración de GSH se calculó a partir de una curva estándar utilizando GSH en lugar de muestra. Los resultados se expresaron en nanomoles de equivalentes de glutatión (GSH-Eq) por miligramo de proteína.
Daño oxidativo
Para cuantificar el daño oxidativo a los lípidos de la leche se midieron los niveles de peroxidación como el contenido de sustancias reactivas al ácido tiobarbitúrico (TBARS) mediante la cuantificación de la concentración de malondialdehído (MDA). El MDA es un pigmento rosa cristalino que se forma cuando los hidroperóxidos y aldehidos lipídicos, producto de la lipoperoxidación, reaccionan con el ácido tiobarbitúrico (TBA) y se registra la absorbancia a 532 nm20. Los resultados se expresaron en nmoles de TBARS por miligramo de proteínas solubles. El daño oxidativo a proteínas se cuantificó calculando el contenido de carbonilos proteicos21 midiendo la formación de un complejo entre los derivados carbonilados de las proteínas y la 2,4-dinitrofenil hidracina (DNPH). Los resultados se expresaron en μmoles de carbonilos proteicos por miligramo de proteínas.
Proteínas solubles
Para estandarizar los resultados, se calculó la concentración de proteínas solubles presentes en la leche utilizando el kit de Bio-Rad© (Laboratories Hercules, CA) basado en el método de Bradford (1976) adaptado a microplaca y con albúmina bovina sérica como estándar.
Análisis Estadísticos
Se realizaron pruebas de estadística descriptiva (frecuencias absolutas y relativas, medias, medianas y percentiles al 25% al 75%) y pruebas de probabilidad Kolmogorov-Smirnov22 para medir el ajuste de la distribución de las muestras a la curva normal. Se utilizó estadística no paramétrica para analizar diferencias entre los tres grupos (una, dos, y tres o más gestas) mediante el análisis de varianza de Kruskall-Wallis (K-W)23. La diferencia de la edad entre los grupos se estimó a través de la prueba de ANOVA. Se utilizó la r de Spearman para evaluar la correlación entre la edad de las mujeres lactantes y los indicadores de estrés oxidativo en leche materna. El nivel de probabilidad alfa de 5% se tomó para todas la pruebas estadísticas. Los análisis estadísticos se llevaron a cabo mediante el uso de los paquetes SYSTAT 12.0 SPSS 18.0 y STATISTICA 8 para computadora personal.
Resultados
La edad de las 108 mujeres presentó un rango entre los 16 y los 41 años. Los valores promedio de edad de los grupos son 22 ± 4 años para el grupo I, 28 ± 9 años para el grupo II y 30 ± 6 en el grupo III (p<0.01).
Enzimas antioxidantes
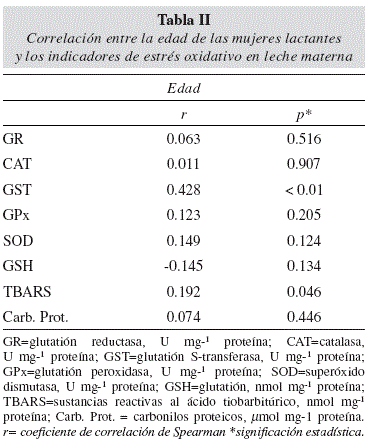
Los datos de actividad de las enzimas antioxidantes en mujeres lactantes de Baja California Sur en relación al número de gestas se presentan en la tabla I. No se observaron diferencias significativas en la actividad de SOD entre grupos (una gesta, 132.37U mg-1 proteína; dos gestas, 236.54U mg-1 proteína; tres o más gestas, 267.00U mg-1 proteína; p = 0.12). Sin embargo, se observó que la actividad de SOD es 101% mayor en el grupo de una gesta comparado con el de tres o más gestas. No se encontraron diferencias significativas (p = 0.71) en la actividad de CAT entre grupos (una gesta, 0.23 U mg-1 proteína; dos gestas, 0.27 U mg-1 proteína; tres o más gestas, 0.27 U mg-1 proteína). No obstante, se observó que la actividad de CAT es 13.29% es mayor en el grupo de una gesta que en el de tres o más gestas. Se observó mayor actividad (112%) de la enzima GPx en el grupo con una gesta (0.04 U mg-1 proteína) que en el grupo con tres o más gestas (0.08 U mg-1 proteína), sin diferencia significativa entre los grupos (p=0.13). La actividad de GST fue aproximadamente 171% mayor en el grupo con una gesta (0.0011 U mg-1 proteína) que en el grupo con tres o más gestas (0.0031 U mg-1 proteína) (p<0.01). A pesar de que no se encontraron diferencias significativas en la actividad de GR entre grupos, se observó mayor actividad (156%) de esta enzima entre las mujeres del grupo con una gesta (0.0075 U mg-1 proteína) y las del grupo con tres o más gestas (0.0193 U mg-1 proteína) (p = 0.34). Se observó una correlación positiva (r= 0.428) entre la actividad de la enzima antioxidante GST y la edad de las madres (p<0.01) (tabla II).
Glutatión
No se encontraron diferencias significativas en la concentración de GSH-Eq entre el grupo con una gesta (20.64 nmol mg-1 proteína), el grupo con dos gestas (27.40 nmol mg-1 proteína) y el grupo con tres o más gestas (19.38 nmol mg-1 proteína) (p = 0.71) (tabla I). La concentración de GSH-Eq fue 6.11% menor en el grupo con tres o más gestas que en el grupo con una gesta. No se observaron diferencias significativas en la concentración de GSH-Eq por la edad de las madres lactantes (tabla II).
Daño oxidativo
Los resultados del daño oxidativo a lípidos y proteínas en relación al número de gestas se presentan en la tabla I. Se encontraron diferencias significativas en la concentración de TBARS entre el grupo con una gesta (143.35 nmol mg-1 proteína), el grupo con dos gestas (265.74 nmol mg-1 proteína) y el grupo con tres o más gestas (262.39 nmol mg-1 proteína) (p = 0.04). Se observó, una mayor concentración de TBARS de 83.04 % entre el grupo con una gesta y el grupo con tres o más gestas. No se observaron diferencias significativas en la concentración de carbonilos proteicos entre el grupo con una gesta (31.43 μmol mg-1 proteína), el grupo con dos gestas (15.27 μmol mg-1 proteína) y el grupo con tres o más gestas (23.89 μmol mg-1 proteína) (p = 0.63). A pesar de no encontrar diferencias entre grupos, se observó menor concentración (171%) de carbonilos proteicos en el primer grupo en comparación con el tercer grupo. Se encontró una relación significativa entre los indicadores de daño oxidativo a lípidos y la edad de las madres (p = 0.046) (tabla II).
Discusión
Defensas antioxidantes
Estudios realizados en otras especies de mamíferos reportan una mayor actividad de las enzimas antioxidantes en leche con el número de gestas. Por ejemplo, la actividad de SOD, GPx y GST en leche de madres porcinas con una sola gesta es menor en comparación con las madres con 2 o más gestas8. En un estudio con vacas a 90 ± 30 días de lactancia, divididas en dos grupos, primíparas y multíparas, las cuales fueron suplementadas con aceite de pescado y de semillas, se reportó un aumento en las moléculas antioxidantes en ambos grupos; sin embargo, el contenido de antioxidantes endógenos liposolubles (vitamina A y E) fue mayor en vacas multíparas9.
Los resultados del presente estudio coinciden con ambos trabajos, en relación con la actividad de las enzimas antioxidantes en leche materna, la cual es mayor en el grupo de mujeres multíparas. Sin embargo, el contenido de antioxidantes no enzimáticos (en este caso, GSH-Eq) es menor conforme incrementa el número de gestas, posiblemente al ser utilizado en las reacciones enzimáticas antioxidantes.
La actividad de la enzima SOD observada en el presente trabajo (236.54 GI, 67.00 GII, y 132.37 U mg-1 proteína GIII), es mayor que la reportada previamente25-27. Al-Awadi y Srikumar (2000) encontraron que las mujeres de Kuwait presentaban una mayor actividad de SOD en comparación con mujeres de otras regiones25. La diferencia en la actividad de SOD, al parecer, se debe a una mayor concentración de zinc (Zn, 11%) en la leche de las mujeres de esa región, atribuida a la alimentación; este mineral es uno de los principales cofactores de la esta enzima25. SOD se considera la primera línea de defensa contra las ERO, específicamente contra el radical O2•-, cuya concentración se incrementa con el metabolismo. Por lo tanto, es de esperarse que durante la lactancia y el consecuente aumento en el metabolismo basal de las mujeres28, se incremente la actividad de esta enzima. Adicionalmente, en México la dieta promedio está basada en el consumo de cereales ricos en Zn29,30 y, en particular en Baja California Sur, la alta disponibilidad de pescados y mariscos representa otra fuente importante de Zn31,32. Una alimentación que incluye concentraciones suficientes de Zn puede estar contribuyendo a la actividad de SOD observada en las mujeres de este estudio.
Friel et al. (2002) reportaron una actividad de CAT de 0.82 U mg-1 proteína en leche en la segunda semana de lactancia; dicho valor es mayor al reportado en este estudio (GII y GII 0.27 U mg-1 proteína). L'Abbe y Friel (2000) reportaron la actividad de GPx en 0.011 U mg-1 de proteína en muestras de leche obtenidas durante la segunda semana posparto en un grupo de mujeres de 24 a 44 años26. Estos valores se encuentran por debajo de los valores promedio (0.04, 0.07, 0.08 U mg-1 proteína GI, GII y GII respectivamente) reportados para muestras colectadas entre el séptimo y el onceavo día de lactancia en el presente trabajo. Dodge et al. (1999) en un estudio con mujeres lactantes de China concluyen que la enzima GPx ejerce una importante función de protección contra la peroxidación de lípidos y encontraron una correlación entre una adecuada ingesta de selenio (Se) y la óptima actividad de GPx33. Niveles bajos de Se, al parecer, disminuyen la actividad de GPx, mientras que en exceso se produce una saturación de la enzima sin incrementar su actividad33. Debido a que en este estudio se presentó una mayor actividad de GPx que de CAT, se asume que GPx es la enzima encargada de la transformación de peróxidos en moléculas menos dañinas en leche materna.
Algunos tipos de GST tienen funciones similares a la GPx, catalizando la conversión de peróxidos orgánicos a alcoholes, con intervención de GSH y producción de GSSG34; por lo tanto, contribuyen así a la protección contra la peroxidación. En estudios realizados en cerdos, la actividad promedio de GST fue de 0.0036 y 0.0045 U mg-1 de proteína en el primer y segundo o tercer parto, respectivamente; es decir, la actividad de la enzima aumentó con el número de embarazos8. En el presente trabajo, de manera similar se observa mayor actividad de GST en relación al número de gestas.
La actividad reportada en este trabajo para GR fue 156% mayor en el grupo de tres gestas que en el de una gesta. Esta diferencia en la actividad de la enzima, a pesar de no ser estadísticamente significativa, puede contribuir a una mayor concentración de GSH, el cual es necesario para llevar a cabo las reacciones antioxidantes y/o detoxificantes catalizadas por GPx y GST34.
La concentración de GSH-Eq fue mayor en el grupo con una gesta que en el grupo con tres o más gestas. Se ha encontrado que el GSH y la enzima GPx remueven el H2O2 en eritrocitos. Estudios previos por otros autores han demostrado que las enzimas peroxidasas, CAT y GPx, presentan una actividad equivalente en la detoxificación de H2O2 en eritrocitos35. Sin embargo, otros estudios realizados en eritrocitos humanos encontraron una disminución en la concentración de GSH y GPx, pero no de CAT, durante el almacenamiento de los glóbulos rojos; en este caso se observó una liberación de GSH por los eritrocitos como respuesta al estrés oxidativo36. Tanto por la estabilidad de la actividad de CAT como por los bajos niveles de la concentración de GSH, se ha sugerido que el GSH representa la primera línea de defensa contra la oxidación de lípidos y proteínas en eritrocitos humanos36. En el presente estudio, el GSH puede estar realizando un papel similar como donador de equivalentes reductores en la leche materna, lo cual es sugerido por la diferencia en la concentración de GSH-Eq (6.11%, NS) entre los grupos con una y con tres o más gestas.
Daño oxidativo
Staicu et al. (2011) realizaron un estudio con dos grupos de ratas, primíparas y multíparas, midieron en sangre los indicadores de daño oxidativo, malondial-dehído (MDA) y carbonilos proteicos, encontrando una mayor concentración de MDA en ratas primíparas (40%), y una mayor concentración de carbonilos proteicos en ratas multíparas (60%)37. Staicu et al. (2011) utilizaron como marcadores de defensa antioxidante la capacidad donante de hidrógeno (HD) y el contenido total de grupos tiol (-SH), observando un aumento en HD (2%) en ratas primíparas y un aumento del contenido de -SH en multíparas (50%)37.
En el presente trabajo se observó 83.04% mayor concentración de TBARS en el grupo de una gesta que en el de tres o más gestas; la diferencia en carbonilos proteicos (-23.98 %) no fue estadísticamente significativa. Los resultados de estos marcadores en el presente estudio no concuerdan con las tendencias reportadas en cuanto a daño oxidativo en el estudio realizado por Staicu et al. (2011). Otros estudios han relacionado el aumento en los marcadores de daño oxidativo a lípidos con la disminución de la actividad de SOD en mujeres con problemas de preeclampsia38. En el presente estudio, la actividad de SOD, por un lado, indica la buena salud de las mujeres evaluadas y, por otro, sugiere la contribución de esta enzima antioxidante a los niveles de los indicadores de daño a lípidos.
La menor oxidación de proteínas, reportada en este estudio como carbonilos proteicos, en relación al número de hijos puede deberse a la acción del GSH. El grupo -SH de este antioxidante puede contribuir a reparar ciertos aminoácidos y disminuir el daño a proteínas39.
Se ha reportado que al final del embarazo existe un incremento de la lipoperoxidación, por un cambio en el perfil lipídico (incremento de triglicéridos fácilmente oxidables), y un consecuente decremento en la concentración de GSH10,40, el cual es un antioxidante y además contribuye a la actividad de las enzimas antioxidantes GPx y GST. Estas enzimas han sido relacionadas con la conversión de peróxidos orgánicos, disminuyendo la lipoperoxidación de moléculas. De acuerdo con los resultados obtenidos en este trabajo, un aumento en el número de gestas puede incrementar la lipoperoxidación de la leche materna. Sin embargo, la mayor (no significativa) actividad de CAT observada en el presente estudio sugiere que el contenido de peróxidos no es alto en leche, ya que la actividad de esta enzima se reporta principalmente en condiciones con altas concentraciones de H2O241. La respuesta fisiológica del organismo para contrarrestar el daño oxidativo incluye un incremento de la actividad de las enzimas antioxidantes, en este caso principalmente de la GST. Esta enzima se conoce también por su función detoxificante, ya que se encuentra relacionada con el metabolismo de xenobióticos, los cuales son metabolizados mediante una reacción de conjugación con el GSH. Por lo tanto, el incremento en la actividad de GST observado en el presente estudio puede estar asociado a la concentración de xenobióticos presentes en el tejido adiposo de la madre. Los contaminantes, como los metales pesados y los plaguicidas, se bioacumulan y son liberados a través de la movilización de lípidos requerida para la producción de leche. Se han cuantificado los niveles de metales en leche materna, sobre todo en zonas donde existe alto consumo de productos marinos, como es el caso de Baja California Sur42. Estos alimentos no sólo pueden incrementar el contenido de metales en leche, sino también contribuyen con micronutrientes que funcionan como cofactores de enzimas antioxidantes, como el Se que es cofactor de GPx43.
Estrés oxidativo y edad
La teoría del envejecimiento por radicales libres sugiere que el deterioro de la función celular incrementa con la edad y se relaciona con la acumulación del daño oxidativo causado por ERO11. En la actualidad, existe una variedad de reportes sobre el efecto que causa la edad en el organismo. En su mayoría coinciden en que el incremento de la edad conlleva al aumento en la producción de ERO, lo que provoca daño en diferentes moléculas, además de una disminución en la síntesis proteica y poca eficiencia de los mecanismos de reparación. A esto se le añaden los cambios en el sistema antioxidante endógeno, aunque algunos autores reportan discrepancias en cuanto al incremento o disminución de la actividad de ciertas enzimas antioxidantes44,45.
Se ha reportado tanto una disminución como un incremento en la actividad de SOD y GPx con la edad; es más común encontrar correlaciones negativas entre la actividad de GR y GST con la edad, atribuidas a la disminución en la concentración de GSH; y, por otro lado, para la actividad de CAT generalmente se reportan correlaciones negativas con la edad o bien sin efecto por la edad45.
Chakraborty et al. (2012) estudiaron el efecto del envejecimiento sobre el daño oxidativo a lípidos y proteínas, así como los niveles de defensas antioxidantes presentes en glóbulos rojos y suero en humanos entre 11 y 60 años; los autores encontraron una disminución en la concentración de GSH y en la actividad de las enzimas CAT, SOD, GST, GPx y GR, así como un incremento en la oxidación de lípidos (cuantificada como la concentración de MDA) y proteínas (cuantificada como carbonilos proteicos) conforme aumenta la edad de los individuos46. Otros estudios comparativos del daño oxidativo en mujeres reportan una mayor oxidación lipídica en aquellas de mayor edad en comparación con mujeres más jóvenes47. Al parecer, los estudios reportados coinciden en el incremento de la oxidación de lípidos en relación a la edad; sin embargo, en el presente estudio se observó además un aumento en la actividad antioxidante en leche materna. La diferencia puede deberse a que en el estudio de Chakraborty et al. (2012) se evaluó el daño oxidativo a lípidos en hombres y mujeres; los resultados pueden diferir entre sexos por procesos biológicos como reproducción y lactancia (exclusivo a mujeres). Estos procesos se han relacionado con un incremento en la producción de ERO y con consecuentes incrementos del daño oxidativo y también de las defensas antioxidantes endógenas48.
En el presente estudio, las correlaciones positivas de la edad con los niveles de TBARS y con la actividad de GST, coinciden con la evaluación por número de gestas, debido a que el incremento en los embarazos está relacionado con un aumento en la edad promedio de las madres en cada grupo. Por ello, es posible que la acumulación del daño por ERO a través del tiempo sea otro factor que contribuye al incremento del daño oxidativo a lípidos (expresado como TBARS) y mayores niveles de las defensas antioxidantes, como la actividad de la GST. Esta enzima está relacionada con la detoxificación de ciertos contaminantes y con el metabolismo de peróxidos lipídicos; esto último se refleja en niveles bajos de MDA y baja actividad de CAT. Por lo tanto, se puede esperar que los lípidos de la leche materna no presenten un daño oxidativo considerable, contribuyendo a mantener su calidad aún considerando el tiempo de almacenamiento. Miranda el al. (2011) reportan que la capacidad antioxidante de la leche humana almacenada en congelación disminuye la peroxidación de lípidos49. Además de la edad y el número de gestas, es posible que las variaciones en las defensas antioxidantes y el daño oxidativo se relacionen a otros factores, como la alimentación, actividad física o contaminantes42 no analizados en el presente estudio.
Conclusión
En el presente estudio se encontraron diferencias de acuerdo al número de gestas, encontrando mayores niveles de TBARS en la leche en mujeres con 3 o más gestas. Esto está posiblemente relacionado con el incremento en la edad promedio de las madres con mayor número de gestas y, de acuerdo a la teoría del envejecimiento, se debe a una mayor producción de ERO y, por ende, mayor daño oxidativo a lípidos. La actividad de la enzima antioxidante GST fue mayor en leche de mujeres con mayor número de embarazos, posiblemente para metabolizar lipoperoxidos, y quizá en relación a una posible acumulación de contaminantes a través de la vida de las madres. A pesar del mayor daño oxidativo a lípidos encontrado con el número de gestas y la edad, los niveles de TBARS parecen mantenerse en niveles bajos. Las diferencias (no significativas) de la actividad de las enzimas antioxidantes entre los grupos sugiere que en el proceso de lactancia se incrementan las defensas antioxidantes, posiblemente como mecanismo de protección de la estructura y función de los nutrientes y factores inmunológicos presentes en la leche que son necesarios para la nutrición de infante.
Agradecimientos
Los autores agradecen al personal y estudiantes del laboratorio de Estrés Oxidativo, particularmente a N.O. Olguín-Monroy y O. Lugo-Lugo por el apoyo técnico en el procesamiento de las muestras.
Referencias
1. Valdés V, Pérez A. Habbok M. Fisiología de la glándula mamaria. En: Lactancia para la Madre y el Niño. Ed. Santiago Mediterráneo 1994; 21p. [ Links ]
2. Sanchez Lopez CL, Hernandez A, Rodriguez AB, Rivero M, Barriga C, Cubero J. Nitrogen and protein content analysis of human milk, diurnality vs nocturnality. Nutr Hosp 2011;26:511-4. [ Links ]
3. Tijerina Sáenz A, Innis S, Kitts D. Antioxidant capacity of human milk and its association with vitamins A and E and fatty acid composition. Acta Paediatr 2009;98:1793-8. [ Links ]
4. Cordero M, Ravelo MV, Padilla López CA, Villar NM, Baeza MR, Gómez García CI. La estimulación prenatal; resultados relevantes en el periparto. Nutr Hosp 2012;27. [ Links ]
5. Fujita M, Roth E, Lo Y-J, Hurst C, Vollner J, Kendell A. In poor families, mothers' milk is richer for daughters than sons: A test of Trivers-Willard hypothesis in agropastoral settlements in Northern Kenya. Am JPhys Anthropol 2012;149:52-9. [ Links ]
6. Sies H. Oxidative stress: oxidants and antioxidants. Exp Physiol 1997;82:291-5. [ Links ]
7. Abramson JL, Hooper WC, Jones DP, et al. Association between novel oxidative stress markers and C-reactive protein among adults without clinical coronary heart disease. Atherosclerosis 2005;178:115-21. [ Links ]
8. Lipko-Przybylska J, Kankofer M. Antioxidant defence of colostrum and milk in consecutive lactations in sows. Ir Vet J 2012;65:2-8. [ Links ]
9. Puppel K, Nałęcz Tarwacka T, Kuczyńska B, Gołębiewski M, Kordyasz M, Grodzki H. The age of cows as a factor shaping the antioxidant level during a nutritional experiment with fish oil and linseed supplementation for increasing the antioxidant value of milk. J. Sci. Food Agric 2012;92:2494-9. [ Links ]
10. Patil S, Kodliwadmath M, Kodliwadmath S. Role of lipid peroxidation and enzymatic antioxidants in pregnancy-induced hypertension. Clin Exp Obstet Gyn 2006;34:239-41. [ Links ]
11. Golden TR, Hinerfeld DA, Melov S. Oxidative stress and aging: beyond correlation. Aging cell 2002;1:117-23. [ Links ]
12. Sadeghi N, Oveisi MR, Jannat B, Hajimahmoodi M, Bonyani H, Jannat F. Incidence of aflatoxin M1 in human breast milk in Tehran, Iran. Food control 2009;20:75-8. [ Links ]
13. Hermes-Lima M, Storey K. Xanthine oxidase and xanthine dehydrogenase from an estivating land snail. Zeitschrift fur Naturforschung C. J Biosci 1994;50:685-94. [ Links ]
14. Aebi H. Catalase in vitro. Methods Enzymol 1984;105:121-6. [ Links ]
15. Hermes-Lima M, Storey KB. Role of antioxidant defenses in the tolerance of severe dehydration by anurans. The case of the leopard frog Rana pipiens. Mol Cell Biochem 1998;189:79-89. [ Links ]
16. Flohé L, Günzler WA. Assays of glutathione peroxidase. In: Lester P, ed. Methods in Enzymology: Academic Press; 1984:114-20. [ Links ]
17. Habig W, Jakoby W. Glutathione S-transferases (rat and human). Methods Enzymol 1980;77:218-31. [ Links ]
18. Goldberg D, Spooner R. Glutathione reductase. Methods of enzymatic analysis 1983;3:258-65. [ Links ]
19. Griffith OW. Determination of glutathione and glutathione disulfide using glutathione reductase and 2-vinylpyridine. Anal Biochem 1980;106:207-12. [ Links ]
20. Persky AM, Green PS, Stubley L, et al. Protective effect of estrogens against oxidative damage to heart and skeletal muscle in vivo and in vitro. Proceedings of the Society for Experimental Biology and Medicine 2000;223:59-66. [ Links ]
21. Vázquez-Medina JP, Zenteno-Savín T, Elsner R. Antioxidant enzymes in ringed seal tissues: potential protection against dive-associated ischemia/reperfusion. Comp Biochem Physiol C 2006;142:198-204. [ Links ]
22. Zar JH. Biostatistical analysis, 3rd. Edition Prentice Hall, Upper Saddle River, New Jersey 1996. [ Links ]
23. Sabadlas AV. Estadística descriptiva e inferencial: Univ de Castilla La Mancha; 1996. [ Links ]
24. Cáceres RA. Estadística multivariante y no paramétrica con SPSS: aplicación a las ciencias de la salud: Ediciones Díaz de Santos; 1994. [ Links ]
25. Al-Awadi FM, Srikumar TS. Trace-element status in milk and plasma of Kuwaiti and non-Kuwaiti lactating mothers. Nutrition 2000;16:1069-73. [ Links ]
26. L'Abbe MR, Friel JK. Superoxide dismutase and glutathione peroxidase content of human milk from mothers of premature and full-term infants during the first 3 months of lactation. J Pediatr Gastroenterol Nutr 2000;31:270-4. [ Links ]
27. Kasapović J, Pejić S, Mladenović M, Radlović N, Pajović SB. Superoxide dismutase activity in colostrum, transitional and mature human milk. Turkish J Pediatr 2005;47:343-7. [ Links ]
28. Speakman JR, Garratt M. Oxidative stress as a cost of reproduction: Beyond the simplistic trade off model. Bio Essays 2014;36:93-106. [ Links ]
29. Rosado JL, Díaz M, Muñoz E, et al. Bioavailability of zinc oxide added to corn tortilla is similar to that of zinc sulfate and is not affected by simultaneous addition of iron. Food Nutr Bull 2012;33:261-6. [ Links ]
30. Méndez RO, Bueno K, Campos N, López D, Wyatt CJ, Ortega MI. Contenido total y disponibilidad in vitro de hierro y zinc en alimentos de mayor consumo en Sonora y Oaxaca, México. Arch Latinoam Nutr 2005;55:187-93. [ Links ]
31. Ortiz RAC, Díaz GP, Villa MÁ. El sector pesquero en Baja California Sur: un enfoque de insumo-producto. Región y Sociedad 2006;18. [ Links ]
32. Romaña DL, Castillo C, Diazgranados D. El zinc en la salud humana-I. Rev. chil. nutr 2010;37:234-9. [ Links ]
33. Dodge ML, Wander RC, Xia Y, Butler JA, Whanger PD. Glutathione peroxidase activity modulates fatty acid profiles of plasma and breast milk in Chinese women. J Trace Elem Med Biol 1999;12:221-30. [ Links ]
34. Halliwell B, Gutteridge J. Free radicals in biology and medicine. 2007. [ Links ]
35. Gaetani GF, Galiano S, Canepa L, Ferraris AM, Kirkman HN. Catalase and glutathione peroxidase are equally active in detoxification of hydrogen peroxide in human erythrocytes. Blood 1989;73:334-9. [ Links ]
36. Dumaswala U, Wilson M, Wu Y, et al. Glutathione loading prevents free radical injury in red blood cells after storage. Free Radic Res 2000;33:517-29. [ Links ]
37. Staicu ML, Muresan A, Tache S, Moldovan R. Effects of exogenous antioxidants on oxidative stress in pregnancy. J Med Life 2011;4:163-7. [ Links ]
38. Ilhan N, Ilhan N, Simsek M. The changes of trace elements, malondialdehyde levels and superoxide dismutase activities in pregnancy with or without preeclampsia. Clin Biochem 2002;35:393-7. [ Links ]
39. Friguet B. Oxidized protein degradation and repair in ageing and oxidative stress. FEBS letters 2006;580:2910-6. [ Links ]
40. Toescu V, Nuttall S, Martin U, Kendall M, Dunne F. Oxidative stress and normal pregnancy. Clin Endocrinol (Oxf) 2002;57:609-13. [ Links ]
41. Mahmoud RH, Ewadh MJ, Al-Hamadani KJ. Clinical Assessment of glutathione peroxidase and catalase to the status of malondialdehyde in urolithiasis. Pak J Med Sci 2009;25:738-43. [ Links ]
42. Gaxiola-Robles R, Zenteno-Savín T, Labrada-Martagón V, Celis A, Acosta-Vargas B, Méndez-Rodríguez LC. Concentraciones de mercurio en leche de mujeres del noroeste de México; posible asociación a la dieta, tabaco y otros factores maternos. Nutr Hosp 2013;28. [ Links ]
43. Simpson BK, Nollet LM, Toldrá F, Benjakul S, Paliyath G, Hui Y. Food biochemistry and food processing: John Wiley & Sons; 2012. [ Links ]
44. Trubitsyn A. The joined aging theory. Adv Gerontol 2013;3:155-72. [ Links ]
45. Voss P, Siems W. Clinical oxidation parameters of aging. Free Radic Ress 2006;40:1339-49. [ Links ]
46. Chakraborty SP, Gautam N, Kundu PK, Roy S. Age associated oxidative damage in RBC and serum of humans. Asian Pac J Trop Dis 2012;2:S268-S74. [ Links ]
47. Meydani M, Natiello F, Goldin B, et al. Effect of long-term fish oil supplementation on vitamin E status and lipid peroxidation in women. J. Nutr 1991;121:484-91. [ Links ]
48. Monaghan P, Metcalfe NB, Torres R. Oxidative stress as a mediator of life history trade offs: mechanisms, measurements and interpretation. Ecol lett 2009;12:75-92. [ Links ]
49. Miranda M, Gormaz M, Romero FJ, y Silvestre D. Estabilidad de la capacidad antioxidante y pH en leche humana refrigerada durante 72 horas: estudio longitudinal. Nutr Hosp 2011;26, 722-728. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ramón Gaxiola Robles PhD.
Centro de Investigaciones Biológicas del Noroeste, S.C.
Programa de Planeación Ambiental y Conservación.
Instituto Politécnico Nacional 195,
Playa Palo de Santa Rita Sur.
Código Postal 23096,
La Paz Baja California Sur, México.
E-mail: r.gaxiolar@gmail.com
Recibido: 22-V-2014.
Aceptado: 28-VI-2014.