My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.33 n.2 Madrid Mar./Apr. 2016
https://dx.doi.org/10.20960/nh.132
Ventilación y lactato sanguíneo en niños durante una prueba máxima incremental en cicloergómetro
Ventilation and blood lactate in children during a maximal incremental cycling test
Ivonne Villa Jiménez1, María José Aguilar Cordero1, Rafael Guisado Barrilao1, José Naranjo Orellana2 y Laura Guerrero Almeida3
1 Universidad de Granada. Granada
2 Universidad Pablo de Olavide. Sevilla.
3 Universidad de Sevilla. Sevilla
Dirección para correspondencia
RESUMEN
Este estudio analiza la respuesta ventilatoria en 46 niños varones (8,28 ± 1 años) durante una prueba máxima incremental en cicloergómetro y las concentraciones de lactato sanguíneo al final de la prueba. El incremento fue de 10 vatios cada minuto y se inició a 25 vatios. Durante la prueba el aire espirado se recolectó a través de una mascarilla facial y se analizó respiración a respiración. El segundo umbral ventilatorio (VT2) se determinó según los métodos de intercambio de gases.
Todos los niños alcanzaron una potencia máxima (Pmáx) de 82,4 ± 1,6 W y un consumo pico de oxígeno (VO2) de 44,69 ± 3,01 ml/kg/min. El VT2 estaba en el 86,5% del VO2pico. El lactato sanguíneo al final de la prueba fue de 9,65 ± 1,58 mM/l. Las concentraciones de lactato sanguíneo son mucho mayores que las registradas en la mayoría de los estudios previos y no parecen ser diferentes a las observadas en deportistas bien entrenados al final de una prueba similar.
La ecuación que obtuvimos de la relación entre producción de dióxido de carbono (VCO2) y ventilación (VE) fue lineal (y = 0,0324x - 0,008; R2 = 0,999). En comparación con adultos evaluados previamente en nuestro laboratorio (y = 0,0347x + 0,1452; R2 = 0,9854) fueron prácticamente idénticas. Esto puede ser un argumento válido para considerar que la capacidad de eliminar CO2 en niños es tan alta como la de los adultos.
Palabras clave: Metabolismo anaeróbico. Potencia anaeróbica. Ventilación. Ejercicio. Niños. Lactato.
ABSTRACT
This study analyzes the ventilatory response in 46 male children (8.28 ± 1 year) during a maximal incremental test in cycle ergometer and the blood lactate concentrations at the end of the test. The increase was 10 watts every minute starting at 25 watts. During the test the expired air was collected through a facial mask and analyzed breath by breath. The second ventilatory threshold (VT2) was determined according to gas exchange methods.
All children carried out a maximum power (Pmax) of 82.4 ± 1.6 W and a peak oxygen consumption (VO2) of 44.69 ± 3.01 mL/kg/min. The VT2 was at 86.5% of peak VO2. The blood lactate at the end of the test was 9.65 ± 1.58 mM/L. The blood lactate concentrations are much higher than those reported in most studies and they do not seem to be different to those observed in well-trained sportsmen at the end of a similar test.
We obtained the equation for the relationship between carbon dioxide production (VCO2) and ventilation (VE) and it was linear (y = 0.0324x - 0.008; R2 = 0.999). When compared with adults previously assessed in our laboratory (y = 0.0347x + 0.1452; R2 = 0.9854) they were practically identical. This may be a good argument to consider the ability for eliminating carbon dioxide in children as high as that in adults.
Key words: Anaerobic metabolism. Anaerobic power. Ventilation. Exercise. Children. Lactate.
Introducción
La respuesta de los niños al ejercicio anaeróbico comparada con la de los adultos ha sido de interés médico durante mucho tiempo. Un hecho ampliamente aceptado es que las concentraciones de lactato sanguíneo en los niños (como indicador de la actividad de la glucólisis anaeróbica) son menores para cualquier intensidad de ejercicio (1,2). La concentración de lactato en la sangre es de 1 o 2 mmol/l en reposo, pero puede aumentar hasta 20 mmol/l durante un esfuerzo intenso. Se debe recordar que el pH fisiológico en el cuerpo humano se encuentra solo en su forma disociada, es decir, como lactato y no como ácido.
En un estudio sobre la glucólisis en músculo aislado de ratón, Danforth y Lyon (3) propusieron que la fosfofructocinasa (PFK) era un factor limitante para la glucólisis anaeróbica. Esta idea dio lugar a diferentes trabajos en los que una reducción de los niveles de PFK se consideró la causa de una supuesta ineficiencia del metabolismo anaeróbico en los niños (4,5). Aunque al mismo tiempo otros trabajos (6,7) comunicaban una actividad enzimática muscular en niños similar a los adultos, la hipótesis de una capacidad glucolítica menor en los niños (debida a una menor actividad de la PFK) se expandió ampliamente (8).
Respecto al consumo de oxígeno (VO2) en los niños, algunos aspectos (tales como los valores normales) están ampliamente aceptados (9), mientras que otros todavía son temas de controversia, debido fundamentalmente a problemas metodológicos. De hecho, un metaanálisis realizado en 2003 (10) tuvo que eliminar 29 de 51 estudios por problemas metodológicos. No obstante, revisiones recientes establecen algunos acuerdos básicos al respecto (11).
Por otra parte, la mayoría de los estudios sobre respuestas fisiológicas al ejercicio en niños están realizados cerca de la pubertad por su importancia en los procesos de crecimiento y maduración, lo que hace que exista una falta importante de datos en edades más tempranas.
Objetivos
El objetivo de este estudio es analizar y describir la respuesta ventilatoria y las concentraciones de lactato sanguíneo en niños de corta edad durante un test máximo incremental en cicloergómetro, a fin de establecer la contribución del metabolismo anaeróbico al total del esfuerzo.
Material y Métodos
Hemos estudiado a 46 niños de entre 7 y 9 años (media 8,3 ± 1) pertenecientes al mismo centro escolar. Todos ellos practicaban fútbol tres días a la semana como actividad deportiva extraescolar. El peso fue 33,9 ± 0,5 kg y la talla 133,4 ± 1,2 cm.
Todos los niños participaron voluntariamente en el estudio y, al ser menores de edad, sus padres firmaron un consentimiento tras ser informados de los contenidos. El estudio contó con la aprobación del Comité de Ética del Centro Andaluz de Medicina del Deporte (en cuyas instalaciones se llevó a cabo el trabajo) y se ajusta a los principios éticos de la Declaración de Helsinki (12).
Se trata de un estudio descriptivo, transversal y cuasiexperimental en el que la muestra es aleatoria. La variable independiente es la intensidad controlada de ejercicio y las variables dependientes son los diferentes parámetros ventilatorios y metabólicos que se indican más adelante. El protocolo de estudio incluía un cuestionario de historia clínica que fue cumplimentado por los padres con anterioridad a las pruebas, una exploración médica, medición de peso y talla, presión arterial y electrocardiograma de reposo.
Tras explicarles el procedimiento, se realizó un test incremental hasta el agotamiento en un cicloergómetro electrónico Jaegger ER 800® (Bitz, Alemania) comenzando a 25 vatios y con incrementos de 10 vatios por minuto. Justo en el instante de finalizar el test se obtuvo una muestra de sangre de la yema del dedo para analizar la concentración de lactato sanguíneo en un fotómetro Dr. Lange LP20® (Berlín, Alemania).
Durante la prueba se recogió el aire espirado a través de una máscara facial y se analizó respiración a respiración en un analizador Vmax Spectra® (Sensor Medics; Yorba Linda, California, EE. UU.) de célula química para el oxígeno y de infrarrojos para el CO2.
La ventilación fue analizada de forma continua como una integral del flujo a través de un flujómetro de diferencia de temperatura. El segundo umbral ventilatorio (VT2) se determinó de acuerdo con los métodos de intercambio gaseoso propuestos por Skinner y McLellan (13). La frecuencia cardiaca se registró durante toda la prueba con un monitor Polar 810i® (Kempele, Finlandia).
Para el propósito de este trabajo se centró la atención en la potencia, VO2, VT2 y concentración de lactato sanguíneo.
El análisis estadístico fue descriptivo, aportando medias, desviaciones estándar y ecuaciones de regresión en las comparaciones gráficas.
Todas las pruebas se llevaron a cabo en las mismas condiciones de laboratorio, por los mismos investigadores y con la calibración previa de todos los instrumentos de medida.
Resultados
La tabla I muestra los datos de todos los niños expresados como media y desviación estándar. Estos datos son la potencia pico (W y W/kg), lactato en la sangre al final del test (mM/l) y VO2pico tanto absoluto (l/min) como relativo a la masa corporal (ml/kg/min).
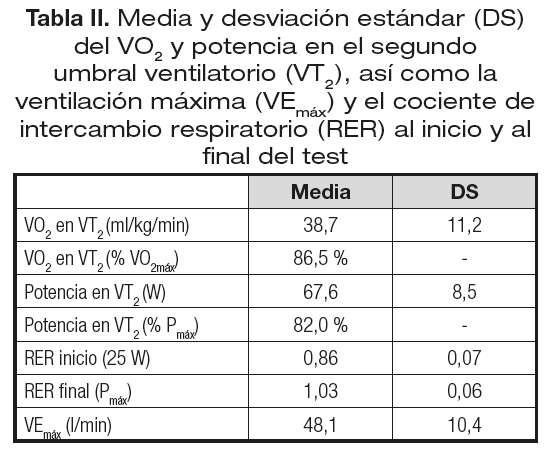
En la tabla II se muestran los valores de VO2 y potencia en VT2 (tanto en valores absolutos como en porcentaje de los valores máximos), los datos de ventilación (VE) máxima y los valores del cociente de intercambio respiratorio (RER) al comienzo y al final del test.
La relación entre VE y producción de CO2 (VCO2) fue lineal (Fig. 1).
Discusión
El número de niños estudiados (n = 46) es suficiente y mayor que en la mayoría de los estudios realizados a esta edad. La edad del grupo (8,28 ± 1 años) nos permite asumir una situación prepuberal y, por tanto, descartar diferencias debidas a posibles diferentes niveles de entrenamiento (14).
El VO2pico es la forma más adecuada para medir el consumo de O2 en niños al final del ejercicio (11) y el valor obtenido es muy similar al reportado por McMurray y cols. (9) en un estudio longitudinal con 529 niños y 535 niñas de 8 a 16 años.
Quizá el hallazgo más importante de este trabajo es que las concentraciones de lactato sanguíneo encontradas (9,6 ± 1,6 mM/l) son mucho mayores que las aportadas por la mayoría de estudios (4,15,16), aunque hay algunos trabajos que aportan datos similares a los nuestros (17,18) e incluso mayores cuando se trata de ejercicio intermitente (19). En este último caso, Engel y cols. (20) reportan valores medios de lactato de 12,6 mM/l en niños, frente a 16,3 mM/l en adultos durante un ejercicio de alta intensidad en cicloergómetro.
Dado que estas cifras de lactato encontradas no son diferentes de las que vemos en adultos entrenados al final de un test similar (21), nos preguntamos si realmente la producción de lactato en los niños es menor que en los adultos.
Numerosos trabajos han reportado concentraciones de lactato sanguíneo y muscular menores en niños que en adultos (1,2,22), pero la mayoría de estos trabajos se han realizado usando pruebas de potencia anaeróbica (como el test de Wingate) que podrían no ser las más adecuadas en sujetos que todavía no han alcanzado su desarrollo muscular completo. El hecho de que el pico de potencia y la potencia media en un test de Wingate sean inferiores en niños (23) no implica necesariamente que tengan una limitación en la producción de energía a través de la glucólisis anaeróbica, pudiendo haber otras explicaciones alternativas como factores hormonales y neuromusculares.
Algunos estudios sobre la potencia muscular durante el crecimiento (24,25) ya demostraron las limitaciones de los test de potencia en los niños, concluyendo que las diferencias observadas entre ellos eran una expresión de factores neuromusculares y hormonales más que de una limitación en la producción de energía.
Es frecuente el hecho de que un protocolo con incrementos graduales de la carga se utilice habitualmente para estudiar la potencia y capacidad aeróbicas. Sin embargo, la posición del VT2 y el valor de la relación VE/VCO2 a partir de él pueden ser una aproximación válida a la contribución anaeróbica al esfuerzo total, dado que la fase III de la respuesta ventilatoria (que comienza en VT2) refleja la compensación respiratoria de la acidosis metabólica (12,26). Por otra parte, Beneke y cols. (27) informan de que no hay diferencias de edad en los valores de máximo estado estable de lactato (MLSS) obtenidos en cargas progresivas en niños y adultos.
En la hipótesis de una actividad PFK inmadura hay dos aspectos que nos hacen dudar. El primero es que no consideramos razonable que una vía metabólica tan temprana en la filogenia del metabolismo de los mamíferos (28), como es la glucólisis anaeróbica, pueda tener una falta de madurez tras el nacimiento, mientras que una vía posterior y mucho más compleja (como la vía oxidativa) esté trabajando a plena capacidad. La segunda es que dado que la PFK actúa en un estadio que es común tanto en la fase aeróbica como anaeróbica de la glucólisis, su defecto debería causar una reducción global de la energía obtenida a partir de carbohidratos y no solo de la obtenida por procesos anaeróbicos. De hecho, esto es lo que ocurre en la enfermedad de Tauri, que es un déficit congénito de PFK.
Con respecto a la respuesta ventilatoria, la eficiencia de la ventilación para eliminar CO2 es evidente por el alto valor de la posición del VT2 (86,5% del VO2pico) en niños que no tienen un alto nivel de entrenamiento y, sobre todo, por la relación lineal observada entre VCO2 y VE (Fig. 1), y que ya ha sido reportada previamente (29,30).
Si comparamos esta relación (y = 0,0324x + 0,008; R2 = 0,999) con la que encontramos en nuestro laboratorio (31) en un grupo de 34 atletas adultos (y = 0,0347x + 0,15; R2 = 0,985), la similitud es evidente y la existencia de dos pendientes prácticamente idénticas (0,0324 vs. 0,0347) es un argumento válido para considerar que la capacidad para eliminar CO2 en los niños es, al menos, tan alta como la de los adultos. Esta capacidad de ajustar la eliminación de CO2 a los niveles de ventilación requeridos parece ser una constante (31), a menos que existan condicionantes mecánicos como la obesidad (32).
No parece lógico que los niños tengan un metabolismo anaeróbico inmaduro antes de la pubertad, ya que la actividad espontánea observada durante toda la niñez requiere una vía rápida para obtener la energía (33,34). Deberían considerarse otros mecanismos para explicar los valores bajos de lactato encontrados en niños durante pruebas de potencia anaeróbica (35), puesto que parece claro que esto no es así en otro tipo de pruebas como las que nosotros hemos realizado. Entre otros mecanismos habría que considerar un aclaramiento más rápido desde el compartimento sanguíneo (36) o una mayor actividad de la neoglucogénesis hepática (Ciclo de Cori) como ocurre durante la vida fetal (37,38), cuando la demanda energética es tan alta (39).
Una hipótesis a tener en cuenta sería que la glucólisis anaeróbica estuviera plenamente activa en los niños (con la consiguiente alta producción de lactato), pero estuviera equilibrada tanto por una alta actividad del Ciclo de Cori como por una ventilación muy eficiente. De hecho, en algunos deportes como la natación, los valores de lactato se pueden utilizar para la determinación de intensidades de entrenamiento con la misma validez que en jóvenes y adultos (40). Por otra parte, parece ser que los valores de lactato son independientes de la edad cuando se ponen en relación con la tasa de oxidación de carbohidratos (41).
En cualquier caso, creemos firmemente que la interpretación de los parámetros fisiológicos en niños durante el ejercicio debe ser coherente con la filogenia del metabolismo de los mamíferos (28).
La eficiencia para eliminar CO2 durante un ejercicio progresivo es similar en niños y adultos y no hay evidencias para sostener que la producción de lactato en niños es inferior a la de los adultos, al menos en ejercicios progresivos. Esto indica que la contribución de la glucólisis anaeróbica no es diferente en los niños y que, por tanto, no es coherente la hipótesis de una inmadurez de la PFK en niños.
Bibliografía
1. Fellman N, Coudert J. Physiology of muscular exercise in children. Arch Pediatr 1994;1(9):827-40. [ Links ]
2. Boisseau N, Delamarche P. Metabolic and hormonal responses to exercise in children and adolescents. Sports Med 2000;30(6):405-22. [ Links ]
3. Danforth W, Lyon J. Glycogenolysis during titanic contraction of isolated mouse muscles in the presence and absence of phosphorylase a. J Biol Chem 1964;238:4047-52. [ Links ]
4. Eriksson BO, Gollnick PD, Saltin B. Muscle Metabolism and Enzyme Activities after Training in boys 11-13 Years Old. Acta Physiol Scand 1973;87:485-97. [ Links ]
5. Eriksson BO, Karlsson J, Saltin B. Muscle metabolites during exercise in pubertal boys. Acta Paediat Scand 1971;217:57-63. [ Links ]
6. Haralambie G. Enzyme activities in skeletal muscle of 13-15 years old adolescents. Bull Europ Physiopath Resp 1982;18:65-74. [ Links ]
7. Haralambie G, Reinartz H. Human Skeletal Muscle Enolase and Factors Influencing Its Activity. Enzyme 1978;23:404-9. [ Links ]
8. Ratel S, Bedu M, Hennegrave A, Dore E, Duche P. Effects of age and recovery duration on peak power output during repeated cycling sprints. Int J Sports Med 2002;23(6):397-402. [ Links ]
9. McMurray RG, Harrell JS, Bangdiwala SI, HU J. Tracking of physical activity and aerobic power from childhood through adolescence. Med Sci Sports Exerc 2003;35(11):1914-22. [ Links ]
10. Baquet G, Van Praag E, Berthoin S. Endurance training and aerobic fitness in young people. Sports Med 2003;33(15):1127-43. [ Links ]
11. Massim MM. The role of exercise testing in pediatric cardiology. Arch Cardiovasc Dis 2014;107:319-27. [ Links ]
12. Wma.net (Internet). France: World Medical Association, Inc; (updated October 2004; cited 2015). Available at: http://www.wma.net/s/index.htm. [ Links ]
13. Skinner J, Mclellan T. The transition from aerobic to anaerobic metabolism. Res Q Exerc Sport 1980;51:234-48. [ Links ]
14. McNarry MA, Mackintosh KA, Stoedafalke K. Longitudinal investigation of training status and cardiopulmonary responses in pre and early-puberal children. Eur J Appl Physiol 2014;114(8):1573-80. [ Links ]
15. Tanaka H, Shindo M. Running Velocity at Blood Lactate Threshold of Boys Aged 6-15 Years Compared with Untrained and trained young Males. Int J Sports Med 1985;6:90-4. [ Links ]
16. Armstrong N, Welsman J, Chia M. Short term power output in relation to growth and maturation. Br J Sports Med 2001;35:118-24. [ Links ]
17. Gaul CA, Docherty D, Cicchini R. Differences in Anaerobic Performance Between Boys and Men. Int J Sports Med 1995;16(7):51-455. [ Links ]
18. Dotan R, Ohana S, Bediz C, Falk B. Blood Lactate Disappearance Dynamics in Boys and men Following Exercise of Similar and Dissimilar Peak-lactate Concentrations. Journal of Pediatric Endocrinilogy & Metabolism 2003;16(3):419-29. [ Links ]
19. Mero A. Blood lactate production and recovery from anaerobic exercise in trained and untrained boys. Eur J Appl Physiol 1988;57:660-6. [ Links ]
20. Engel F, Härtel S, Wagner MO, Strahler J, Bös K, Sperlich B. Hormonal metabolic and cardiorespiratory responses of young and adult athletes to a single session of high-intensity cycle exercise. Pediatr Exerc Sci 2014;26(4):485-94. [ Links ]
21. Karlsson J, Diamant B, Saltin B. Muscle Metabolites during Submaximal and Maximal Exercise in Man. Scand J Clin Lab Invest 1971;26:385-94. [ Links ]
22. Zafeiridis A, Dalamitros A, Dipla K, Manou V, Galanis N, Kellis S. Recovery during high-intensity intermittent anaerobic exercise in boys, teens and men. Med Sci Sports Exerc 2005;37(3):505-12. [ Links ]
23. Inbar O, Bar-Or O. Anaerobic characteristics in male children and adolescents. Med Sci Sports Exerc 1986;18(3):264-9. [ Links ]
24. Van Praagh E, Doré E. Short-Term Muscle Power During Growth and Maturation. Sports Med 2002;32(11):701-28. [ Links ]
25. Martin R, Dore E, Twisk J, Van Praagh E. Longitudinal Changes of Maximal Short-Term Peak Power in Girls and Boys during Growth. Med Sci Sports Exerc 2004;36(3):498-503. [ Links ]
26. Wasserman K, Stringer WW, Casaburi R, Koike A, Cooper CB. Determination of the anaerobic threshold by gas exchange: biochemical considerations, methodology and physiological effects. Z Kardiol 1994;83(3):1-12. [ Links ]
27. Beneke R, Heck H, Hebestreit H, Leithäuser RM. Predicting maximal lactate steady state in children and adults. Pediatr Exerc Sci 2009;21(4):493-505. [ Links ]
28. Singer D. Phylogeny of Mammalian metabolism. Anasthesiol Intensivmed Notfallmed Schmerzther 2002;37(8):441-60. [ Links ]
29. Guerrero Almeida L, Naranjo Orellana J, Carranza Márquez MD. Gender Influence on ventilatory efficiency during exercise in young children. J Sports Sci 2008;26(13):1455-7. [ Links ]
30. Brown SJ, Raman A, Schlader Z, Stannard SR. Ventilatory efficiency in juvenile elite cyclists. J Sci Med Sport 2013;16(3):266-70. [ Links ]
31. Naranjo J, Centeno RA, Beaus M. El flujo inspiratorio como factor determinante de la ventilación durante el ejercicio. Archivos de Medicina del Deporte 2000;79:395-400. [ Links ]
32. Carpio C, Santiago A, García de Lorenzo A, Álvarez-Sala R. Función pulmonar y obesidad. Nutr Hosp 2014;30:1054-62. [ Links ]
33. Wirth A, Trager E, Scheele K, Mayer D, Diehm K, Reischle K, et al. Cardiopulmonary Adjustment and Metabolic Response to Maximal and Submaximal Physical Exercise of Boys and Girls at Different Stages of Maturity. Eur J Appl Physiol 1978;39:229-40. [ Links ]
34. Bailey RC, Olson J, Pepper SB, Porszasz J, Barstow TJ, Cooper DM. The level and tempo of children's physical activities: an observational study. Med Sci Sports Exerc 1995;27:1033-41. [ Links ]
35. Beneke R1, Hütler M, Leithäuser RM. Anaerobic performance and metabolism in boys and male adolescents. Eur J Appl Physiol 2007;101(6):671-7. [ Links ]
36. Beneke R, Hutler M, Jung M, Leithauser RM. Modeling the blood lactate kinetics at maximal short-term exercise conditions in children, adolescents and adults. J Appl Physiol 2005;99(2):499-504. [ Links ]
37. Ascuitto RJ, Ross-Asscuitto NT. Substrate metabolism in the developing heart. Semin Perinatol 1996;20(6):542-63. [ Links ]
38. Magnusson AL, Powell T, Wennergren M, Jansson T. Glucose metabolism in the human preterm and term placenta of IUGR fetuses. Placenta 2004;25(4):337-46. [ Links ]
39. Aguilar Cordero MJ, Sánchez López AM, Mur Villar N, Hermoso Rodríguez E, Latorre García J. Effect of nutrition on growth and neurodevelopment in the preterm infant: a systematic review. Nutr Hosp 2014;31(2):716-29. [ Links ]
40. Toubekis AG, Tokmakidis SP. Metabolic responses at various intensities relative to critical swimming velocity. J Strength Cond Res 2013;27(6):1731-41. [ Links ]
41. Beneke R1, Hütler M, Leithäuser RM. Carbohydrate and fat metabolism related to blood lactate in boys and male adolescents. Eur J Appl Physiol 2009;105(2):257-63. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
María José Aguilar Cordero.
Departamento de Enfermería.
Facultad de Ciencias de la Salud.
Universidad de Granada.
Av. de la Ilustración, s/n.
18071 Granada
e-mail: mariajaguilar@telefonica.net
Recibido: 29/10/2015
Aceptado: 19/11/2015