My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.33 n.3 Madrid May./Jun. 2016
https://dx.doi.org/10.20960/nh.260
TRABAJO ORIGINAL / Pediatría
Evolución del riesgo cardiometabólico en pacientes supervivientes de leucemia aguda infantil
Evolution of cardiometabolic risk among childhood acute leukemia survivors
Elena Guadalupe Corella Aznar1, Ariadna Ayerza Casas2, Pilar Samper Villagrasa3, Carmen Rodríguez Vigil4, Lorenzo Jiménez Montañés2, Carlota Calvo Escribano4 y José Ignacio Labarta Aizpun5
1Hospital Infantil Miguel Servet.
2Unidad de Cardiología Pediátrica. Hospital Infantil Miguel Servet.
3Departamento de Pediatría. Hospital Clínico Universitario.
4Unidad Oncología y Hematología Pediátricas. Hospital Infantil Miguel Servet.
5Unidad de Endocrinología Pediátrica. Hospital Infantil Miguel Servet. Zaragoza.
Dirección para correspondencia
RESUMEN
Introducción: los supervivientes de leucemia aguda (LA) infantil presentan un riesgo incrementado de alteraciones metabólicas y cardiovasculares que aumentan su morbimortalidad a largo plazo.
Objetivo: estimar la prevalencia de obesidad, resistencia a la insulina, dislipemia e hipertensión arterial como factores de riesgo cardiometabólico (FRCM) en un grupo de supervivientes de LA infantil, y analizar las posibles causas asociadas a su desarrollo.
Material y métodos: estudio observacional retrospectivo en 47 supervivientes de LA tratados en un periodo de 4 años, que recibieron seguimiento durante 10 años.
Resultados: el 40% de los participantes presentaron al menos un FRCM durante el seguimiento, siendo la dislipemia (aumento LDL) el más frecuente (38,3%), seguido de obesidad/sobrepeso (31,9%) y HTA sistólica (23,4%). El sexo femenino se estableció como factor de riesgo para el desarrollo de todos ellos (RR 1,6; RR 3,16; RR 1,69; p < 0,05). Ningún superviviente desarrolló diabetes mellitus, pero sí resistencia a la insulina el 19,4%. Los pacientes con leucemias de peor pronóstico presentaron mayor riesgo de desarrollar obesidad, resistencia a la insulina y aumento de LDL (RR 3,56; RR 4,08; RR 2,53; p < 0,05). Los pacientes tratados con trasplante de progenitores hematopoyéticos presentaron mayor riesgo de obesidad, aumento de LDL e HTA sistólica (RR 2,86; RR 2,39; RR 3,12; p<0,05). La radioterapia se asoció de igual modo con un incremento de resistencia a la insulina e hipertensión arterial sistólica (RR 2,47; RR 2,53; p < 0,05).
Conclusiones: existe un aumento en la prevalencia de obesidad/sobrepeso, dislipemia, resistencia a la insulina y alteración de la tensión arterial sistólica en supervivientes de leucemia aguda infantil a lo largo del tiempo, especialmente en aquellos con enfermedades y tratamientos más agresivos.
Palabras clave: Supervivientes cáncer infantil. Leucemia aguda. Factores de riesgo cardiometabólico.
ABSTRACT
Background: Survivors of childhood acute leukemia (AL) face an increased risk of metabolic and cardiovascular late effects which increase their long-term morbimotality.
Objective: To assess the prevalence of obesity, insulinresistance, dyslipidemia and hypertension as cardiometabolic risk factors in survivors of a childhood AL, and also to determine possible causes for these adverse cardiometabolic traits.
Material and methods: A retrospective cohort study of 47 pediatric acute leukemia survivors diagnosed between 0-15 years, with a ten years follow-up.
Results: Forty percent of participants had at least one cardiometabolic risk factor. Dyslipidemia (increased LDL cholesterol) was the most frequent (38.3%), secondly overweight/obese (31.9%), followed by systolic hypertension (23.4%). Females in contrast to males had an increased risk of developing all three risk factors (RR 1.6; RR 3.16; RR 1.69; p < 0.05). Only 19.4% of participants developed insulin resistance, while none were diagnosed with diabetes mellitus. High risk acute leukemia survivors were significantly more likely than low risk leukemia survivors to manifest multiple cardiometabolic traits like overweight/obesity, insulin resitance and dyslipidemia (RR 3.56; RR 2.39; RR 2.53; p < 0.05). Also, those who received hematopoietic cell trasplantation had an increased prevalence of overweight/obesity, increased LDL-cholesterol and systolic hypertension. Radiotherapy treatment was also associated with insulin resitance and systolic hypertension (RR 2.47; RR 2.53; p < 0.05).
Conclusions: There is an increased risk of overweight/obesity, dyslipidemia, insulin resistance and systolic blood pressure modification in childhood acute leukemia survivors, specially in those who were diagnosed as a high risk acute laukemia and those treated with more aggressive treatments.
Key words: Childhood cancer survivors. Acute leukemia. Cardiometabolic risk factors.
Introducción
La enfermedad cardiovascular (ECV) constituye la primera causa de muerte en nuestro país. A pesar de que su manifestación en la edad pediátrica es rara, el proceso de arterioesclerosis puede iniciarse durante la infancia e incluso acelerarse ante la presencia de factores de riesgo cardiometabólico (FRCM) identificables (1). Por ello, es importante establecer un diagnóstico precoz de los mismos.
Son de especial interés los grupos pediátricos que presentan un mayor riesgo de desarrollar estos FRCM, como son los supervivientes del cáncer infantil, quienes presentan un riesgo cuatro veces superior de muerte por causa cardiovascular (2,3).
La leucemia aguda (LA) es el cáncer más frecuente en la infancia y su tratamiento se basa en múltiples agentes: quimioterapia, radioterapia (RT) y trasplante de progenitores hematopoyéticos (TPH), entre otros, en función de las características de la enfermedad y su evolución. Todos estos tratamientos tienen potenciales efectos tóxicos a largo plazo, que aumentan el riesgo de ECV.
Entre los FRCM, la obesidad infantil es uno de los problemas de salud pública más importantes de este siglo, y los supervivientes al cáncer infantil no son inmunes a esta epidemia. Los resultados del Childhood Cancer Survivor Study (CCSS) muestran una mayor prevalencia de obesidad en estos pacientes (4), y definen un perfil lipídico caracterizado por un incremento de los triglicéridos y disminución de las lipoproteínas de alta densidad (HDL colesterol). A esto se suma un mayor riesgo de desarrollar hipertensión arterial (HTA) y resistencia a la insulina (RI), favoreciendo todo ello al desarrollo de arterioesclerosis de forma precoz (4,5). Esta situación cobra aún mayor importancia al manifestarse en pacientes que pueden presentar una miocardiopatía asociada, secundaria al tratamiento recibido (6).
Objetivo
De la repercusión que supone el desarrollo temprano de estos factores en una población con una esperanza de vida creciente (7), surgen los objetivos de este estudio, que son: a) definir la prevalencia de los siguientes factores de riesgo cardiometabólico: obesidad, resistencia a la insulina (RI) o diabetes mellitus 2 (DM 2), dislipemia e hipertensión arterial (HTA), en pacientes supervivientes de leucemia aguda y b) investigar posibles causas asociadas a su desarrollo relacionadas con el tumor, el tratamiento recibido y las características del paciente.
Material y métodos
Se realizó un estudio observacional retrospectivo longitudinal en pacientes en edad pediátrica (de 0 a 15 años), diagnosticados de leucemia aguda durante un periodo de 4 años (del 1 enero de 1999 al 1 enero de 2003). Se analizaron los datos durante 10 años de seguimiento en el Hospital Infantil Miguel Servet de Zaragoza.
Del estudio se excluyeron aquellos pacientes fallecidos antes de recibir tratamiento quimioterápico (2 casos), los pacientes perdidos durante el seguimiento (2 casos) y aquellos en los que no se encontraron datos suficientes (1 caso), siendo un total de 47 los que fueron incluidos para formar parte del estudio.
Se recogieron datos epidemiológicos y de tratamiento recibido, incluyendo dosis de citostáticos, RT y TPH. El tratamiento recibido y la estadificación tumoral se llevó a cabo según los protocolos en el momento de diagnóstico vigentes (LAL/SHOP-94, LAL/SHOP-99, SHOP-LANL 2001 y PETHEMA LAL BR 01), definiendo pacientes con leucemia linfoblástica aguda de bajo riesgo (BR) los siguientes criterios: edad 1-9 años, leucocitos < 20x109/L, ausencia afectación extramedular, presencia de inmunofenotipo común (CD19+, CD10+ y ausencia de μ citoplasmática) y ausencia de hipodiploidía; riesgo intermedio (RI): edad 1-9 años, leucocitos < 20x109/L, ausencia de alteración citogenética desfavorable y de afectación extramedular, y < 5% de blastos en médula ósea en día +14 del tratamiento; alto riesgo (AR): edad al diagnóstico > 10 años, cualquier inmunofenotipo salvo el de bajo riesgo, leucocitos 20-200x109/L, afectación extramedular y pacientes de RI con > 5% de blastos en MO el día +14; muy alto riesgo (MAR), si además de lo anterior presentan: leucocitos > 200x109/L, mutaciones t(9;22) o BCR/ABL, t(4;11) o MLL, casi haploidía (24-29 cromosomas) o índice DNA < 0,6 (8). En las leucemias mieloblásticas se definieron: bajo riesgo (BR): < 100 x109/L, respuesta precoz al tratamiento (recuperación de las 3 series hematológicas con ausencia de blastos en sangre periférica y < 5% en médula ósea y LCR normal en 3 punciones consecutivas tras primer ciclo de inducción), síndrome Down o inv16, t(8;21); y alto riesgo (AR): presencia de monosomías 5 y 7 (9).
En cuanto a los FRCM, se definieron: obesidad al índice de masa corporal (IMC = peso en kg/talla en m2) por encima del p97, sobrepeso al IMC comprendido entre p85-p96 y normopeso entre el p10-p85 corregidos para la edad y sexo (10); resistencia a la insulina a la disminución de la respuesta biológica a la actividad de dicha hormona, considerándose con un índice HOMA (insulinemia en ayunas (μU/mL) x glucemia en ayunas (mmol/L)/ 22,5) mayor de 3 (11); intolerancia a hidratos de carbono a cifras de glucemia en ayunas 100-125 mg/dL o hemoglobina glicada A1c (Hb A1c) 5,7-6,5% y diabetes mellitus a glucemia en ayunas ≥ 126 mg/dL o Hb A1c ≥ 6,5% (12); dislipemia al aumento en las cifras de: triglicéridos ≥ 100 mg/dL (0-9 años)/≥ 130 mg/dL (10-19 años); colesterol total ≥ 200 mg/dL; LDL-colesterol ≥ 130 mg/dL o HDL-colesterol < 40 mg/dL (13), e hipertensión arterial a cifras de tensión arterial sistólica y diastólica mayores al p95 corregidas para la talla según edad y sexo (14). Se registraron estos parámetros en 3 momentos diferentes: al diagnóstico, al final del tratamiento y al final del seguimiento.
ANÁLISIS ESTADÍSTICO
Estudio descriptivo para conocer frecuencias, medidas de tendencia central y medidas de dispersión. Para el estudio analítico se emplearon diferentes test estadísticos, en función de la naturaleza de las variables. Para su realización se utilizó el paquete estadístico SPSS versión 21.0. El límite mínimo de significación estadística aceptado en todo el cálculo estadístico ha sido del 95% (p < 0,05).
Resultados
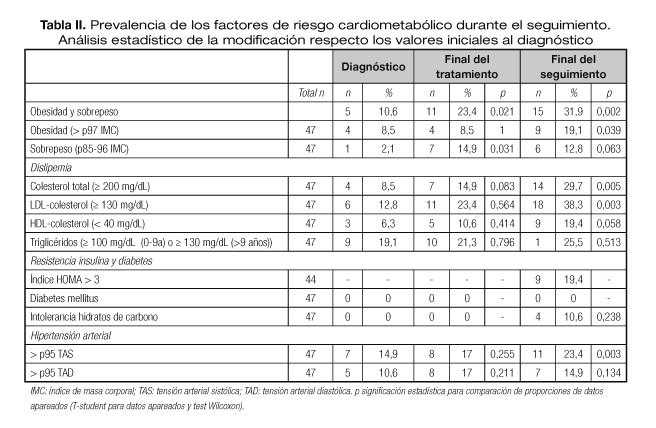
Se analizaron un total de 47 pacientes afectos de leucemia aguda, el 87,2% (41/47) de ellas de origen linfoblástico (LAL). La edad media al diagnóstico fue de 6,8 ± 4,4 años (2 meses - 15 años) y el grupo etario más frecuente el mayor de 5 años (53,2%). Todos los pacientes recibieron tratamiento con antraciclinas, el 25,5% (12/47) precisó radioterapia (9 irradiación corporal total (ICT), 3 craneoespinal) y el 27,7% (13/47) un trasplante de progenitores hematopoyéticos (TPH) (Tabla I). El 40,4% (19/47) de los pacientes presentó 1 FRCM, el 46,8% 2 (22/47) y el 12,8% 3 o más FRCM. A lo largo del seguimiento se observó un aumento significativo en la prevalencia de obesidad, dislipemia y resistencia a la insulina (Fig. 1).
OBESIDAD
El 31,9% (15/47) de los supervivientes presentaron obesidad o sobrepeso al final del seguimiento, lo cual supone un incremento del 21,3% respecto a las evaluaciones antropométricas al diagnóstico (p = 0,005) (Tabla II), siendo el 53,3% menores a 5 años. Predictores de este riesgo fueron: el sexo femenino (RR 3,16 IC 95%: 1,08-9,19), la edad al diagnóstico menor a 5 años (RR 1,27 IC 95%: 0,72-2,21), el TPH (RR 2,86 IC 95%: 1,03-7,89) y padecer una leucemia de alto/muy alto riesgo (RR 3,56 IC 95%: 1,22-10,38) (Tabla I).
RESISTENCIA A LA INSULINA Y DIABETES MELLITUS TIPO 2
El 19,4% (9/47) de los supervivientes presentó resistencia a la insulina al final del seguimiento y el 10,6% (4/47) hiperglucemia en rango de intolerancia de los hidratos de carbono, sin encontrar ningún paciente afecto de DM 2 (Tabla II). La RT y el elevado riesgo tumoral (AR y MAR) se asociaron de forma significativa con el desarrollo de resistencia a la insulina con un riesgo de presentarla del 2,47 (IC 95%: 1,02-6,39) y 4,08 (IC 95%: 1,04-16,1), respectivamente (Tabla I).
DISLIPEMIA
Al final del seguimiento, un 29,7% (14/47) de los pacientes presentaban elevación de las cifras de colesterol total con un colesterol medio final de 212,61 ± 20,72 mg/dL, así como el aumento del LDL-colesterol por encima del límite en el 38,3% (18/47) y descenso del HDL-colesterol en el 19,4% (9/47). Se encontró a lo largo del seguimiento un aumento estadísticamente significativo del colesterol y LDL, mientras que el descenso de HDL no alcanzó significación estadística (Fig. 2). La prevalencia de la hipertrigliceridemia no sufrió cambios significativos a lo largo del seguimiento (Tabla II).
HIPERTENSIÓN
La tensión arterial sistólica sufrió un ascenso significativo desde el diagnóstico hasta el final del seguimiento, del 14,9% al 23,4%, pero no lo hizo la tensión diastólica (Tabla II). El 72,7% (8/11) de los pacientes con hipertensión sistólica habían recibido TPH (RR 3,12 IC 95%: 1,16-8,32). En cuanto al tratamiento, los supervivientes que desarrollaron HTA sistólica recibieron mayores dosis de metrotexato (p = 0,05) y corticoide (p = 0,01), sin hallar diferencias con el resto de agentes antitumorales (Tabla I).
Discusión
Este estudio demuestra que los supervivientes de LA infantil presentan un riesgo aumentado de padecer ECV tras la curación de su enfermedad, que se incrementa a lo largo del tiempo. Este riesgo parece aumentado principalmente en función del pronóstico de la enfermedad y la agresividad del tratamiento.
Según los datos obtenidos, más del 40% presentó al menos un FRCM al final del seguimiento. La dislipemia por aumento del LDL fue el más frecuente (38,3%), seguido de obesidad/sobrepeso (31,9%) e HTA sistólica (23,4%). Estas cifras superan ampliamente las encontradas en niños y adolescentes sanos, en poblaciones estudiadas en el mismo periodo. A nivel nacional, estudios como enKid (15), Cuatro Provincias (16), Carmona (17) y el estudio ALADINO (18) muestran una prevalencia de obesidad en sujetos sanos del 13,95%, 9,4%, 7,4%, y 16,8% respectivamente. Otros estudios como RICARDIN (19) y FRICELA (20), e incluso estudios a nivel internacional (4), muestran una menor prevalencia de los FRCM que los expuestos en este estudio.
El perfil lipídico observado al final del seguimiento se puede clasificar como aterogénico según el Adult Treatment Panel III (ATP-PANEL III), por las cifras elevadas de lipoproteínas de baja densidad y bajos niveles de colesterol dependiente de lipoproteínas de alta densidad (4). No se evidenció en nuestro estudio el ascenso en los niveles sanguíneos de triglicéridos, descrito en la mayoría de los estudios de supervivencia del Chilhood Cancer Survivor (21,22).
En cuanto a la obesidad y sobrepeso son secuelas clásicamente descritas en supervivientes de cáncer infantil (23). Basándonos en el IMC como predictor de la composición corporal (24) durante el seguimiento, nuestros resultados son comparables a los descritos por Zhang (40%) (25) y Veringa (38,2%) (26), existiendo varias hipótesis acerca de las causas que contribuirían a esta deletérea ganancia ponderal, independientemente del tratamiento recibido. Atkinson (27) y Warner (28) coinciden en que el sexo femenino y una edad más precoz al diagnóstico conllevan un mayor riesgo de obesidad.
En nuestra muestra el sexo femenino parece ser un factor de riesgo de desarrollo de varios FRCM, pero no ocurre lo mismo con la edad.
El aumento observado en la prevalencia de obesidad es comparable a la de otros estudios (25,26,29), al igual que la resistencia a la insulina (30,31) y dislipemia (32), mostrando cómo los supervivientes de leucemia aguda infantil son más vulnerables para desarrollar enfermedad cardiovascular de forma precoz, puesto que, además de los factores definidos en la población general, estos sujetos están expuestos a otros adicionales que facilitan su desarrollo. En este sentido, se demuestra cómo ciertos tratamientos coadyuvantes suponen un riesgo para la presentación de 2 o más de los FRCM expuestos (33-35); el TPH sobre el desarrollo de obesidad y dislipemia, y la RT en la aparición de resistencia insulínica (30,31), suponiendo ambas un mayor riesgo para la aparición de HTA sistólica. La tensión diastólica no sufrió cambios significativos en la cohorte estudiada, a pesar de encontrarse descrita en otros estudios de mayor seguimiento (4,29,36), probablemente porque su desarrollo suele aparecer más tardíamente, entre los 10 y 30 años tras la finalización del tratamiento (34).
La principal limitación del estudio que debe tenerse en cuenta a la hora de interpretar los resultados es el pequeño tamaño muestral, que limita la potencia del estudio y la obtención de resultados significativos en el subanálisis de las variables. Por otra parte, es importante destacar que las estrategias terapéuticas modernas han minimizado el uso de la radioterapia craneal como preparación al TPH en pacientes afectos de leucemia aguda, lo que puede influir en un nuevo perfil cardiometabólico en estos pacientes. Sin embargo, pese a que el empleo de la radioterapia craneal se ha reducido en los últimos años, existe una gran parte de los supervivientes que la recibieron durante su tratamiento, para quienes los riesgos aquí descritos son relevantes. A pesar de estas limitaciones, el presente estudio aporta una nueva visión sobre la relación entre el pronóstico tumoral y el riesgo cardiovascular, asociando una mayor agresividad tumoral con la aparición temprana de obesidad, resistencia a la insulina y dislipemia.
En conclusión, la presencia a una edad temprana de 2 o más factores de riesgo cardiometabólico permite afirmar que los pacientes supervivientes de leucemia aguda infantil presentan riesgo incrementado de enfermedad cardiometabólica precoz. Estos hallazgos muestran la importancia de establecer adecuados protocolos de seguimiento que permitan un diagnóstico y tratamiento temprano de los mismos (37), así como la necesidad de implantar estrategias preventivas que promuevan adecuados hábitos de vida, con el objetivo de disminuir la morbimortalidad y mejorar la calidad de vida de estos enfermos.
Responsabilidades éticas
Se obtuvo la aprobación del Comité Ético de Investigación Clínica de Aragón (CEICA).
Bibliografía
1. Sociedad Española de Cardiología (SEC). Informe sobre la incidencia de la enfermedad cardiovascular en España. Disponible en: http://www.secardiologia.es/libros-multimedia/biblioteca-virtual/187-informe-de-la-enfermedades-cardiovascular-en-espana-2009. [ Links ]
2. Mertens AC, Liu Q, Neglia JP, Wasilewski K, Leisenring W, Armstrong GT, et al. Cause-specific late mortality among 5-year survivors of childhood cancer: the Childhood Cancer Survivor Study. J Natl Cancer Inst 2008;100(19):1368-79. [ Links ]
3. Mody R, Li S, Dover DC, Sallan S, Leisenring W, Oeffinger KC, et al. Twenty-five-year follow-up among survivors of childhood acute lymphoblastic leukemia: a report from the Childhood Cancer Survivor Study. Blood 2008;111(12):5515-23. [ Links ]
4. Nottage KA, Ness KK, Li C, Srivastava D, Robison LL, Hudson MM. Metabolic Syndrome and Cardiovascular Risk among Long-Term Survivors of Acute Lymphoblastic Leukaemia - From the St. Jude Life time Cohort. Br J Haematol 2014;165(3):364-74. [ Links ]
5. Armstrong GT, Oeffinger KC, Chen Y, Kawashima T, Yasui Y, Leisenring W, et al. Modifiable Risk Factors and Major Cardiac Events Among Adult Survivors of Childhood Cancer. J Clin Oncol 2013;31:3673-80. [ Links ]
6. Lipshultz SE, Landy D, Lopez-Mitnik G, Lipsitz SR, Hinkle AS, Constine LS, et al. Cardiovascular status of Childhood Cancer Survivors Exposed and Unexposed to Cardiotoxic Therapy. J Clin Oncol 2012;30(10):1050-7. [ Links ]
7. Registro Nacional de Tumores Infantiles (RNTI-SEHOP) Informe Estadístico 1980-2013. Disponible en: http://www.uv.es/rnti/pdfs/Informe_RNTI-SE-HOP_1980-2013.pdf. [ Links ]
8. Cubells Y. Protocolo de estudio y tratamiento de la leucemia aguda linfoblástica en pediatría (LAL/SHOP-99). Rev Esp Pediatr 2001;57:523-33. [ Links ]
9. Verdeguer A, Couselo JM, Fernández-Delgado R, Cubells J. Protocolo de estudio y tratamiento de la leucemia mieloide aguda en pediatría (Grupo de leucemias de las Sociedades Españolas de Hematología y Oncología Pediátricas). SHOP-LMA-2001. Disponible en: http://www.recerca.com/shop/entrar/prot_pdf/Protocolo%20LMA%202001%20y%20LPA99.pdf. [ Links ]
10. Grupo de trabajo de la Guía de Práctica Clínica sobre la Prevención y el Tratamiento de la Obesidad Infanto juvenil. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad y Política Social, 2009. Guías de Práctica Clínica del SNS: No 2007/25. Disponible en: http://www.guiasalud.es/GPC/GPC_452_obes_infantojuv_AATRM_compl.pdf. [ Links ]
11. Tresaco B, Bueno G, Pineda I, Moreno LA, Garagorri JM, Bueno M. Homeostatic model assessment (HOMA) index cut-off values to identify the metabolic syndrome in children. J Physiol Biochem 2005;61(2):381-8. [ Links ]
12. American diabetes association. Diagnosis and classification of diabetes mellitus. Diabetes Care 2010;33(1):S62-S69. [ Links ]
13. Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents. Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Children and Adolescents: summary report. Pediatrics 2011;128 (5):S213-S256. [ Links ]
14. Lurbe E, Cifkova R, Cruickshank JK, Dillon MJ, Ferreira I, Invitti C, et al. Manejo de la hipertensión arterial en niños y adolescentes: recomendaciones de la Sociedad Europea de Hipertensión. An Pediatr 2010;73:51.e1-28. [ Links ]
15. Serra Majem L, Ribas Barba EL, Aranceta Bartrina J, Pérez Rodrigo C, Saavedra Santana P, Peña Quintana L. Obesidad infantil y juvenil en España. Resultados del Estudio enKid (1998-2000). Med Clin 2003;121(19):725-32. [ Links ]
16. Garcés C, de Oya M. Factores de riesgo cardiovascular en la edad infantil. Resultados globales del estudio Cuatro Provincias. Rev Esp Cardiol 2007;60(5):517-24. [ Links ]
17. Martín S, López García-Aranda V, Almendro M. Prevalencia de factores de riesgo cardiovascular en la infancia y adolescencia: estudio Carmona. Clin Invest Arterioscl 2005;17(3):112-21. [ Links ]
18. Pérez-Farinós N, López-Sobaler AM, Dal Re MA, Villar C, Labrado E, Robledo T, et al. The ALADINO Study: A National Study of Prevalence of Overweight and Obesity in Spanish Children in 2011. Biomed Res Int 2013;2013:163687. [ Links ]
19. Brotons Cuixart C, Gabriel Sánchez R, Muñiz García J, Ribera Solé A, Málaga Guerrero S, Sáenz Aranzubia PE, et al. Patrón de la distribución de colesterol total y cHDL en niños y adolescentes españoles: estudio RICARDIN. Med Clin 2000;115(17):644-9. [ Links ]
20. Paterno CA. Factores de riesgo coronario en la adolescencia. Estudio FRICELA. Rev Esp Cardiol 2003;56(56):452-8. [ Links ]
21. Oudin C, Simeoni MC, Sirvent N, Contet A, Begu-Le Coroller A, Bordigoni P, et al. Prevalence and risk factors of the metabolic syndrome in adult survivors of childhood leukemia. Blood 2011;117(17):4442-8. [ Links ]
22. Steinberger J, Sinaiko AR, Kelly AS, Leisenring WM, Steffen LM, Goodman P, et al. Cardiovascular risk and insulin resistance in childhood cancer survivors. J Pediatr 2012;160:494-9. [ Links ]
23. Ford ES, Li C, Zhao G, Mokdad AH. Concentrations of Low-Density Lipoprotein Cholesterol and Total Cholesterol Among Children and Adolescents in the United States. Circulation 2009;119(8):1108-15. [ Links ]
24. van Santen HM, Geskus RB, Raemaekers S, van Trotsenburg AS, Vulsma T, van der Pal HJ, et al. Changes in body mass index in long-term childhood cancer survivors. Cancer 2015;121:4197-204. [ Links ]
25. Zee P, Chen CH. Prevalence of obesity in children after therapy for acute lymphoblastic leukemia. Am J Pediatr Hematol Oncol 1986;8(4):294-9. [ Links ]
26. Zhang FF, Rodday AM, Kelly MJ, Must A, MacPherson C, Roberts SB, et al. Predictors of being overweight or obese in survivors of pediatric acute lymphoblastic leukemia (ALL). Pediatr Blood Cancer 2014; 61(7):1263-9. [ Links ]
27. Atkinson HC, Marsh JA, Rath SR, Kotecha RS, Gough H, Taylor M, et al. Increased body mass index during therapy for childhood acute lymphoblastic leukemia: a significant and underestimated complication. Int J Pediatr 2015;2015:386413. [ Links ]
28. Warner EL, Fluchel M, Wright J, Sweeney C, Boucher KM, Fraser A, et al. Population-based study of childhood cancer survivors' body mass index. J Cancer Epidemiol 2014;2014:531958. [ Links ]
29. Veringa SJ, van Dulmen-den Broeder E, Kaspers GJ, Veening MA. Blood pressure and body composition in long-term survivors of childhood acute lymphoblastic leukemia. Pediatr Blood Cancer 2012;58(2):278-82. [ Links ]
30. Meacham LR, Sklar CA, Li S, Liu Q, Gimpel N, Yasui Y, et al. Diabetes mellitus in long term survivors of childhood cancer-increased risk associated with radiation therapy: a report for the childhood cancer survivor study. Arch Intern Med 2009;169(15):1381-8. [ Links ]
31. Oeffinger KC, Adams-Huet B, Victor RG, Church TS, Snell PG, Dunn AL, et al. Insulin resistance and risk factors for cardiovascular disease in young adult survivors of childhood acute lymphoblastic leukemia. J Clin Oncol 2009;27:3698-704. [ Links ]
32. Van Waas M, Neggers SJ, Pieters R, van den Heuvel-Eibrink MM. Components of the metabolic syndrome in 500 adult long-term survivors of childhood cancer. Ann Oncol 2010;21(5):1121-6. [ Links ]
33. Chow EJ, Simmons JH, Roth CL, Baker KS, Hoffmeister PA, Sanders JE, et al. Increased cardiometabolic traits in pediatric survivors of acute lymphoblastic leukemia treated with total body irradiation. Biol Blood Marrow Transplant 2010;16(12):1674-81. [ Links ]
34. Baker KS, Chow EJ, Goodman PJ, Leisenring WM, Dietz AC, Perkins JL, et al. Impact of Treatment Exposures on Cardiovascular Risk and Insulin Resistance in Childhood Cancer Survivors. Impact of Treatment Exposures on Cardiovascular Risk and Insulin Resistance in Childhood Cancer Survivors. Cancer Epidemiol Biomarkers Prev 2013;22(11):1954-63. [ Links ]
35. Faienza MF, Delvecchio M, Giodano P, Cavallo L, Grano M, Brunetti G, et al. Metabolic syndrome in childhood leukemia survivors: a meta-analysis. Endocrine 2015;49(2):353-60. [ Links ]
36. Meacham LR, Chow EJ, Ness KK, Kamdar KY, Chen Y, Yasui Y, et al. Cardiovascular risk factors in adult survivors of pediatric cancer-a report from the childhood cancer survivor study. Cancer Epidemiol Biomarkers Prev 2010;19(1):170-81. [ Links ]
37. Lipshultz SE, Adams MJ, Colan SD, Constine LS, Herman EH, Hsu DT, et al. Long-term cardiovascular toxicity in children, adolescents, and young adults who receive cancer therapy: pathophysiology, course, monitoring, management, prevention, and research directions: a scientific statement from the American Heart Association. Circulation 2013;128(17):1927-95. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Elena Guadalupe Corella Aznar.
Hospital Infantil Miguel Servet.
Paseo Isabel la Católica, 1-3.
50009 Zaragoza
e-mail: elena_corella88@hotmail.com
Recibido: 10/01/2016
Aceptado: 12/04/2016