My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.33 n.4 Madrid Jul./Aug. 2016
https://dx.doi.org/10.20960/nh.394
TRABAJO ORIGINAL / Otros
Estudio del impacto del índice de masa corporal pretrasplante sobre el pronto funcionamiento del injerto renal
Studying the impact of body mass index on pretransplant early renal graft function
Rafael Fernández Castillo1, Gustavo R. Cañadas de la Fuente1, Guillermo A. Cañadas de la Fuente1, Emilia Inmaculada de la Fuente Solana1, Rafael José Esteban de la Rosa2 y Juan Bravo Soto2
1Departamento de Enfermería. Facultad de Ciencias de la Salud. Universidad de Granada. Granada.
2Unidad de Hemodiálisis. Servicio de Nefrología. Hospital Universitario Virgen de las Nieves. Granada
Dirección para correspondencia
RESUMEN
Introducción: la obesidad y el sobrepeso presentan efectos adversos sobre la salud, lo que contribuye a la aparición de enfermedades metabólicas y cardiovasculares que ponen en peligro la integridad del injerto.
Objetivo: investigar la influencia del IMC pretrasplante renal sobre el funcionamiento del injerto renal al año de trasplante mediante el estudio de cuatro métodos distintos de medir la filtración glomerular.
Material y métodos: en este trabajo se ha seguido a 1.336 pacientes de ambos sexos trasplantados renales; se les realizaron mediciones pretrasplante y postrasplante de parámetros bioquímicos, mediciones antropométricas y función renal mediante medidas de filtrado glomerular.
Resultados: a mayor índice de masa corporal pretrasplante se produce una disminución del filtrado glomerular medido por cuatro métodos distintos, así como mayor porcentaje de rechazos.
Conclusiones: un IMC elevado pretrasplante contribuye a la disfunción del injerto, a una disminución del filtrado glomerular y a complicaciones del injerto en el primer año postrasplante.
Palabras clave: Trasplante renal. Alteraciones lipídicas. Hiperlipidemia. Hipertrigliceridemia. Antropometría. Densidad mineral ósea.
ABSTRACT
Introduction: Obesity and overweight have adverse health effects contributing to the presence of oxidative metabolic and cardiovascular diseases that threaten the integrity of the graft.
Objective: To investigate the influence of body mass index on pre transplant graft function one year after transplant by studying four different methods of measuring the glomerular filtration rate.
Material and methods: The sample consisted of 1336 kidney transplant patients of both sexes, measurements were performed pre transplant and post transplant of biochemical parameters, anthropometric measurements and kidney function by glomerular filtration steps.
Results: When an increased body mass index pretransplant occurs, there is a decrease in glomerular filtration rate measured by four different methods and greater percentage of rejections.
Conclusions: A high body mass index pretransplant contributes to graft dysfunction, a decrease in glomerular filtration rate and graft complications in the first year after transplant.
Key words: Renal transplantation. Lipid disorders. Hyperlipidemia. Hypertriglyceridemia. Anthropometry. Bone mineral density.
Introducción
Según datos de la Organización Mundial de la Salud de 2015, el número de adultos obesos se ha duplicado desde 1980. En el año 2014 el 39% de los adultos presentaban sobrepeso y el 13% obesidad (1). Esa tendencia también se puede observar en pacientes en listas de espera para trasplante renal. La obesidad y el sobrepeso presentan efectos adversos sobre la salud, no solo aumentan el riesgo de enfermedades cardiovasculares, como la hipertensión o la resistencia a la insulina, sino también la aparición de complicaciones quirúrgicas y perioperatorias (2,3).
Un elevado índice de masa corporal (IMC) en receptores de trasplante renal se ha asociado con resultados adversos inmediatamente después del mismo, tales como complicaciones de la herida, incluyendo dehiscencia, ruptura e infección (4). La relación entre el IMC, la función retardada del injerto y las complicaciones quirúrgicas en el paciente trasplantado renal (como la trombosis venosa profunda, estenosis ureteral, fuga y obstrucción, reintervención y hernia) no está clara; investigaciones previas han mostrado resultados contradictorios (5).
La obesidad se ha relacionado con complicaciones durante el trasplante de riñón, debido a un problema añadido cuando se interviene para trasplantar el órgano, los tiempos de funcionamiento del injerto tienden a ser más largos y se produce un retraso en la cicatrización (6,7). Por esta razón, algunos centros de trasplante excluyen a los pacientes con IMC superior a 30 kg/m2de las listas de espera de trasplante, mientras que otros se oponen a los pacientes con IMC superior a 35 kg/m2. Esta variación tan grande refleja la incertidumbre en torno a asociaciones entre el IMC, el retraso en el funcionamiento del injerto y las complicaciones quirúrgicas, de ahí la necesidad de una mayor investigación en esta área (8-10).
Objetivo
Este estudio tiene como objetivo investigar la influencia del IMC pretrasplante renal sobre el funcionamiento del injerto renal al año de trasplante mediante el estudio de cuatro métodos distintos de medir la filtración glomerular.
Material y métodos
PACIENTES
La muestra estuvo formada por 1.336 pacientes trasplantados renales de ambos sexos que acuden de forma periódica a la consulta de trasplante renal en el Hospital Universitario Virgen de las Nieves de Granada. No fueron seleccionados mediante procedimientos de muestreo aleatorio y su participación en el estudio estuvo determinada por la asistencia a la consulta en las fechas en que se realizó el mismo (marzo de 1998 a marzo de 2011) para su seguimiento y control. Las edades estaban comprendidas entre 16 y 80 años, 829 hombres y 506 mujeres en total. La enfermedad de base se recoge en la figura 1.
Métodos
A todos los pacientes se les efectuaron mediciones antropométricas de peso y altura. El peso se midió mediante una balanza tallímetro Perperson 113481 en kilogramos y la altura en metros. El índice de masa corporal fue calculado mediante la fórmula peso/talla², y agrupado según la clasificación de la OMS en IMC < 18,5 kg/m2: bajo peso; 18,5 a 24,99 kg/m2: normal; de 25 a 29,99 kg/m2: sobrepeso, y ≥ 30 kg/m2: obesidad.
La función renal se midió mediante cuatro métodos de estimación de la filtración glomerular: (FG)ormula de Cockcroft-Gault, EDTA Cr-51, MDRD (Modification of Diet in Renal Disease) y aclaramiento de creatinina sérica Crs.
Se aplicó la fórmula de Cockcroft-Gault para determinación del FG:

Además, se determinó el filtrado glomerular mediante inyección de radiofármaco EDTA Cr-51, para calcular este aclaramiento. Para ello se prepararon jeringas con actividad similar para el paciente y para la preparación de un estándar de dilución. Se extrajeron muestras sanguíneas a tiempos prefijados y se determinó el área bajo la curva de aclaramiento plasmático. El valor del aclaramiento se obtuvo a partir de la siguiente expresión:

Asimismo, se calculó la TFG según la ecuación MDRD (Modification of Diet in Renal Disease): TFGe (ml/min/1,73m2) = 186 x (CrS)-1,154 x (edad)-0,203 x (0,742 si es mujer).
Por último, se determinó en sangre la creatinina sérica (Crs) usando la reacción cinética de Jaffé (la creatinina reacciona en una solución alcalina con picrato formando un complejo de color rojo; se determina midiendo el aumento de absorbancia a 512 nm; la velocidad de formación del complejo es directamente proporcional a la concentración de creatinina).
Se recogieron datos de edad, sexo, pedida del injerto antes del año, datos de retraso del funcionamiento del injerto desde su implante, tipo de isquemia del injerto, rechazo agudo después del tercer mes postrasplante, hipertensión arterial después del año, aumento del colesterol > 250 mg al año, aumento del colesterol después del año, aumento de los triglicéridos > 250 mg al año, aumento de los triglicéridos después del año.
A todos los pacientes se les recomendó antes del alta del hospital consumir 1,4 a 1,5 g/kg por día de proteína, dieta de 30 a 35 calorías (kcal)/kg/día durante los primeros 3 meses después del trasplante renal; asimismo, los lípidos no debían representar más del 30% de la ingesta total de la dieta, evitando el consumo de azúcares simples. Después de 3 meses se les recomendó a los pacientes reducir el consumo de proteínas a 1 g/kg por día.
Los valores del filtrado glomerular se establecieron en la clasificación en estadios de la enfermedad crónica según las guías de la National Kidney Foundation (Tabla I).
ANÁLISIS ESTADÍSTICO
El análisis se realizó mediante el paquete estadístico IBM SPSS Statics 20. Los resultados se expresan como frecuencias, porcentajes y media ± desviación estándar. Para valorar las diferencias entre IMC y función renal se utilizó el análisis de varianza (ANOVA). Todos los datos se expresan en valor medio + desviación estándar (X ± DS), considerándose significación estadística con valores de p < 0,05. Se estudia el funcionamiento del injerto, en comparaciones dos a dos de los grupos con diferente IMC. Para ello se calcula la probabilidad bayesiana de obtener valores superiores en un grupo respecto al resto, en los cuatro tipos de filtrado. El análisis bayesiano se realiza con el programa WinBugs.
Resultados
Como se puede apreciar en la tabla II, a medida que aumenta el IMC se produce un mayor porcentaje de pérdidas del injerto; lo mismo ocurre con la normalidad de funcionamiento del riñón, que ve retrasada su función. Asimismo, se produce un rechazo agudo del riñón después del tercer mes, sobre todo en pacientes con obesidad. Otro hecho constatable es el aumento del porcentaje de pacientes con hipertensión y el porcentaje de pacientes que ven aumentado su colesterol por encima de 250 mg/dl y de triglicéridos por encima de 200 mg/dl a medida que aumenta el IMC. Lo mismo ocurre con el porcentaje de pacientes que experimentan un aumento de colesterol y triglicéridos al año de ser trasplantados.
La media de edad de pacientes trasplantados es mayor entre aquellos que presentan bajo peso. No parece haber diferencias entre el tipo de isquemia al que se sometió el riñón y el IMC del paciente, así como el tiempo que el paciente estuvo en diálisis (Tabla III).
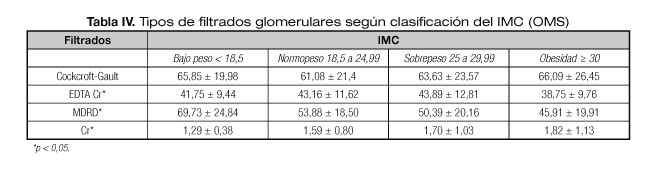
En cuanto a la función glomerular medida por cuatro métodos distintos (Tabla IV), vemos cómo se produce una disminución del filtrado en las medidas de EDTA-Cr y MDRD estadísticamente significativa a medida que aumenta el IMC; en cambio, no se produce una disminución, sino un aumento, en la fórmula de Cockcroft-Gault y creatinina sérica, también en esta última estadísticamente significativa a medida que aumenta el IMC.
Se compara el funcionamiento del injerto en los cuatro grupos de IMC, considerados dos a dos mediante análisis inferencial bayesiano. En la tabla V se incluyen las probabilidades de obtener indicadores superiores en cada grupo con respecto a los restantes, en los cuatro tipos de filtrado considerados. Los resultados apoyan la tendencia que aparecía en análisis anteriores (Tabla IV), incluso cuando se realiza el análisis de comparaciones específicas de los grupos, lo que constituye una mayor garantía en las inferencias que se concluyen para este tipo de pacientes.
Discusión
Muchos estudios han demostrado que un aumento del índice de masa corporal después del trasplante renal puede afectar desfavorablemente no solo a la función del injerto, sino también al injerto y a la supervivencia del paciente. También hay un mayor riesgo de complicaciones perioperatorias y enfermedades concomitantes (11-14).
Nuestro estudio se ha focalizado fundamentalmente en observar el comportamiento de la función renal al año de ser trasplantado el paciente, centrándonos en el IMC pretrasplante del paciente. En este sentido se produjo un alto porcentaje de pérdidas de injertos en pacientes con IMC antes del trasplante con bajo peso, sobrepeso y obesidad, hecho que concuerda con otros estudios que consideran que un IMC inadecuado es un factor de riesgo para la pérdida y rechazo prematuro del injerto (15,16). Lo mismo ocurre con la función retrasada del injerto, tanto la obesidad como el sobrepeso representan un serio inconveniente para que el riñón mantenga una adecuada filtración, hecho que coincide con otros estudios donde se observa la obesidad como factor de riesgo para el establecimiento de una función renal normalizada (17,18).
Otro de los factores no menos importantes es el hecho del aumento y mantenimiento del colesterol y los triglicéridos después del trasplante y su correlación con el peso y la diabetes. Muchos estudios consideran que un IMC ≥ 30 kg/m2, junto con las cifras de colesterol y triglicéridos encontradas en nuestro estudio, presenta un aumento significativo del riesgo de desarrollar diabetes mellitus postrasplante permanente en pacientes, por lo que el sobrepeso puede llevar a un efecto negativo a largo plazo en el metabolismo de la glucosa y producir complicaciones cardiovasculares y rechazo en estos pacientes (19-21).
En este estudio hemos demostrado que un IMC > 30 kg/m2 antes del trasplante renal se correlaciona con un mayor porcentaje de disfunción del injerto. Además, hemos demostrado que a medida que aumenta el IMC se produce una disminución del filtrado glomerular, sobre todo en las medidas tomadas mediante los métodos de EDTA Cr y MDRD. En cambio, con la fórmula de Cockcroft-Gault y la determinación de creatinina sérica no ocurre. Esto es debido a que este último método es un marcador del daño renal, por tanto, a medida que se aumenta el IMC se produce también un mayor sufrimiento renal, hecho que confirman y corroboran los hallazgos de otros estudios que han demostrado que un mayor índice de masa corporal provoca hiperfiltración (22-24) y una mayor concentración de creatinina en suero y, como resultado, una disminución del volumen del filtrado glomerular (25).
En conclusión, un IMC elevado pretrasplante contribuye a la disfunción del injerto, a una disminución del filtrado glomerular y a complicaciones del injerto en el primer año postrasplante.
Bibliografía
1. Zrim S, Furlong T, Grace B, Meade A. Body mass index and postoperative complications in kidney transplant recipients. Nephrology (Carlton) 2012;17:582-7. [ Links ]
2. Aalten J, Christiaans M, de Fijter H, Hené R, van der Heijde JH, Roodnat J, et al. The influence of obesity on short and long-term graft and patient survival after renal transplantation. Transpl Int 2006;19:901-7. [ Links ]
3. Chang S, Coates O, McDonald S. Effects of body mass index at transplant on outcomes of kidney transplantation. Transplantation 2007;84:981. [ Links ]
4. Fernández Castillo R, Fernández Gallegos R, Peña Amaro MP, Esteban de la Rosa RJ. Assessment of lipid profiles and bone mineral density in renal transplant patients. Nutr Hosp 2015;31(6):2503-10. [ Links ]
5. Fernández Castillo R, De Alarcon RM, Esteban RJ, Haouari O, Planell E, Perán F, et al. Bone mineral density in patients with renal hyperparathyroidism undergoing surgery: relationship with bone parameters. Med Clin (Barc) 2010;135:156-9. [ Links ]
6. Sharif A, Moore R, Baboolal K. Influence of lifestyle modification in renal transplant recipients with postprandial hyperglycemia. Transplantation 2008;85:353-8. [ Links ]
7. Favaloro R, Peradejordi M, Bertolotti A, Diez M, Favaloro L, Gomez C, et al. Results of heart transplantation: 16 years' experience in a center in Argentina. Transplant Proc 2010;42(1):321-3. [ Links ]
8. Fernández Castillo R, Fernández Gallegos R, Gomez Urquiza JL, Cañadas de la Fuente GA, Esteban de la Rosa RJ, Peña Amaro MP. Study and prevalence of post-transplant diabetes mellitus; analysis on a group of kidney transplant recipients. Nutr Hosp 2014;30(4):813-7. [ Links ]
9. Fernández Castillo R, Fernández Gallegos R, Esteban de la Rosa RJ, Peña Amaro MP. Longitudinal study of weight and body mass index after renal transplantation during 5 years of evolution. Nutr Hosp 2014;30(2):287-92. [ Links ]
10. Nazemian F, Naghibi M. Weight-gain-related factors in renal transplantation. Exp Clin Transplant 2005;3(1):329-32. [ Links ]
11. Kisielnicka E, Zdrojewski Z, Wróblewska M, Kortas B, Rutkowski B. Lipid disturbances in a two-year follow-up after successful kidney transplantation. Transplant Proc 2000;32(6):1358-62. [ Links ]
12. Tse KC, Lam MF, Yip PS, Li FK, Lai KN, Chan TM, et al. A long-term study on hyperlipidemia in stable renal transplant recipients. Clin Transplant 2004;18(3):274-80. [ Links ]
13. Hernández D, Álvarez A, Torres A. Cardiovascular risk profile in nondiabetic renal transplant patients: cyclosporine versus tacrolimus. Transplant Proc 2003;35:1727-9. [ Links ]
14. Martins L, Ventura A, Costa S, Henriques A, Dias L, Sarmento A. Long-term complications after renal transplantation. Transplant Proc 2003;35(3):1083-4. [ Links ]
15. Fernández Castillo R, Fernández Gallegos R, Zaragoza Fernández GM. Longitudinal study of the metabolic syndrome after kidney transplantation. Nutr Hosp 2014;31(3):1142-6. [ Links ]
16. Vega J, Huidobro JP, De La Barra S, Haro D. Influence of weight gain during the first year after kidney transplantation in the survival of grafts and patients. Rev Med Chil 2015;143(8):961-70. [ Links ]
17. O'Hare AM, Choi AI, Bertenthal D, Bacchetti P, Garg AX, Kaufman JS, et al. Age affects outcomes in chronic kidney disease. J Am Soc Nephrol 2007;18:2758-65. [ Links ]
18. Berman N, Hostetter TH. Comparing the Cockcroft-Gault and MDRD equations for calculation of GFR and drug doses in the elderly. Nat Clin Practice 2007;3:644-5. [ Links ]
19. Chan G, Garneau P, Hajjar R. The impact and treatment of obesity in kidney transplant candidates and recipients. Can J Kidney Health Dis 2015;2:26. [ Links ]
20. Huang E, Bunnapradist S. Pre-Transplant Weight Loss and Survival after Kidney Transplantation. Am J Nephrol 2015;41(6):448-55. [ Links ]
21. Chang A, Greene TH, Wang X, Kendrick C, Kramer H, Wright J, et al. The effects of weight change on glomerular filtration rate. Nephrol Dial Transplant 2015;30(11):1870-7. [ Links ]
22. Booth JC, Joseph JT, Jindal RM. Influence of hipercolesterolemia on patient and graft survival in recipients of kidney transplants. Clin Transplant 2003;17:101-5. [ Links ]
23. Boratynska M, Banasik M, Watorek E, Klinger M, Dorobisz A, Szyber P. Influence of hypercholesterolemia and acute graft rejection on chronic nephropathy development in renal transplant recipient. Transplant Proc 2003;35(6):2209-12. [ Links ]
24. Suarez O, Pardo M, Gonzalez S, Escobar-Serna DP, Castaneda DA, Rodriguez D, et al. Diabetes mellitus and renal transplantation in adults: is there enough evidence for diagnosis, treatment, and prevention of new-onset diabetes after renal transplantation? Transplant Proc 2014;46(9):3015-20. [ Links ]
25. Marks WH, Florence LS, Chapman PH, Precht AF, Perkinson DT. Morbid obesity is not a contraindication to kidney transplantation. Am J Surg 2004;187(5):635-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rafael Fernández Castillo.
Universidad de Granada. Facultad de Ciencias de la Salud.
Parque Tecnológico de Ciencias de la Salud.
Avda. de la Ilustración, s/n. 18071 Granada
e-mail: rafaelfernandez@ugr.es
Recibido: 20/11/2015
Aceptado: 04/02/2016