Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.33 no.6 Madrid nov./dic. 2016
https://dx.doi.org/10.20960/nh.809
Efecto del tratamiento dietoterápico de la obesidad sobre el metabolismo óseo
Effect of dietary treatment of obesity on bone metabolism
Juan José López Gómez1,3, José Luis Pérez Castrillón2,3, Enrique Romero Bobillo1,3 y Daniel A. de Luis Román1,3
1Servicio de Endocrinología y Nutrición. Hospital Clínico Universitario de Valladolid.
2Servicio de Medicina Interna. Hospital Universitario RÍo Hortega.
3Centro de Investigación de Endocrinología y Nutrición. Facultad de Medicina. Universidad de Valladolid. Valladolid
Dirección para correspondencia
RESUMEN
La obesidad interfiere con el metabolismo óseo a través de factores mecánicos, hormonales e inflamatorios. El principal tratamiento de dicha enfermedad es la dieta, modificación de la cantidad y tipo de alimento. Este tratamiento nutricional tiene una influencia sobre el metabolismo óseo en dos sentidos: modifica el efecto del sobrepeso y la obesidad sobre el hueso e interviene directamente en el turnover óseo a través de las características de los nutrientes utilizados.
Esta revisión analiza la evidencia del efecto sobre el hueso del descenso de peso y del patrón dietético utilizado. Por otra parte, se valorarán las modificaciones que se pueden realizar en la dieta indicada en un paciente obeso para prevenir la pérdida ósea, a corto y largo plazo, y disminuir el riesgo de fractura.
Palabras clave: Obesidad. Metabolismo óseo. Terapia dietética. Pérdida de peso.
ABSTRACT
Obesity interferes with bone metabolism through mechanical, hormonal and inflammatory factors. The main treatment of this disease is the diet with modification of the amount and type of food. This nutritional therapy has an influence on bone metabolism in two ways: It modifies the effect of overweight and obesity on bone; and it intervenes in bone turnover through the characteristics of the nutrients used.
This review examines the evidence of the effect on bone of weight loss and dietary pattern used. Moreover, we will assess the modifications that can be made in weight-reduction diet to prevent short and long term bone loss and reduce the risk of fracture.
Key words: Obesity. Bone metabolism. Diet therapy. Weight loss.
Introducción
Clásicamente se han considerado el sobrepeso e índice de masa corporal (IMC) elevado como factores protectores de la osteoporosis y el riesgo de fractura (1,2). En el momento actual esta relación no parece estar tan clara y, en algunos casos, se ha relacionado la obesidad y su tratamiento con alteraciones en el metabolismo óseo y el aumento del riesgo de fractura (3,4). Esta situación se puede deber a que la obesidad actúa sobre el hueso a través de factores mecánicos, hormonales e inflamatorios, algunos de ellos pueden promover la formación ósea mientras que otros contribuyen a su destrucción (5).
El tratamiento básico de la obesidad es la modificación de los patrones alimentarios y de actividad física para conseguir el descenso de peso con la menor tasa de efectos adversos posible. Se ha planteado que este tratamiento de la obesidad y los déficits nutricionales asociados al mismo pueden influir negativamente sobre el metabolismo óseo. Esta modificación dietética puede repercutir sobre la salud ósea a través de dos vías: modificando el efecto beneficioso de la situación de obesidad sobre el hueso (carga mecánica, efecto hormonal parcial...); e interviniendo directamente en el turnover óseo por las características de la terapia utilizada (6).
Según estas premisas será necesario valorar el efecto de la dieta sobre el hueso desde dos puntos de vista: uno cuantitativo, relacionado con la propia restricción calórica y el descenso de peso; y otro cualitativo, debido a la utilización de determinados nutrientes que pueden intervenir en el metabolismo óseo (7).
Es, por tanto, importante conocer los factores que influyen sobre la pérdida de masa ósea en relación con el tratamiento dietético de la obesidad, aquellos pacientes más susceptibles al daño óseo tras realizar un descenso del peso corporal y aquellas modificaciones en el tratamiento dietoterápico que pueden mejorar la salud ósea. El conocimiento de estas tres circunstancias nos permitirá realizar un tratamiento más personalizado y que minimice el desarrollo de complicaciones a nivel del hueso.
Factores modificadores del metabolismo óseo relacionadoscon el tratamiento de la obesidad
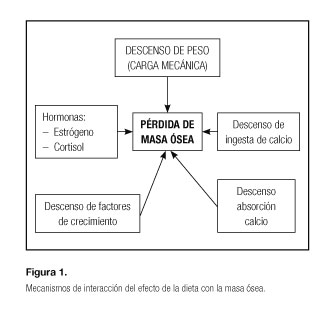
Al analizar el tratamiento dietoterápico en la obesidad mediante dietas estrictas, que optimizan la bajada de peso de manera rápida, se postula que se asocian a una pérdida de masa ósea en relación con los siguientes factores (Fig. 1):
- La pérdida de peso, sobre todo en aquellas dietas con gran pérdida de masa magra, puede producir una reducción de la carga mecánica realizada sobre el hueso y una pérdida de masa ósea (8,9).
- Clásicamente se ha pensado que un aumento de ingesta proteica (sobre todo si se asocia a restricción importante de la ingesta de hidrato de carbono) se asocia a una acidosis metabólica leve, lo que produce que, a través del aumento de funcionamiento del buffer óseo, exista una pérdida de masa ósea (10).
- Por otra parte las dietas relacionadas con aumento de ingesta proteica se asocian a un aumento en el consumo de grasa que puede interferir en la absorción del calcio (11).
- Además la disminución en la ingesta de distintos nutrientes que influyen sobre el metabolismo del hueso como el calcio, la vitamina D o el magnesio puede producir un aumento de la resorción ósea a través del aumento compensador de PTH. Asimismo, además de la disminución en la ingesta de calcio parece existir una disminución en la eficiencia de su absorción en el intestino; esto se relaciona con la influencia relativa de un descenso dietético de la vitamina D. Aunque la vitamina D puede aumentar con la pérdida de peso al disminuir la adiposidad (12).
- Durante la pérdida de peso debido a la disminución de la masa grasa se produce una disminución de los estrógenos circulantes y otras hormonas sexuales, además del aumento de proteína transportadora de hormonas sexuales (SHBG). Estos cambios pueden influir negativamente en los osteoblastos y estimular la actividad de los osteoclastos. Estas modificaciones suelen ser más importantes en pacientes ancianos (13,14).
- En el ámbito hormonal hipofisario se encuentra bien contrastado también el descenso de la IGF-1 durante las dietas restrictivas; lo que puede disminuir su efecto anabólico sobre el hueso (15).
Descenso de peso y pérdida de masa ósea
La pérdida de peso relacionada con la dieta actúa como el principal efector de activación del metabolismo óseo y la pérdida de masa ósea en el paciente con obesidad en tratamiento dietético.
Se ha observado que una pérdida de peso de un 10% respecto del peso inicial se asocia con una pérdida de masa ósea de 1-2% en columna y cadera y 3-4% en zonas de predominio trabecular como trocánter y radio (16,17). Por otra parte una pérdida de peso moderada (5-10%) puede relacionarse con la preservación de la masa ósea frente al mantenimiento de la obesidad (18). En esta línea también se ha observado que en hombres y mujeres ancianos la tasa de pérdida ósea es el doble (12,19). Por tanto no se conoce hasta qué punto es importante esta pérdida de masa respecto a la propia de la edad, la intensidad de la pérdida de peso y el mantenimiento de esa pérdida de peso a lo largo del tiempo.
El efecto de la dieta y la pérdida de peso sobre la activación del metabolismo óseo parece más marcada en las mujeres. Esta situación se repite en la literatura observándose en mujeres postmenopáusicas un aumento del turnover óseo y descenso de la densidad mineral ósea a un año de inicio de una dieta pobre en lácteos (20) y de manera similar en una dieta con pérdida de peso (21). Se observó el mismo efecto sobre el metabolismo óseo con un aumento en los niveles de crosslaps en mujeres premenopáusicas que realizaron una dieta hipocalórica (22).
El efecto más importante de este descenso de masa ósea es el riesgo de fractura. Se ha observado que pérdidas de peso de más del 5% producen mayor pérdida de masa ósea y riesgo de fractura, este efecto aumenta conforme aumenta la pérdida de peso. En dos estudios a largo plazo sobre 11.000 y 7.500 pacientes mostraron en 10 y 17 años de seguimiento un incremento de la fractura no vertebral con un Odds Ratio (OR) de 1,70 en el primero y un OR de 1,33 en el segundo. Esto muestra que la pérdida de peso ya sea voluntaria o involuntaria puede inducir una pérdida de masa ósea y un incremento del riesgo de fractura (23,24).
Existe una influencia importante del sexo, la edad y el peso inicial sobre la pérdida ósea secundaria al descenso de peso. Así se ha podido demostrar que existe pérdida de masa ósea en hombres y mujeres ancianos pero este cambio no se ha objetivado en personas más jóvenes, esto se puede relacionar con una mayor masa muscular en jóvenes (25). En cuanto al peso inicial, existe mayor pérdida de hueso en pacientes en los que el peso anterior a la pérdida de peso es menor.
Tanto la masa grasa como la masa libre de grasa son factores independientes del contenido en masa ósea. Un descenso en el contenido de masa grasa ha demostrado una relación con el descenso de densidad mineral ósea (26). De la misma manera se ha observado que un descenso de la masa muscular se asocia con una pérdida de masa ósea (27,28). A pesar de estos hallazgos parece que la masa muscular se encuentra relacionada más intensamente con la densidad mineral ósea que la masa grasa y el peso. De esta manera, una pérdida de masa magra (0,9%) con un aumento de masa grasa (9%) se asocia con un descenso de la masa ósea (1,6%) tras cinco años de seguimiento (29).
Por tanto las estrategias dietéticas en el manejo de la obesidad deben ir encaminadas a la pérdida de peso con el mantenimiento o la menor pérdida posible de masa muscular. Esto puede conseguirse con modificaciones en el patrón dietético, o bien, mediante la realización de ejercicio físico regular de manera concomitante al desarrollo del plan dietético (30).
Prevención del deterioro de la masa ósea
Debido a la potencial pérdida de masa ósea relacionada con la pérdida de peso se han valorado distintos cambios cualitativos o suplementaciones en la dieta a tener en cuenta en pacientes de riesgo (Fig. 2):
SUPLEMENTO CON CALCIO
Según distintos ensayos clínicos aleatorios la suplementación con calcio puede disminuir el aumento de la actividad del eje PTH-Calcio y minimizar la pérdida de masa ósea previamente comentada. Las dosis administradas van desde 0,8 a 1,8 g de calcio al día (17,31,32). La principal limitación de estos estudios es que no se valora la ingesta de calcio previa al inicio de la dieta restrictiva y el efecto del calcio se podría relacionar con el llenado del espacio resortivo.
Por otra parte, la mayor parte de los estudios con suplementación con calcio se encuentran realizados en mujeres, normalmente postmenopáusicas (17,31,32). En hombres no existen estudios con suficiente potencia, aunque también podría ser beneficioso. Es necesaria más evidencia en otros grupos poblacionales (5).
En el tratamiento de la obesidad, el aumento del calcio dietético y la modificación cualitativa de la ingesta puede llevar a cambios en la relación calcio:fósforo (Ca:P). Habitualmente la dieta normal y la dieta hipocalórica se asocian a ingestas incrementadas en fósforo y, relativamente bajas en calcio, esta situación nos lleva a una relación Ca:P disminuida (33). El aumento del fósforo dietético y, sobre todo, la disminución en la relación Ca:P se asocia a un incremento de la resorción ósea (34,35). Por esta razón, se ha postulado que en las dietas hipocalóricas es necesario incrementar la cantidad de calcio dietético, así como un descenso del consumo de fósforo. Este perfil de alimentación se consigue con un aumento de los alimentos con una relación Ca:P alta y un descenso de alimentos ricos en fósforo (quesos curados, sardina, marisco, chocolate, huevos, carnes rojas...) (36).
AUMENTO DEL APORTE DE PROTEINAS
Clásicamente se consideró que un aumento de la carga ácida de la dieta de pérdida de peso, asociada a una ingesta hiperproteica, se podría relacionar con un descenso de la masa ósea (37). Aunque recientemente y a la luz de nuevas evidencias se viene postulando que una ingesta proteica en torno al 24% del contenido calórico total puede prevenir la pérdida de masa ósea (16). Este efecto se sustenta en que existe una mejoría sobre la masa ósea por varios mecanismos: a) atenuación del descenso de IGF-1 (38,39); b) optimización de la absorción de calcio intestinal, regulando el metabolismo cálcico y óseo (40); y c) preservación de la masa magra que permite un efecto mecánico positivo sobre el hueso (17).
El efecto de las dietas hiperproteícas sobre el metabolismo óseo varía en función de la fuente analizada. Múltiples estudios no han demostrado beneficio del aumento del porcentaje proteico sobre la masa ósea en la pérdida de peso (41) aunque en estos casos no se estudió el efecto sobre el riesgo de fractura.
El principal problema de estos estudios es la heterogeneidad del diseño, características iniciales de los pacientes, fuente de proteína utilizada y, sobre todo patrón dietético en el que se engloba.
La principal limitación de estos hallazgos es que la mayoría de estudios realizados no se encuentran controlados por la ingesta de calcio. En aquellos estudios que separan la ingesta de calcio de la ingesta de proteínas parece que la suplementación de calcio tiene un efecto mayor que el incremento proteico sobre los marcadores de resorción ósea (42). No obstante en otros trabajos, el efecto del consumo de una dieta hiperproteíca con una suplementación de calcio y vitamina D parece asociarse con una mejoría en la densidad mineral ósea (43).
En resumen el patrón dietético hiperproteico podría asociarse a una mejoría en los parámetros de resorción ósea (44,45) y un descenso en la pérdida de densidad mineral ósea (46) aunque estos datos no son concluyentes y no se ha demostrado que se produzca un aumento de la misma (47).
SUPLEMENTOS DE VITAMINA D
En la población obesa existe un descenso de los niveles de vitamina D sobre todo en situaciones de alto grado de la misma (48,49). La modificación de los niveles de la vitamina D secundaria al descenso de peso puede producirse en dos sentidos: por una parte se puede producir un descenso en relación con la disminución de la ingesta de determinados tipos de alimento; por otra puede producirse un aumento relativo de los niveles plasmáticos al disminuir la masa grasa y el secuestro de vitamina D por la misma (50).
El efecto de la asociación de calcio con vitamina D en la prevención del descenso de la masa ósea es bien conocido (51). Aunque, en el momento actual, no está bien establecido que esta asociación pueda ser beneficiosa en las dietas hipocalóricas debido a la falta de evidencia.
En el déficit de vitamina D asociado a la obesidad parece ser necesario un incremento de la ingesta de vitamina D para evitar el daño sobre el hueso. Esta suplementación debería realizarse de manera continua, intentando evitar megadosis con largos intervalos de tiempo intermedios pues o no se observa beneficios o podría aumentar del riesgo de fractura (52-54).
Los niveles plasmáticos de 25OH vitamina D necesarios para evitar alteraciones secundarias al déficit se encuentran por encima de 30 ng/ml (51), aunque las concentraciones óptimas son aquellas que están entre 36-40 ng/ml.
Las recomendaciones dietéticas de vitamina D son de 15 μg/día (600 UI) hasta los 71 años y a partir de entonces, de 20 μg/día (800 UI) (55,56); aunque en muchos casos estas cantidades no son suficientes para mantener niveles adecuados de vitamina D en sangre teniendo que recomendar cantidades superiores a 1.000 UI/día (57). El paciente obeso suele necesitar cantidades mayores de esta vitamina para conseguir niveles plasmáticos adecuados necesitando 2,5 UI/kg para elevar 1 ng/ml en plasma (58).
OTROS NUTRIENTES
Entre los nutrientes que se consideran protectores de la masa ósea se encuentran las isoflavonas, fitoestrógenos que se encuentran predominantemente en la soja. El efecto de estos nutrientes sobre el metabolismo óseo se realiza a través de dos vías: a) facilitando la 1-alfa-hidroxilación de la vitamina D; y b) activando el receptor estrogénico que produce un aumento de la osteoprotegerina, que produce un descenso en la resorción ósea, además de inducir la formación ósea a través de la estimulación de la actividad del osteoblasto (59).
Al analizar el efecto de los suplementos con isoflavonas de soja se observa un aumento de la densidad mineral ósea con un descenso de los parámetros de resorción urinarios, mientras que no se encuentra efecto sobre los marcadores de formación en suero. Los efectos sobre la masa ósea pueden relacionarse con la menopausia, el tipo de suplementación y la duración de la intervención (60).
Se han valorado otros nutrientes y alimentos que pueden ser beneficiosos sobre el metabolismo óseo, de esta manera podrían mejorar la masa ósea el almidón resistente a la amilasa, ciruelas pasas, semilla de lino y ajo. Aunque ninguno tiene una evidencia suficiente como para ser recomendados más allá de los comentados (5).
EJERCICIO FÍSICO
El acompañamiento de la dieta restrictiva por el ejercicio físico puede tener múltiples efectos beneficiosos: a) mejorar en la eficiencia de la pérdida y el mantenimiento de peso; b) prevenir la pérdida de masa magra y potenciar la pérdida de masa grasa; y c) minimizar la pérdida de masa ósea al aumentar la carga mecánica sobre el hueso durante el propio ejercicio y durante el reposo al potenciar la masa magra (61,62).
Este efecto se ha corroborado en distintos ensayos clínicos, aunque se puede ir perdiendo conforme se va reduciendo el peso, y no se observa diferencia en estudios de corta duración (63).
Los ejercicios más beneficiosos son aquellos en los que actúan varias fuerzas sobre el hueso como efecto de la gravedad y la carga muscular (5). De esta manera, incluso en pacientes con pesos bajos como las gimnastas, se ha observado un aumento de la densidad mineral ósea en zona lumbar y cuello femoral más que en corredores, donde se entrenan menos grupos musculares, y aún más que en nadadores donde el efecto de la gravedad es menor (64).
En los pacientes mayores de 65 años (mayor riesgo de descenso de masa ósea) se ha observado que el volumen de ejercicio (sobre todo el de resistencia) es extremadamente importante para atenuar la pérdida de hueso y músculo (65).
La realización del ejercicio en los pacientes con obesidad puede ser difícil debido a la limitación mecánica y/o a los hábitos de vida. Por tanto, es especialmente importante ajustar el tipo de ejercicio en función del paciente y monitorizarlo adecuadamente para poder conseguir una mayor eficacia.
Patrones dietéticos y pérdida de masa ósea
En la mayor parte de los casos la dieta prescita para perder peso no consiste únicamente en una restricción energética sino que se realiza también una modificación cualitativa de la misma lo que lleva el cambio en múltiples nutrientes y, por tanto del patrón dietético. Es, por tanto, interesante valorar el efecto sobre el hueso de los patrones dietéticos más frecuentemente utilizados en la obesidad.
DIETAS BAJAS EN HIDRATOS DE CARBONO Y DIETAS CETOGÉNICAS
En los últimos años se han popularizado las dietas bajas en hidratos de carbono en el tratamiento de la obesidad frente a las dietas bajas en grasa.
Las dietas bajas en hidrato de carbono son aquellas que restringen este macronutriente a menos de 20-60 g/día (< 20% del aporte calórico total) mientras que se denominan cetogénicas aquellas que aportan menos de 20 g/día.
Estas dietas han mostrado un mejor perfil en la pérdida de peso a corto plazo y una eficacia similar a largo plazo que las dietas bajas en grasa (66). Pero, por otra, parte tienen un mayor perfil de efectos secundarios como malestar, calambres, cefaleas y múltiples déficit vitamínicos (A, B, C, E) y de minerales (calcio, magnesio, hierro, potasio) (67,68).
Estas dietas pueden tener una influencia negativa sobre el hueso a través de la acidificación del medio interno relacionada con la cetosis que puede potenciar el buffer óseo y la hipercalciuria (69). El déficit vitamínico y de minerales puede frenar la formación ósea. Y, por último, el aumento de alimentos ricos en grasas saturadas y ácidos grasos omega-6 puede potenciar el daño sobre el hueso (70).
Los estudios sobre el efecto de las dietas bajas en hidrato de carbono sobre el hueso son escasos. En la mayor parte de los casos no se observa un efecto sobre los marcadores de metabolismo óseo frente a una dieta control (71,72). Tampoco se observó variación en la densidad mineral ósea ni en ratas ni en humanos (73,74). Aunque el mantenimiento de una dieta cetogénica en pacientes con densidad mineral ósea baja de base puede empeorar su situación basal (75). La principal limitación de estos estudios es el pequeño tamaño muestral y la corta duración de los mismos que no permite valorar el efecto sobre la densidad mineral ósea y el riesgo de fractura.
DIETA MEDITERRÁNEA
El patrón basado en la dieta mediterránea se basa en un alto consumo de vegetales, legumbres, frutas y cereales; consumo moderado-alto de pescado; un bajo consumo de grasas saturadas con un predominio de insaturadas, cuya fuente principal es el aceite de oliva; bajo-moderado consumo de lácteos y un consumo moderado de alcohol, la mayor parte en forma de vino (76).
Este patrón dietético en condiciones isocalóricas no ha demostrado superioridad a otras dietas en el descenso de peso, pero se usa de manera hipocalórica en gran cantidad de las dietas de adelgazamiento (66).
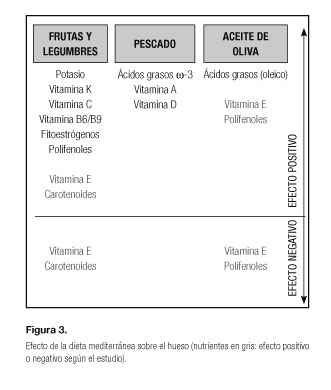
Los alimentos contenidos en la dieta mediterránea se asocian a moléculas con efecto antioxidante, antiinflamatorio y de pH alcalino que pueden influir sobre la salud ósea (77). Los distintos componentes de la dieta que actúan a este nivel son (Fig. 3):
- Aceite de oliva: así como el consumo de grasas saturadas parece tener un efecto negativo sobre el hueso, los ácidos grasos monoinsaturados y, en especial, el aceite de oliva podrían producir un efecto beneficioso sobre el hueso como se ha observado en varios estudios (78,79). Esta situación se puede relacionar con su efecto antiinflamatorio.
- Consumo de frutas y vegetales: la mejoría en el metabolismo y la masa ósea relacionada con estos alimentos se puede relacionar con los componentes de los mismo como minerales (alcalinizantes); las vitaminas (antioxidantes), los productos fitoquímicos, en especial fitoestrógenos y los oligosacáridos. Estos pueden influir sobre la optimización de la absorción del calcio y la optimización del metabolismo óseo (76).
- Consumo moderado de alcohol: el consumo moderado de alcohol, predominantemente bebidas de baja graduación (vino, cerveza...) pueden tener un efecto beneficioso sobre el hueso (80). Es importante la cantidad, pues un consumo excesivo puede tener un efecto contrario disminuyendo la densidad mineral ósea y aumento el riesgo de caídas; con un incremento del riesgo de fractura (76).
- Consumo de pescado: esta característica de la dieta mediterránea afecta al hueso en distintos aspectos como el aporte de una fuente de proteína de alta calidad biológica, ácidos grasos omega-3, vitamina D y minerales como el calcio, yodo y zinc. Estos nutrientes en conjunto y por separado tienen un efecto beneficioso sobre la densidad mineral ósea y pueden disminuir el riesgo de fractura (81-83). Entre estos nutrientes destaca el estudio de los ácidos grasos omega-3 que han mostrado en dietas enriquecidas con los mismos no producir variaciones sobre la masa ósea en la pérdida de peso (84), y, aun así en algunos casos, disminuir el riesgo de fractura relacionada con fragilidad (85).
A pesar de la hipótesis formulada y lo mecanismos que la sustentan la evidencia sobre el efecto positivo en la masa ósea es controvertida. Por una parte bastantes estudios han demostrado que el efecto combinado de los distintos nutrientes contenidos mejoran los marcadores de turnover (79), masa ósea (86) y disminuyen el riesgo de fractura (87,88). Pero, por otra, también muchas investigaciones no han mostrado efecto alguno sobre los parámetros relacionados con el metabolismo óseo y sus consecuencias (89,90).
Se hacen necesarios más estudios con un diseño más adecuado para demostrar una posible relación beneficiosa. De la misma manera sería necesario dilucidar el efecto del descenso de peso asociado a la dieta mediterránea con el efecto sobre el hueso y el riesgo de fractura.
DIETAS DE MUY BAJO CONTENIDO CALÓRICO
Las dietas de muy bajo contenido calórico o very low calorie diets (VLCD) son una modalidad de tratamiento dietético de la obesidad que aportan menos de 800 kcal/día. Se realizan normalmente a través de fórmulas artificiales con un rango de aportes mínimos tanto de macro como de micronutrientes (hidratos de carbono y grasas disminuidas con un aumento del aporte proteico) (91). Son dietas que se deben utilizar con indicaciones clínicas concretas y seguimiento estricto debido a la alta tasa de complicaciones que pueden producir (71).
El efecto principal de estas dietas es una reducción de peso importante (92) que puede producir un descenso de la densidad mineral ósea como se ha comentado previamente. Pero el contenido cualitativo de las mismas suele ser de alta carga proteica por lo que puede existir un efecto positivo sobre la masa ósea (93). Dado que son dietas que se mantienen durante un período corto de tiempo no se sabe si el efecto que tienen sobre el hueso es recortado o puede mantenerse a largo plazo y tener repercusión sobre el riesgo de fractura.
Al comparar este tipo de dietas con una dieta hipocalórica estándar en algunos casos no han mostrado un efecto negativo sobre el hueso, en relación con la sustitución parcial de comidas (94) o bien con una suplementación específica de algunos micronutrientes como vitamina D (95). Por otra parte existen otros estudios en los que existe un incremento de los parámetros de turnover óseo en aquellos pacientes sometidos a dietas VLCD completas (únicamente con alimentación artificial); en ocasiones este efecto puede persistir durante la fase de mantenimiento de peso (96).
En cualquier caso el efecto neto de las dietas VLCD sobre el hueso aún no es bien conocido debido a la escasez de estudios existentes, la heterogeneidad de ellos y la corta duración de los mismos. Se requiere más evidencia para poder dilucidar su papel sobre el metabolismo óseo.
Recomendaciones generales de dieta para perder peso en el paciente obeso
El principal efecto de la dietoterapia de la obesidad sobre el hueso se produce a través del descenso del peso. Es necesario un descenso de peso paulatino, moderado, mantenido y acompañado de ejercicio físico para conseguir un menor efecto negativo sobre el hueso.
La influencia de los alimentos sobre el metabolismo óseo se da a través de los nutrientes aislados pero, sobre todo, tiene efecto mediante la integración de estos en patrones dietéticos específicos. Es necesaria una mayor evidencia para conocer que patrones nutricionales tienen un efecto más positivo sobre el hueso para poder aplicarlos en los grupos de riesgo.
Por tanto, en la realización de un protocolo de tratamiento dietético para la obesidad de cara a disminuir la alteración del metabolismo óseo y el riesgo de fractura habrá que tener en cuenta las siguientes consideraciones dietéticas:
- Consumo de una dieta con un contenido adecuado en proteínas en torno al 18-25% del valor calórico total.
- Consumo de una cantidad suficiente de calcio y vitamina D para conseguir llegar al menos a las RDA según edad y sexo para un mantenimiento adecuado de los niveles sanguíneos. Si es preciso añadir suplementación farmacológica de calcio y vitamina D, en función del peso y enfermedades asociadas.
- Restricción del consumo de fósforo dietético a unos niveles dentro de las RDA.
- Complementar la dieta con ejercicio físico frecuente de tipo, intensidad y duración ajustadas a la edad y patologías concomitantes.
Conclusiones
La elección del tratamiento dietético de la obesidad puede influir sobre la patología ósea en determinados grupos de pacientes. Por lo tanto en la decisión sobre el tipo de dieta habrá que tener en cuenta el efecto de la misma sobre el metabolismo óseo.
En resumen para optimizar un adecuado tratamiento dietético en la obesidad es preciso: a) conocer y detectar las alteraciones del metabolismo óseo que pueden estar relacionadas con la obesidad; b) adaptar el tratamiento dietoterápico (patrón dietético y ejercicio físico) a las características fisiopatológicas del paciente; y c) añadir una suplementación de micronutrientes (calcio y vitamina D, preferentemente) en los casos en los que sea necesario.
Bibliografía
1. De Laet C, Kanis JA, Odén A, Johanson H, Johnell O, Delmas P, et al. Body mass index as a predictor of fracture risk: a meta-analysis. Osteoporos Int 2005;16:1330-8. [ Links ]
2. Felson DT, Zhang Y, Hannan MT, Anderson JJ. Effects of weight and body mass index on bone mineral density in men and women: the Framingham Study. J Bone Miner Res 1993;8:567-73. [ Links ]
3. Johansson H, Kanis JA, Oden A, McCloskey E, Chapurlat RD, Christiansen C. A meta-analysis of the association of fracture risk and body mass index in women. J Bone Miner Res 2014;29(1):223-33. [ Links ]
4. Caffarelli C, Alessi C, Nuti R, Gonnelli S. Divergent effects of obesity on fragility fractures. Clin Interv Aging 2014;9:1629-36. [ Links ]
5. Shapses SA, Sukumar D. Bone Metabolism in Obesity and Weight Loss. Annu Rev Nutr 2012;32:287-309. [ Links ]
6. Villalon KL, Gozansky WS, Van Pelt RE, Wolfe P, Jankowski CM, Schwartz RS, et al. A losing battle: weight regain does not restore weight loss-induced bone in postmenopausal women. Obesity (Silver Spring). 2011;19(12):2345-50. [ Links ]
7. Valtueña S. Obesidad y osteoporosis: efecto de la variación ponderal sobre la masa ósea. Nutr Hosp 2002;17:49-54. [ Links ]
8. Kohrt WM, Barry DW, Schwartz RS. Muscle forces or gravity: What predominates mechanical loading on bone? Med Sci Sports Exerc 2009;41: 2050-5. [ Links ]
9. Weinheimer EM, Sands LP, Campbell WW. A systematic review of the separate and combined effects of energy restriction and exercise on fat-free mass in middle-aged and older adults: implications for sarcopenic obesity. Nutr Rev 2010;68:375-88. [ Links ]
10. Wachman A, Bernstein DS. Diet and osteoporosis. Lancet 1968;1:958-9. [ Links ]
11. Cao JJ. Effects of obesity on bone metabolism. J Orthop Surg Res 2011;6:30-7. [ Links ]
12. Shapses SA, Riedt CS. Bone, body weight and weight reduction: what are the concerns? J Nutr 2006;136(6):1453-6. [ Links ]
13. Ettinger B, Pressman A, Sklarin P, Bauer DC, Cauley JA, Cummings SR. Associations between low levels of serum estradiol, bone density, and fractures among elderly women: the Study of Osteoporotic Fractures. J Clin Endocrinol Metab 1998;83:2239-43. [ Links ]
14. Khosla S, Melton LJ III, Atkinson EJ, O'Fallon WM, Klee GG, Riggs BL. Relationship of serum sex steroid levels and bone turnover markers with bone mineral density in men and women: a key role for bioavailable estrogen. J Clin Endocrinol Metab 1998;83:2266-74. [ Links ]
15. Niu T, Rosen CJ. The insulin-like growth factor-I gene and osteoporosis: a critical appraisal. Gene 2005;361:38-56. [ Links ]
16. Sukumar D, Ambia-Sobhan H, Zurfluh R, Sclussel Y, Stahl TJ, et al. Areal and volumetric bone mineral density and geometry at two levels of protein intake during caloric restriction: a randomized, controlled trial. J Bone Miner Res 2011;26:1339-48. [ Links ]
17. Riedt CS, Cifuentes M, Stahl T, Chowdhury HA, Schlussel Y, Shapses SA. Overweight postmenopausal women lose bone with moderate weight reduction and 1 g/day calcium intake. J Bone Mineral Res 2005;20:455-63. [ Links ]
18. Pop LC, Sukumar D, Tomaino K, Schlussel Y, Schneider SH, Gordon CL, et al. Moderate weight loss in obese and overweight men preserves bone quality. Am J Clin Nutr 2015;101:659-67. [ Links ]
19. Bleicher K, Cumming RG, Naganathan V, Travison TG, Sambrook PN, et al. The role of fat and lean mass in bone loss in older men: findings from the CHAMP study. Bone 2011;49:1299-305. [ Links ]
20. Labouesse MA, Gertz ER, Piccolo BD, Souza EC, Schuster GU, Witbracht MG, et al. Associations among endocrine, inflammatory, and bone markers, body composition and weight loss induced bone loss. Bone 2014;64:138-46. [ Links ]
21. Chao D, Espeland MA, Farmer D, Register TC, Lenchik L, Applegate WB, et al. Effect of voluntary weight loss on bone mineral density in older overweight women. J Am Geriatr Soc 2000;48(7):753-9. [ Links ]
22. Uusi-Rasi K, Sievanen H, Kannus P, Pasanen M, Kukkonen-Harjula K, Fogelholm M. Influence of weight reduction on muscle performance and bone mass, structure and metabolism in obese premenopausal women. J Musculoskelet Neuronal Interact 2009;9(2):72-80. [ Links ]
23. Wilsgaard T, Jacobsen BK, Ahmed LA, Joakimsen RM, Stormer J, Jorgensen L. BMI change is associated with fracture incidence, but only in non-smokers. The Tromsø Study Osteoporos Int 2011;22:1237-45. [ Links ]
24. Omsland TK, Schei B, Gronskag AB, Langhammer A, Forsen L, Gjesdal CG, et al. Weight loss and distal forearm fractures in postmenopausal women: the Nord-Trondelag health study, Norway. Osteoporos Int 2009;20:2009-16. [ Links ]
25. Redman LM, Rood J, Anton SD, Champagne C, Smith SR, Ravussin E. Calorie restriction and bone health in Young, overweight individuals. Arch Intern Med 2008;168:1859-66. [ Links ]
26. Bosy-Westphal A, Later W, Schautz B, Lagerpusch M, Goele K, Heller M, et al. Impact of intra- and extra-osseus soft tissue composition on changes in bone mineral density with weight loss and regain. Obesity (Silver Spring) 2011;19(7):1503-10. [ Links ]
27. Sowers MF, Kshirsagar A, Crutchfield MM, Updike S. Joint influence of fat and lean body composition compartments on femoral bone mineral density in premenopausal women. Am J Epidemiol 1992;136(6):257-65. [ Links ]
28. Tirosh A, De Souza RJ, Sacks F, Bray GA, Smith SR, LeBoff MS. Sex differences in the effects of weight loss diets on bone mineral density and body composition: POUNDS LOST Trial. J Clin Endocrinol Metab 2015;100(6):2463-71. [ Links ]
29. Pasco JA, Gould H, Brennan SL, Nicholson GC, Kotowicz MA. Musculoskeletal deterioration in men accompanies increases in body fat. Obesity 2014;22(3):863-7. [ Links ]
30. Hunter GR, Byrne NM, Sirikul B, Fernandez JR, Zuckerman PA, Darnell BE, et al. Resistance training conserves fat free mass and resting energy expenditure following weight loss. Obesity 2008;16:1045-51. [ Links ]
31. Ricci TA, Chowdhury HA, Heymsfield SB, Stahl T, Pierson RN, Shapses SA. Calcium supplementation suppresses bone turnover during weight reduction in postmenopausal women. J Bone Miner Res 1998;13:1045-50. [ Links ]
32. Jensen LB, Quaade F, Sorensen OH. Bone minerals changes in obese women during a moderate weight loss with and without calcium supplementation. J Bone Miner Res 2001;16:141-7. [ Links ]
33. Pinheiro MM, Schuch NJ, Genaro PS, Ciconelli RM, Ferraz MB, Martini LA. Nutrient intakes related to osteoporotic fractures in men and women-The Brazilian Osteoporosis Study (BRAZOS). Nutr J 2009;8:6. [ Links ]
34. Kemi VE, Kärkkäinen MU, Rita HJ, Laaksonen MM, Outila TA, Lamberg-Allardt CJ. Low calcium: phosphorus ratio in habitual diet affects serum parathyroid hormone concentration and calcium metabolism in healthy women with adequate calcium intake. Br J Nutr 2010;103(4):561-8. [ Links ]
35. Brot C, Jorgensen N, Madsen R, Jensen LB, Sorensen OH. Relationships between bone mineral density, serum vitamin D metabolites and -calcium: phosphorus intake in healthy perimenopausal women. J Intern Med 1999;245(5):509-16. [ Links ]
36. Radak TL. Caloric restriction and calcium's effect on bone metabolism and body composition in overweight and premenopausal women. Nutr Rev 2004;62(12):468-81. [ Links ]
37. Conigrave AD, Brown EM, Rizzoli R. Dietary protein and bone health: roles of amino acid-sensing receptors in the control of calcium metabolism and bone homeostasis. Annu Rev Nutr 2008;28:131-55. [ Links ]
38. Larsson S, Wolk K, Brismar K, Wolk A. Association of diet with serum insulin-like growth factor I in middle-aged and elderly men. Am J Clin Nutr 2005;81:1013-6. [ Links ]
39. Takata Y, Maskarinec G, Rinaldi S, Kaaks R, Nagata C. Serum insulin-like growth factor-I levels among women in Hawaii and Japan with different levels of tofu intake. Nutr Cancer 2006;56:136-42. [ Links ]
40. Kerstetter J, O'Brien K, Insogna K. Dietary protein, calcium metabolism, and skeletal homeostasis revisited. Am J Clin Nutr 2003;78(Suppl):S584-92. [ Links ]
41. Santesso N, Akl EA, Bianchi M, Mente A, Mustafa R, Heels-Ansdell D, et al. Effects of higher- versus lower-protein diets on health outcomes: a systematic review and meta-analysis. Eur J Clin Nutr 2012;66:780-88. [ Links ]
42. Shapses S, Robin S, Schwartz E, Chowdhury H. Short-term changes in calcium but not protein intake alter the rate of bone resorption in health subjects as assessed by urinary pyridinium cross-link excretion. J Nutr 1995;125:2814-21. [ Links ]
43. Dawson-Hughes B, Harris S. Calcium intake influences the association of protein intake with rates of bone loss in elderly men and women. Am J Clin Nutr 2002;75:773-9. [ Links ]
44. Josse AR, Atkinson SA, Tarnopolsky MA, Phillips SM. Diets higher in dairy foods and dietary protein support bone health during diet- and exercise-induced weight loss in overweight and obese premenopausal women. J Clin Endocrinol Metan 2012;97:251-60. [ Links ]
45. Bowen J, Noakes M, Clifton PM. A high dairy protein, high calcium diet minimizes bone turnover in overweight adults during weight loss. J Nutr 2004;134(3):568-73. [ Links ]
46. Thorpe MP, Jacobson EH, Layman DK, He X, Kris-Etherton PM, Evans EM. A diet high in protein, dairy, and calcium attenuates bone loss over twelve months of weight loss and maintenance relative to a conventional high-carbohydrate diet in adults. J Nutr 2008;138(6):1096-100. [ Links ]
47. Jesudason D, Nordin BE, Keogh J, Clifton P. Comparison of 2 weight-loss diets of different protein content on bone health: a randomized trial. Am J Clin Nutr 2013;98:1343-52. [ Links ]
48. Buffington C, Walker B, Cowan GS, Scruggs D. Vitamin D deficiency in the Morbidly Obese. Obes Surg 1993;3:421-4. [ Links ]
49. Carlin AM, Rao DS, Meslemani AM, Genaw JA, Parikh NJ, Levy S, Bhan A, Talpos GB. Prevalence of vitamin S depletion among morbidly obese patients seeking gastric bypass surgery. Surg Obes Relat Dis 2006;2(2):98-103. [ Links ]
50. Wortsman J, Matsuoka LY, Chen TC, Lu Z, Holick MF. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr 2000;72:690-3. [ Links ]
51. Watts NB, Bilezikian JP, Camacho PM, Greenspan SL, Harris ST, Hodgson SF, Kleerekoper M. American Association of Clinical Endocrinologists Guidelines for Clinical Practice for the diagnosis and treatment of postmenopausal osteoporosis. Endocr Pract 2010;16(Suppl 3):1-37. [ Links ]
52. Jorde R, Sneve M, Torjesen PA, Figenschau Y, Hansen J-B, Grimnes G. No significant effect on bone mineral density by high doses of vitamin D3 given to overweight subjects for one year. Nutr J 2010;9,1. DOI:10.1186/1475-2891-9-1. [ Links ]
53. Sanders KM, Stuart AL, Williamson EJ, Simpson JA, Kotowicz MA, Young D, Nicholson GC. Annual high-dose oral vitamin D and falls and fractures in older women: A randomized controlled trial. JAMA 2010;303:1815-22. [ Links ]
54. Steffensen LH, Jorgensen L, Straume B, Mellgrem SI, Kampman MT. Can vitamin D(3) supplementation prevent bone loss in persons with MS? A placebo-controlled trial. J Neurol 2011;258:1624-31. [ Links ]
55. González-Campoy J, St Jeor ST, Castorino K, Ebrahim A, Hurley D, Jovanovic L, et al. Clinical Practice Guidelines for healthy eating for the prevention and treatment of metabolic and endocrine diseases in adults: cosponsored by the American association of clinical endocrinologists/The American College of Endocrinology and The Obesity Society. Endocr Pract 2013;19(Suppl 3):1-82. [ Links ]
56. SENC. Objetivos nutricionales para la población española. Consenso de la Sociedad Española de Nutrición Comunitaria 2011. Rev Esp Nutr Com 2011;17:178-99. [ Links ]
57. Bischoff-Ferrari HA, Giovanucci E, Willet WC, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr 2006;84:18-28. [ Links ]
58. Drincic A, Fuller E, Heaney RP, Armas LA. 25-hydroxyvitamin D response to graded vitamin D3 supplementation among obese adults. J Clin Endocrinol Metab 2013;98:4845-51. [ Links ]
59. Park CY, Weaver CM. Vitamin D interactions with soy isoflavones on bone after menopause: a review. Nutrients 2012;4(11):1610-21. [ Links ]
60. Wei P, Liu M, Chen Y, Chen DC. Systematic review of soy isoflavone supplements on osteoporosis in women. Asian Pac J Trop Med 2012;5(3):243-8. [ Links ]
61. Santanasto AJ, Glynn Nw, Newman MA, Taylor CA, Brooks MM, et al. Impacto of weight loss on physical function with changes in strength, muscle mass, and muscle fat infiltration in overweight to moderately obese older adults: a randomized clinical trial. J Obes 2011;2011:516576. [ Links ]
62. Villareal DT, Chode S, Parimi N, Sinacore DR, Hilton T, et al. Weight loss, exercise, or both and physical function in obese older adults. N Engl J Med 2011;364:1218-29. [ Links ]
63. Beavers DP, Beavers KM, Loeser RF, Walton NR, Lyles MF, Nicklas BJ, et al. The independent and combined effects of intensive weight loss and exercise training on bone mineral density in overweight and obese, older adults with osteoarthritis. Osteoarthritis Cartilage 2014;726-33. [ Links ]
64. Taaffé DR, Robinson TL, Snow CM, Marcas R. High-impact exercise promotes bone gain in well-trained female athletes. J Bone Res 1997;12:255-60. [ Links ]
65. Waters DL, Ward AL, Villareal DT. Weight loss in obese adults 65 years and older: a review of the controversy. Exp Gerontol. 2013;48(10):1054-61. [ Links ]
66. Gargallo M, Basulto J, Bretón I, Quiles J, Salas-Salvadó J, Formiguera X, et al. Recomendaciones nutricionales basadas en la evidencia para la prevención y el tratamiento del sobrepeso y la obesidad en adultos (Consenso FESNAD-SEEDO). Rev Esp Obes 2011;10(S1):1-80. [ Links ]
67. Freedman MR, King J, Kennedy E. Popular diets: a scientific review. Obes Res 2001;9(Suppl 1):1S-40S. [ Links ]
68. Yancy WS, Olsen MK, Guyton JR, Bakst RP, Westman EC. A low carbohydrate, ketogenic diet versus a low-fat diet to treat obesity and hyperlipidemia: a randomized controlled trial. Ann intern Med 2004;140:769-77. [ Links ]
69. Barzel US, Massey LK. Excess dietary protein can adversely affect bone. J Nutr 1998;128(6):1051-3. [ Links ]
70. MacDonald HM, New SA, Golden MH, Campbell MK, Reid DM. Nutritional association with bone loss during menopausal transition: evidence of a beneficial effect of calcium, alcohol, and fruit and vegetable nutrients and detrimental effects of fatty acids. Am J Clin Nutr 2004;79(1):155-65. [ Links ]
71. Carter JD, Vasey FB, Valeriano J. The effect of a low-carbohydrate diet on bone turnover. Osteoporos Int 2006;17:1398-403. [ Links ]
72. Bertoli S, Striuli L, Testolin G, Cardinali S, Veggiotti P, Salvatori GC, et al. Nutritional status and bone mineral mass in children treated with ketogenic diet. Recenti Prog Med. 2002; 93(12): 671-5. [ Links ]
73. Zengin A, Kropp B, Chevalier Y, Junnila R, Sustarsic E, Herbach N, et al. Low-carbohydrate, high fat diets have sex-specific effects on bone health in rats. Eur J Nutr 2015; DOI 10.1007/s00394-015-1040-9. [ Links ]
74. Bertoli S, Trentani C, Ferraris C, De Giorgis V, Veggiotti P, Tagliabue. Long-term effects of a ketogenic diet on body composition and bone mineralization in GLUT-1 deficiency syndrome. Nutrition 2014;30:726-8. [ Links ]
75. Bergqvist AG, Schall JI, Stallings VA, Zemel BS. Progressive bone mineral content loss in children with intractable epilepsy treated with the ketogenic diet. Am J Clin Nutr 2008;88:1678-84. [ Links ]
76. Romero Pérez A, Rivas Velasco A. Adherence to Mediterranean diet an bone health. Nutr Hosp 2014;29(5):989-96. [ Links ]
77. Puel C, Coxam V, Davicco MJ. Mediterranean diet and osteoporosis prevention. Med Sci (Paris) 2007;23:756-60. [ Links ]
78. Rivas A, Romero A, Mariscal-Arcas M, Moteagudo C, Feriche B, Lorenzo ML, Olea F. Mediterranean diet and bone mineral density in two ages groups of women. Int J Food Sci Nutr 2013;64(2):155-61. [ Links ]
79. Fernández-Real JM, Bulló M, Moreno-Navarrete JM, Ricart W, Ros E, Estruch R, et al. A Mediterranean diet enriched with olive oil is associated with higher serum total osteocalcin levels in elderly men at high cardiovascular risks. J Clin Endocrinol Metab 2012;97(10):3792-8. [ Links ]
80. Tucker KL, Jugdaohsingh R, Powell JJ, Qiao N, Hannan MT, Sripanyakorn S, et al. Effects of beer, wine, and liquor intakes on bone mineral density in older men and women. Am J Clin Nutr 2009;89(49):1188-96. [ Links ]
81. Chen YM, Ho SC, Lam SS. Higher sea fish intake is associated with greater bone mass and lower osteoporosis risk in postmenopausal Chinese women. Osteoporos Int 2010;21:939-46. [ Links ]
82. Paunescu AC, Ayotte P, Dewailly E, Dodin S, Pedersen HS, Mulvad G, et al. Polyunsatured fatty acids and calcaneal ultrasound parameters among Inuit women from Nuuk (Greenland): a longitudinal study. Int J Circumpolar Health 2013;72:20988. [ Links ]
83. Calderón-García JF, Morán JM, Roncero-Martín R, Rey-Sánchez P, Rodríguez-Velasco FJ, Pedrera-Zamorano JD. Dietary habits, nutrients and bone mass in Spanish premenopausal women: the contribution of fish to better bone health. Nutrients 2012;5(1):10-22. [ Links ]
84. Longo AB, Ward WE. PUFAs, bone mineral density, and fragility fracture: findings from human studies. Adv Nutr 2016;7(2):299-312. [ Links ]
85. Chen JS, Hill CL, Lester S, Ruediger CD, Battersby R, Jones G, et al. Supplementation with omega-3 fish oil has no effect on bone mineral density in adults with knee osteoarthritis: a 2-year randomized controlled trial. Osteoporos Int 2016;27(5):1897-905. [ Links ]
86. Rivas A, Romero A, Mariscal M, Monteagudo C, Hernández J, Olea-Serrano F. Validation of questionnaires for the study of food habits and bone mass. Nutr Hosp 2009;24(5):521-8. [ Links ]
87. Benetou V, Orfanos P, Petterson-Kymmer U, Bergström U, Svensson O, Johansson I, et al. Mediterranean diet and incidence of hip fractures in a European cohort. Osteoporos Int 2013;24(5):1587-98. [ Links ]
88. Feart C, Lorrain S, Ginder Coupez V, Samieri C, Letenneur L, Paineau D et al. Adherence to a Mediterranean diet and risk of fractures in French older persons. Osteoporos Int 2013;24(12):3031-41. [ Links ]
89. Bullo M, Amigo-Correig P, Márquez-Sandoval F, Babio N, Martínez González MA, Estruch R, et al. Mediterranean diet and high dietary acid load associated with mixed nuts: effect on bone metabolism in elderly subjects. J Am Geriatr Soc 2009;57(10):1789-98. [ Links ]
90. Kontogianni MD, Melistas L, Yannakoulia M, Malagaris I, Panagiotakos DB, Yiannakouris N. Association between dietary patterns and indices of bone mass in a sample of Mediterranean women. Nutrition 2009;25:165-71. [ Links ]
91. SCOOP-VLCD Task 73. Reports on tasks for scientific cooperation. Collection of data onn products intended for use in very low valorie diets. 2002. [ Links ]
92. De Luis D, Domingo JC, Izaola O, Casanueva FF, Bellido D, Sajoux I. Effect of DHA supplementation in a very low-valorie diet ketogenic diet in the treatment of Obesity: a randomized clinical trial. Endocrine 2016 Apr 27. (Epub ahead of print). [ Links ]
93. Vilchez López FJ, Campos Martín C, Amaya García MJ, Sánchez Vera P, Pereira Cunill JL. Las dietas de muy bajo valor calórico (DMBVC) en el manejo clínico de la obesidad mórbida. Nutr Hosp 2013;28(2):275-85. [ Links ]
94. Li Z, Treyzon L, Chen S, Yan E, Thames G, Carpenter CL. Protein-enriched meal replacements do not adversely affect liver, kidney or bone density: an outpatient randomized controlled trial. Nutr Journal 2010;9:72. [ Links ]
95. Leeds AR. Formula Food-reducing diets: a new evidence-based addition to the weight management tool box. Nutr Bull 2014;39(3):238-46. [ Links ]
96. Hinton PS, LeCheminan JD, Smith BK, Rector RS, Donnelly JE. Weight loss-induced alterations in serum markers of bone turnover persist during weight maintenance in obese men and women. J Am Coll Nutr 2009;28(5):565-73. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan José López Gómez.
Servicio de Endocrinología y Nutrición.
Hospital Clínico Universitario Valladolid.
Avenida Ramón y Cajal, 3.
47003 Valladolid
e-mail: jjlopez161282@hotmail.com
Recibido: 16/05/2016
Aceptado: 22/08/2016