My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.34 suppl.3 Madrid 2017
https://dx.doi.org/10.20960/nh.1376
Requerimientos en nutrición parenteral pediátrica
Requirements for pediatric parenteral nutrition
Cecilia Martínez Costa1 y Consuelo Pedrón Giner2
1Sección de Gastroenterología y Nutrición Pediátrica. Hospital Clínico. Universidad de Valencia. 2Sección de Gastroenterología y Nutrición Pediátrica. Hospital Infantil Universitario Niño Jesús. Madrid
INTRODUCCIÓN
La nutrición parenteral (NP) en el niño enfermo tiene como principal objetivo suministrar las demandas específicas de energía y nutrientes debidas a su enfermedad, manteniendo un balance de energía positivo que permita un crecimiento y desarrollo adecuados, procurando evitar tanto la infra como la sobrenutrición.
REQUERIMIENTOS ENERGÉTICOS
Clásicamente, la principal preocupación a la hora de prescribir una NP era el no alcanzar las necesidades energéticas del paciente; sin embargo, actualmente, el problema se centra más en las consecuencias negativas a las que conduce el exceso o desequilibrio de los diversos nutrientes. La estimación de las necesidades energéticas en los niños con NP precisa considerar los distintos componentes del gasto energético y el hecho de que la mayoría de ellos están hospitalizados, inactivos, con o sin alimentación enteral concomitante y con diversos grados de estrés metabólico (1,2).
Componentes del gasto energético del niño
La energía ingresada diariamente con los macronutrientes en su mayor proporción va a ser utilizada por el organismo (energía metabolizable), excepto una pequeña parte que se pierde de forma obligada (orina, heces, sudor). Esta energía disponible se va a consumir en el metabolismo basal, en la termogénesis de los alimentos (ambos constituyen el gasto energético en reposo, GER), en la termorregulación, en la actividad física y en el crecimiento (3). Este último es el que diferencia esencialmente la nutrición del niño respecto a la del adulto haciéndolo especialmente vulnerable en épocas de crecimiento acelerado sobre todo en el recién nacido pretérmino (RNPT) (1). La suma de todos ellos constituye el gasto energético total (GET) cuyo principal componente es el metabolismo basal (3). De este modo, el balance energético del niño será:

Si sobra energía esta se almacenará en forma de grasa y si falta se movilizarán los depósitos orgánicos.
En el niño enfermo estas circunstancias pueden variar considerablemente. Aunque hay que contemplar los requerimientos suplementarios para la recuperación de la desnutrición, se debe poner especial cuidado en evitar el exceso de energía debido a las complicaciones que puede comportar: esteatosis hepática, hiperglucemia e infecciones. Clásicamente se ha hecho un gran énfasis en el balance negativo generado por el estrés, sin embargo, diferentes estudios en niños sometidos a cirugía o que precisan cuidados intensivos demuestran que el aumento del gasto metabólico no es tan grande como se creía y se produce solo en las primeras 24 horas. En general, el paciente encamado tiene un GET generalmente disminuido por la inactividad lo que puede en parte compensar el incremento condicionado por diversos mecanismos (inflamación, pérdidas por ostomías...) (1,4,5).
Cálculo de los aportes energéticos en el niño con NP
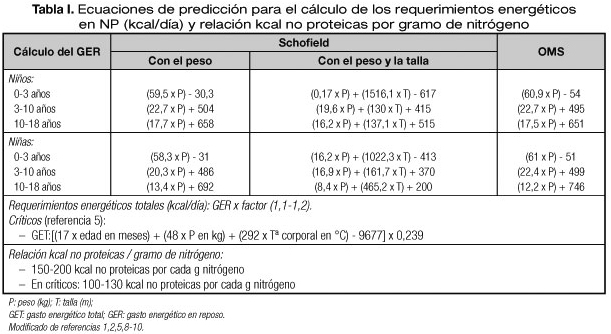
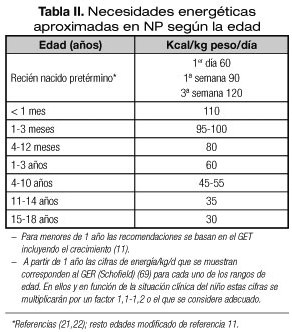
El cálculo de los requerimientos energéticos debe realizarse de forma individualizada, según edad, estado nutricional y enfermedad subyacente. En pacientes con enfermedades que conlleven alto riesgo de desnutrición (cirugía mayor, neoplasias, fibrosis quística, cardiopatías congénitas, etc.), el mejor método es el cálculo del GER corregido por un factor que incluye la actividad y el grado de estrés. La forma más idónea de conocer el GER es mediante calorimetría indirecta que determina el O2 consumido y el CO2 eliminado durante la oxidación de los nutrientes, obteniendo el cociente respiratorio (VCO2/VO2). Esta medición por calorimetría incluye las modificaciones del metabolismo basal por el estrés, a diferencia de las ecuaciones predictivas, y solo precisa del ajuste por actividad física. Sin embargo, la mayoría de los clínicos no disponen de esta técnica y, por tanto, precisan aproximar las necesidades energéticas con cálculos orientativos mediante ecuaciones de predicción, siendo la más aceptada la fórmula de Schofield (6). Si no se dispone de la talla se puede emplear la de Schofield para el peso o la fórmula de la Organización Mundial de la Salud (OMS) (1,2,5,7-10) (Tabla I). Para lactantes estas ecuaciones calculan cifras muy por debajo de las necesidades reales y no contemplan el crecimiento acelerado en esta edad. Para esta edad, en la tabla II se proponen las recomendaciones basadas en el GET incluyendo el crecimiento (11).
Una vez calculado el GER tal como se indica en la tabla I se corregirá por un factor que tenga en cuenta el estrés de la enfermedad y la actividad, considerando que ambos se van a compensar en la mayoría de los casos. Generalmente para evitar la sobrealimentación se suele emplear un factor de multiplicación 1,1 a 1,2 en niños con enfermedad de moderada intensidad (GdE 4) (5). No hay razones para incrementar la energía en casos de cirugía no complicada (GdE 2) (5). En situaciones de NP prolongada y desnutrición grave este factor se puede incrementar hasta 1,5-1,6. Algunos autores recomiendan cantidades aproximadas de energía según la edad que se recogen en la tabla II (1,2,5).
Circunstancias especiales
1. Teniendo en cuenta que la obesidad infantil ha alcanzado una prevalencia muy elevada en los últimos años, es preciso considerar el soporte parenteral en estos casos. Desde el punto de vista antropométrico, consideraremos obesidad cuando el z-score del índice de masa corporal (IMC) del paciente previo a la enfermedad sea superior a 2 desviaciones estándares (DE) en relación a los patrones de referencia para niños mayores de 5 años y superior a 3 DE para los menores de 5 años (WHO 2006 para 0-5 años) (12) y WHO 2007 para 5-19 años (13), siendo este exceso de peso debido principalmente a adiposidad. En los adolescentes obesos, la American Society for Parenteral and Enteral Nutrition (ASPEN) recomienda calcular el GER, siempre que sea posible, utilizando la calorimetría indirecta (GdE 5) (14), debido a las diferencias que pueden existir en la masa magra, y considerando por ello, que ni el peso ideal ni ninguna ecuación de predicción puede determinar estas diferencias. Pese a ello, si no se dispone de calorimetría, recomendamos calcular el GER con el peso correspondiente a un IMC entre 0 y +1 DE.
2. Los niños con desnutrición requieren calorías extra para el crecimiento de recuperación (catch up) y por ello el cálculo de calorías no se hará en función del peso actual sino del peso ideal para su talla, teniendo en cuenta que la administración debe hacerse de forma muy progresiva. Suele ser necesario multiplicar por 1,3-1,5 (GdE 4) (5).
3. Los pacientes críticos tienen elevado riesgo de desnutrición relacionado con las alteraciones metabólicas que conlleva su estado de estrés y de inflamación, pero también de sobrenutrición si el soporte no es el adecuado. En ambos casos, el pronóstico de la enfermedad puede afectarse negativamente (15). Por ello, según ASPEN, es necesaria la planificación de un soporte nutricional especializado evitando la sobre y la subnutrición (GdE 5) suministrando siempre que sea posible nutrición enteral (NE) (GdE 5) (15). Sin embargo, actualmente aún no existe una guía clara de actuación en relación a la NP y NE (16). Las necesidades energéticas se calcularán por calorimetría indirecta, y si no es posible, aplicando fórmulas o normogramas (GdE 5) (15). Se ha publicado una fórmula que correlaciona bien con el GER medido (5) y que se expone así mismo en la tabla I. Recientemente se ha comunicado que aproximadamente el 60% de los niños críticos (0-14 años) estaban sobrealimentados, sugiriendo el uso de la calorimetría indirecta siempre que sea posible (17). Un análisis multicéntrico en unidades de críticos concluye que la NP precoz cuando no es posible alcanzar el objetivo calórico con NE, no mejora la evolución de los pacientes frente a la NP iniciada a partir del 8º día (18). El análisis de estos resultados se expone en el capítulo de "Nutrición parenteral en situaciones clínicas especiales".
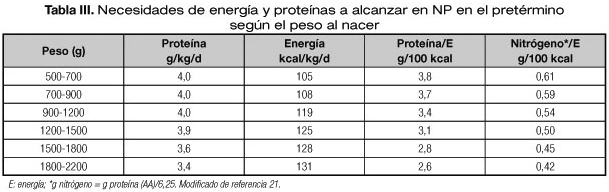
4. En los RNPT existe evidencia de que alcanzar los objetivos calóricos y proteicos precozmente (Tablas II y III), mejora la evolución clínica, reduce la restricción del crecimiento y favorece el neurodesarrollo, por lo que se recomienda una nutrición intensiva desde los primeros días (19,20). Se recomienda iniciar la NP aportando 60 kcal/kg/día, con incrementos hasta 90-100 kcal/kg/día en la primera semana y hasta 120 a la tercera semana (21,22) (Tabla II). Sin embargo esta pauta aún es escasamente implementada en las unidades neonatales (19).
Ejemplo de cálculo energético:
Niño 8 años sometido a NP tras intervención por peritonitis. El cálculo del GER para su peso de 24 kg según la ecuación de Schofield (Tabla I) es de 1.050 kcal y corregido por un factor actividad-estrés de 1,1 serían 1.155 kcal/día (48 kcal/kg/día), mientras que corregido por un factor de 1,2 supondrá un total de aproximadamente 1.260 kcal/día (53 kcal/kg/día).
Distribución calórica
Una vez calculada la energía total diaria es fundamental que su aporte en principios inmediatos esté equilibrado para conseguir una adecuada retención nitrogenada y evitar alteraciones metabólicas (4). El cálculo de los requerimientos de proteína debe realizarse siempre en primer lugar y es el que determina el resto del aporte calórico no proteico. Se recomienda 150-200 kcal no proteicas por cada gramo de nitrógeno lo que equivale a 24-32 kcal no proteicas /gramo de proteína (1,2,8-10) (Tabla I). Para calcular los gramos de nitrógeno se divide la cantidad total de aminoácidos por 6,25 (el contenido de nitrógeno de la proteína es aproximadamente del 16%). Estos aportes vienen a suponer una distribución calórica final de 12-16% de las calorías en forma de aminoácidos y el resto, que constituyen las kcal no proteicas, se reparten aproximadamente entre lípidos 25-40% y glucosa 75-60% (1,2,5). En circunstancias de estrés elevado (paciente crítico, trasplante de médula…), la relación kcal no proteicas/g de nitrógeno puede llegar a ser 100/1 a 130/1.
Consideración especial merece el RNPT de bajo peso debido a la rápida acreción proteica por el crecimiento y a que la oxidación proteica contribuye de forma especial a la producción de energía. En ellos la relación proteína/energía (g/100 kcal) varía en función del peso al nacimiento (21) (Tabla III). En fase estable también se recomienda mantener una relación 150-200 kcal no proteicas por cada gramo de nitrógeno (21).
REQUERIMIENTOS PROTEICOS
Las proteínas se suministran en forma de soluciones de aminoácidos (AA) y son esenciales para mantener la masa corporal magra. Su aporte debe minimizar el catabolismo proteico inducido por el estrés y el ayuno, y favorecer la síntesis proteica sin producir complicaciones hepáticas y/o renales (1).
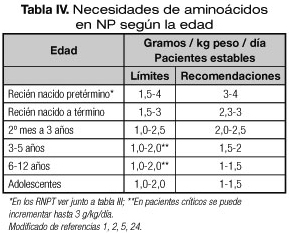
Los aportes recomendados según la edad se recogen en la tabla IV (1,2,5). Estudios recientes sustentan la importancia de alcanzar rápidamente las dosis máximas incluso en el neonato pretérmino siempre que se guarde la relación nitrógeno/kcal no proteicas. En el RNPT es segura su utilización desde el primer día con un aporte mínimo de 1,5 g/kg/día que evite el balance nitrogenado negativo (5,21). Las estudios más recientes comienzan con 2,4-3,6 g/kg/día incluso desde el primer día, considerándose necesario llegar a aportes hasta de 4 g/kg/día para favorecer la retención proteica (1,2,5,21,23). Recientemente se ha cuantificado que la síntesis de albúmina es sustancialmente superior cuando a los RNPT se les administra precozmente dosis elevadas de AA/lípidos (3,6/2 g/kg/día) frente a la administración de dosis menores de AA/lípidos (2,4/2 g/kg/día) y exclusivamente AA (2,4/0 g/kg/día) (24) (ver capítulo de "Nutrición parenteral en situaciones clínicas especiales").
En los casos especiales en que exista desnutrición grave con riesgo de síndrome de realimentación, la introducción será más lenta.
Las soluciones de AA parenterales deben contener una adecuada proporción de aminoácidos esenciales y no esenciales; conviene recordar que los AA no esenciales pueden ser esenciales en determinadas circunstancias dependientes de la edad, estrés y enfermedad subyacente. Así la cisteína, tirosina y taurina son AA semiesenciales en el recién nacido (RN) a término (RNT) y RNPT lo que obliga a su inclusión en las soluciones parenterales administradas en esta edad. La cisteína es un sustrato para el glutatión y por ello tiene propiedades antioxidantes. La taurina puede mejorar la colestasis neonatal y prevenir la alteración retiniana (1,5,23).
REQUERIMIENTOS DE LÍPIDOS
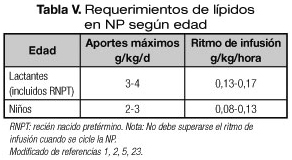
Los lípidos deben formar parte de las soluciones de NP por su elevada densidad calórica, por ser fuente de ácidos grasos esenciales (AGE) importantes para el neurodesarrollo (especialmente en RNPT), por disminuir la osmolaridad de la solución y por evitar los efectos negativos de la sobrecarga de glucosa. Además, se ha demostrado que su adición a la NP mejora el balance de nitrógeno (23). Se recomienda que constituyan del 25 al 40% de las calorías no proteicas, pero su máxima oxidación se produce cuando suministran el 40% de las calorías no proteicas en el RN y hasta el 50% en resto de los lactantes (1,5). Los aportes máximos diarios y velocidad de infusión recomendados en NP se resumen en la tabla V (1,5). Como ya hemos mencionado, es más importante que la mezcla total sea equilibrada que su introducción progresiva. En RNPT de muy bajo peso con hiperbilirrubinemia, es recomendable incrementos paulatinos de 0,5-1 g/kg/día (22,23) que permiten controlar la hipertrigliceridemia. Las cifras no deben superar la concentración de 150 mg/dL en pretérminos, 250 mg/dL en lactantes y 400 mg/dL en los niños mayores (5,22). En una revisión sistemática se demostró que su inicio en los dos primeros días de vida parece ser seguro en los RNPT de muy bajo peso al nacer (25) y no se han demostrado efectos adversos sobre el pulmón o sobre la toxicidad de la bilirrubina (21).
En algunas circunstancias, hay que tener precaución y reducir los aportes (0,5-1 g/kg/día) garantizando el aporte de AGE: infecciones graves (disminución de lipoproteinlipasa); hiperbilirrubinemia neonatal (riesgo kernicterus); trombocitopenia (inferior a 100.000/mm3); insuficiencia hepática y enfermedades pulmonares (8,9).
Se recomienda incluirlos en la bolsa junto a AA y glucosa en forma de soluciones ternarias, a no ser que sea inestable debido a su composición (ver capítulo de "Preparación de las nutriciones parenterales pediátricas"). Se sugiere la adición de carnitina en NP de más de 4 semanas (5) aunque no se ha demostrado evidencia de que mejore la nutrición y la tolerancia lipídica en la NP de los neonatos (26). De forma sistemática ASPEN recomienda su inclusión rutinaria en la NP del RN a dosis de 2-5 mg/kg/día si no lleva ningún aporte por vía enteral (27). La adición de heparina a la NP no está justificada en la inmensa mayoría de las situaciones, a pesar de ser una práctica frecuente en Unidades Neonatales en nuestros centros (ver capítulo de "Componentes de las mezclas de nutrición parenteral para pediatría"). En neonatos se ha aconsejado la adición de heparina con el objetivo de disminuir la formación de fibrina en los catéteres de larga duración y con ello, la reducción de la adhesión bacteriana (28).
Las soluciones de lípidos han evolucionado en su composición en los últimos años. La solución de lípidos procedente de soja (Intralipid®) fue sustituida en las unidades pediátricas europeas por otras soluciones basándose en el desequilibrio en AGE por exceso de omega-6 y en la hepatotoxicidad (29) debida a la peroxidación lipídica y al efecto de los fitosteroles (30,31). Las soluciones mixtas de LCT y MCT (Lipofundina MCT/LCT 20%®) han sido administradas durante tiempo siendo bien toleradas incluso en lactantes pequeños (1). La disponibilidad de soluciones más complejas como el Lipoplus® que incluye aceite de soja, MCT y aceite de pescado o el SMOFlipid® que incluye estos además de aceite de oliva se consideran seguras y con buena tolerancia en todas las edades pediátricas. Al reducir el aporte de soja y contener vitamina E se postula que el aporte y proporción de AGE es muy equilibrado (31,32) y deben disminuir la peroxidación lipídica y contribuir a reducir la enfermedad hepática relacionada con la NP especialmente en casos de síndrome de intestino corto (SIC).
El tipo de lípidos en NP continúa siendo un aspecto controvertido y no existen recomendaciones claras. En RNPT se obtuvo una significativa reducción de bilirrubina total y directa junto con un equilibrio en la proporción de AGE en los tratados con SMOFlipid® frente a los que recibieron Intralipid® (33). Estos beneficios en los niveles de bilirrubina, así como en los de triglicéridos e incidencia de infección, no se han confirmado en un metaanálisis posterior (34). Otros metaanálisis no han podido demostrar en el RN el efecto protector del aceite de pescado frente a la enfermedad hepática relacionada con la NP (35) ni pruebas suficientes para recomendar ninguna solución lipídica mixta sobre las convencionales a base de aceite puro de soja o viceversa sugiriendo la necesidad de estudios adicionales, aunque se haya observado una pequeña reducción de la retinopatía del prematuro y de la displasia broncopulmonar en los tratados con la fórmula SMOFlipid® (36).
En el caso del SIC la guía ASPEN (2014) no resulta aclaratoria para nuestra práctica, ya que en EE. UU. la comercialización de soluciones lipídicas es muy distinta a la europea: no existe comercializada la solución de Lipoplus® o de SMOFlipid® y siguen usando mayoritariamente Intralipid® a la que añaden una solución de aceite de pescado (Omegaven®) en casos de colestasis (reduciendo simultáneamente el aporte de soja) (37,38). La solución Omegaven® ha mostrado eficacia en el tratamiento de rescate de pacientes con enfermedad hepática relacionada con la NP especialmente en los afectos de SIC (32,40), aunque la mejoría en la colestasis no siempre se asocia a menor progresión de la fibrosis (41,42). En un reciente metaanálisis realizado por ESPGHAN (39) solo se ha podido concluir que a pesar de la falta de trabajos suficientes para sustentarlo, existe cierta evidencia de que las emulsiones lipídicas mixtas conteniendo aceite de pescado pueden contribuir a reducir los niveles de bilirrubina en niños con fallo intestinal y NP prolongada (ver capítulo de "Complicaciones de la nutrición parenteral pediátrica" y "Nutrición parenteral domiciliaria pediátrica").
En resumen, en tanto se dispone de estudios con evidencia suficiente sobre los efectos de las soluciones mixtas, consideramos que por su composición (equilibrio de AGE, ausencia de fitosteroles, contenido en vitamina E) parecen las más recomendables.
Se recomienda que las soluciones de lípidos se administren al 20% por producir menor elevación de lípidos plasmáticos y tener una relación triglicéridos/fosfolípidos más adecuada (1,2,8-10,23) (ver "Componentes de las mezclas de nutrición parenteral para pediatría").
REQUERIMIENTOS DE GLUCOSA
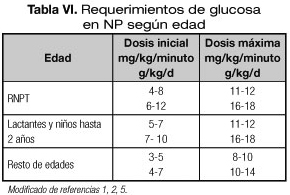
La D-glucosa es el hidrato de carbono indicado en la NP. Es responsable, en gran parte, de la osmolaridad de la solución. Su aporte no debe exceder el 60-75% de las calorías no proteicas (50% kcal totales) (1,2,5). El ritmo de infusión (mg/kg/minuto) debe ser progresivo y dependiente de la edad, tal y como se detalla en la tabla VI, con el fin de evitar la hiperglucemia y la diuresis osmótica. En pacientes críticos el ritmo de infusión de glucosa puede tener que limitarse a 5 mg/kg/minuto (5).
Su concentración en la solución parenteral por vía periférica no debe sobrepasar el 10-12%; sin embargo, por vía central se puede incrementar en función del aporte de líquido (1,2,8-10,41).
Especial cuidado se debe tener en los casos de desnutrición grave en los que se debe realizar el aporte muy progresivo (1,2,8-10) para evitar el síndrome de realimentación.
En los neonatos especialmente en los RNPT, ASPEN recomienda poner especial énfasis en evitar la hipoglucemia y en tratarla sistemáticamente en caso de presentarse (GdE 1) (43). Se sugiere además que la glucemia no sobrepase los 150 mg/dL (GdE 5) (43) ya que se asocia con mayores complicaciones particularmente en los RNPT y/o de bajo peso al nacer. Es importante evitar el exceso de energía en forma de glucosa y administrar lípidos conjuntamente siempre que sea posible (sin olvidar que su contenido en glicerol es un sustrato neoglucogénico) (44).
Las principales consecuencias de los aportes excesivos de glucosa e insuficientes de lípidos a cualquier edad son: a) la hiperglucemia, con retención hídrica y diuresis osmótica; b) el aumento en la producción de CO2 con incremento del cociente respiratorio (VCO2/VO2) y la retención hídrica que pueden inducir insuficiencia respiratoria en pacientes con función pulmonar comprometida; c) la esteatosis y la alteración de la función hepática; y d) el aumento del riesgo de infección (5,8-10).
La tolerancia a la glucosa depende de muchas circunstancias (estado metabólico, enfermedad aguda, modo de administración continuo vs. cíclico); por ello, debe monitorizarse con frecuencia.
En los RN no se recomienda el uso rutinario de insulina precozmente para evitar la hiperglucemia debido al riesgo elevado de hipoglucemia e incremento de mortalidad (43,44); solo se propone su administración en casos de hiperglucemia persistente cuando ya se han intentado evitar y/o regular sus causas (43). Se infundirá en perfusión continua conectada en "Y" a la NP o bien, se puede incluir en la bolsa de la NP (esta última posibilidad se contemplará en pacientes estables). Se recomienda administrar a dosis de 0,02-0,04 U/kg/hora poniendo especial cuidado en preparar una dilución adecuada (de 0,05 a 0,2 unidades/mL) (1).
REQUERIMIENTOS DE AGUA Y ELECTROLITOS
Los requerimientos de agua para la NP se calcularán en función de la edad, tamaño corporal, estado de hidratación, factores ambientales y enfermedad subyacente.
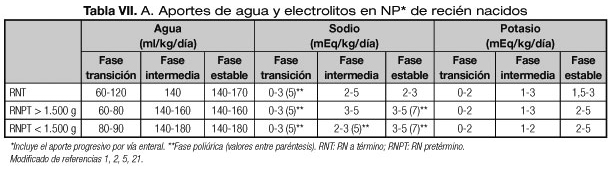
- En el RNT y especialmente en el RNPT, los aportes hídricos deben ser muy cuidadosos y ajustados a su fase de adaptación postnatal (Tablas VII A y B). Se deben contemplar tres momentos especiales (5,12):
1. Fase de transición, inmediata al nacimiento (primeros 3-6 días), caracterizada por oliguria seguida de poliuria, horas o días después, que finaliza cuando se da la máxima pérdida de peso. En el pretérmino el aporte de líquidos guarda relación inversa con el peso al nacer debido a las pérdidas insensibles transcutáneas muy elevadas (20,21). De este modo en los RNPT de peso > 1.500 gramos, se comenzará con 60-80 mL/kg/día el primer día, y en los de peso < 1.500 g se iniciará con aportes de 80-90 mL/kg/día, con incrementos progresivos en ambos en los días siguientes (1,2,5,21,45).
2. Fase intermedia, de duración 5-15 días, en la que disminuyen las pérdidas cutáneas, la diuresis se incrementa a 1-2 mL/kg/hora y disminuye la excreción de sodio.
3. Fase de crecimiento estable que se caracterizada por un balance positivo de agua y sodio paralelo al incremento ponderal.
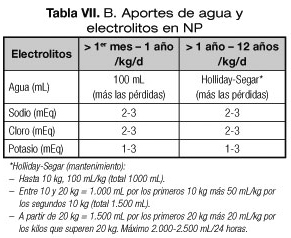
- En el lactante a partir del mes de edad se administrarán 100 mL/kg/día, más las pérdidas extraordinarias (120-150, máximo 180 mL/kg/día).
- En el resto de las edades se realizará el cálculo de Holliday-Segar (mantenimiento) (1,2,46) al que se sumarán los requerimientos específicos y las pérdidas extraordinarias (1,2,5,8-10). De forma aproximada se administrarán: de 1-2 años, 80-120 mL/kg/día; de 3-5 años, 80-100 mL/kg/día; de 6-12 años 60-80 mL/kg/día; y de 13-18 años, 50-70 mL/kg/día (5) (Tabla VIIB).
Debe vigilarse el peso, el estado de hidratación y las constantes hemodinámicas (frecuencia cardiaca, tensión arterial), la diuresis, la densidad urinaria y el balance hidroelectrolítico según se indica en el capítulo de "Monitorización de la nutrición parenteral pediátrica". Diversas condiciones pueden modificar estos cálculos: a) el exceso de líquidos en el RNPT puede asociarse a persistencia del ductus arterioso, displasia broncopulmonar y hemorragia intraventricular; por ello, en esta edad, se debe tener especial cuidado con el balance hidroelectrolítico; b) las necesidades se pueden incrementar en situaciones de: fiebre, fototerapia con calor radiante, diarrea, vómitos, aspiración gástrica, glucosuria, poliuria, deshidratación, hiperventilación y estados hipercatabólicos; y c) puede ser necesaria la restricción hídrica en: insuficiencia cardiaca, insuficiencia renal oligoanúrica, enfermedad respiratoria y situaciones que cursan con edema (1,2).
En relación a los electrolitos, en la tabla VIIB se resumen las necesidades para cada edad. Los aportes a los RN y especialmente a los pretérmino se harán adecuándose a sus cambios biológicos de adaptación postnatal. Es imprescindible tener en cuenta el ingreso de electrolitos por fármacos y por otras perfusiones; por ello se requiere la monitorización frecuente (8-10).
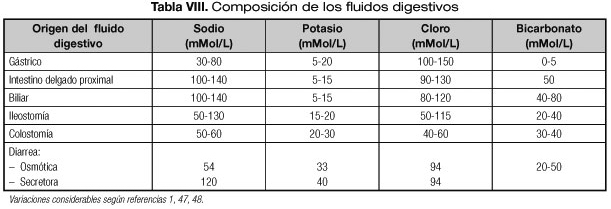
En pacientes que han sufrido cirugía abdominal y particularmente los que tienen ostomías se deben corregir las pérdidas digestivas con fluidos cuya composición en iones se asemeje al del contenido intestinal y que se resumen en la tabla VIII (1,47,48). Con el fin de adaptarse lo máximo posible a la situación del paciente, se recomienda su reposición con otras soluciones electrolíticas independientes de la NP que puedan ajustarse a lo largo del día en ritmo y composición (1).
Se debe tener especial cuidado en la terapia nutricional del niño muy desnutrido particularmente al inicio, evitando el aporte rápido y excesivo de fluidos y ajustando muy bien los aportes de iones, evitando el exceso de sodio y administrando potasio de forma muy progresiva (ver síndrome de realimentación en el capítulo de "Complicaciones de la nutrición parenteral pediátrica").
REQUERIMIENTOS DE MINERALES Y OLIGOELEMENTOS
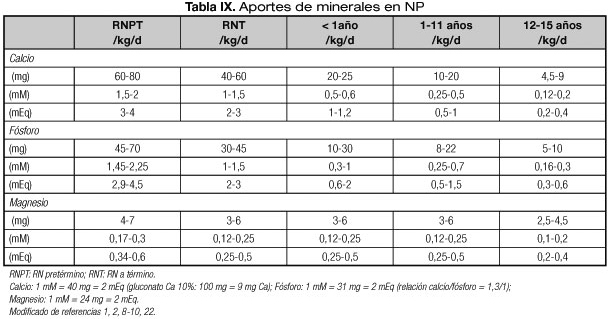
Los requerimientos de minerales varían según la edad y peso corporal (1,2,8-10,22) (Tabla IX). Las cantidades de calcio y fósforo totales están limitadas por su solubilidad que dependen del pH de la fórmula (un pH alcalino favorece la precipitación) y de la proporción entre ambos. Sin embargo, si se utilizan fuentes orgánicas de fosfato es posible alcanzar todos los requerimientos (ver Componentes de la nutrición parenteral y Preparación). Para conseguir una mejor retención fosfo-cálcica se recomienda una relación calcio:fósforo molar de 1,3/1 o una relación por peso de 1,3-1,7/1 (1,2,8-10). En el pretérmino, aunque algunos autores recomiendan cantidades superiores de calcio y de fósforo, nos parecen más conveniente las reseñadas en la tabla IX, ya que hay que tener en consideración que diversos factores como la acidosis, el uso de diuréticos y de corticoides pueden favorecer la nefrocalcinosis. Adicionalmente, conviene tener en cuenta la posibilidad de hipermagnesemia en neonatos que por factores maternos han sido expuestos a sulfato magnésico prenatal y considerarlo para la NP del primer día (ver capítulo de "Nutrición parenteral en situaciones clínicas especiales").
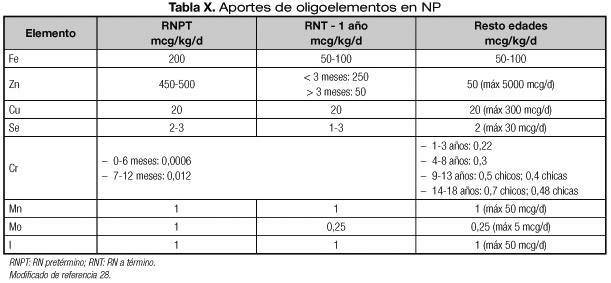
Los oligoelementos (Tabla X) suelen administrarse de forma conjunta, aunque es posible proporcionar algún elemento aislado como el zinc. Es controvertida la adición de hierro a las fórmulas de NP; se ha administrado el hierro dextrano muy diluido sin complicaciones, sin embargo se piensa que puede aumentar el riesgo de infección. Además, tanto el hierro como el cobre favorecen la peroxidación cuando se adicionan a soluciones ternarias (1,8).
Se recomienda si la NP es mixta (con enteral) administrar zinc diariamente y el resto de oligoelementos de forma periódica (semanal). La adición de oligoelementos diaria puede condicionar excesivo aporte de algunos oligoelementos como el cobre por lo que si se administra deberían monitorizarse sus niveles. El manganeso cuando se administra a dosis elevadas es un tóxico hepático y del sistema nervioso central. El cobre y manganeso se deben limitar en caso de colestasis y en enfermedades renales el selenio, molibdeno y cromo (1,2,8-10). El cromo es especialmente nefrotóxico en neonatos por lo que ASPEN recomienda reducir su administración (hasta dosis 0,0006 mcg/kg/día) (Tabla X) o administrar productos que no lo contengan (27).
REQUERIMIENTOS DE VITAMINAS
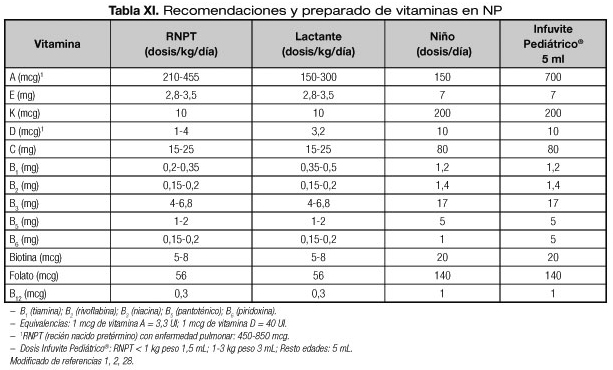
Las recomendaciones según ASPEN en vitaminas para el RNPT y resto de las edades, se recogen en la tabla XI constituyendo una síntesis de las principales recomendaciones (1,2,28). Como se expone en la misma, actualmente se dispone de un preparado comercial que cubre estas necesidades (Infuvite Pediátrico®) aunque también se pueden alcanzar con la combinación de otros productos. Las dosis para neonatos y resto de las edades, se especifican en la misma tabla XI (ver capítulos de "Componentes de las mezclas de nutrición parenteral para pediatría" y "Preparación de las nutriciones parenterales pediátricas"). El sistema de infusión deberá estar protegido de la luz y ser lo más corto posible (1,8).
RECOMENDACIONES
- Las necesidades energéticas en NP se deben calcular procurando evitar tanto la infra como la sobrenutrición. La forma idónea es calcular el GER usando calorimetría indirecta y multiplicarlo por un coeficiente de actividad (generalmente 1-1,2) (GdE 4). Si no se dispone de calorimetría, el GER se calculará mediante ecuaciones de predicción para niños mayores de un año (Schofield, OMS) (GdE 2). En lactantes las recomendaciones se basan en sus necesidades energéticas incluido el crecimiento. No hay razones para incrementar la energía en casos de cirugía no complicada (GdE 2). En desnutrición suele ser necesario multiplicar por 1,3-1,5 (GdE 4).
- Es fundamental que la mezcla sea equilibrada y guarde la relación de 150-200 Kcal no proteicas por g de nitrógeno, o menor en pacientes críticos o gravemente enfermos.
- Los aportes de proteínas variarán en función de la edad y del grado de estrés. En neonatos se tiende a comenzar con aportes elevados incluso desde el primer día (2,4-3,6 g/kg/día), siendo necesarios aportes posteriores hasta de 4 g/kg/día para favorecer la retención proteica. Diversos estudios han demostrado que la administración de AA desde el primer día consiguen un balance de nitrógeno positivo sin efectos adversos (GdE 1).
- Los lípidos deben formar parte de las soluciones de NP por su elevada densidad calórica, por ser fuente de AGE importantes para el neurodesarrollo (especialmente en RNPT), por disminuir la osmolaridad de la solución y por evitar los efectos negativos de la sobrecarga de glucosa. Se ha demostrado que su adición a la NP mejora el balance de nitrógeno. En pretérminos de muy bajo peso al nacer, su inicio en los dos primeros días de vida es seguro (GdE 1). No se conoce con exactitud cuál debe de ser la solución de lípidos adecuada; sin embargo, aquellas que incluyen aceite de soja, MCT, aceite de oliva y aceite de pescado se consideran seguras y con buena tolerancia en todas las edades pediátricas.
- El ritmo de infusión de glucosa (mg/kg/minuto) debe ser progresivo y dependiente de la edad, con el fin de evitar la hiperglucemia y la diuresis osmótica, especialmente en pacientes críticos. En los neonatos sobre todo en los RNPT, ASPEN recomienda poner especial énfasis en evitar la hipoglucemia y en tratarla sistemáticamente en caso de presentarse (GdE 1).
- Los requerimientos de agua, minerales y vitaminas para la NP se calcularán en función de la edad, tamaño corporal, estado de hidratación, factores ambientales y enfermedad subyacente.
BIBLIOGRAFÍA
1. Martínez Costa C, Pedrón Giner C. Requerimientos en nutrición parenteral pediátrica. En: Documento de consenso SENPE/SEGHNP/SEFH sobre nutrición parenteral pediátrica. Disponible en: https://www.gastroinf.es/sites/default/files/files/5%20Requerimientos%20en%20NPP.pdf
2. Gomis Muñoz P, Gómez López L, Martínez Costa C, Moreno Villares JM, Pedrón Giner C, Pérez-Portabella Maristany C, et al. Documento de consenso SENPE/SEGHNP/SEFH sobre nutrición parenteral pediátrica. Nutr Hosp 2007;22:710-9.
3. Food and Nutrition Board. Institute of Medicine. Dietary Reference Intakes (DRI) for energy, carbohydrate, fiber, fat, fatty acids, cholesterol, protein and aminoacids, 2002. Available at: www.nap.edu.
4. Shulman RJ, Phillips S. Parenteral nutrition in infants and children. J Pediatr Gastroenterol Nutr 2003;36:587-607.
5. Koletzko B, Goulet O, Hunt J, Krohn K, Shamir R; Parenteral Nutrition Guidelines Working Group; European Society for Clinical Nutrition and Metabolism; European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN); European Society of Paediatric Research (ESPR).1. Guidelines on Paediatric Parenteral Nutrition of the European Society of Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) and the European Society for Clinical Nutrition and Metabolism (ESPEN), Supported by the European Society of Paediatric Research (ESPR). J Pediatr Gastroenterol Nutr 2005;41(Suppl 2):S1-87.
6. Schofield W. Predicting basal metabolic rate, new standards and review of previous work. Human Nutr Clin Nutr 1985; 39C (Suppl 1): 5-41.
7. Joint FAO/WHO/UNU Expert Consultation. Energy and protein requirements. Technical Report Series 724. Geneva: WHO; 1985.
8. Martínez Costa C, Sierra C, Pedrón Giner C, Moreno Villares JM, Lama R y Codoceo R. Nutrición enteral y parenteral en pediatría. An Esp Pediatr 2000; 52(Supl 3):1-33.
9. Martínez Costa C, Pedrón Giner C. Nutrición enteral y parenteral. En: Moro Serrano M, Málaga Guerrero S, Madero López L, editoress. Cruz Tratado de Pediatría. 11 ed. Madrid: Panamericana; 2014. pp. 1061-73.
10. Pedrón Giner C, Martínez Costa C, Moreno Villares JM. Parenteral nutrition in infants and children. In: Watson RR, Grimble G, Preedy VR, Zibadi S, editors. Nutrition in infancy. London: Springer; 2013. pp. 233-45.
11. Report of a Joint FAO/WHO/UNU Expert consultation. Human energy requirements [Monografía en Internet]. Rome: FAO Food and Nutrition Technical Report Series 1; 2004 [Consultado10 jul 2016]. Disponible en: http://www.fao.org/ag/agn/nutrition/requirements_pubs_en.stm
12. Child growth standards. Disponible en: http://www.who.int/childgrowth/standards/bmi_for_age/en/
13. Growth reference 5-19 years. Disponible en: http://www.who.int/growthref/who2007_bmi_for_age/en/
14. Jesuit C, Dillon C, Compher C, American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors; and Lenders CM. A.S.P.E.N. clinical guidelines: Nutrition support of hospitalized pediatric patients with obesity. JPEN J Parenter Enteral Nutr 2010;34(1):13-20.
15. Mehta NM, Compher C, and A.S.P.E.N. Board of Directors. A.S.P.E.N. Clinical Guidelines: Nutrition support of the critically ill child. JPEN J Parenter Enteral Nutr 2009;33:267-76.
16. Joffe A, Anton N, Lequier L, Vandermeer B, Tjosvold L, Larsen B, et al. Nutritional support for critically ill children. Cochrane Database Syst Rev 2009; 2:CD005144.
17. Dokken M, Rustoen T, Stubhaug A. Indirect calorimetry reveals that better monitoring of nutrition therapy in pediatric intensive care is needed. JPEN J Parenter Enteral Nutr 2015;39:344-52.
18. Fivez T, Kerklaan D, Mesotten D, Verbruggen S, Wouters PJ, Vanhorebeek I, et al. Early versus late parenteral nutrition in critically ill children. N Engl J Med 2016;374:1111-22.
19. Ng DV, Brennan-Donnan J, Unger S, Bando N, Gibbins S, Nash A, et al. How close are we to achieving energy and nutrient goals for very low birth weight infants in the first week? JPEN J Parenter Enteral Nutr 2017;41(3):500-6.
20. Ribed Sánchez A, Romero Jiménez RM, Sánchez Gómez de Orgaz MC, Sánchez Luna M, Sanjurjo Sáez M. Aggressive parenteral nutrition and growth velocity in preterm infants. Nutr Hosp 2013;28:2128-34.
21. Poindexter BB, Ehrenkranz RA. In: Martin RJ, Faranoff AA, Walsh MC. Faranoff and Martin's Neonatal Perinatal Medicine. Diseases of the fetus and infant. Philadephia: Elsevier Saunders; 2015. pp. 592-612.
22. Adamkim DH, Radmacher PG, Lewis S. Nutrition and selected disorders of the gastrointestinal tract. In: Klaus and Faranoff's. Care of the high risk neonate. 6th ed. Philadelphia: Elsevier Saunders; 2013. pp. 151-200.
23. Rigo J, De Curtis M. Parenteral nutrition in premature infants. En: Guandalini S, editor. Textbook of Pediatric Gastroenterology and Nutrition. London: Taylor and Francis; 2004. pp. 619-38.
24. Vlaardingerbroek H, Schierbeek H, Rook D, Vermeulen MJ, Dorst K, Vermes A, et al. Albumin synthesis in very low birth weight infants is enhanced by early parenteral lipid and high-dose amino acid administration. Clin Nutr 2016;35(2):344-50.
25. Vlaardingerbroek H, Veldhorst MAB, Spronk S, van den Akker CHP, van Goudoever JB. Parenteral lipid administration to very-low-birth-weight infants. Early introduction of lipids and use of new lipid emulsions: A systematic review and meta-analysis. Am J Clin Nutr 2012;96:255-68.
26. Cairns PA, Stalker DJ. Carnitine supplementation of parenterally fed neonates. In: The Cochrane Collaboration: John Wiley & Sons, Ltd; 2009.
27. ASPEN Board of Directors and the Clinical Guidelines Task Force. Guidelines for the use of parenteral and enteral nutrition in adult and pediatric patients. JPEN J Parenter Enteral Nutr 2002;Suppl 1:1SA-138SA.
28. Vanek VW, Borum P, Buchman A, Fessler TA, Howard L, Jeejeebhoy K, et al. A.S.P.E.N. Position Paper: Recommendations for changes in commercially available parenteral multivitamin and multi-trace element products. Nutr Clin Pract 2012;27:440-91. Erratum in: Nutr Clin Pract 2014;29(5):701. Dosage error in article text.
29. Rangel SJ, Calkins CM, Cowles RA, Barnhart DC, Huang EY, Abdullah F, et al. American Pediatric Surgical Association Outcomes and Clinical Trials Committee. Parenteral nutrition associated cholestasis: An American Pediatric Surgical Association Outcomes and Clinical Trials Committee systematic review. J Pediatr Surg 2012;47:225-40.
30. Llop JM, Virgili N, Moreno-Villares JM, García-Peris P, Serrano T, Forga M, et al. Phytosterolemia in parenteral nutrition patients: implications for liver disease development. Nutrition 2008;24:1145-52.
31. Kurvinen A, Nissinen MJ, Gylling H, Miettinen TA, Lampela H, Koivusalo AI, et al. Effects of long-term parenteral nutrition on serum lipids, plant sterols, cholesterol metabolism, and liver histology in pediatric intestinal failure. J Pediatr Gastroenterol Nutr 2011;53:440-6.
32. Cowan E, Nandivada P, Puder M. Fish oil-based lipid emulsion in the treatment of parenteral nutrition-associated liver disease. Curr Opin Pediatr 2013;25:193-200.
33. Rayyan M, Devlieger H, Jochum F, Allegaert K. Short-term use of parenteral nutrition with a lipid emulsion containing a mixture of soybean oil, olive oil, medium-chain triglycerides, and fish oil: a randomized double-blind study in preterm infants. JPEN J Parenter Enteral Nutr 2012; 36(1 Suppl):81S-94.
34. Finn KL, Chung M, Rothpletz-Puglia P, Byham-Gray L. Impact of providing a combination lipid emulsion compared with a standard soybean oil lipid emulsion in children receiving parenteral nutrition: A Systematic review and meta-analysis. JPEN J Parenter Enteral Nutr 2015;39:656-67.
35. Park HW, Lee Nm, Kim JH, Kim KS, Kim SN. Parenteral fish oil-containing lipid emulsions may reverse parenteral nutrition-associated cholestasis in neonates: A systematic review and metaanalysis. J Nutr 2015;145:277-83.
36. Kapoor V, Glover R, Malviya M. Emulsiones grasas alternativas versus emulsiones grasas a base de aceite puro de soja para lactantes prematuros alimentados por vía parenteral. Cochrane Database of Systematic Reviews 2015 Issue 12. Art. No.: CD009172. DOI: 10.1002/14651858.CD009172.
37. Wales PW, Allen N, Worthington P, George D, Compher C; American Society for Parenteral and Enteral Nutrition, Teitelbaum D. A.S.P.E.N. Clinical Guidelines: Support of pediatric patients with intestinal failure at risk of parenteral nutrition-associated liver disease. JPEN J Parenter Enteral Nutr 2014;38:538-57.
38. Calkins KL, Dunn JCY, Shew SB, Reyen L, Farmer DG, Devaskar SU, et al. Pediatric intestinal failure associated liver disease is reversed with 6 months of intravenous fish oil. JPEN J Parenter Enteral Nutr 2014;38(6):682-92.
39. Hojsak I, Colomb V, Braegger C, Bronsky J, Campoy C, Domellöf M, et al. ESPGHAN Committee on Nutrition Position Paper. Intravenous Lipid Emulsions and Risk of Hepatotoxicity in Infants and Children: a Systematic Review and Meta-analysis. J Pediatr Gastroenterol Nutr 2016;62:776-92.
40. Gura KM, Lee S, Valim C, Zhou J, Kim S, Modi BP, et al. Safety and efficacy of a fish-oil-based fat emulsion in the treatment of parenteral nutrition-associated liver disease. Pediatrics 2008;121;e678-86.
41. Matsumoto CS, Kaufman SS, Island ER, Kallakury B, Yazigi NA, Khan KM, et al. Hepatic explant pathology of pediatric intestinal transplant recipients previously treated with omega-3 fatty acid lipid emulsion. J Pediatr 2014;165(1):59-64.
42. Mercer DF, Hobson BD, Fischer RT, Talmon GA, Perry DA, Gerhardt BK, et al. Hepatic fibrosis persists and progresses despite biochemical improvement in children treated with intravenous fish oil emulsion. J Pediatr Gastroenterol Nutr 2013;56(4):364-9.
43. Arsenault D, Brenn M, Kim S, Gura K, Compher C, Simpser E, et al. A.S.P.E.N. Clinical Guidelines: Hyperglycemia and hypoglycemia in the neonate receiving parenteral nutrition. JPEN J Parenter Enteral Nutr 2012;36:81-95.
44. Sinclair JC, Bottino M, Cowett RM. Interventions for prevention of neonatal hyperglycemia in very low birth weight infants. In: The Cochrane Collaboration: John Wiley & Sons, Ltd; 2009.
45. Lin PW, Simmons CF. Tratamiento hidroelectrolíticos. En: Cloherty JP, Eichendwald EC, Stark AR, editors. Manual de cuidados neonatales. 4ª ed. Barcelona: Masson; 2005. p. 117-32.
46. Holliday MA, Segar WE. Maintenance need for water in parenteral fluid therapy. Pediatrics 1957;19:823.
47. Baker SS, Baker RD. Parenteral Nutrition. En: Walter WA, Goulet O, Leinman R, Herman M, Shneider L, Sanderso IR, editors. Pediatric gastrointestinal disease. 4th ed. Hamilton, Ontario: BC Decker Inc; 2004. pp. 1958-80.
48. Dell KM. Fluid, electrolytes, and acid-base homeostasis. In: Martin RJ, Faranoff AA, Walsh MC. Faranoff and Martin's Neonatal Perinatal Medicine. Diseases of the fetus and infant. Philadephia: Elsevier Saunders; 2015. pp. 613-29.