My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.34 suppl.3 Madrid 2017
https://dx.doi.org/10.20960/nh.1378
Componentes de las mezclas de nutrición parenteral para pediatría
Available products for pediatric parenteral nutrition
Pilar Gomis Muñoz
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid
AMINOÁCIDOS
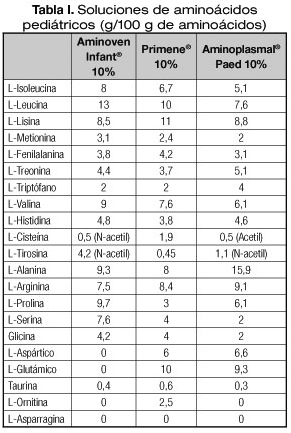
En pacientes pediátricos, y especialmente en neonatos, está recomendado el uso de soluciones de aminoácidos (AA) específicas debido a la inmadurez de sus sistemas enzimáticos. No existen estudios sobre la adecuación de estas soluciones a niños de mayor edad, aunque tampoco sobre la idoneidad de las soluciones para adultos.
El aporte proteico por vía intravenosa se administra en forma de soluciones de L-aminoácidos libres o dipéptidos y aportan aproximadamente 4 kcal por gramo. Además de los ocho AA esenciales y de la histidina, los recién nacidos pretérmino (RNPT) y a término (RNT), debido en parte a su inmadurez hepática y/o renal, requieren también cisteína, tirosina y taurina. Existen soluciones de nutrición parenteral (NP) específicas para el recién nacido y el lactante. Estas soluciones se han diseñado intentando reproducir el aminograma plasmático del cordón umbilical o el del niño alimentado con leche materna.
La inclusión de taurina en las soluciones pediátricas de AA se realizó después de observarse que niños con NP a largo plazo tenían niveles plasmáticos de taurina disminuidos que se correlacionaban con electrorretinogramas anormales y que mejoraban suplementando con taurina la NP (1).
Algunos AA tienen poca estabilidad en medio acuoso, como es el caso de la glutamina, que no se incluye en las soluciones de AA pediátricas disponibles en nuestro país. Actualmente existen suplementos y soluciones completas de glutamina para adultos que lo aportan en forma de dipéptido lo que incrementa su estabilidad. Sin embargo, debido a su alto coste no se añade rutinariamente a las soluciones de AA. Además, los estudios realizados hasta ahora no han encontrado una clara ventaja de la adición de glutamina a la NP en prematuros (2) o pacientes críticos (3).
En algunas formulaciones, AA como la tirosina o la cisteína se aportan en su forma acetilada (N-acetil-L-tirosina, N-acetil-L-cisteína) para aumentar su solubilidad en agua o disminuir su oxidación. Sin embargo su biodisponibilidad se puede ver disminuida.
No está claro cuándo los niños alcanzan los niveles de metabolización del adulto, pero parece que es bastante antes del primer año de vida. Sería recomendable que la composición de las soluciones de AA fuese distinta según los distintos rangos de edad (4). Se necesitarían más estudios para conocer cuál es la composición ideal para cada rango ya que, incluso las soluciones de AA comercializadas, no consiguen normalizar los niveles plasmáticos de todos los AA en RNPT de bajo peso (5), ni en postquirúrgicos de menos de un mes de edad (4).
En la tabla I se muestran las soluciones de AA pediátricos disponibles en nuestro país.
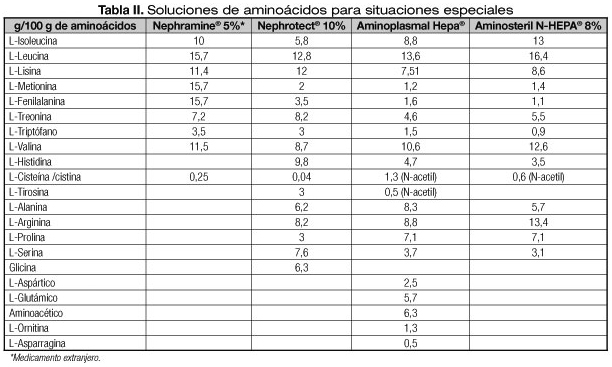
Existen en el mercado soluciones enriquecidas en AA ramificados y con menor concentración de AA aromáticos para pacientes adultos. También existen soluciones de AA esenciales cuyo uso en pacientes adultos con insuficiencia renal es controvertida. Las consideraciones sobre su utilización en niños se harán en el capítulo de modificaciones en situaciones especiales (Tabla II).
HIDRATOS DE CARBONO
Como fuente de hidratos de carbono en NP pediátrica se utilizan exclusivamente soluciones estériles de D-glucosa. En el mercado español existen soluciones de concentraciones entre el 5% al 70%.
LÍPIDOS
Actualmente se recomienda el uso de emulsiones lipídicas al 20%. Las que contienen ácidos grasos w3 parecen tener ventajas clínicas, especialmente en neonatología. El uso rutinario de heparina no está recomendado.
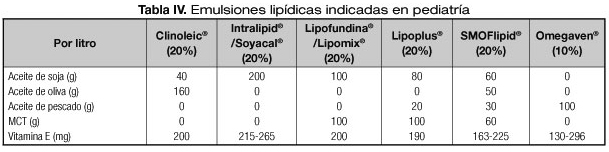
Las emulsiones lipídicas están compuestas por triglicéridos de distinta procedencia (aceite de soja, oliva, coco, pescado), emulgentes, coemulgentes, isotonizantes y estabilizantes (Tabla III). Los fosfolípidos, principalmente la fosfatidil colina procedente de la yema de huevo, se utilizan como emulgentes y aportan fósforo a la emulsión lipídica resultante (14-15 mmol/L). En general el contenido de fosfolípidos por gramo de lípidos depende de la concentración de la emulsión lipídica. Un aporte elevado de fosfolípidos se ha relacionado con hipertrigliceridemia y formación de partículas de aclaramiento lento. Por esta razón no se recomienda el uso de emulsiones al 10% que aportan más fosfolípidos. El aporte calórico de los lípidos es de aproximadamente 9 kcal/g, sin embargo se calcula que las emulsiones lipídicas suministran cerca de 10 kcal/g debido a otros componentes.
Las emulsiones lipídicas también contienen vitaminas K y E aunque las cantidades dependen del tipo de lípido y del lote. Además, las emulsiones lipídicas de origen vegetal aportan fitosteroles, compuestos con estructura similar al colesterol que proceden de las membranas celulares de las plantas. Los más comunes son sitosterol, campesterol y estigmasterol. Estos compuestos son muy poco absorbidos por vía enteral y su aporte parenteral aumenta los niveles sanguíneos y tisulares y podrían ser tóxicos para las células. Los fitosteroles inhiben enzimas involucradas en la síntesis de colesterol y ácidos biliares y se excretan por vía biliar, y por ello se les ha relacionado con la hepatopatía asociada a NP. El contenido de fitosteroles cambia también con el lote y tipo de lípidos. Las emulsiones lipídicas con 100% de soja tienen mayores cantidades que las que tienen aceites de diverso origen. El aceite de pescado no aporta fitosteroles.
Durante muchos años, las únicas emulsiones lipídicas disponibles para administración intravenosa fueron los triglicéridos de cadena larga (LCT). Estas emulsiones eran una buena fuente de ácidos grasos esenciales (AGE) y demostraron su eficacia y seguridad. Posteriormente aparecieron en el mercado las mezclas de triglicéridos de cadena larga y media (LCT/MCT 50%) y los lípidos basados en el aceite de oliva que incorporan un pequeño porcentaje de LCT para suministrar AGE. Ambas, cuando se comparaban con el LCT como única fuente lipídica, tenían la ventaja de ser más estables en las emulsiones de NP (6) generar menor cantidad de peróxidos (ya que esta generación está relacionada con la cantidad de ácidos grasos poliinsaturados [AGPI] y el aporte de vitamina E) y disminuir la producción de ácido araquidónico y sus derivados proinflamatorios debido al menor aporte de ácido linoleico. Actualmente se ha incorporado a estas mezclas aceite de pescado y, en comparación con las de LCT, parece que estas nuevas mezclas generan menor estrés oxidativo (7,8), atenúan la respuesta inflamatoria (9), disminuyen la incidencia de broncodisplasia pulmonar (10), y pueden revertir la colestasis asociada a NP en neonatos (11,12). Sin embargo una revisión Cochrane reciente no encuentra diferencias significativas en la evolución clínica de niños prematuros (13). En la tabla IV se compara la composición de las distintas emulsiones lipídicas comercializadas en España. Existen también emulsiones lipídicas cuyo único aporte es aceite de pescado, que aunque no están comercializadas en nuestro país, se pueden obtener a través de medicamentos extranjeros. Varias publicaciones describen mejoría de la colestasis, con reducciones significativas de la bilirrubina en pacientes dependientes de NP, utilizando estas emulsiones como única fuente de lípidos (14,15). Sin embargo esta mejoría de la colestasis no siempre se asocia a una menor progresión a fibrosis (16-19).
Durante mucho tiempo se ha administrado rutinariamente 1 UI/mL de heparina para mejorar la tolerancia de los lípidos y disminuir el riesgo de trombosis. Sin embargo, cuando se administra conjuntamente con calcio y lípidos puede producir desestabilización de la emulsión lipídica (20).
Los mayores efectos adversos de los lípidos se producen al administrarlos en tiempos cortos. Se recomienda administrar en 24 horas o de 8-16 horas en pacientes con NP cíclica, forma de administración frecuente en pacientes con NP domiciliaria. La administración de los lípidos conjuntamente con el resto de la NP tiene ventajas como disminuir la manipulación (y por tanto el riesgo de infección), prevenir procesos de peroxidación y disminuir la degradación de vitaminas. Las emulsiones lipídicas tienen una osmolaridad baja por lo que su uso es habitual en NP periférica.
Para evitar sobredosificación del aporte lipídico es importante tener en cuenta si el niño está recibiendo lípidos como vehículo de alguna medicación.
ELECTROLITOS
El mayor problema para poder añadir en la bolsa de NP todos los electrolitos que requiere el paciente pediátrico es la precipitación calcio-fosfato. Esta se puede disminuir con la utilización del glicerofosfato sódico. Es indispensable el uso de filtros de 1,2 micras en el sistema de administración para evitar los posibles precipitados.
Los electrolitos tienen un papel fundamental en la regulación de muchos procesos orgánicos. Existen en el mercado distintas presentaciones en viales o ampollas que aportan los distintos electrolitos requeridos. En pediatría se recomienda utilizar las presentaciones de menor concentración porque si se produce un error en la elaboración de la NP, su repercusión sería menor. El potasio y el sodio se pueden aportar como cloruro, acetato o fosfato. El uso de uno u otro dependerá de las necesidades del niño. En situaciones de acidosis se utilizará el acetato, ya que se transforma en bicarbonato en el organismo (21). Este último no se puede añadir directamente a la NP ya que es inestable.
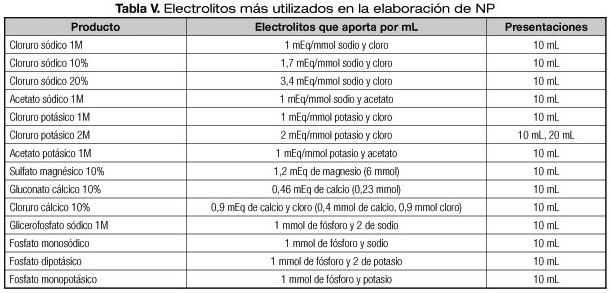
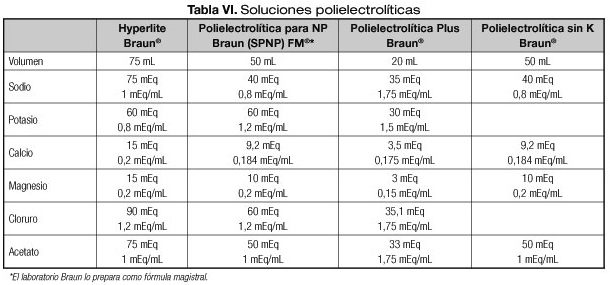
El fosfato se puede administrar en forma orgánica o inorgánica. En pediatría el uso de fosfato orgánico permite poder alcanzar los requerimientos de forma segura (22-26). Para evitar el paso de posibles precipitados se recomienda el uso de filtros en la administración de la NP, ya que incluso con el uso de fuentes orgánicas de fosfato podrían producirse precipitados (27). El único fosfato orgánico comercializado en España es el glicerofosfato sódico. Es un compuesto seguro y eficaz como fuente de fosfato (28,29). Su desventaja es que aporta dos mmol de sodio por cada mmol de fosfato. Cuando es necesaria una restricción de sodio se debe valorar la utilización de fosfatos inorgánicos aunque no se logren alcanzar las necesidades del niño. En la tabla V se describe la composición de los electrolitos comercializados más utilizados en la elaboración de NP. También existen soluciones polielectrolíticas que tienen la ventaja de facilitar la elaboración de las NP (Tabla VI).
VITAMINAS
Existen multivitamínicos intravenosos (IV) diseñados para pediatría por sus necesidades específicas.
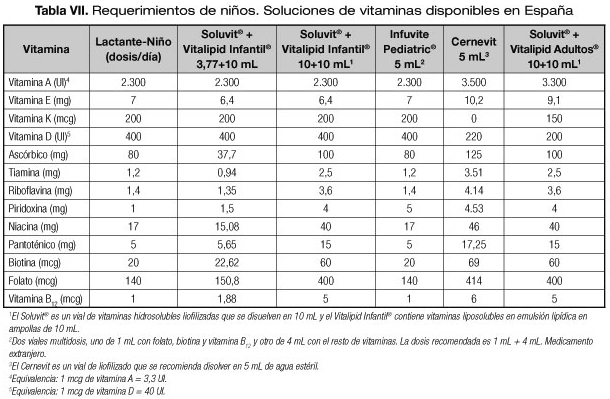
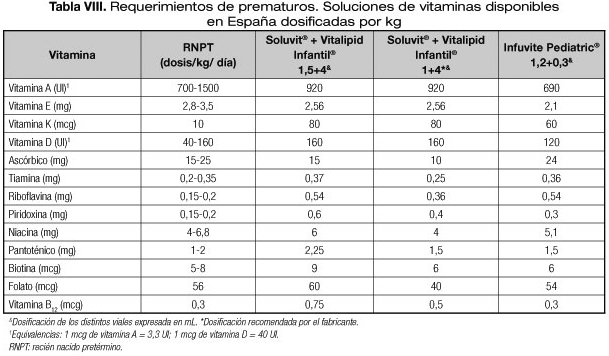
En al año 2012, la American Society for Parenteral and Enteral Nutrition (ASPEN) publicó unas recomendaciones sobre micronutrientes en NP. La mayoría de estas recomendaciones fueron apoyadas por la European Society for Clinical Nutrition and Metabolism (ESPEN) (30). En las tablas VII y VIII se describe la composición de los multivitamínicos pediátricos IV disponibles en España y algunas posibles dosificaciones en comparación con los requerimientos de la ASPEN. En España solamente está registrado:
- Soluvit®: vitaminas hidrosolubles para adultos y pediatría.
- Vitalipid Infantil® y Vitalipid Adultos®: vitaminas liposolubles.
Ambos tienen como vehículo Intralipid 10% y tiene que añadirse a los lípidos o las emulsiones de NP con lípidos por lo que los niños que no requieran lípidos no pueden recibir vitaminas liposolubles con este preparado.
- Infuvite Pediatric®: su composición se adecua mejor a las recomendaciones. Se importa a través de Medicamentos Extranjeros y esta preparación se puede añadir a una NP sin lípidos. Debido a la falta de estudios de estabilidad, en la ficha técnica del producto los fabricantes especifican que no se recomienda su mezcla directa con emulsiones grasas intravenosas. Sin embargo algunos hospitales lo añaden de rutina a las NP sin lípidos sin observarse cambios en el aspecto de la emulsión, ni aumentar la obstrucción de los filtros en la administración.
- Cernevit®: vitaminas para niños mayores y adultos. No contiene vitamina K.
En la tabla VII se describe la composición de los distintos multivitamínicos disponibles. También se incluye una columna limitando el volumen de Soluvit® a 3,77 mL porque esta combinación se asemeja más a las recomendaciones en lactantes, exceptuando la vitamina C. En la tabla VIII se incluyen tanto las dosificaciones recomendadas para prematuros como otras que también se ajustan a los requerimientos.
OLIGOELEMENTOS
Existen soluciones de oligoelementos IV específicos para pediatría. En pacientes con NP a largo plazo es importante que no haya exceso de manganeso o cromo.
En el mercado español no existe actualmente comercializada ninguna solución de multioligoelementos adecuada para el paciente pediátrico. Las soluciones diseñadas para adultos tienen el problema de que contienen una concentración muy elevada de manganeso comparativamente con el resto de los elementos y una menor concentración de selenio. El manganeso es potencialmente tóxico y se ha descrito, en este rango de dosis, acumulación en ganglios basales y otras zonas del cerebro (31); esta acumulación no siempre se asocia a aumento de niveles sanguíneos de manganeso (32) y puede estar aumentada en pacientes con hiperbilirrubinemia (33). Por ello se importa a través de Medicamentos Extranjeros Peditrace® que se adecua más a los requerimientos, como se ve en la tabla IX. La dosificación sería 1 mL/kg/día hasta 10 mL o 15 mL que se asemeja bastante a las recomendaciones de adultos. El aporte de selenio es menor del recomendado. En niños pretérminos los requerimientos de zinc son mayores, pero se puede suplementar con Oligoelementos Zinc que aporta solo este elemento. El cromo y molibdeno no están incluidos en el Peditrace® pero las soluciones utilizadas para la preparación de NP pueden aportarlos como contaminantes, al igual que otros elementos como el zinc, cobre, manganeso, boro, aluminio, titanio, bario, vanadio, arsénico y estroncio que se han visto que pueden contaminar la NP en concentraciones mayores a 1 mcg/L (34). La contaminación de las soluciones de NP con aluminio puede dar lugar a cuadros patológicos (35,36). Los recién nacidos, fundamentalmente pretérminos, son mucho más sensibles a concentraciones altas de aluminio por la inmadurez de su función renal. La mayor contaminación de aluminio se debe a las sales de calcio y fosfato, y estos niños tienen unos requerimientos muy altos de estas sales. Se ha relacionado en prematuros la cantidad de aluminio de la NP recibida con el desarrollo neurológico (37,38).
El hierro no está incluido en los multioligoelementos pediátricos, pero existen preparados para administración intravenosa si fuera necesario.
Aunque durante años se alternaba el aporte de las vitaminas y oligoelementos por problemas de estabilidad, actualmente se recomienda su uso diario (ver capítulo de "Preparación de las nutriciones parenterales pediátricas").
No existen soluciones de multioligoelementos adecuadas para insuficiencia renal o hepática y el único oligoelemento disponible de forma separada es el zinc; por ello, para reducir la cantidad administrada de los oligoelementos que se pueden acumular en estas patologías, se tiene que disminuir el aporte del resto de elementos traza.
CARNITINA
No existe evidencia de que la incorporación de carnitina aporte efectos beneficiosos, aunque tampoco nocivos.
La principal función de la carnitina es permitir el paso de los triglicéridos de cadena larga a la mitocondria para su posterior oxidación. La leche materna y la mayoría de las fórmulas infantiles contienen carnitina.
Los pacientes pediátricos, especialmente neonatos pretérmino, tienen mayor probabilidad de presentar déficit de carnitina porque la síntesis está disminuida por su inmadurez enzimática. Se ha descrito que un alto porcentaje de pacientes de menos de 5 kg que solamente reciben NP tienen bajos niveles plasmáticos de carnitina (39). También se han encontrado niveles plasmáticos y tisulares inferiores a los normales en pacientes con NP a largo plazo que revierte al suplementar la NP con carnitina. La carnitina es además inocua y es estable en NP. Sin embargo, los resultados de los estudios publicados hasta ahora no son concluyentes. La ASPEN (26) recomienda aportar 2-5 mg/kg/día a todas las NP de neonatos (ver capítulo de "Requerimientos en nutrición parenteral pediátrica").
COLINA
No hay todavía preparados en el mercado español para aportar colina en la NP.
La ASPEN considera la colina como un nutriente esencial (26) para todos los grupos de edad, sin embargo todavía no existen preparados comerciales para poder añadirla a las soluciones de NP.
FÁRMACOS
Para poder añadir medicamentos a la bolsa de NP deben de ser compatibles con todos los componentes de la NP y no deben desestabilizar la emulsión.
Algunos de los fármacos utilizados rutinariamente dentro de la bolsa de NP son los que se exponen a continuación.
Insulina
Aunque algunos describen una disminución muy importante de la concentración de insulina debido a la adherencia a las paredes de la bolsa de NP, otros estudios, sin embargo, encuentran una disponibilidad de la misma del 90-95%. Esta adherencia está influenciada por el tipo de bolsa, el tipo y la longitud del sistema, el tipo de aminoácidos, la temperatura y la exposición previa a la insulina de la línea de administración. La presencia de lípidos aumenta la disponibilidad de insulina. Sin embargo esta disminución de concentración no parece muy importante, ya que la administración de insulina en la bolsa de NP se hace de rutina en muchos centros alcanzándose un buen control glucémico en los pacientes.
Antihistamínicos H2
La inclusión dentro de la bolsa de los antihistamínicos H2 tiene la ventaja de una infusión continua, en el caso de que la infusión de la NP se haga en 24 horas, y de disminuir la manipulación, sobre todo en pacientes con NP domiciliaria. Tanto la ranitidina como la famotidina y cimetidina son estables en NP. La estabilidad de la ranitidina, que es la más estudiada, es mayor cuando la solución lleva lípidos.
Octreótido/somatostatina
Son fármacos bastante utilizados en pacientes con NP tanto en el hospital como en domicilio y que se benefician de una infusión continua. Se pueden adherir a las paredes de la bolsa de NP disminuyendo la biodisponibilidad del fármaco, aunque esta no parece muy importante si la NP se utiliza en 24-48 horas.
Heparina
La adición de la heparina a la NP es un tema controvertido. Se han postulado distintas razones para su uso: disminución de tromboflebitis y tromboembolismos, aumento de vida de las vías periféricas, mejora del aclaramiento plasmático de lípidos, etc. Como se ha dicho anteriormente, el principal problema de la adición de heparina a una NP es la posibilidad de desestabilización de la emulsión lipídica, debido a la interacción de cargas negativas de la heparina con las cargas positivas de los iones calcio en la superficie de las gotículas de grasa. Se podría añadir a la bolsa de NP si la NP no contiene lípidos.
Recomendaciones
- En pacientes pediátricos, y especialmente en neonatos, está recomendado el uso de soluciones de aminoácidos específicas debido a la inmadurez de sus sistemas enzimáticos (GdE 5).
- Se recomienda el uso de filtros de 1,2 micras en la administración de mezclas ternarias, y de filtros de 0,22 micras para mezclas binarias con el objetivo de evitar el paso de partículas o precipitados (GdE 5).
- Se recomienda el aporte diario de vitaminas y oligoelementos específicos para pediatría (GdE 5).
BIBLIOGRAFÍA
1. Geggel HS, Ament ME, Heckenlively JR, Martin DA, Kopple JD. Nutritional requirement for taurine in patients receiving long-term parenteral nutrition. N Engl J Med 1985;312:142-6.
2. Moe-Byrne T, Wagner JV, McGuire W. Glutamine supplementation to prevent morbidity and mortality in preterm infants. Cochrane Database Syst Rev 2012;3:CD001457. DOI: 10.1002/14651858.CD001457.pub4
3. Jordan I, Balaguer M, Esteban ME, Cambra FJ, Felipe A, Hernández L, et al. Glutamine effects on heat shock protein 70 and interleukines 6 and 10: Randomized trial of glutamine supplementation versus standard parenteral nutrition in critically ill children. Clin Nutr 2016;35(1):34-40. DOI: 10.1016/j.clnu.2015.01.019
4. Shelton CM, Clark AJ, Storm MC, Helms RA. Plasma amino acid concentrations in 108 children receiving a pediatric amino acid formulation as part of parenteral nutrition. J Pediatr Pharmacol Ther 2010;15(2):110-8.
5. Morgan C, Burgess L. High Protein intake does not prevent low plasma levels of conditionally essential amino acids in very preterm infants receiving parenteral nutrition. JPEN J Parenter Enteral Nutr 2017;41(3):455-62. DOI: 10.1177/0148607115594009
6. Driscoll DF, Giampietro K, Wichelhaus DP, Peterss H, Nehne J, Niemann W, et al. Physicochemical stability assessments of lipid emulsions of varying oil composition. Clin Nutr 2001;20(2):151-7.
7. Skouroliakou M, Konstantinou D, Koutri K, Kakavelaki C, Stathopoulou M, Antoniadi M, et al. A double-blind, randomized clinical trial of the effect of omega-3 fatty acids on the oxidative stress of preterm neonates fed through parenteral nutrition. Eur J Clin Nutr 2010;64(9):940-7.
8. Deshpande G, Simmer K, Deshmukh M, Mori TA, Croft KD, Kristensen J. Fish Oil (SMOFlipid) and olive oil lipid (Clinoleic) in very preterm neonates. J Pediatr Gastroenterol Nutr 2014;58(2):177-82.
9. Skouroliakou M, Konstantinou D, Agakidis C, Kaliora A, Kalogeropoulos N, Massara P, et al. Parenteral MCT/w-3 polyunsaturated fatty acid-enriched intravenous fat emulsion is associated with cytokine and fatty acid profiles consistent with attenuated inflammatory response in preterm neonates: A randomized, double-blind clinical trial. Nutr Clin Pract 2016;31(2):235-44. DOI: 10.1177/0884533615602011
10. Skouroliakou M, Konstantinou D, Agakidis C, Delikou N, Koutri K, Antoniadi M, Karagiozoglou-Lampoudi T. Cholestasis, bronchopulmonary dysplasia, and lipid profile in preterm infants receiving MCT/ω-3-PUFA-containing or soybean-based lipid emulsions. Nutr Clin Pract 2012;27(6):817-24.
11. Lam HS, Tam YH, Poon TC, Cheung HM, Yu X, Chan BP, et al. A double-blind randomised controlled trial of fish oil-based versus soy-based lipid preparations in the treatment of infants with parenteral nutrition-associated cholestasis. Neonatology 2014;105(4):290-6.
12. Park HW, Lee NM, Kim JH, Kim KS, Kim SN. Parenteral fish oil-containing lipid emulsions may reverse parenteral nutrition-associated cholestasis in neonates: a systematic review and meta-analysis. J Nutr 2015;145(2):277-83.
13. Kapoor V, Glover R, Malviya MN. Alternative lipid emulsions versus pure soy oil based lipid emulsions for parenterally fed preterm infants. Cochrane Database Syst Rev 2015;12:CD009172. DOI: 10.1002/14651858.CD009172.pub2
14. Fallon EM, Le HD, Puder M. Prevention of parenteral nutrition-associated liver disease: role of omega-3 fish oil. Curr Opin Organ Transplant 2010; 15(3):334-40.
15. de Meijer VE, Gura KM, Meisel JA, Le HD, Puder M. Parenteral fish oil monotherapy in the management of patients with parenteral nutrition-associated liver disease. Arch Surg 2010;145(6):547-51.
16. Imseis E, Rhoads JM. Review on hepatic explant pathology of pediatric intestinal transplant recipients: Is it time for an oil change? World J Gastroenterol 2015;21(17):5115-8.
17. Matsumoto CS, Kaufman SS, Island ER, Kallakury B, Yazigi NA, Khan KM, et al. Hepatic explant pathology of pediatric intestinal transplant recipients previously treated with omega-3 fatty acid lipid emulsion. J Pediatr 2014;165(1):59-64.
18. Mercer DF, Hobson BD, Fischer RT, Talmon GA, Perry DA, Gerhardt BK, et al. Hepatic fibrosis persists and progresses despite biochemical improvement in children treated with intravenous fish oil emulsion. J Pediatr Gastroenterol Nutr 2013;56(4):364-9. DOI: 10.1097/MPG.0b013e31827e208c
19. Fitzgibbons SC, Jones BA, Hull MA, Zurakowski D, Duro D, Duggan C, et al. Relationship between biopsy-proven parenteral nutrition-associated liver fibrosis and biochemical cholestasis in children with short bowel syndrome. Pediatr Surg 2010;45(1):95-9; discussion 99. DOI: 10.1016/j.jpedsurg.2009.10.020
20. Driscoll DF, Silvestri AP, Bistrian BR. Stability of MCT/LCT-based total nutrient admixtures for neonatal use over 30 hours at room temperature: Applying pharmacopeial standards. JPEN J Parenter Enteral Nutr 2010;34(3):305-12.
21. Peters O, Ryan S, Matthew L, Cheng K, Lunn J. Randomised controlled trial of acetate in preterm neonates receiving parenteral nutrition. Arch Dis Child Fetal Neonatal Ed 1997;77(1):F12-5.
22. MacMohon P, Mayne PD, Blair M, Pope I, Zovar IZ. Calcium and phosphorus solubility in neonatal intravenous feeding solutions. Arch Dis Child 1990;65:352-4.
23. Hanning RM, Mitchell MK, Atkinton SA. In vitro solubility of calcium glycerophosphate versus convencional mineral salts in pediatric parenteral nutrition solutions. J Pediatr Gastroenterol Nutr 1989;9:67-72.
24. Raupp P, Kries RV, Pfahl HG, Manz F. Glycero-vs Glucose-phosphate in parenteral nutrition of premature infants: Evaluation of calcium/phosphorus compatibility. JPEN J Parenter Enteral Nutr 1991;15:469-73.
25. MacKay M, Anderson C. Physical compatibility of sodium glycerophosphate and calcium gluconate in pediatric parenteral nutrition solutions. JPEN J Parenter Enteral Nutr 2015;39(6):725-8.
26. Anderson C, MacKay M. Physical compatibility of calcium chloride and sodium glycerophosphate in pediatric parenteral nutrition solutions. JPEN J Parenter Enteral Nutr 2016;40(8):1166-9.
27. Chaieb SD, Chaumeil JC, Jebnoun S, Khrouf N, Hedhili A, Sfar S. Calcium and phosphate compatibility and stability studies in different neonatal parenteral nutrition mixtures. Eur J Hosp Pharm Sci Pract 2006;12(2):35-45.
28. Hanning RM, Atkinson SA, Whyte RK. Efficacy of calcium glycerophophste vs convencional mineral salts for total parenteral nutrition in low birth weight infants: a randomized clinical trial. Am J Clin Nutr 1991;54:903-8.
29. Costello I, Powell C, Williams AF. Sodium glycerophosphate in the treatment of neonatal hypophosphataemia. Arch Dis Child 1995;73:F44-5.
30. Vanek VW, Borum P, Buchman A, Fessler TA, Howard L, Jeejeebhoy K, et al; Novel Nutrient Task Force, Parenteral Multi-Vitamin and Multi-Trace Element Working Group; American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.) Board of Directors. A.S.P.E.N. Position paper: recommendations for changes in commercially available parenteral multivitamin and multi-trace element products. Nutr Clin Pract 2012; 27(4):440-91. Erratum in: Nutr Clin Pract 2014;29(5):701. Dosage error in article text.
31. Fell JME, Meadows N, Khan K, Long SG, Milla PJ, Reynolds AP, et al. Manganese toxicity in children receiving long-term parenteral nutrition. Lancet 1996;347:1218-21.
32. Aschner JL, Anderson A, Slaughter JC, Aschner M, Steele S, Beller A, et al. Neuroimaging identifies increased manganese deposition in infants receiving parenteral nutrition. Am J Clin Nutr 2015;102(6):1482-9.
33. Aschner JL, Anderson A, Slaughter JC, Aschner M, Steele S, Beller A, et al. Neuroimaging identifies increased manganese deposition in infants receiving parenteral nutrition. Am J Clin Nutr 2015;102(6):1482-9.
34. Pluhator-Murton MM, Fedorak RN, Audette RJ, Marriage BJ, Yatscoff RW, Gramlich LM. Trace element contamination of total parenteral nutrition. 1. Contribution of component solutions. JPEN J Parenter Enteral Nutr 1999;23(4):222-7.
35. Hernández-Sánchez A, Tejada-González P, Arteta-Jiménez M. Aluminium in parenteral nutrition: a systematic review. Eur J Clin Nutr 2013;67(3):230-8.
36. Gura KM. Aluminum contamination in parenteral products. Curr Opin Clin Nutr Metab Care 2014;17(6):551-7.
37. Bishop NJ, Morley R, Day JP, Lucas A. Aluminium neurotoxicity in preterm infants receiving intravenous-feeding solutions. N Engl J Med 1997;336(22):1557-61.
38. Fewtrell MS, Edmonds CJ, Isaacs E, Bishop NJ, Lucas A, Fewtrell MS, et al. Aluminium exposure from parenteral nutrition in preterm infants and later health outcomes during childhood and adolescence. Proc Nutr Soc 2011;70(3):299-304.
39. Winther B, Jackson D, Mulroy C, MacKay M. Evaluation of serum carnitine levels for pediatric patients receiving carnitine-free and carnitine-supplemented parenteral nutrition. Hosp Pharm 2014;49(6):549-53.