My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Nutrición Hospitalaria
On-line version ISSN 1699-5198Print version ISSN 0212-1611
Nutr. Hosp. vol.34 suppl.3 Madrid 2017
https://dx.doi.org/10.20960/nh.1380
Preparación de las nutriciones parenterales pediátricas
Preparation of pediatric parenteral nutrition solutions
Pilar Gomis Muñoz
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid
PROCESO DE PREPARACIÓN DE LA NUTRICIÓN PARENTERAL
Las nutriciones parenterales (NP) se deben preparar en cabina de flujo laminar horizontal. Es importante realizar controles microbiológicos periódicamente.
La preparación de las NP está centralizada desde hace bastantes años en los Servicios de Farmacia. Las principales ventajas de esta centralización son garantizar unas condiciones de asepsia en la manipulación de sus componentes y validar la compatibilidad, estabilidad y adecuación de los requerimientos prescritos. La preparación de las NP se debe realizar en áreas de ambiente controlado con cabina de flujo laminar horizontal clase 100 cumpliendo estrictamente una normativa de trabajo que incluye la manera de preparar las NP y la limpieza del área y cabina.
El proceso de elaboración debe garantizar el mantenimiento de las condiciones de asepsia en la manipulación para conseguir la esterilidad de las NP. Periódicamente hay que realizar controles microbiológicos y validar el proceso de preparación.
IDENTIFICACIÓN DE LAS BOLSAS
Todas las bolsas preparadas deben ir identificadas con el nombre del paciente y su ubicación, la composición exhaustiva de la mezcla y otros datos que puedan ayudar en la administración como la osmolaridad, la velocidad de infusión, etc.
Las bolsas, una vez preparadas, deben identificarse con información sobre el paciente y sobre la mezcla. Lo mejor es consensuar esta información entre el Servicio de Farmacia y los Servicios de Pediatría para que sea lo más útil posible tanto para el personal de enfermería, a la hora de la administración, como para el personal médico, si tiene que consultar algún dato de la composición.
Se enumera la información que puede contener una etiqueta identificativa de NP pediátrica. Está subrayada la información indispensable:
- Relativa al paciente: nombre y apellidos del paciente, unidad de enfermería, cama, peso, número de historia, etc.
- Relativa a la composición de la mezcla: esta información puede expresarse en cantidades totales, en cantidades por kg o de ambas formas. En el caso de que se exprese en cantidades por kg habrá que indicar también el peso del paciente. Es muy frecuente añadir una cantidad extra para el purgado del sistema. Esta cantidad tiene que venir reflejada en la etiqueta en forma de porcentaje o de valor absoluto. Las cantidades indicadas en la etiqueta suelen ser cantidades totales prescritas por lo que no incluyen esta cantidad extra para el purgado del sistema. También se puede expresar la información en forma de concentración.
•Volumen.
• Calorías.
•Contenido de macronutrientes (g): aminoácidos, glucosa, lípidos.
•Contenido en electrolitos (mEq o mmol): sodio, potasio, cloro, acetato, magnesio, calcio.
•Contenido en electrolitos (mmol): fósforo (el fósforo o fosfato debe de expresarse siempre en mmoles para evitar errores).
•Contenido en micronutrientes: volumen de los multivitamínicos o multioligoelementos añadidos. Si es posible se deberían poner los preparados utilizados. Si existe un problema de espacio en la etiqueta es suficiente con que estos consten en el protocolo de NP pediátrica. Al menos hay que poner que se añaden vitaminas y oligoelementos según protocolo.
•Medicamentos añadidos: principio activo, dosis, unidades.
•Osmolaridad.
- Otros:
•Vía de administración.
•Velocidad de administración.
•Condiciones de conservación.
•Caducidad.
ESTABILIDAD DE LA EMULSIÓN LIPÍDICA
Para evitar la desestabilización de las NP es importante seguir un orden de adición de los componentes (siempre los aminoácidos -AA- primero) y vigilar la concentración final de AA (mayor de 2-2,5%), glucosa y lípidos.
Las NP "todo en uno" necesitan menor manipulación, tanto en la preparación como en la administración, suponen menor gasto de material fungible y de personal, solo precisan una bomba de administración y son peor caldo de cultivo para microorganismos que los lípidos separados. Por estas razones, si la estabilidad de la emulsión lo permite, esta es la forma ideal de administración. Cuando ello no es posible se administran los lípidos separados y a ser posible por una vía distinta ya que, si se utiliza una misma vía, los componentes se mezclan en el catéter pudiendo producirse también desestabilización de la emulsión y obstrucciones del catéter. Este riesgo es mayor en los servicios de neonatología por la lenta velocidad de administración y las elevadas temperaturas dentro de las incubadoras. Para evitar el paso de partículas y gotículas mayores de 1,2 micras es necesario utilizar filtros en la administración.
Los factores que mayor influencia tienen en la estabilidad de la emulsión lipídica son (1,2):
- pH de la solución: a menor pH menor estabilidad de la emulsión.
- Concentración de AA: los AA tienen un efecto protector sobre la emulsión por su efecto tampón, por situarse en la superficie de la gotícula de grasa aumentando la estabilidad de la misma y por formar complejos con cationes divalentes reduciendo la actividad de estos iones. Los diferentes tipos de soluciones de AA pueden tener distinto valor de pH y por tanto distinto comportamiento.
- Concentración de glucosa: si se añade glucosa directamente a la emulsión lipídica se produce un aumento del diámetro de las gotículas de grasa que puede llevar a la rotura de la emulsión posiblemente relacionado con el pH ácido de las soluciones de glucosa. Parece que influyen de forma más negativa las soluciones de glucosa de mayor y menor concentración.
- Concentración de electrolitos: al aumentar la carga electrolítica fundamentalmente cationes tri (hierro) y divalentes (calcio y magnesio) disminuye la estabilidad de la emulsión, ya que estos iones actúan de puente entre glóbulos de grasa facilitando su unión.
- Orden de adición: se recomienda mezclar primero los AA y la glucosa e introducir en último lugar las grasas para minimizar el efecto desestabilizante del pH ácido de la glucosa.
- Tipo de lípidos: existen estudios que verifican que las emulsiones de LCT son menos estables que las que incluyen MCT o las basadas en el aceite de oliva (3). Se ha observado que concentraciones muy pequeñas de lípidos también pueden desestabilizar la emulsión.
- Temperatura: temperaturas extremas pueden disminuir la estabilidad.
El proceso de desestabilización produce un aumento del tamaño de las partículas lipídicas. Fases tempranas de este proceso consisten en agregación de partículas que pueden desplazarse hacia la parte superior por su menor densidad formando el llamado "creaming". Este proceso es todavía reversible por agitación. Cuando las gotículas lipídicas se fusionan para formar gotas más grandes se produce el proceso de coalescencia, que ya es irreversible y que lleva a la rotura de la emulsión.
Casi todos los estudios de estabilidad de NP "todo en uno" están hechos en NP diseñadas para pacientes adultos. Las NP pediátricas tienen unas características distintas que les confieren una menor estabilidad:
- Tienen menor concentración de AA.
- Tienen mayor concentración de calcio y fosfato.
- Tienen menor concentración de lípidos cuando se inicia la NP.
- Pueden llevar heparina.
En Estados Unidos y Canadá existe muy poca experiencia en el uso de NP ternarias y, por ello, encontramos muchos autores de estos países cautelosos sobre este tema (2). Sin embargo, en Europa, y especialmente en España, existe una amplia experiencia, de más de 20 años, en la utilización de estas emulsiones. Teniendo la precaución de utilizar en la administración filtros de 1,2 micras y que la composición de las mezclas tenga al menos 2-2,5% (4) de aminoácidos y 1-1,5% de lípidos esta práctica puede considerarse segura. Otro aspecto que hay que tener en cuenta es evitar añadir heparina a la NP cuando esta lleve calcio (5).
PRECIPITADOS
La precipitación calcio-fosfato es la más común y preocupante en las NP. Para evitarla se recomienda el uso de fosfatos orgánicos (glicerofosfato sódico) y el uso de filtros en la administración.
Precipitación calcio-fosfato
La precipitación calcio-fosfato es el mayor problema de compatibilidad de las mezclas de NP. Se produce a rangos de concentración compatibles con las necesidades del paciente, especialmente en niños ya que tienen altos requerimientos de estos iones (6).
La precipitación de fosfato cálcico se ve favorecida por los siguientes factores:
- Mayor concentración de calcio y fosfato.
- Aumento del pH de la solución, ya que en estas condiciones se aumenta la forma diácida de fosfato que es la más propensa a precipitar como fosfato cálcico.
- Disminución de la concentración de AA. Los AA, por una parte, pueden formar complejos con el calcio y el fosfato haciéndolos menos accesibles. Por otra parte, al actuar como tampón impiden que el pH aumente.
- Aumento de la temperatura. Al aumentar el movimiento, provocado por el aumento de temperatura, existen más posibilidades de unión entre los iones calcio y fosfato.
- Orden de adición: se ha visto experimentalmente que la precipitación es mayor si se adiciona primero el calcio y luego el fosfato, aunque no se sabe exactamente la razón.
- Largo tiempo de reposo y velocidad de infusión lenta ya que hay mayor tiempo para la cristalización de la sal.
- Fuente de calcio: el cloruro cálcico se disocia más que otros compuestos como el gluconato cálcico o glubionato cálcico, por lo que se recomienda utilizar estos últimos.
- Fuente de fosfato: si se utilizan fosfatos inorgánicos es mejor el fosfato monoácido en vez del diácido. Las fuentes orgánicas de fosfato se disocian mucho menos que las inorgánicas y tienen muy poca probabilidad de precipitar.
Si utilizamos fosfatos inorgánicos hay una alta probabilidad de no poder alcanzar los requerimientos de calcio y fósforo del niño. Como hemos dicho anteriormente, estos requerimientos son mayores en los niños que en los adultos y además, no es infrecuente que estos pacientes, especialmente los pretérminos, tengan restricción de volumen lo que imposibilitaría aún más incluir sus necesidades en la bolsa de NP. Para minimizar el riesgo de precipitación cuando se usan fuentes inorgánicas de fósforo existen diagramas que permiten conocer las concentraciones máximas de calcio y fosfato que se pueden alcanzar según el pH y la concentración de AA de la mezcla. Chaieb y cols. estudiaron este problema con fuentes inorgánicas de fosfato y concluyen que solo son compatibles concentraciones menores de 9 mmol /L de fosfato cuando se utiliza hasta 30 mmol /L de calcio y de 5 mmol /L de calcio para concentraciones hasta 13 mmol /L de fosfato (6). Las sales orgánicas de calcio y fosfato son mucho menos proclives a precipitar que las inorgánicas (7-9) por lo que deberían ser las de primera elección (1). Los fosfatos orgánicos tienen una buena tolerancia y son una fuente eficaz de fósforo (10,11). Las concentraciones máximas que se pueden alcanzar con estos compuestos son mayores que las necesarias para aportar los requerimientos de los pacientes pediátricos (12-14), aunque hay que tener especial precaución cuando el aporte proteico sea muy bajo (menor de 0,5 %) y el volumen esté muy restringido. El glicerofosfato sódico es el único fosfato orgánico disponible en nuestro país. Este ión aporta dos mmol de sodio por cada mmol de fósforo lo que hay que tener en cuenta si se quiere restringir el aporte de sodio. Aunque la probabilidad de precipitación es menor con las fuentes orgánicas de fosfato, se recomienda siempre filtrar las soluciones de NP con filtros en la administración (0,22 micras las mezclas binarias y 1,2 micras las mezclas ternarias y los lípidos).
Otros precipitados
Se ha descrito la precipitación de complejos con oligoelementos a altas dosis y con algunos medicamentos. Por ello es de suma importancia no mezclar ni administrar en Y con la NP ningún medicamento del que no conozcamos su estabilidad. Recientemente se ha descrito la formación de precipitados de cisteína y cobre con oscurecimiento del filtro de infusión en Cánada (15,16). Hasta la fecha no se ha descrito la formación de precipitados con los multioligoelementos pediátricos usados en nuestro país.
PARTÍCULAS EN SUSPENSIÓN
Se recomienda filtrar las mezclas de NP con filtros de 0,22 micras cuando no llevan lípidos y con filtros 1,2 micras para NP "todo en uno".
En la manipulación de ampollas, viales, frascos que se realiza para preparar las bolsas de NP se generan una gran cantidad de partículas. Se han observado microscópicamente partículas de cristal de las ampollas, goma y metal de los tapones, fibras de algodón provenientes de las gasas con las que se desinfectan los tapones, etc. Para evitar el paso de partículas al paciente se pueden filtrar las NP con filtros de 1,2 micras para emulsiones lipídicas y de 0,22 micras para soluciones no lipídicas, ya sea en el momento de la preparación o posteriormente en la administración.
DEGRADACIÓN DE VITAMINAS
Se recomienda el aporte diario de vitaminas y oligoelementos. Se pueden aportar juntos en la misma bolsa. La degradación de vitaminas se puede minimizar utilizando NP "todo en uno", bolsas multicapa y bolsas exteriores de fotoprotección.
Las vitaminas más inestables en NP son la vitamina C y la vitamina A.
El ácido ascórbico en presencia de oxígeno se oxida y el cobre es un catalizador de esta reacción. Por esta causa, durante muchos años se recomendó la administración de vitaminas y oligoelementos en días alternos. Hoy día se conoce que este efecto catalizador no es tan significativo y que lo realmente importante es intentar evitar el contacto con el oxígeno, ya sea en el momento de la preparación como posteriormente en la bolsa. Por ello, la utilización de bolsas multicapa que impide el paso del oxígeno reduce casi totalmente esta degradación cuando usamos oligoelementos conjuntamente con vitaminas y quitamos el aire residual de las bolsas (17-20).
La degradación de vitamina A parece que se debe a procesos de foto-degradación y de adherencia al plástico de las bolsas y sistemas, y podría ser distinta según el tipo de multivitamínico y de lípidos (21). Para minimizar esta degradación se recomienda administrarla en NP con lípidos o en la bolsa de los lípidos, proteger de la luz tanto la bolsa como los sistemas (22) y utilizar bolsas multicapa (8,23).
El resto de las vitaminas son bastante estables siempre que se usen mezclas ternarias, bolsas multicapa, soluciones de AA sin bisulfitos y fotoprotección. Basándonos en los estudios realizados hasta la fecha (24), parece razonable administrar conjuntamente vitaminas y oligoelementos en las condiciones descritas anteriormente y preparar la NP, si es necesario, con anterioridad a su administración.
PROCESOS DE PEROXIDACIÓN
La generación de peróxidos es de especial importancia por su efecto deletéreo en neonatología. Para prevenirla es fundamental evitar la luz y el contacto con el oxígeno. Por ello se recomienda el uso de bolsas multicapa en la preparación de NP, su fotoprotección con sobrebolsas fotoprotectoras y la utilización de sistemas de administración que eviten el paso de la luz.
En la última década se han publicado varios estudios que asocian la generación de radicales libres con el aumento de morbilidad de diversas patologías fundamentalmente en prematuros (25,26). Por otra parte también se ha constatado que la NP es una fuente de peróxidos y que los neonatos que reciben NP muestran mayor estrés oxidativo que los que no la reciben (27). La luz tiene un papel fundamental en la generación de peróxidos y se ha relacionado la protección de las NP de la luz, tanto de las bolsas como de los sistemas de administración, con una menor incidencia de enfermedad pulmonar (28,29). Sin embargo, parece que la fotoprotección de la bolsa solo, sin fotoproteger el sistema de administración, no es suficiente para disminuir la incidencia de broncodisplasia o muerte en neonatos (30). Se ha encontrado también relación entre la fotoprotección de la bolsa y del sistema, con menores niveles de glucosa y colesterol en sangre en prematuros (31) y con una mejor tolerancia a la nutrición enteral, lo que indica una mejor evolución del paciente (32). Los principales factores que influyen en los procesos de oxidación de las NP son la luz, el contacto con el oxígeno, la presencia de metales como el hierro o el cobre y la temperatura (33). Se ha descrito que el uso de bolsas multicapa disminuye estos procesos de generación de peróxidos (8). La peroxidación también está directamente relacionada con el contenido en ácidos grasos poliinsaturados (AGPI) de la fuente lipídica e inversamente con el contenido en vitamina E de la NP (34). Sin embargo, altas concentraciones de vitamina E pueden tener efectos pro-oxidantes. Las emulsiones lipídicas con alto contenido en AGPI como los que aportan un 100% de triglicéridos de cadena larga contienen mayor cantidad de peróxidos (8,14). La administración de vitaminas conjuntamente con los lípidos y protegidos de la luz inhibe casi completamente la formación de peróxidos (35). Recientemente se ha publicado un metaanálisis en el que encuentran que la mortalidad de los niños prematuros que recibieron NP protegida de la luz fue la mitad que los que la recibieron sin proteger (36).
Para evitar la peroxidación se recomienda:
- Almacenar las bolsas de NP en refrigeración y protegidas de la luz.
- Proteger de la luz la NP.
- Proteger de la luz el sistema de administración en neonatología.
- Utilizar bolsas multicapa, sobre todo para largos periodos de almacenaje y cuando los lípidos se administran separados.
- Usar mezclas "todo en uno" o administrar los multivitamínicos conjuntamente con los lípidos.
- Utilizar lípidos con bajo contenido en AGPI.
CONTAMINACIÓN POR ALUMINIO
El aluminio se puede acumular en el cuerpo y producir efectos deletéreos. Es importante conocer el contenido de aluminio de los distintos componentes de la NP para intentar disminuir su aporte. Es preferible utilizar electrolitos en envases plásticos que en cristal.
Las soluciones utilizadas en la preparación de NP pueden contener aluminio procedente tanto de la materia prima como del proceso de fabricación o de los envases utilizados (37). Además el material utilizado en la preparación de la NP también puede ceder aluminio a la mezcla (38). El aluminio administrado por vía intravenosa puede depositarse en hueso, hígado, cerebro y otros tejidos pudiendo producir complicaciones graves (39-41). Los recién nacidos, fundamentalmente los pretérminos, son mucho más sensibles a concentraciones altas de aluminio por la inmadurez de su función renal. Este grupo de pacientes es además el que mayor cantidad de aluminio por kilo de peso recibe con la NP, ya que la mayor concentración de aluminio parece estar en las sales de calcio y fosfato, y estos niños tienen unos requerimientos muy altos de estas sales. En niños con NP a largo plazo se han observado niveles plasmáticos de aluminio elevados (42).
Los envases de cristal tienen mayor propensión a ceder aluminio a la solución. Se ha visto que existe una gran variabilidad entre lotes y que dentro de un lote el contenido de aluminio es mayor cuanto más próxima esté la fecha de caducidad. En EE. UU. se ha emitido una normativa que obliga a los fabricantes de productos destinados a la elaboración de NP a incluir en la etiqueta un mensaje indicando que la concentración es menor de 25 mcg/L o el contenido máximo que puede tener cada lote. En Europa todavía no hay ninguna normativa similar. Es importante conocer el contenido de aluminio de las soluciones para intentar disminuir su aporte sobre todo en neonatología y en pacientes con NP largo plazo. Varios autores han medido la cantidad de aluminio en los productos de NP concluyendo que los aportes de gluconato cálcico, sales de fosfato y multioligoelementos son los que más aluminio aportan (43-46). Recientemente el grupo de trabajo de farmacia SENPE/SEFH ha estudiado la cantidad de aluminio en los productos del mercado español, encontrando que los que mayor cantidad de aluminio contiene son las sales de fosfato, especialmente las presentaciones de vidrio (datos pendientes de publicar).
ADICIÓN DE FÁRMACOS DENTRO DE LA BOLSA DE NP
Solamente se pueden incluir en la bolsa de NP los medicamentos compatibles con los componentes de la NP y que no desestabilicen la emulsión. Algunos de los fármacos utilizados rutinariamente dentro de la bolsa de NP son los siguientes:
- Insulina.
La insulina se adhiere en cierta medida a las paredes de la bolsa de NP. Sin embargo esta disminución de concentración no parece muy importante sobre todo si la insulina pautada se ajusta después de su administración con la NP, ya que se ha visto que pacientes con insulina en la NP muestran un buen control glucémico.
-Antihistamínicos H2.
Los antihistamínicos H2 son habitualmente utilizados en pacientes con NP. Su inclusión dentro de la bolsa tiene la ventaja de una infusión continua, en el caso de infusión de la NP durante 24 horas, y de disminuir la manipulación, sobre todo en pacientes con NP domiciliaria. Tanto la ranitidina como la famotidina y cimetidina son estables en NP. La estabilidad de la ranitidina, que es la más estudiada, es mayor cuando la NP lleva lípidos.
- Octreótido/somatostatina.
Son también fármacos bastante utilizados en pacientes con NP tanto en el hospital como en domicilio y que se benefician de una infusión continua. Se pueden adherir a las paredes de la bolsa de NP disminuyendo la biodisponibilidad del fármaco, aunque esta no parece muy importante si la NP se utiliza en 24-48 horas.
- Heparina.
La adición de la heparina a la NP es un tema controvertido. Se han postulado distintas razones para su uso: disminución de tromboflebitis y tromboembolismos, aumento de vida de las vías periféricas, mejora del aclaramiento plasmático de lípidos, etc. El principal problema de la adición de heparina a una NP que contenga lípidos y calcio es la posibilidad de desestabilización de la emulsión lipídica, debido a la interacción de cargas negativas de la heparina con las cargas positivas de los iones calcio en la superficie de las gotículas de grasa. La desestabilización de la emulsión se puede producir tanto en la bolsa de la NP como en el sistema cuando se administran los lípidos en Y, ya que se unen grandes cantidades de lípidos, con calcio, heparina y la lenta velocidad de infusión.
Hay varios factores que pueden contribuir a este proceso:
• Velocidad de infusión. Una velocidad de infusión lenta, muy frecuente en neonatos, produce un mayor tiempo de contacto antes de entrar en el torrente circulatorio, con mayor posibilidad de separación de fases.
• Concentración de heparina. A mayor concentración de heparina o de lípidos, mayor rapidez de formación de creaming.
• Concentración de calcio. A mayor concentración de calcio, muy común en NP pediátrica, mayor desestabilización.
TIPOS DE NUTRICIONES PARENTERALES SEGÚN EL LUGAR DE PREPARACIÓN
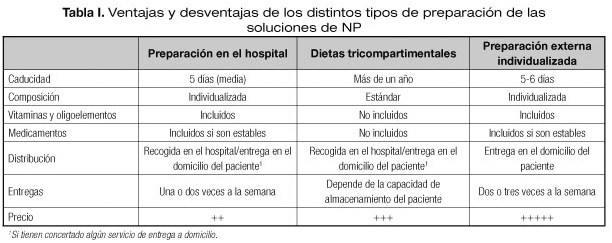
Aunque la mayoría de los hospitales preparan las bolsas de NP pediátrica en el Servicio de Farmacia, existen en nuestro país laboratorios que ofrecen este servicio, ya sea elaborando la NP con una composición individualizada y distinta para cada paciente o comercializando bolsas tricompartimentales. Estos sistemas pueden ser de utilidad para pacientes con NP domiciliaria, ya que en algunos casos ofrecen el servicio del transporte al domicilio del paciente. En la tabla I se comparan las ventajas e inconvenientes de los distintos sistemas. (Tablas II y III)
RECOMENDACIONES
- Las NP se deben preparar en cabina de flujo laminar horizontal. Es importante realizar controles microbiológicos periódicamente. (GdE 5).
- Todas las bolsas preparadas deben de ir identificadas con el nombre del paciente y su ubicación, la composición exhaustiva de la mezcla y otros datos que puedan ayudar en la administración como la osmolaridad, la velocidad de infusión, etc. (GdE 5).
- Para evitar la desestabilización de las NP es importante seguir un orden de adición de los componentes (siempre los aminoácidos primero) y vigilar la concentración final de aminoácidos (mayor de 2-2,5%), glucosa y lípidos (GdE 5).
- Para minimizar la precipitación calcio-fosfato se recomienda el uso de fosfatos orgánicos y el uso de filtros en la administración (GdE 5).
- Se recomienda el aporte diario de vitaminas y oligoelementos. Se pueden aportar juntos en la misma bolsa. La degradación de vitaminas se puede minimizar utilizando NP "todo en uno", bolsas multicapa y bolsas exteriores de fotoprotección (GdE 5).
- La generación de peróxidos es de especial importancia por su efecto deletéreo en neonatología. Para prevenirla es fundamental evitar la luz y el contacto con el oxígeno. Se recomienda su fotoprotección con sobrebolsas fotoprotectoras y la utilización de sistemas de administración que eviten el paso de la luz (GdE 1).
BIBLIOGRAFÍA
1. Consenso español sobre preparación de mezclas nutrientes parenterales 2008. Grupo de nutrición de la SENPE y SEFH. Farm Hosp 2009;33(Nº Extraordinario 1):81-107.
2. Blackmer AB, Partipilo ML. Three-in-one parenteral nutrition in neonates and pediatric patients: risks and benefits. Nutr Clin Pract 2015;30(3):337-43.
3. Driscoll, DF, Giampietro K, Wichelhaus DP, Nehne J, Niemann W, Bistrian BR. Physicochemical stability assessments of lipid emulsions of varying oil composition. Clin Nutr 2001;20(2):151-7.
4. Driscoll DF, Silvestri AP, Bistrian BR. Stability of MCT/LCT-based total nutrient admixtures for neonatal use over 30 hours at room temperature: Applying Pharmacopeial Standards. JPEN J Parenter Enteral Nutr 2010;34(3):305-12.
5. Athanasiou C, Hatziantoniou S, Skouroliakou M, Markantonis-Kyroudis S. Assessment of the physicochemical stability of all-in-one parenteral emulsions for neonates according to USP specifications. JPEN J Parenter Enteral Nutr 2014;38(7):867-72.
6. Chaieb SD, Chaumeil JC, Jebnoun S, Khrouf N, Hedhili A, Sfar S. Calcium and phosphate compatibility and stability studies in different neonatal parenteral nutrition mixtures. Eur J Hosp Pharm Sci Pract 2006;12(2):35-45.
7. Hanning RM, Mitchell MK, Atkinton SA. In vitro solubility of calcium glycerophosphate versus conventional mineral salts in pediatric parenteral nutrition solutions. J Pediatr Gastroenterol Nutr 1989;9:67-72.
8. Raupp P, Kries RV, Pfahl HG, Manz F. Glycero vs Glucose-phosphate in parenteral nutrition of premature infants: Evaluation of calcium/phosphorus compatibility. JPEN J Parenter Enteral Nutr 1991;15:469-73.
9. Ronchera CL, Jiménez NV, Peidro J. Stability of parenteral nutrition admixtures containing organic phosphates. Clin Nutr 1995;14:373-80.
10. Hanning RM, Atkinson SA, Whyte RK. Efficacy of calcium glycerophosphate vs convencional mineral salts for total parenteral nutrition in low birth weight infants: a randomized clinical trial. Am J Clin Nutr 1991;54:903-8.
11. Costello I, Powell C, Williams AF. Sodium glycerophosphate in the treatment of neonatal hypophosphataemia. Arch Dis Child 1995;73:F44-5.
12. MacKay M, Anderson C. Physical compatibility of sodium glycerophosphate and calcium gluconate in pediatric parenteral nutrition solutions. JPEN J Parenter Enteral Nutr 2015;39(6):725-8.
13. Anderson C, MacKay M. Physical compatibility of calcium chloride and sodium glycerophosphate in pediatric parenteral nutrition solutions. JPEN J Parenter Enteral Nutr 2016;40(8):1166-9.
14. Bouchoud L, Fonzo-Christe C, Sadeghipour F, Bonnabry P. Maximizing calcium and phosphate content in neonatal parenteral nutrition solutions using organic calcium and phosphate salts. JPEN J Parenter Enteral Nutr 2010;34(5):542-5.
15. Foinard A, Perez M, Barthélémy C, Lannoy D, Flamein F, Storme L, et al. In vitro assessment of interaction between amino acids and copper in neonatal parenteral nutrition. JPEN J Parenter Enteral Nutr 2016;40(6):827-34. DOI: 10.1177/0148607115571967.
16. Thibault M. Possible Incompatibility between Amino Acids and Copper in Solutions for Pediatric Parenteral Nutrition. Can J Hosp Pharm 2014;67(2):160-4.
17. Balet A, Cardona D, Jane S, Molins-Pujol AM, Sánchez Quesada JL, Gich I, et al. Effects of multilayered bags vs ethylvinyl-acetate bags on oxidation of parenteral nutrition. JPEN J Parenter Enteral Nutr 2004;28(2):85-91.
18. Depertuis YM, Morch A, Fathi M, Sierro C, Genton L, Kyle UG, et al. Physical characteristics of total parenteral nutrition bags significantly affect the stability of vitamins C and B1: a controlled prospective study. JPEN J Parenter Enteral Nutr 2002;26(5):310-6.
19. Gomis P, Míguelez S, Navarro JA, Estenoz J, Alegre E, Moreno JM, et al. Estabilidad de vitaminas en nutrición parenteral: comparación de bolsas multicapa frente a unicapa. Nutr Hosp 1996;11:259-64.
20. Dupertuis YM, Ramseyer S, Fathi M, Richard C. Assesment of ascorbic acid stability in different multilayered parenteral nutrition bags: Critical influence of the bag wall material. JPEN J Parenter Enteral Nutr 2005;29(2):125-30.
21. Guidetti M, Sforzini A, Bersani G, Corsini C, Grossi G, Zolezzi C, et al. Vitamin A and vitamin E isoforms stability and peroxidation potencial of all-in-one admixtures for parenteral nutrition. Int J Vitam Nutr Res 2008;78(3):156-66.
22. Hass C, Genzel-Boroviczény O, Koletzco B. Losses of vitamin A and E in parenteral nutrition suitable for premature infants. Eur J Clin Nutr 2002;56:906-12.
23. Vazquez R, Hoang ML, Martin J, Yahia YA, Graffard H, Guyon F, et al. Simultaneous quantification of water-soluble and fat-soluble vitamins in parenteral nutrition admixtures by HPLC-UV-MS/MS. Eur J Hosp Pharm Sci Pract 2009;15(2):28-35.
24. Such A, Sánchez C, Gomis P, Herreros de Tejada A. Estabilidad de vitaminas en nutrición parenteral. Nutr Hosp 2009;24:1-9.
25. Inder TE, Darlow BA, Sluis KB, Winterbourn CC, Graham P, Sanderson KJ, et al. The correlation of elevated levels of an index of lipid peroxidation (MDA-TBA) with adverse outcome in the very low birthweight infant. Acta Paediatr 1996;85(9):1116-22.
26. Collard KJ, Godeck S, Holley JE, Quinn MW. Pulmonary antioxidant concentrations and oxidative damage in ventilated premature babies. Arch Dis Child Fetal Neonatal Ed 2004;89(5):F412-6.
27. Basu BR, Muller DP, Papp E, Merryweather I, Eaton S, Klein N, et al. Free radical formation in infants: the effect of critical illness, parenteral nutrition, and enteral feeding. J Pediatr Surg 1999;34:1091-5.
28. Bassiouny MR, Almarsafawy H, Abdel-Hady H, Nasef N, Hammad TA, Aly H. A randomized controlled trial on parenteral nutrition, oxidative stress, and chronic lung diseases in preterm infants. J Pediatr Gastroenterol Nutr 2009;48(3):363-9.
29. Chessex P, Harrison A, Khashu M, Lavoie JC. In preterm neonates, is the risk of developing bronchopulmonary dysplasia influenced by the failure to protect total parenteral nutrition from exposure to ambient light? J Pediatr 2007;151(2):213-4.
30. Sherlock R, Chessex P. Shielding parenteral nutrition from light: does the available evidence support a randomized, controlled trial? Pediatrics 2009;123(6):1529-33.
31. Khashu M, Harrison A, Lalari V, Gow A, Lavoie J, Chessex P. Impact of shielding parenteral nutrition from light on routine monitoring of blood glucose and triglyceride levels in preterm neonate. Arch Dis Child Fetal Neonatal Ed 2009;94(2):F111-5.
32. Khashu M, Harrison A, Lalari V, Gow A, Lavoie JC, Chessex P. Photoprotection of parenteral nutrition enhances advancement of minimal enteral nutrition in preterm infants. Semin Perinatol 2006;30(3):139-45.
33. Steger PJ, Muhlebach SF. Lipid peroxidation of intravenous lipid emulsions and all-in-one admixtures in total parenteral nutrition bags: the influence of trace elements. JPEN J Parenter Enteral Nutr 2000;24(1):37-41.
34. Pironi L, Guidetti M, Zolezzi C, Fasano MC, Paganelli F, Merli C, et al. Peroxidation potential of lipid emulsions after compounding in all-in-one solutions. Nutrition 2003;19(9):784-8.
35. Silvers KM, Sluis KB, Daerlow BA, Mcguill F, Stocker R, Winterbourn CC. Limiting light-induced lipid peroxidation and vitamin loss in infant parenteral nutrition by adding multivitamin preparation to Intralipid. Acta Paediatr 2001;90:242-9.
36. Chessex P, Laborie S, Nasef N, Masse B, Lavoie JC. Shielding parenteral nutrition from light improves survival rate in premature infants: A meta-analysis. JPEN J Parenter Enteral Nutr 2017;41(3):378-83. DOI: 10.1177/0148607115606407
37. Gura KM, Puder M. Recent developments in aluminium contamination of products used in parenteral nutrition. Curr Opin Nutr Metab Care 2006;9:239-46.
38. de Oliveira SR, Bohrer D, Garcia SC, do Nascimento PC, Noremberg S. Aluminum content in intravenous solutions for administration to neonates: role of product preparation and administration methods. JPEN J Parenter Enteral Nutr 2010;34(3):322-8.
39. Gura KM. Aluminum contamination in parenteral products. Curr Opin Clin Nutr Metab Care 2014;17(6):551-7.
40. Hernández-Sánchez A, Tejada-González P, Arteta-Jiménez M. Aluminum in parenteral nutrition: a systematic review. Eur J Clin Nutr 2013;67(3):230-8.
41. Fewtrell MS, Edmonds CJ, Isaacs E, Bishop NJ, Lucas A. Aluminium exposure from parenteral nutrition in preterm infants and later health outcomes during childhood and adolescence. Proc Nutr Soc 2011;70(3):299-304.
42. Courtney-Martin G, Kosar C, Campbell A, Avitzur Y, Wales PW, Steinberg K, et al. Plasma Aluminum concentrations in pediatric patients receiving long-term parenteral nutrition. JPEN J Parenter Enteral Nutr 2015;39(5):578-85.
43. Lima-Rogel V, Romano-Moreno S, de Jesús López-López E, de Jesús Escalante-Padrón F, Hurtado-Torres GF. Aluminum contamination in parenteral nutrition admixtures for low-birth-weight preterm infants in Mexico. JPEN J Parenter Enteral Nutr 2016;40(7):1014-20.
44. Menéndez AM, Farías SS, Servant R, Morisio Y, Misischia Y, Simón S, et al. Aluminum content in individual components, used to prepare adult total parenteral nutrition mixtures in Argentine, and in comparison with international regulation. Nutr Hosp 2014;29(6):1380-7.
45. Migaki EA, Melhart BJ, Dewar CJ, Huston RK. Calcium chloride and sodium phosphate in neonatal parenteral nutrition containing TrophAmine: precipitation studies and aluminum content. JPEN J Parenter Enteral Nutr 2012;36(4):470-5.
46. Poole RL, Pieroni KP, Gaskari S, Dixon T, Kerner JA. Aluminum exposure in neonatal patients using the least contaminated parenteral nutrition solution products. Nutrients 2012;4(11):1566-74.