INTRODUCCIÓN
Durante el envejecimiento se pierde masa muscular de manera gradual y progresiva 1) (2) (3. Dependiendo de los criterios diagnósticos, esta disminución de masa muscular conocida como sarcopenia se estima que ocurre entre el 5% y el 45% de los ancianos 2) (4) (5. La sarcopenia es un síndrome geriátrico multifactorial que se asocia a fracturas, discapacidad física y otras comorbilidades 6) (7. Su tratamiento combina actividad física y alimentación 8) (9. La actividad física se asocia con mayor masa muscular, previniendo fragilidad y disfunción; la sarcopenia ha sido ampliamente observada en ancianos sedentarios 10) (11) (12. Además, se ha descrito disminución en la tasa metabólica secundaria a la disminución de actividad física y de la masa libre de grasa, incrementando la prevalencia de resistencia a la insulina, diabetes mellitus tipo 2, dislipidemia e hipertensión 13. Una alimentación adecuada en energía y, especialmente, en proteína ayuda a tratar la disminución de la masa muscular, fuerza y habilidades funcionales relacionadas con la edad 9. En ancianos, la malnutrición conduce a un balance negativo de nitrógeno y, finalmente, a fragilidad y sarcopenia, condiciones que resultan en discapacidad, y eventualmente en pérdida de independencia, caídas, fracturas y muerte 9) (14.
Los ancianos, en general, necesitan más proteína en la dieta que los adultos jóvenes; sin embargo, los ancianos usualmente comen menos alimento, incluida menos proteína 14. Esto es relevante, ya que en mexicanos hospitalizados se ha identificado que un nivel de albúmina de 3,1 g/dl o mayor se asocia con una evolución satisfactoria intrahospitalaria 15. Aunque la cantidad diaria recomendada de proteína es de 0,8 g/kg/d para adultos de todas las edades 16, varios estudios (Protein Summit 2.0, PROT-AGE, New Nordic Nutrition Recommendations) argumentan que la ingesta de proteína de 1,0-1,5 g/kg/día podría beneficiar la salud de los ancianos 8) (9) (14) (16. En general, la recomendación de proteína dietética sería del 15-20% de las calorías totales de la dieta para ancianos sanos. Se sabe que incrementar la proteína en la dieta mantiene músculos saludables en los ancianos, y por ello las recomendaciones para el consumo de proteína deberían estar bien dirigidas. Por ejemplo, se recomienda lograr un umbral de proteína de 25-30 g en cada una de las tres principales comidas (desayuno, comida, cena) 14. Por otro lado, muchos ancianos desayunan alimentos ricos en hidratos de carbono y bajos en proteína, lo que favorece aún más la dislipidemia en este grupo de edad 14. Otra recomendación está basada en el consumo de carne, y se sugiere consumir 113 g de carne (220 kcal; 30 g de proteínas) cinco veces a la semana 17. En este estudio evaluamos la ingesta de proteína y los niveles de lípidos séricos en ancianos con fractura de cadera y determinamos su correlación con la fuerza de prensión en ambas manos.
MATERIALES Y MÉTODOS
El estudio incluyó 47 pacientes adultos de 65-85 años hospitalizados en la Unidad Médica de Alta Especialidad No. 1 (UMAE1) por reciente fractura de cadera (menos de una semana y aún sin intervención quirúrgica), los cuales firmaron el consentimiento informado. Se determinó peso y talla de los pacientes, se midió la fuerza muscular de ambas manos, se aplicó el MNA 18 para evaluar el estado de nutrición y se recabó información del consumo de alimentos ricos en proteína. Además, se tomaron muestras sanguíneas por venopunción previo ayuno de ocho horas para determinar perfil de lípidos (colesterol total, triglicéridos, colesterol LDL, HDL y VLDL), biometría hemática y pruebas de función hepática.
Para la inferencia del peso corporal se utilizó la fórmula de Jung 19) (20: peso en hombres (kg) = altura talón-rodilla x 1,10 + circunferencia de brazo (cm) x 3,07 - 75,81, y peso en mujeres (kg) = altura talón-rodilla x 1,09 + circunferencia de brazo (cm) x 2,68 - 65,51; predicción de la talla (cm) = 2 x media brazada (cm). La media brazada se determinó con el paciente con el brazo extendido y con cinta métrica se midió la distancia desde la punta del dedo medio hasta la parte central de la escotadura del esternón a la altura de la tráquea. Para la circunferencia de brazo se identificó el punto medio existente entre la saliente ósea del acromion y el olecranon, a lo largo de la lateral del brazo no dominante, con el codo flexionado a 90°. Una vez identificado el punto medio, se dejó caer el brazo de manera natural y se colocó la cinta horizontalmente alrededor del punto indicado. Después, para la obtención de la altura talón-rodilla, se midió la distancia entre el talón y la parte más alta de la articulación de la rodilla, por la parte lateral externa, con la pierna flexionada en el individuo acostado y formando un ángulo de 90° entre el muslo y la pantorrilla.
La fuerza muscular de prensión de ambas manos se evaluó con un dinamómetro marca TAKEI modelo SMEDLEY III T-18A. La prueba se efectuó manteniendo al paciente sentado y confortable con los hombros aducidos y sin rotaciones, el brazo y codo pegados al tronco, este último en flexión de 90° con antebrazo y muñeca en posición neutra, con la manilla del dinamómetro tomada con garra cilíndrica por parte del paciente y la pantalla del indicador digital mirando hacia el evaluador. Se le indicó a cada paciente que debía realizar una empuñadura con la máxima fuerza posible mediante un impulso rápido pero continuado hasta alcanzar la máxima potencia. De esta manera se realizaron dos medidas sucesivas para cada mano, esperando al menos 60 segundos entre dos mediciones sucesivas para la misma mano a fin de evitar la fatiga muscular, y se promediaron ambas lecturas para el valor de una mano. Posteriormente, también se promediaron los valores de ambas manos. La masa muscular fue estimada por la circunferencia de la pantorrilla (punto de corte 31 cm para ambos géneros).
RESULTADOS
Los ancianos estudiados son pacientes de un hospital público que habían ingresado por fractura de cadera, predominantemente mujeres y con una edad homogénea de 80 años en promedio. Los hombres consumían mayor cantidad de proteínas que las mujeres, sin que se identificara diferencia en la fuerza muscular entre ellos (Tabla I y Tabla II). De acuerdo al MNA, el 93% de los participantes estaban malnutridos o en riesgo de malnutrición.
Tabla I Estadísticas descriptivasde la muestra
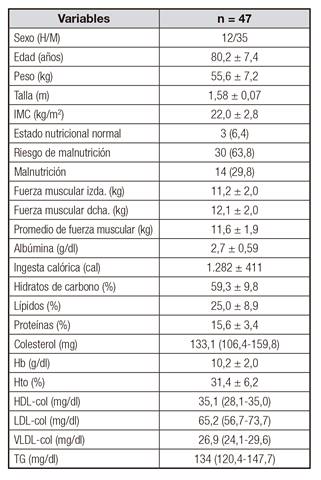
Los valores se muestran como medias ± SD o como medianas (rangos) de acuerdo a su distribución normal o sesgada.
Tabla II Comparación entre hombres y mujeres con respecto a edad, consumo de proteína y fuerza muscular

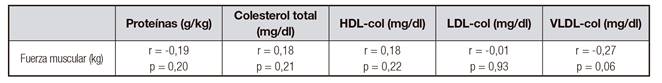
Los hombres consumieron significativamente más proteína que las mujeres (t45 = 2,021, p-valor = 0,049 para los gramos proteína por kg de peso; t45 = 3,41, p-valor = 0,001 para gramos de proteína totales) (Tabla II). Luego, buscamos asociación del consumo de proteína (gramos de proteína totales y gramos de proteína por kg de peso) y del perfil de lípidos con fuerza muscular, sin observar valores de correlación significativos, solo un valor limítrofe para VLDL colesterol y fuerza muscular (Tabla III). Sin embargo, la fuerza muscular asoció negativamente con los niveles de triglicéridos (r = -0,29, p-valor = 0,04) (Fig. 1). Diecisiete ancianos (36,1%) mostraron niveles de triglicéridos superiores a 150 mg/dl.
Tabla III Correlación de la ingesta de proteínas y los niveles de lípidos séricos con la fuerza muscular
Considerando que en pacientes mexicanos hospitalizados se ha identificado que un nivel de albúmina de 3,1 g/dl o mayor se asocia con una evolución satisfactoria intrahospitalaria, se realizó comparación de la fuerza muscular entre estos grupos y se observó que 34 pacientes presentaron niveles de albúmina menor de 3,5 y 13 ≥ 3,1 g/dl, pero la fuerza muscular promedio no fue diferente entre los grupos (11,2 vs. 10,8 kg; p = 0,55).
De acuerdo a los grupos de MNA (estado nutricional), se efectuó ANOVA y no se identificó diferencia de la fuerza muscular entre los grupos (F = 0,28; p = 0,75) (Tabla IV).
DISCUSIÓN
La fuerza muscular se asoció negativamente a los niveles de triglicéridos en los ancianos hospitalizados con fractura de cadera. Aunque no evaluamos actividad física, esta podría estar representada en la fuerza muscular y, por tanto, podría explicar por qué quienes tienen menor fuerza muscular tienen mayores niveles de triglicéridos, ya que el ejercicio genera la depuración del colesterol muscular a través del mismo músculo esquelético que en el estado posprandial está repleto de VLDL del plasma 21. Por otra parte, los TG plasmáticos son hidrolizados en ácidos grasos vía lipoproteína lipasa (LPL). La disminución en los niveles de VLDL circulantes permite entonces menor competencia por la actividad de LPL, favoreciendo así el incremento en la hidrólisis de TG 21) (22. La actividad de la LPL disminuye con la edad, pero el ejercicio puede incrementar esta actividad en el músculo esquelético y disminuir las concentraciones de TG 22.
Por otro lado, el contenido intrahepático de TG puede afectar adversamente la sensibilidad a la insulina aun en personas no diabéticas 23. Un estudio en ancianas japonesas, que implicó un programa de 12 semanas de caminata (120 min/semana), mostró que los cambios en los TG, ácido úrico y glutamiltransferasa (GGT) se asociaron significativamente con cambios en el HOMA-IR, e incluso se observó una asociación sinérgica entre la disminución de TG y ácido úrico y la disminución del HOMA-IR 24. Otro estudio en pacientes con enfermedad obstructiva crónica (EPOC) asoció fuerza muscular con resistencia a la insulina, y se observó que el HOMA2 IR fue mayor en personas con debilidad de cuádriceps que en aquellas sin debilidad. El análisis multivariado evidenció que una unidad de incremento de resistencia a la insulina se asoció con una disminución en la fuerza del cuádriceps y un incremento del riesgo en la debilidad del mismo de 4,2 veces 25.
Para los ancianos, el entrenamiento de fuerza y el consejo nutricional a largo plazo han mostrado efectos favorables en los lípidos séricos y lipoproteínas con disminución en los niveles de colesterol total, LDL-colesterol y triacilgliceroles, así como incremento en los niveles de HDL-colesterol. Asimismo, disminuyen las concentraciones de insulina y las cifras de presión arterial 26.
La Encuesta Nacional de Examen de Salud y Nutrición (NHANES) evaluó a más de 3.000 ancianos y los categorizó de acuerdo a los tertiles de la circunferencia de cintura y fuerza muscular en las piernas como sigue: a) sin dinapenia/sin obesidad abdominal (S-DIN/S-OA); b) con dinapenia/sin obesidad abdominal (C-DIN/ S-OA); c) sin dinapenia/con obesidad abdominal (S-DIN/C-OA); y d) con dinapenia/con obesidad abdominal (C-DIN/C-OA). Se observó que el último grupo mostró niveles más bajos de HDL colesterol y más elevados de triglicéridos y glucosa que los grupos S-DIN/S-OA y C-DIN/S-OA. Mayores niveles de TG se observaron en el grupo C-DIN/C-OA comparado con el grupo S-DIN/C-OA. Las probabilidades de tener síndrome metabólico, enfermedades cardiovasculares y diabetes tipo 2 fueron mayores en el grupo C-DIN/C-OA comparado con C-DIN/S-OA y S-DIN/S-OA. Por lo tanto, los ancianos con dinapenia y obesidad abdominal parecen tener mayor riesgo de alteraciones metabólicas que los que muestran dinapenia exclusiva o que aquellos que no muestran ni obesidad abdominal ni dinapenia 27. También se ha demostrado que los ancianos con obesidad y dinapenia muestran menor función física objetiva y subjetiva que los que solo presentan dinapenia u obesidad por separado 28.
Otros marcadores se han asociado con la fuerza muscular y la resistencia a la insulina. En un estudio transversal en adolescentes, se encontró una asociación inversa entre el grado de fuerza muscular y los biomarcadores inflamatorios ajustados para edad, sexo, estado puberal, nivel socioeconómico, adherencia a la dieta mediterránea, función cardiorrespiratoria, grado de riesgo metabólico y grasa corporal. El análisis de covarianza mostró que los adolescentes con un perfil inflamatorio adverso y bajos niveles de fuerza muscular mostraron el más severo grado de factores de riesgo metabólicos (suma de Z-scores de presión arterial sistólica, TG, radio de colesterol total/HDL colesterol, HOMA-IR y circunferencia de cintura). Se considera pues que el estado inflamatorio explica una parte significativa del elevado grado de riesgo metabólico en adolescentes con baja fuerza muscular 29. También, un estudio efectuado en niños hispanos de escuelas de bajos ingresos demostró que niveles elevados de fuerza muscular y resistencia se relacionaron con bajos niveles de riesgo cardiometabólico (consistente de HDL colesterol, TG, circunferencia de cintura, glucosa sanguínea y presión arterial media) al comparar por tertiles de fuerza muscular; por ejemplo, para los tertiles medio y superior la fuerza muscular y la resistencia se asoció con menor score (más favorable) de riesgo metabólico, independientemente de la capacidad aeróbica 30.
Los mediadores biológicos relevantes del síndrome metabólico y el envejecimiento no saludable incluyen obesidad sarcopénica, resistencia a la insulina con acumulación de grasa ectópica, alteraciones del metabolismo del magnesio, inflamación sistémica e hipotalámica, acortamiento de la longitud de los telómeros, epigenética y alteraciones del ritmo circadiano. El síndrome metabólico se relaciona con una mayor acumulación de adiposidad central e infiltración de grasa ectópica en el músculo esquelético y el hígado, relacionada con la sobrealimentación y el sedentarismo, con consecuencias perjudiciales en la vida tardía. La obesidad puede complicarse con la sarcopenia, que se refiere a la pérdida de masa muscular, fuerza y calidad en las poblaciones mayores 31.
La dieta de los ancianos debe proporcionar al menos 1,0-1,2 g de proteína/kg de peso corporal/día y 1,2-1,5 g para ancianos con enfermedad. En nuestro estudio, nosotros hipotetizamos que los ancianos consumían menos de 1,0 g de proteína/kg de peso corporal/día y que la ingesta de proteínas se asociaba con la fuerza muscular. El consumo promedio de proteína fue de 0,9 g de proteína/kg de peso corporal/día y las mujeres consumieron significativamente menos proteína (0,8 g) que los hombres (1,1 g). Sin embargo, no encontramos asociación entre ingesta de proteína y la fuerza de presión de las manos. En este estudio no incluimos un grupo control sin fractura de cadera, pero de acuerdo a la literatura en adultos mayores tanto del área rural como del área urbana de bajos recursos en México, a las que pertenecían nuestros pacientes, tienen un consumo semejante del 15% de proteínas 32. Con respecto a parámetros comparativos de la fuerza muscular, no existen tablas de valores para nuestra población. Un estudio con escaso número de adultos mayores mexicanos reportó fuerza muscular de prensión de 24,3 kg, pero no se describe la metodología 33. Con respecto a tablas de población española 34 en población ≥ 80 años, el promedio de fuerza muscular es de 17,8 kg para los hombres y de 9,7 kg para las mujeres, lo que parece muy diferente para hombres pero no para mujeres en nuestro estudio.
Un objetivo de futuros estudios podría ser identificar el tipo y la cantidad óptima de proteína y/o aminoácidos específicos para ancianos ya que una amplia gama de factores pueden afectar la cantidad de proteína dietética necesaria. Existen varias razones por las cuales los ancianos no consumen suficiente proteína para satisfacer necesidades como la predisposición genética al bajo apetito, los cambios fisiológicos y las condiciones médicas que llevan a la anorexia asociada con la enfermedad, las discapacidades físicas y mentales que limitan la preparación de alimentos y la inseguridad alimentaria debido a limitaciones financieras y sociales.
Nosotros concluimos que los niveles de TG se asociaron de forma inversa con la fuerza muscular en ancianos con fractura de cadera y esto tiene relevancia debido a que los niveles de TG mayores de 150 mg son un factor del síndrome metabólico. Estos resultados, que deberán validarse en otras poblaciones, muestran que los niveles elevados de TG se asocian a baja fuerza muscular en ancianos, lo cual es relevante debido a que la prevención de la obesidad y el síndrome metabólico es una prioridad a través de la promoción de estilos de vida más saludables y políticas de alimentación que podrían implementarse ampliamente.
















