INTRODUCCIÓN
En 1873, Sir William Gull en Inglaterra y Charles Lasegue en Francia describieron, por primera vez, la anorexia nerviosa (AN) como "un estado mental mórbido", basándose en su experiencia clínica de finales del siglo xix. De este modo, los trastornos de la conducta alimentaria (TCA) quedaron anclados en un contexto histórico y cultural, hecho que, aunque revelador, puede haber supuesto ciertas limitaciones para la comprensión de los TCA tal y como los concebimos hoy día 1,2). No obstante, los intentos de modificar de forma voluntaria la ingesta alimentaria datan de mucho antes. Existen referencias ya en la Biblia en este sentido ligadas a aspectos religiosos. Atrofia nerviosa fue el término empleado por Whytt, un teórico de la medicina, para describir este estado de baja energía, estilo taciturno, pérdida de apetito y malas digestiones 3.
Los factores culturales adquieren especial relevancia cuando se trata de entender cómo describe, diagnostica y trata una sociedad una determinada condición de salud. En el caso de los TCA, este es un aspecto fundamental a tener en cuenta, pues las primeras descripciones de la enfermedad caracterizaban a los pacientes como mujeres jóvenes, saludables, bien educadas, occidentales y provenientes de familias con buena posición socioeconómica. Actualmente, podemos afirmar que, aunque este fenotipo sigue estando vigente, no es ni mucho menos exclusivo.
Los TCA se caracterizan por la presencia persistente de una alteración del comportamiento alimentario que compromete el estado de salud y el funcionamiento psicosocial. Bajo el término trastorno de la conducta alimentaria quedan englobados la AN, la bulimia nerviosa (BN) y, más recientemente, con la publicación de la quinta edición del Manual de Enfermedades Mentales (DSM-5) 4, se ha incluido el trastorno por atracón (TA).
La idea, en cierto modo culturalmente impuesta, de que existe un ideal de belleza femenina y éxito social vinculado a la delgadez, ha contribuido a la definición de aspiraciones y motivación para conseguir dicha delgadez 5. Son muchos los aspectos que alimentan esta obsesión por la pérdida de peso: las revistas dirigidas a las mujeres, por ejemplo, están cargadas de mensajes para el control del peso, dietas, ejercicios y hábitos destinados para conseguir una silueta esbelta. El mundo de la moda o el cine es otro claro ejemplo de este bombardeo continuo en promoción de la delgadez. En este sentido, la AN podría considerarse la enfermedad resultante del triunfo de este deseo/obsesión por la delgadez frente a la propia salud.
La AN es, por tanto, un TCA determinado por una alteración del comportamiento alimentario caracterizado por un miedo extremo a la ganancia ponderal y por la realización de dietas restrictivas e hipocalóricas, a pesar de cursar con un peso muy inferior al límite de la normalidad 6.
CRITERIOS DIAGNÓSTICOS
Para el diagnóstico de la enfermedad, la Asociación Americana de Psiquiatría (APA) propone en su última edición del Manual de enfermedades mentales (DSM-5) tres criterios diagnósticos frente a los 4 que se recogían en la edición anterior de dicho manual 7.
Los criterios diagnósticos vigentes hoy día son:
existencia de una ingesta oral reducida e inferior a los requerimientos a pesar de un bajo peso.
miedo intenso a ganar peso.
alteración en la percepción del peso corporal y del propio cuerpo.
Los criterios diagnósticos DSM-5 completamente desarrollados y comparados con los criterios DSM-IV previos se recogen en la Tabla I. Los criterios diagnósticos según CIE-10 (Clasificación Internacional de Enfermedades) se recogen en la Tabla II.
Cabe destacar que en la última edición del DSM, se debe especificar el tipo de trastorno y su severidad, así como si la enfermedad se encuentra en situación de remisión total o parcial. Para ello, el propio manual explica qué criterios han de reunir uno y otro estado. Sin embargo, no contempla ninguna indicación con respecto a lo que ha de ser considerado un periodo de tiempo relevante. En la experiencia de los miembros de este grupo de trabajo, sería necesario que los criterios de remisión parcial se mantuvieran al menos durante dos años para plantear la remisión total de la enfermedad.
La sospecha clínica es muy importante en este tipo de trastornos. De hecho, debemos pensar en un trastorno de la conducta alimentaria en mujeres con índice de masa corporal (IMC) bajo para los estándares según edad y sexo, en mujeres que consultan para perder peso, aun no teniendo exceso ponderal, con alteraciones menstruales o amenorrea, con síntomas digestivos y/o vómitos de repetición, y, en general, en enfermos con signos físicos de desnutrición y niños con retraso del crecimiento 8.
Aunque no se diseñó de forma específica para la AN, destacamos el método de screening SCOFF 9 para los TCA, una herramienta destinada a identificar aquellos casos que precisarían de una evaluación posterior exhaustiva.
El método de screening SCOFF consiste en 5 sencillas preguntas clínicas (las siglas provienen de los términos en inglés incluidos en cada una de las preguntas):
¿Se siente mal consigo mismo/a cuando percibe sensación de plenitud?
¿Le preocupa haber perdido el control acerca de lo que ha comido?
¿Ha perdido o ganado más de 6,35 kg en los últimos 3 meses?
¿Cree que está por encima de su peso a pesar de que los que le rodean indiquen lo contrario?
¿Diría que la comida domina en cierto sentido su vida?
Según los datos del estudio original que describía esta herramienta de screening, la respuesta positiva a dos o más de las 5 preguntas se asociaba a una sensibilidad del 100% y a una especificidad del 87,5% para el diagnóstico de TCA 9. No obstante, esta herramienta ha de ser validada a nivel poblacional.
Uno de los cuestionarios más utilizados es el EAT 26 (Eating Attitudes Test). Este cuestionario consta de veintiséis ítems que el paciente cumplimenta dotándolo de una puntuación (tres puntos si siempre está presente y cero puntos si nunca lo está), y tiene una tasa de aciertos de aproximadamente el 90% en pacientes con TCA cuando se alcanzan veinte puntos 10. Otros test de cribado validados en español son el EAT-40 y el ChEAT, este último para niños de entre 8 y 12 años.
La entrevista familiar puede aportar información sobre otros síntomas frecuentes en estos pacientes, como una pérdida de peso excesiva, preocupación por la imagen corporal, la realización de dieta, la inquietud por las calorías y los nutrientes, el rechazo a comer ciertos alimentos, que luego se extiende hacia todos los demás grupos, comentarios frecuentes sobre "sentirse gordo", negación del sentimiento de hambre, desarrollo de rituales respecto a la comida, excusas repetidas para evitar el momento de comer, regímenes de ejercicio severos, y abandono de los amigos habituales y de las actividades cotidianas.
El diagnóstico de la AN suele ser sencillo dada la delgadez excesiva que los pacientes suelen presentar, el miedo manifiesto a engordar y las restricciones dietéticas autoimpuestas. A pesar de ello, algunas de estas manifestaciones clínicas pueden solaparse con otros cuadros con los que tendremos que hacer el diagnóstico diferencial. De forma amplia, han de contemplarse 3 grandes grupos de enfermedades en el diagnóstico diferencial 11, a saber:
Otros TCA como la BN.
Otras enfermedades psiquiátricas como la depresión mayor, la fobia social, trastorno obsesivo compulsivo, desorden dismorfofóbico corporal, trastornos psicóticos, trastornos de hiperactividad/ déficit de atención.
Procesos patológicos que puedan cursar con pérdida de peso, anorexia y amenorrea como las neoplasias, infecciones crónicas o síndromes de malabsorción.
ETIOPATOGENIA
La patogenia de la AN no se conoce bien a día de hoy, aunque se asume multifactorial, con participación de factores genéticos, psicológicos, biológicos, sociofamiliares y culturales, entre los más importantes 1.
Se establecen una serie de factores de riesgo para desarrollarla y entre ellos cabe destacar: género femenino, adolescencia, carácter depresivo, un nivel socioeconómico medio-alto y determinados aspectos culturales relacionados con la búsqueda de la perfección y de un ideal de belleza centrado en la delgadez.
Se han señalado aspectos de la personalidad, inespecíficos, que pudieran adquirir relevancia en la etiopatogenia de los TCA 1,3. Entre ellos, inmadurez, hipersensibilidad, impulsividad, baja tolerancia a la frustración, inseguridad, baja autoestima, dependencia, temor a la pérdida de control, temor a la soledad y al abandono, tendencias obsesivo-compulsivas, vivencias de control externo y problemas de identidad.
En las familias de los sujetos con TCA se observan con frecuencia antecedentes de depresión, de abuso de sustancias, generalmente alcohol, obesidad y/o insatisfacción con la imagen corporal en las madres, e incluso alteraciones en la conducta alimentaria.
Un dato muy relevante a este respecto es el antecedente de realización de una dieta hipocalórica, que se describe hasta en un 90% de los casos, y actúa como un factor desencadenante.
Determinados grupos poblacionales podrían estar más expuestos a este tipo de trastorno por representar el control del peso una clave de su éxito; ejemplos de estos colectivos podrían ser modelos, actores y actrices de cine, y determinadas disciplinas deportivas o artísticas (gimnasia rítmica, ballet, etc.).
Se cree que en el desarrollo de la AN también pudieran intervenir factores genéticos, además de los ambientales, habida cuenta de la frecuencia con la que se observan varios casos en el seno de una misma familia. Si bien, los estudios genómicos realizados hasta la fecha no han identificado polimorfismos que se asocien de forma consistente a la enfermedad 5.
A nivel de neurobiología, en estudios de imagen y de función cerebral se han observado cambios o alteraciones que se repiten en estos pacientes, si bien, desde la evidencia, no resulta fácil establecer si los cambios son el origen o la consecuencia de la enfermedad. De hecho, algunos de estos cambios revierten con la remisión de la enfermedad, aunque otros permanecen.
EPIDEMIOLOGÍA
La AN es la enfermedad psiquiátrica más frecuente en las mujeres jóvenes y la tercera enfermedad crónica tras la obesidad y el asma en las adolescentes 6). Es la causa más frecuente de pérdida de peso sustancial en mujeres jóvenes en los países occidentales 11. Afecta preferentemente a mujeres, alcanzando una ratio de 10:1 según los estudios 5. La prevalencia estimada a lo largo de la vida es tres veces mayor en las mujeres.
Suele afectar a sujetos jóvenes, situándose la media de edad al diagnóstico alrededor de los 18 años.
Estimar la prevalencia e incidencia de la AN no resulta sencillo, entre otras cuestiones porque no es habitual que los pacientes afectos de TCA hablen abiertamente de ello y los datos de que disponemos corresponden a aquellos que contactan con los servicios sanitarios, los cuales a su vez dependen y varían en función de los criterios diagnósticos empleados 3.
La prevalencia estimada de la AN se sitúa alrededor del 0,6% en Estados Unidos y del 4% en Finlandia. Estas diferencias podrían deberse a la mayor conciencia de enfermedad de estos últimos y de los criterios diagnósticos empleados. Estudios llevados a cabo en España revelan cifras de prevalencia del 0,3% en adolescentes de Navarra, del 0,9% en Reus y del 0,4% en Málaga. En una revisión de los estudios epidemiológicos sobre TCA llevados a cabo en España 12, se observa la escasez existente de datos nacionales, pues la mayoría han sido llevados a cabo, por separado, en comunidades autónomas.
EL EQUIPO DE SOPORTE NUTRICIONAL
Los TCA muestran una gran variabilidad en su presentación y en su gravedad, lo que va a condicionar diferentes abordajes terapéuticos. Esto implica, además, la individualización del tratamiento y la necesidad de un alto nivel de control de cada paciente por parte del equipo terapéutico. Por ello, se hace indispensable un enfoque multidisciplinar y altamente especializado de su tratamiento. Por otro lado, los resultados obtenidos por estas unidades terapéuticas en todo el mundo hacen indiscutible su utilidad y su necesidad, aunque se requiere más investigación en este sentido 13.
En nuestro país hace años se vienen implantado estas unidades en respuesta a la creciente demanda y al requerimiento de adecuar el tratamiento a las necesidades de estos pacientes. La estructura de las distintas unidades varía en función de diversos factores (factores profesionales, factores económicos, necesidades de espacio, etc.), pero en un gran número de ellas trabajan de forma conjunta, y al menos participan el equipo de salud mental y de nutrición clínica y dietética 14,15. Sin embargo, tanto en Europa como en Estados Unidos, solo un pequeño porcentaje de los pacientes con AN acceden a un tratamiento especializado 16).
La correcta atención de los TCA requiere de la intervención de especialistas de varias disciplinas trabajando de forma coordinada. Pueden participar en el tratamiento: psiquiatras, psicólogos, médicos de familia, médicos nutriólogos (en nuestro país la mayoría son endocrinólogos), dietistas, enfermeros, terapeutas ocupacionales y de imagen, y cada uno aporta una parte importante desde su especialidad. La interdisciplinariedad permite la transferencia de conocimientos, habilidades, propósitos, instrumentos y tareas, estableciéndose vínculos en el marco de la preservación de las particularidades de cada especialidad, permitiendo abarcar tanto los aspectos fisiológicos como psicológicos de la enfermedad. Todos los miembros del equipo deben tener experiencia en el tratamiento de los TCA y trabajar de forma conjunta, y sus funciones deben estar claramente delimitadas para evitar interferencias que solo pueden repercutir negativamente en el tratamiento de los pacientes. Esto requiere de encuentros de equipo y de un intercambio permanente, de forma tal que todos sus integrantes se conozcan, acuerden el abordaje y respeten el trabajo individual del resto 17.
Generalmente la coordinación de las unidades de TCA corre a cargo del psiquiatra, que suele ser el responsable de establecer las líneas generales del tratamiento y coordina al resto del equipo.
Además, la unidad de TCA, y por ende el médico nutriólogo, debe estar en constante comunicación con los equipos de atención primaria y con el resto de especialistas implicados en el tratamiento del paciente 18.
En este sentido el médico de familia, además de intervenir en los programas de prevención primaria y de intentar realizar un diagnóstico lo más precoz posible, participará, siempre que sea posible y haya sido entrenado, en el programa de prevención de recaídas, una vez que el paciente haya sido dado de alta por los médicos especialistas. De esta forma, será posible detectar precozmente la existencia, nada infrecuente, de recaídas e iniciar tratamiento lo antes posible 19.
En los equipos de nutrición participan diferentes profesionales, con diversas formaciones, responsabilidades y tareas asignadas. Participan el médico especialista y experto en nutrición clínica (nutriólogo para que nos entendamos), el personal de enfermería, al que, aunque no se le reconozca en la actualidad su especialización, tiene en general una extensa experiencia adquirida a lo largo de muchos años de vida profesional, y los dietistas-nutricionistas, que se han incorporado recientemente en nuestro país, pero que desarrollan las actividades educativas con suma pericia 20.
El paciente ha de estar bajo la supervisión y tratamiento del médico nutriólogo, encargado de valorar su estado nutricional y las posibles complicaciones somáticas asociadas. En aquellas situaciones en la que hay una grave afectación orgánica, cobra especial importancia su papel, ya que la malnutrición dificulta e incluso imposibilita el tratamiento psicológico. En estos casos, de hecho, será el principal responsable de restablecer el estado de salud mínimo para que el tratamiento psiquiátrico sea viable. También establecerá un correcto diagnóstico diferencial para descartar enfermedades que pueden cursar con adelgazamiento, como enfermedad celiaca, malabsorción, parasitosis intestinales o enfermedad inflamatoria intestinal, entre otras. También instaurará el tratamiento nutricional y farmacológico más adecuado, así como la necesidad o no de consultar con otros especialistas. Es el encargado de realizar la indicación de ingreso hospitalario en caso de que el estado nutricional y/o la situación orgánica sean de suficiente gravedad o, en caso de ser necesario, redirigirá al paciente a un hospital de día. Realizará la indicación de suplementos calórico-proteicos por vía oral, si la malnutrición persiste y no se consigue una recuperación razonable, siempre de forma temporal, de acuerdo con el paciente y con un objetivo bien definido de recuperación ponderal. Incluso a veces, será necesaria la indicación de nutrición enteral por sonda nasogástrica o nutrición parenteral en situaciones extremas en pacientes gravemente desnutridos en los que no podamos utilizar la vía oral/enteral, bien por razones médicas o psicológicas. Controlará que en todos los casos la renutrición se realice de forma gradual y cuidadosa, monitorizando estrechamente al paciente durante todo el proceso con objeto de prevenir posibles complicaciones y prestando especial atención a prevenir el síndrome de realimentación. También participará en el entrenamiento de la familia en pautas nutricionales y en los comportamientos alimentarios, así como en el soporte y consejo de las actitudes, y en medidas a tomar ante la dieta de los pacientes. Estará atento al estado mental del paciente y se asegurará de que se haya iniciado actividad terapéutica en este sentido. Además, será el encargado de indicar la incorporación del paciente al Programa de Educación Nutricional (EN), escogiendo el momento oportuno para que esta intervención pueda ser efectiva.
El dietista es la persona más indicada para llevar a cabo la tarea de EN, siempre en comunicación con el resto del equipo, aunque personal de enfermería con un alto nivel de entrenamiento y experiencia en esta materia también podría ser capaz de realizar esta función, junto con otras relacionadas con la valoración nutricional 21.
VALORACIÓN CLÍNICA Y NUTRICIONAL
Como en el resto de patologías, la valoración ha de ir precedida de una historia clínica y anamnesis dirigida, seguida de una exploración física y pruebas complementarias de laboratorio, imagen y otras, según proceda. Obviamente el proceso será diferente si se trata de una primera visita o una sucesiva, o de un paciente hospitalizado respecto de uno en hospital de día o que acude a consulta. Así mismo, la valoración clínica y la nutricional del paciente deben formar un proceso continuo en el contexto de la valoración global que realicemos.
HISTORIA CLÍNICA
Lo primero que puede llamar nuestra atención es que, pese al frecuente estado de desnutrición del sujeto y la impresión de gravedad que transmite, el paciente no suele tener conciencia de enfermedad y acude a la consulta con escasa voluntad de cooperación, por lo que deberemos granjearnos su empatía y colaboración. Tras conocer si presenta algún antecedente familiar o personal de interés, en especial de TCA, preguntaremos por el inicio y evolución en el tiempo de la enfermedad junto a la sintomatología exhibida, en especial en los últimos meses. Usualmente el paciente con AN es una mujer joven, por lo que deberemos conocer si mantiene menstruación y sus características, y en caso de amenorrea, el tiempo de duración y si se ha prescrito tratamiento hormonal para la misma.
Indagar en la presencia de vómitos, su frecuencia y si se han acompañado de sangre o no. Asimismo, preguntar por una posible ingesta excesiva de líquidos, toma y tipo de laxantes, diuréticos, productos de herboristería, enemas e incluso ocasionalmente hormonas tiroideas. Si el paciente es diabético, descartar una posible manipulación de las dosis de insulina. Junto a lo anterior y en busca de comorbilidades, preguntar por consumo de alcohol, otras drogas y su dosis. Pese a la presencia de desnutrición, como mecanismo compensatorio para perder peso o simplemente como acción gratificante, suelen realizar una excesiva actividad física. Suele ser de todo tipo, predominando ejercicios que realizan en solitario, en gimnasio o mediante marcha.
Respecto de su alimentación deberemos conocer la cantidad y calidad de alimentos ingeridos, restringidos y evitados. Suelen prescindir de aquellos de alta densidad energética, grasa visible o de cuchara. La confección culinaria suele ser sencilla sin fritos ni guisos, asociada a veces a toma de alimentos poco frecuentes en nuestra alimentación tradicional, incluso de herboristería. Es común, en los casos restrictivos, la detección de dietas con menos de 1.000 kcal/día de meses de duración, estando en general conservada la ingesta de una cantidad mínima de proteínas. Es muy práctico contar con un registro previo de siete días para poder cuantificar las kcal, porcentaje de macronutrientes y detección de posibles déficits de micronutrientes. Si el resultado de la encuesta, la entrevista o la exploración del sujeto aventura una desnutrición grave o estado carencial, deberemos realizar un interrogatorio dirigido en busca de signos de déficits de micronutrientes (cuadro neurológico, sangrado fácil, lesiones cutáneas, ceguera nocturna...).
También es necesario conocer el comportamiento ante la comida (desmenuzan y trocean las raciones, separan lo que les parece grasa visible, retiran restos de aceite del plato...), si comen sentados, en compañía o solos, si cocina el paciente u otro miembro de la familia, tiempo de duración del acto de comer, cantidad de comidas al día, incluso si piensan que el tamaño de su ración es superior al del resto.
EXPLORACIÓN FÍSICA
Los signos exploratorios dependerán del grado de desnutrición y tipo de AN que presente el paciente. Con mucho, el dato más llamativo suele ser la pérdida de grasa subcutánea y de masa muscular proximal o global. Como fenómeno adaptativo podemos encontrar reducción en la temperatura corporal, bradicardia e hipotensión arterial. La piel suele estar seca, pálida y con queratosis folicular y acrocianosis periférica, ocasionalmente carotinémica en manos y pies. Puede presentar caída de cabello junto a la aparición de un vello fino y lacio (lanugo) en extremidades y dorso. Con frecuencia no encontraremos más datos significativos, salvo en los cuadros de AN purgativos por vómitos donde pueden presentar además hipertrofia parotídea, erosión de esmalte dental en cara lingual de incisivos y caninos superiores y, excepcionalmente el signo de Rusell (ulceraciones o erosiones en los nudillos del dorso de la mano por efecto de la provocación del vómito). Con todo, lo más relevante en la exploración es evaluar el estado nutricional y realizar comparaciones futuras según la evolución. Se debe comprobar que el peso es válido, libre de manipulaciones por ingesta previa abusiva de agua o de materiales pesados escondidos entre la ropa del paciente. Calcularemos el IMC (kg/m2) que, con sus limitaciones, nos informará del estado nutricional del individuo según los puntos de corte definidos por consensos. Asimismo calcularemos el índice entre el peso real del paciente y su peso ideal o respecto un IMC de 22 kg/m2; porcentajes inferiores al 80% o 70% reflejan desnutrición moderada o grave, respectivamente. Tan esencial como conocer la pérdida ponderal es el tiempo en que ha ocurrido la misma. Pérdidas voluntarias de peso rápidas (del 5% en 1 mes, o del 10-20% en 3 meses) generan un riesgo nutricional elevado. En los pacientes AN en periodos de crecimiento y desarrollo es importante evaluar por curvas de crecimiento percentiladas si existe un retraso de la talla para su edad o un bajo peso para la estatura, así como registrar el percentil del IMC según sexo y edad 22.
PARÁMETROS DE LABORATORIO
Los datos biológicos estarán, salvo complicaciones, casi siempre en límites de la normalidad, y muchos pacientes con AN invocan lo anterior para justificar que en realidad "no se encuentran enfermos". En la primera visita se solicitará una analítica completa. En el hemograma puede observarse la presencia de anemia leve normocítica en general, salvo en situaciones de carencias de vitamina B12, fólico y hierro. Puede detectarse linfopenia y ocasionalmente neutropenia. La bioquímica puede mostrar niveles bajos de creatinina (relacionados con una baja masa muscular), glucemia en rangos bajos, e hipercolesterolemia e hipotrigliceridemia. Los niveles séricos de calcio, fósforo y magnesio suelen estar en rango de normalidad, pudiendo existir sin embargo un status reducido del mineral en el organismo. En el caso de abuso de líquidos o intoxicación hídrica se puede detectar hiponatremia grave. En cuadros purgativos, en relación a la presencia de vómitos, consumo abusivo de laxantes o diuréticos, puede detectarse una hipokaliemia grave con alcalosis metabólica hipoclorémica y niveles elevados de amilasa con lipasa normal. La concentración plasmática de albúmina, transferrina, prealbúmina o proteína unida a retinol generalmente estará en rango de normalidad. El estudio hormonal inicial puede reflejar niveles de TSH y T4 libre normales con T3 reducida y un incremento en rT3, hallazgos similares a los del síndrome del eutiroideo enfermo. Pueden estar elevados los niveles de cortisol sérico y de cortisol libre en orina, así como de hormona de crecimiento (GH) pero con IGF1 reducida. En presencia de desnutrición severa, los niveles de gonadotropinas están descendidos, también los de testosterona en varones y de estrógenos en mujeres. Se recomienda realizar siempre un test de gestación cuando exista amenorrea, incluso en las pacientes más jóvenes.
OTRAS EXPLORACIONES COMPLEMENTARIAS
Deberemos practicar inicialmente un electrocardiograma, siendo frecuente detectar bradicardia sinusal; también disminución del voltaje e incluso prolongación del espacio QT 23. En los casos más graves, se precisará solicitar un ecocardiograma. Se pedirá una radiografía simple de tórax solo si existe otra patología asociada o para comprobar la colocación de una sonda nasogástrica. Se solicitará una densitometría ósea en presencia de amenorrea de larga duración, pero en general otras pruebas complementarias raramente son necesarias de rutina.
EVALUACIÓN NUTRICIONAL Y DE LA COMPOSICIÓN CORPORAL
Además de la medición del peso y la talla y el correspondiente cálculo del IMC, la medición mediante un lipocalibrador de diferentes pliegues cutáneos (tricipital, bicipital, subescapular y suprailiaco) es de mucha utilidad, y además puede ser empleado para calcular la grasa corporal total 24. Entre sus ventajas está la escasa influencia del estado de hidratación en su medición. Sin embargo, presenta escasa sensibilidad en detectar cambios nutricionales a corto plazo y en la distribución regional de la grasa 25,26. Conviene medir la circunferencia o perímetro del brazo y calcular la circunferencia muscular del brazo (CMB), que puede ser un indicador de la masa muscular 27. El cálculo del índice cintura-cadera permite evaluar y seguir la distribución de grasa regional en la AN durante la ganancia de peso 28,29,30, pudiendo incrementarse durante la realimentación 31.
La medición de creatinina en orina de 24 horas puede ser útil para valorar la pérdida de masa muscular en ausencia de rabdomiólisis o de enfermedad renal crónica. Aunque en el caso de los pacientes con AN que realicen una importante actividad física, se pueden presentar valores más elevados en este índice respecto de su estado nutricional.
- Impedancia bioeléctrica (BIA): la BIA es una técnica que permite el estudio de la composición corporal a pie de cama. Este método puede ser poco fiable cuando se altera el estado de hidratación, frecuente en los trastornos de la alimentación 32 y cuando los pacientes presentan un IMC inferior a 15 kg/m2 (33. Sin embargo, puede ser útil para el seguimiento en el tiempo de los cambios corporales en un mismo sujeto 34. Junto a ello, el análisis vectorial de BIA (BIVA), disponiendo de controles de referencia ajustados a la población de AN, permite seguir durante la realimentación tanto la migración vectorial de la BIA en las elipses de referencia de composición corporal como mediante la longitud del vector su estado de hidratación 31.
- Absorciometría dual de rayos X (DXA): la DXA regional se considera el patrón oro para evaluar la masa ósea de un individuo y debería ser realizada en todo paciente con AN con desnutrición, amenorrea y sospecha de osteopenia 32. Asimismo, la DXA de cuerpo completo puede ser un método útil para valorar la composición corporal en este tipo de pacientes 35. La Figura 1 refleja mediante DXA de cuerpo completo y BIVA combinados, datos característicos de depleción severa en los compartimentos corporales en una paciente con desnutrición grave.
- Valoración funcional: en la práctica clínica se puede realizar mediante la evaluación de la función muscular; asimismo determinados cuestionarios de riesgo nutricional emplean también ítems funcionales. La prueba más difundida es la dinamometría de la mano con medición en kg de la fuerza de prensión, que se relaciona bien con la masa libre de grasa corporal, existiendo puntos de corte que delimitan el diagnóstico de sarcopenia. Otras pruebas funcionales pueden ser la medición del flujo espiratorio máximo y la espirometría incentivada. Estos parámetros de valoración funcional del estado nutricional mejoran de manera intensa y precoz precediendo a las modificaciones en la composición corporal en la AN 31.

Figura 1. DXA de cuerpo completo y BIA-BIVA, combinados: datos característicos de depleción severa de compartimentos corporales en una desnutrición grave: reducción intensa de la masa grasa e índice de masa muscular apendicular (IMMA) por DXA, junto a bajo ángulo de fase con vector de BIVA situado en cuadrante ínfero-externo sobre elipse de tolerancia del 95% de la población control (datos de BIA-BIVA).
Podemos determinar que una aproximación práctica para la valoración nutricional de los pacientes con AN puede ser la asociación de al menos dos métodos de evaluación como el IMC + BIA 36 y observar los cambios producidos durante el seguimiento. Asimismo, y con mayor aplicación en la investigación clínica, la combinación de métodos que no midan directamente los mismos compartimentos, como DXA + BIA o pliegues subcutáneos + BIA, es recomendable 36. Junto a lo anterior, la valoración funcional puede ser una herramienta útil en predecir la evolución clínica de este tipo de pacientes.
Para finalizar, recordar que el gasto energético en reposo se puede calcular mediante ecuaciones predictivas tipo Harris-Benedict, siendo más adecuado medirlo a través de calorimetría indirecta, pues la fórmula de Harris-Benedict puede infravalorar las necesidades respecto de la calorimetría en pacientes desnutridos con AN 31. Los pacientes que presentan hiperactividad física pueden mantener un gasto energético total igual o superior a la población control.
COMPLICACIONES ASOCIADAS
La AN está asociada a numerosas complicaciones médicas y alguna de ellas, como la amenorrea, formaba incluso parte de los criterios diagnósticos de la misma hasta la última actualización del DSM-5 por parte de la APA. Estas complicaciones no solo condicionan el estado de salud y la calidad de vida de estos pacientes, sino que además se relacionan con más de la mitad de las muertes por esta enfermedad. Una revisión sistemática de 42 estudios observacionales (3.006 pacientes) encontró que el ratio absoluto de todas las causas de mortalidad en AN fue de un 6%. Estandarizando todos los ratios de mortalidad por AN, se evidenció que el rango de muerte por AN es 10-12 veces mayor que en la población general 8,37.
Las complicaciones médicas de la AN son el resultado de la pérdida de peso, la malnutrición 38 y los desequilibrios hidroelectrolíticos secundarios a las maniobras de purga. La inanición origina una atrofia de numerosos órganos vitales: corazón, cerebro, riñones y músculos, incrementándose el número de órganos y sistemas afectados con la severidad de la pérdida de peso.
Los principales factores de riesgo implicados en la incidencia de complicaciones asociadas a AN son el grado de pérdida de peso y la cronicidad de la enfermedad. No se conocen factores sociodemográficos relacionados con el desarrollo de las mismas.
El tratamiento de las complicaciones médicas se basa en el manejo sintomático y en el restablecimiento del estado nutricional con la consiguiente recuperación ponderal 39,40,41, aunque hasta el momento no disponemos de estudios randomizados al respecto 42,43.
COMPLICACIONES CARDIOVASCULARES
Las complicaciones cardiovasculares de la AN se pueden clasificar en anomalías estructurales y funcionales 44.
Los cambios estructurales incluyen disminución de la masa cardiaca, disminución de las cavidades y prolapso de la válvula mitral 45. También se ha descrito una disminución de la contractilidad y de la distensibilidad ventricular. Estos cambios cardiacos ocurren de manera significativa cuando los pacientes han sufrido una pérdida de peso en torno al 80% del peso ideal. La clínica se caracteriza por fatigabilidad y peor capacidad funcional frente al ejercicio. Los pacientes con AN pueden quejarse también de dolor torácico o de palpitaciones, en probable relación con la existencia de prolapso valvular mitral que ecográficamente se ha evidenciado en un 20% de los casos. Los síntomas mejoran generalmente con la recuperación ponderal, pero el tamaño cardiaco y las anomalías estructurales pueden tardar en restablecerse semanas o meses.
No existe evidencia de mayor incidencia de cardiopatía isquémica en AN, a pesar de que los niveles de colesterol están aumentados en más del 50% de los pacientes. La hipercolesterolemia está probablemente relacionada con una disminución de la secreción biliar y del catabolismo del colesterol, con un aumento de la lipólisis, y con el hipoestrogenismo y la disminución de los niveles de hormonas tiroideas. Generalmente se detecta un aumento de la fracción cardioprotectora HDL junto con insignificantes elevaciones de la fracción LDL-colesterol.
También se han descrito casos de derrame pericárdico en adolescentes con AN, sin que se hayan comunicado hasta el momento cuadros de taponamiento cardiaco. Este derrame suele desaparecer en los 3 primeros meses tras la realimentación.
Con todo, las complicaciones cardiacas más frecuentes son los trastornos del ritmo, como la bradicardia y las arritmias. Estos trastornos se relacionan con un mayor tiempo de evolución de la enfermedad, trastornos hidroelectrolíticos como la hipopotasemia y la hipocalcemia, el alargamiento del QT y la hipoalbuminemia crónica. La bradicardia, en sí misma, no debería ser un síntoma a tratar de forma directa, pero en pacientes críticos se recomienda monitorización por debajo de 30 lpm y la APA recomienda ingreso hospitalario en los pacientes con menos de 40 lpm. La bradicardia desaparece tras la recuperación del estado nutricional 46.
El riesgo de insuficiencia cardiaca es mayor en estos pacientes, sobre todo durante la realimentación, en relación con la disminución de la masa cardiaca, las alteraciones de la contractilidad y distensibilidad, y el déficit de micronutrientes como la tiamina. Otras complicaciones frecuentes son la tendencia a la hipotensión y el ortostatismo.
COMPLICACIONES ENDOCRINO-METABÓLICAS
La principal complicación en mujeres es la amenorrea secundaria, relacionada con la falta del estímulo hipotalámico pulsátil sobre la secreción de gonadotrofinas, con la consiguiente disminución de hormona luteotropa (LH) y hormona folículo estimulante (FSH) 47. Una pérdida de peso de entre el 10-15% produce disrupción en los ciclos ovulatorios de la mayoría de las mujeres. Sin embargo, en el 20% de las pacientes, la amenorrea puede preceder a la pérdida de peso 48.
La menstruación suele reinstaurarse tras el restablecimiento del peso, pero no siempre es así y en algunas series tarda hasta 9-12 meses después de la mejoría nutricional. El 10-30% de las pacientes pueden seguir en amenorrea después de la ganancia de peso por persistir el origen central del trastorno, aunque se haya restablecido el peso objetivo, desaparezcan las purgas, mejore el estrés o se normalice la actividad física. Se debe individualizar la indicación del tratamiento hormonal sustitutivo en cada caso, ya que no hay consenso en hacerlo de manera generalizada 49.
Aunque la fertilidad se ve comprometida en estas pacientes, pueden quedarse embarazadas y estas gestaciones tienen una mayor tasa de complicaciones tanto gestacionales como neonatales. Basándose en la experiencia clínica, se debería asegurar un aporte correcto de calcio, vitamina D, proteínas y fósforo durante toda la gestación y la lactancia. En todo caso, lo más conveniente sería programar el embarazo cuando se produzca una franca mejoría o curación de la enfermedad y aconsejar métodos anticonceptivos hasta que se alcance. La presencia de una AN activa contraindica tratamientos para la fertilidad 50.
En los varones, la afectación del eje hipotálamo-hipófiso-gonadal se traduce en una disminución de los niveles de testosterona, con síntomas de hipogonadismo como disminución de la líbido y de la potencia sexual.
Además de la afectación del eje hipotálamo-hipófiso-gonadal, los pacientes con AN pueden presentar otra serie de alteraciones hormonales. La producción hepática del factor de crecimiento insulínico tipo 1 (IGF1) disminuye como consecuencia de la desnutrición y los niveles de GH aumentan de manera secundaria; ello supone un fenómeno adaptativo que favorece los efectos metabólicos directos de la GH y disminuye la acción anabólica de la IGF1.
En la esfera adrenal hay una hipercortisolemia, con niveles de la hormona adrenocorticotropa (ACTH) normales, por una activación del eje hipotálamo-hipófiso-adrenal y una mayor producción de hormona liberadora de corticotropina (CRH), en relación con el estrés. La producción de cortisol está aumentada y su vida media prolongada.
La secreción de ADH también puede verse afectada, pudiendo presentar tanto cuadros de secreción inadecuada con hiponatremia como cuadros compatibles con diabetes insípida parcial e hipernatremia.
A nivel tiroideo hay una disminución de la conversión de tiroxina (T4) en triyodotironina (T3) con el fin de disminuir el gasto metabólico. En desnutriciones severas pueden descender también los niveles de T4. No está indicada la suplementación con hormonas tiroideas.
Estos pacientes pueden presentar hipoglucemias en relación con la restricción dietética, el ejercicio excesivo, la depleción de los depósitos de glucógeno y la falta de sustratos para la neoglucogénesis. La hipoglucemia persistente es un signo de mal pronóstico, constituyendo un marcador de fallo hepático.
COMPLICACIONES ÓSEAS
Factores como el hipogonadismo, con el subsiguiente hipoestrogenismo e hipoandrogenismo, el hipercortisolismo, la disminución de IGF1 y un posible aporte insuficiente de calcio y vitamina D con la dieta condicionan un aumento de la reabsorción y una disminución de la formación ósea responsables de la aparición de osteopenia en más del 90% y osteoporosis en el 30-40% de las mujeres con AN, con incremento del riesgo de fractura.
El grado de osteoporosis se correlaciona con la pérdida de peso y con la duración de la amenorrea. Un IMC inferior a 15 kg/m2 y la presencia de amenorrea por más de 6 meses condicionan una disminución de la densidad mineral ósea 51. Se recomienda realizar DXA a las pacientes con amenorrea de más de 6 meses de duración y si se prolonga el trastorno, repetirla al menos cada 2 años.
El tratamiento hormonal sustitutivo con estrógenos y progestágenos es la primera opción para tratar la osteoporosis. Los bifosfonatos no deberían usarse rutinariamente en pacientes en edad fértil dada su teratogenicidad, quedando reservados para los casos más severos. La suplementación de calcio y vitamina D se debe considerar de forma individualizada, tras evaluar la ingesta oral y los niveles circulantes de vitamina D. Los ensayos clínicos realizados documentan escasa evidencia de la utilidad de la administración de IGF1. No existen estudios de seguridad a largo plazo con denosumab. En casos de osteoporosis grave, con fractura vertebral, se podría ensayar tratamiento con teriparatide 51.
COMPLICACIONES GASTROINTESTINALES
La AN causa enlentecimiento del vaciamiento gástrico, gastroparesia, estreñimiento y puede condicionar elevación de las enzimas hepáticas. Se han descrito casos de pancreatitis aguda y síndrome de la arteria mesentérica superior como complicaciones raras 52.
La gastroparesia debería ser manejada de forma conservadora, intentando restablecer el equilibrio nutricional, evitando la ingesta de líquidos durante las comidas y el consumo excesivo de fibra, y fraccionando la ingesta en varias tomas a lo largo del día. Si no hay mejoría, se puede administrar metoclopramida en dosis de 5-10 mg, 30 min antes de las comidas.
El estreñimiento generalmente acompaña a la pérdida de peso. Se recomienda ingerir al menos 6-8 vasos de agua al día y fibra en dosis no superiores a 10 g por día, y se debe evitar el consumo abusivo de laxantes catárticos.
En pacientes vomitadoras es común el reflujo gastroesofágico y la esofagitis por reflujo. Otras posibles complicaciones agudas son la dilatación gástrica, la perforación esofágica/gástrica o la hematemesis.
La pérdida de peso y el ayuno suelen elevar de forma moderada las transaminasas. Raramente se producen elevaciones marcadas y fallo hepático, pero están descritas dichas alteraciones 53.
COMPLICACIONES RENALES Y ALTERACIONES HIDROELECTROLÍTICAS
Estos pacientes pueden presentar una reducción del filtrado glomerular y alteraciones en la capacidad de concentración de la orina, junto con una disminución de la creatinuria por disminución de la masa muscular. Frecuentemente, los pacientes están deplecionados de fósforo, magnesio y potasio. En los casos de AN purgativa, la hipokaliemia y las alteraciones hidroelectrolíticas son más significativas, pudiendo condicionar además deshidratación y fallo renal.
COMPLICACIONES PULMONARES
La desnutrición se asocia con debilidad de la musculatura respiratoria y con una disfunción diafragmática, que son reversibles tras la mejora del estado nutricional 54. Se han descrito casos de neumotórax espontáneo y neumomediastino, por pérdida de la pared alveolar y ruptura de la misma 55.
COMPLICACIONES HEMATOLÓGICAS
Se documentan citopenias en AN 56, en correlación con el grado de pérdida de peso. La anemia está presente hasta en un 83% de los casos, la leucopenia en un 79% y la trombopenia en el 25%. Todas ellas pueden ocurrir bien de forma aislada o simultáneamente. Pueden aparecer petequias y púrpura en extremidades inferiores como resultado de estas complicaciones hematológicas.
COMPLICACIONES NEUROLÓGICAS
Los estudios de neuroimagen han puesto de manifiesto, en pacientes con AN grave, la existencia de atrofia cerebral con reducción de la sustancia gris, aumento del volumen de los ventrículos y agrandamiento del surco interhemisférico 57,58. El origen de estos hallazgos es incierto, pero todos estos cambios son reversibles tras la renutrición.
Los pacientes pueden presentar cefaleas y se han descrito cuadros convulsivos en relación con trastornos hidroelectrolíticos.
El déficit de micronutrientes, sobre todo de vitaminas del grupo B, puede condicionar neuropatías.
COMPLICACIONES DERMATOLÓGICAS
Las manifestaciones dermatológicas son numerosas y cabe destacar la aparición de xerosis, lanugo, hipercarotinemia, acné, hiperpigmentación, acrocianosis, perniosis, petequias, livedo reticularis, paroniquias y estrías cutáneas 59.
ABORDAJE Y SEGUIMIENTO DEL PACIENTE EN CONSULTA EXTERNA
La mayor parte de los pacientes con AN son seguidos en régimen ambulatorio por servicios competentes para abordar dicho tratamiento y capaces de valorar el riesgo físico de estos enfermos 8. El seguimiento ambulatorio requiere de estabilidad médica, ausencia de riesgo autolítico y adecuada capacidad del paciente para la vida familiar, académica o laboral 60.
Cuando el tratamiento es compartido entre atención primaria y especializada, debe haber un claro acuerdo entre los profesionales sobre la monitorización de los pacientes con AN. Los parámetros evolutivos han de constar, y deberían ser compartidos con el paciente y, si fuese apropiado, con la familia y los cuidadores, ya que muchos de los enfermos con AN se muestran ambivalentes sobre su tratamiento 8.
Existen escasas evidencias empíricas sobre el manejo nutricional de los pacientes con AN, tanto en la fase de recuperación ponderal, como en el mantenimiento a largo plazo 61,62. A continuación, se recogen las recomendaciones vertidas en diversas guías de práctica clínica y revisiones realizadas por expertos. Para facilitar la lectura y la comprensión, se han omitido los grados de recomendación, porque en ningún caso se apoyan en una evidencia de alta calidad.
El tratamiento nutricional, incluyendo el consejo dietético, es un componente esencial del plan terapéutico del paciente con AN 63. Sin embargo, el consejo nutricional por sí solo no parece ser efectivo en el mantenimiento ponderal 61,62.
El tratamiento nutricional precoz es particularmente importante para aquellos con emaciación grave o con riesgo de padecerla. Estos pacientes deberían ser priorizados en dicho tratamiento. Siempre que sea posible, los pacientes deben ser atendidos antes de que se produzca esta situación. Esto requiere una detección precoz y una intervención rápida 8.
VALORACIÓN NUTRICIONAL ESPECÍFICA EN EL NIVEL AMBULATORIO
Los casos que lleguen a atención primaria deben ser evaluados por el médico de familia, que ha de responsabilizarse de la primera valoración e iniciar la coordinación de los cuidados. Aquella incluye la determinación de la emergencia médica o de la valoración psiquiátrica 8.
La evaluación integral debe incluir no solo la valoración nutricional, sino también de las necesidades sociales (que pueden comprometer el acceso al cuidado nutricional) 8. En la anamnesis nutricional debe valorarse la existencia de trastornos conductuales: sobre dietas, atracones, extravagancias con la comida, hábitos alimentarios personales y familiares, conductas purgativas y ejercicio, e hiperactividad física 64. En niños y adolescentes, el crecimiento y el desarrollo deben ser valorados como indicadores de su situación nutricional, y aunque el peso y el IMC son parámetros importantes, no han de considerarse como únicos. Deben valorarse también la evolución de la pérdida de peso y la velocidad de crecimiento en niños. En sujetos con AN de larga evolución, no seguidos en atención especializada, debería realizarse al menos una valoración anual (física y psicológica) en atención primaria 8 (Tabla III).
Tabla III. Valoración de los pacientes con AN en el medio ambulatorio en función de la gravedad de la enfermedad



Todos los parámetros deben evaluarse en la primera consulta.Realizar radiología de tórax si se detecta desnutrición resistente al tratamiento, elevación de PCR, presencia de edema o leucocitosis.Puede considerarse solicitar anticuerpos antitransglutaminasa tisular IgA si se sospecha enfermedad celiaca.
ACT: agua corporal total; 𝛽 HCG: gonadotropina coriónica humana; DXA: densitometría de energía dual; DHEA-S: dehidroepiandrosterona sulfato; DMO: densidad mineral ósea; FSH: hormona folículo estimulante; IMC: índice de masa corporal; LH: hormona luteotropa; MG: masa grasa; MLG: masa libre de grasa; MME: masa muscular esquelética; PCR: proteína C reactiva; PRL: prolactina; TA: tensión arterial.
pEn caso de pacientes purgativas.
*Solo si deficiencias previas o datos de desnutrición/escasa ingesta en la valoración nutricional.
**Solo si amenorrea, sospecha de gestación o retraso menstrual.
***Solo si amenorrea.
****Solo si síntomas de hipogonadismo (ginecomastia, disfunción eréctil...).
*****Considerar criterios para asegurar validez de resultados cuando se emplean fórmulas predictivas para los compartimentos corporales. Preparación adecuada.
#Si se observan arritimias, existe desnutrición severa o se detectan anomalías electrolíticas.
******Si se detectan anomalías en la auscultación o existe desnutrición muy severa.
OBJETIVOS DE LA INTERVENCIÓN NUTRICIONAL
En esta fase, los objetivos del tratamiento por parte del equipo se centran en restaurar o normalizar el peso y el estado nutricional, tratar las complicaciones físicas no agudas, proporcionar educación sobre patrones alimentarios y nutricionales sanos adaptados al medio, modificar y mejorar las disfunciones previas o adquiridas -entre ellas las purgas y los atracones-, tratar los trastornos asociados, mejorar las percepciones de hambre y saciedad, conseguir el apoyo familiar -a través de la EN en el entorno más cercano al paciente- y prevenir las recaídas una vez se ha estabilizado el comportamiento alimentario 64,65.
Desde el punto de vista más específico de la AN, se trata de conseguir anabolismo para alcanzar un peso mínimo (IMC > 18 kg/m2; > 85-90% del peso ideal) y reiniciar el crecimiento y el desarrollo físico en niños y adolescentes. En estos, se ha sugerido como objetivo razonable conseguir un percentil de IMC (según edad y sexo) de entre 13 y 30 62. Sin embargo, las metas a lograr deberían tener en cuenta la historia del peso familiar, el desarrollo y crecimiento del paciente, la evolución ponderal del mismo y la funcionalidad actual del enfermo. También puede fijarse un objetivo mínimo para que el paciente pueda acceder a un determinado programa terapéutico 66.
REQUERIMIENTOS DE ENERGÍA
El cálculo teórico de los requerimientos de energía dependerá del grado de desnutrición. En enfermos con desnutrición grave, y aunque no existe un consenso definido en las guías, se aconseja calcular 25-30 kcal/kg/día, sin sobrepasar las 1.000 kcal diarias al inicio.
Debe emplearse el peso real, ya que el ideal sobreestimaría el cálculo y podría producirse un síndrome de realimentación (SR) 64. En otras guías se recomienda comenzar con 30-40 kcal/kg/día (aproximadamente 1.000-1.600 kcal/día) 65. En el contexto ambulatorio debería iniciarse con una ingesta en torno a 20 kcal/kg/día. En el curso de 7 días, habría de aumentarse en 500 kcal cada día (3.500 kcal/semana para conseguir un aumento de medio kilogramo) 61. Los niños y adolescentes que aún están creciendo requieren un aporte extra de energía 67.
Sin embargo, las fórmulas habituales para el cálculo de los requerimientos de energía suelen sobreestimar las necesidades en un primer momento, así que no deben emplearse 66. Y posteriormente, durante la fase de reganancia ponderal, pueden infraestimarlas 68.
En la mayor parte de los pacientes con AN, un aumento semanal de 0,5 kg puede ser un objetivo razonable. Para ello se requiere de 3.500 a 7.000 kcal extras a la semana (8,65). No obstante, el rango de kcal necesarias para aumentar un kg corporal es muy diferente entre distintos estudios. Varios factores han sido relacionados con este hecho: la diferente actividad física que desarrollan, la variabilidad individual en la eficiencia energética, la respuesta termorreguladora, la composición del tejido corporal recuperado, las variaciones en el agua corporal, la edad y la fase del tratamiento 61.
Durante la fase de recuperación ponderal, la ingesta debería avanzar hasta 70-100 kcal/kg/día para algunos pacientes (4.000 o 5.000 kcal o más diarias). Este aumento de peso puede ser especialmente difícil en varones 65. En niños y adolescentes, una vez conseguido un peso saludable, debe garantizarse que dispongan de la energía y de los nutrientes necesarios en su dieta para mantener el crecimiento y el desarrollo alcanzados 8,64.
Debe tenerse en cuenta que, para mantener el peso corporal, los pacientes con AN requieren más kcal diarias que los sujetos sanos (50-60 kcal/kg/día), de tal forma que el exceso de energía debería mantenerse durante un tiempo prolongado. Al cabo de 6 meses, los requerimientos suelen estabilizarse alrededor de las 30-40 kcal diarias 61.
Los enfermos con AN tienen un riesgo elevado de sufrir un SR 69. Aunque se ha observado más frecuentemente en el ámbito hospitalario, al que llegan los pacientes más graves, debe pensarse en esta posibilidad cuando se trata de iniciar el plan terapéutico nutricional del paciente desnutrido.
TRATAMIENTO NUTRICIONAL
Aunque no existe evidencia sobre cuáles serían los mejores alimentos ni cuál sería el mejor reparto de macronutrientes 66, el plan dietético concreto debería estar basado en un patrón de consumo saludable, según se recoge en las recomendaciones sobre alimentación para población española sana de la Sociedad Española de Nutrición Comunitaria 70. No obstante, el tamaño de las raciones se establecerá, con ayuda de dietistas 66, según los requerimientos calculados de energía para cada paciente, que variarán en función de la evolución ponderal y del objetivo de peso pactado. Es importante insistir en la necesidad de ampliar el espectro de grupos de alimentos manejados en la alimentación diaria 65. Un plan estructurado de comidas puede ser necesario en algunos casos para establecer una ingesta completa, proveer de nutrientes esenciales e inducir saciedad, limitando las restricciones dietéticas, pero no se ha descrito cuál es el plan más efectivo 66.
Cuando el paciente no puede consumir la cantidad de requerimientos de energía prescritos, es pertinente utilizar nutrición enteral oral (o suplementos nutricionales orales), que deben tenerse en cuenta siempre en pacientes con dismotilidad intestinal y retraso del vaciado gástrico 61. Asumir dichos suplementos como un fármaco puede aumentar su aceptación por parte de los pacientes 67. En general, han de considerarse necesarios siempre que los requerimientos de energía no puedan ser aportados a través de los alimentos, especialmente si están por encima de las 3.000 kcal diarias.
En algunos casos es preciso el uso de un complejo multivitamínico-mineral durante la recuperación ponderal, y siempre que se detecte la existencia de una carencia de micronutrientes y minerales 8,64,67. Los suplementos de tiamina ambulatorios también pueden ser precisos durante las etapas iniciales de aumento ponderal rápido 67.
En el nivel ambulatorio no suele aconsejarse el tratamiento nutricional artificial (enteral o parenteral), aunque la opción de nutrición enteral domiciliaria puede valorarse en casos muy particulares.
PROGRAMA DE SEGUIMIENTO
La reevaluación nutricional periódica integral es la base de la monitorización del tratamiento nutricional. Es importante revisar el patrón de ingesta del paciente, contando con la información de los cuidadores o de los miembros de la familia, o a través del registro de la ingesta cuando hay colaboración 62.
Los cuidadores y los hermanos, en el caso de niños y adolescentes, deben estar incluidos en cualquier estrategia de EN y en el plan diario de alimentación 8. De hecho, en las normas de alimentación dirigidas a niños y adolescentes con AN, los cuidadores deberían recibir información sobre la planificación de la dieta (con menús prefijados en casos seleccionados) 64.
La Tabla IV propone algunas recomendaciones prácticas para fomentar la colaboración de las familias y en la Tabla V se muestran las instrucciones que debería recibir el paciente al salir de la consulta.
Si el paciente con AN rehúsa el tratamiento, y el tratamiento se considera esencial y existe gravedad, debe buscarse consejo legal 8,64.
Tabla IV. Recomendaciones para toda la familia en las etapas iniciales con el fin de fomentar nuevos hábitos de alimentación

SITUACIONES ESPECIALES A CONSIDERAR
En el caso de pacientes con AN y diabetes mellitus tipo 1, aumenta la probabilidad de riesgos físicos y complicaciones crónicas 8.
Las embarazadas con AN requieren una vigilancia estrecha durante todo el embarazo, tras el parto y en el periodo de lactancia. Debe monitorizarse el estado nutricional prenatal y el desarrollo fetal 8. En enfermas con un IMC < 18,5 kg/m2, puede considerarse apropiado un aumento ponderal de entre 12,7-18,1 kg, y de 11,3-15,9 kg en gestantes con normopeso (IMC 18,5-24,9 kg/m2)66.
Se ha descrito una prevalencia más elevada de vegetarianismo entre pacientes con AN. Estas dietas suelen aportar menos calorías que las dietas convencionales, lo que hace que en situaciones de muy bajo peso su uso pueda estar controvertido. El hierro de las fuentes vegetales es menos biodisponible que el de fuentes animales; además, los abundantes fitatos presentes en ese tipo de alimentación interfieren con la absorción de zinc, hierro y calcio. Si se omite el consumo de leche y huevos, suele existir deficiencia de vitamina B12. Es importante suplementar los nutrientes deficitarios en todos los pacientes que quieran optar por este tipo de patrón dietético 67.
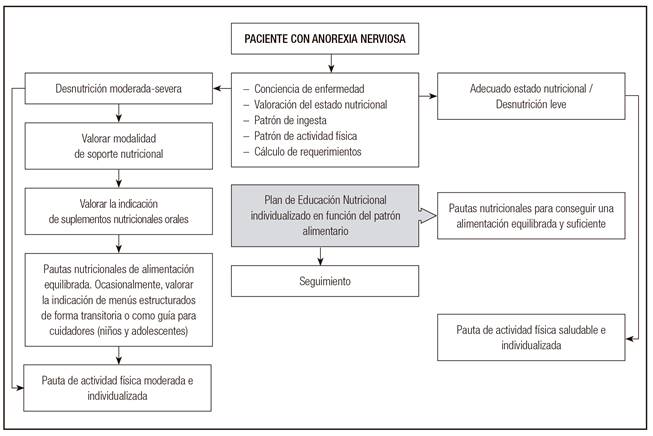
En la Figura 2 y Figura 3 se esquematizan la estrategia de soporte nutricional en el nivel ambulatorio y las sugerencias de plan dietético en este ámbito.
EDUCACIÓN NUTRICIONAL
Dentro de la educación para la salud se encuentra el campo de la EN, cuyo fin es la modificación de la conducta alimentaria hacia patrones más saludables 71.
La EN orienta sus recursos hacia el aprendizaje, adecuación y aceptación de hábitos alimentarios saludables, de acuerdo con la propia cultura alimentaria y con los conocimientos científicos en materia de nutrición. La información adecuada puede motivar la necesidad de un cambio y ayudar a desarrollar las habilidades que permitan una elección adecuada de alimentos, y que faciliten adoptar y mantener esta conducta positiva en el tiempo 72.
En lo que respecta a los TCA y más específicamente a la AN, la EN es un componente esencial del tratamiento y persigue los siguientes objetivos:
- Mejorar la actitud y comportamiento en relación con la comida.
- Alcanzar un número adecuado de comidas al día.
- Mejorar la ingesta energética y de micro y macronutrientes.
- Alcanzar una mejora en el patrón alimentario cumpliendo con la ingesta recomendada de los grupos básicos de alimentos.
- Aclarar mitos y errores derivados de fuentes inadecuadas de información que condicionan y limitan la alimentación.
- Favorecer con todos estos cambios la recuperación del estado nutricional.
Aunque se ha sugerido que los pacientes con AN tienen un buen nivel de conocimientos nutricionales, esto es muy cuestionable. Es cierto que frecuentemente tienen conocimientos detallados sobre la energía contenida en los alimentos, pero falta un conocimiento nutricional general, que les haría ser capaces de planificar un consumo de alimentos después de que el miedo a este cambio haya sido reducido. Los pacientes a menudo tienen creencias muy difíciles de cambiar referidas a alimentos "saludables" y "no saludables", en lugar de un concepto sobre alimentación saludable y equilibrada y, con frecuencia, recurren a fuentes de información no científica que acaban aumentando su confusión y generando gran miedo al cambio, perpetuando comportamientos alimentarios poco saludables, por lo que deben aprender a hacer una lectura crítica de la información, de los medios y su entorno 63,73.
Por otro lado, numerosos estudios sostienen que, si bien los tratamientos para la AN suelen ser efectivos en la normalización del estado nutricional, los comportamientos alimentarios inadecuados (restricción de energía y grasas, baja variedad de la dieta, rechazo a los alimentos de alta palatabilidad, consumo de raciones extremadamente pequeñas) tienden a mantenerse en el tiempo, constituyendo un factor de riesgo de recaídas y recidivas 73,74,75,76. Esto sugiere la necesidad de realizar intervenciones orientadas a reducir los comportamientos anormales en torno a la alimentación y el control del peso corporal 76,77.
Según la APA, el consejo nutricional puede resultar útil como coadyuvante de otras modalidades terapéuticas, ya que minimiza la restricción de alimentos, incrementa la variedad de la comida y fomenta el ejercicio moderado 65,78.
La EN no busca informar al paciente; el concepto de educación supera las aspiraciones de la información/instrucción, persigue un cambio de comportamiento a través de la comprensión del problema y el conocimiento de los beneficios del cambio. Hay que conseguir una convicción profunda en las personas para que asuman los cambios en los hábitos alimentarios que las conduzcan a una salud mejor 79.
Un aspecto clave de la EN es la correcta indicación de la misma, tanto para realizar una adecuada selección de sus beneficiarios como para elegir el momento más adecuado para su implementación. Será fundamental que el paciente posea un estado nutricional mínimo que garantice el aprovechamiento de la educación 80, esté motivado y preparado para el cambio, comprenda la utilidad de la EN y esté de acuerdo en recibirla.
Es importante que la EN la realice un profesional con formación en nutrición, con conocimientos de psicología, con capacitación y experiencia en el tratamiento de esta enfermedad, y que además posea características personales adecuadas, como flexibilidad, empatía y paciencia.
Siempre que se tengan en cuenta los aspectos antes mencionados, la EN puede ser llevada a cabo en las diferentes etapas o modalidades de tratamiento (hospitalización, ambulatoria, etc.), aunque en cada una se perseguirán distintos objetivos y se trabajará sobre diferentes áreas temáticas 81,82.
Debe tenerse en cuenta que los cambios en el comportamiento en relación con la comida no son lineales. A menudo, el paciente sufre retrocesos relacionados con la enfermedad o con situaciones personales, deshaciendo un camino andado que deberá volver a transitar 73.
Otra área en la que la EN debe estar presente en la AN es en prevención primaria. Puede desarrollarse en diferentes poblaciones de riesgo como colegios, profesores, deportistas, entrenadores, familias de adolescentes, etc., y debe focalizarse en ofrecer información contrastada y de evidencia científica sobre los aspectos positivos de una alimentación saludable, la actividad física moderada y la forma de llevarla a la práctica 83,84,85.
En algunos protocolos de tratamiento, se sustituye la EN por la utilización de dietas programadas con diferente aporte calórico. Sin embargo, estas estructuran al paciente, que puede permanecer muchos años aferrado a una dieta o un menú incrementando el riesgo de desarrollar o mantener inadecuados comportamientos en relación con la comida 74. Esto no solo es incorrecto desde el punto de vista nutricional, sino que también es socialmente inaceptable, ya que el paciente acaba condicionando sus actividades y su vida social a "su dieta". La restricción disminuye las emociones positivas relacionadas con el alimento y produce un refuerzo positivo sobre la privación 74.
La Tabla VI describe algunas de las variables que deberán recogerse a fin de contar con una descripción general del patrón alimentario del paciente, que será el punto de partida para orientar la EN a implementar. Además, se presentan las herramientas recomendadas para cuantificar y hacer seguimiento de la evolución de la ingesta.
Tabla VI. Evaluación de hábitos alimentarios, ingesta dietética y su cuantificación

Tener en cuenta que los pacientes suelen subestimar su ingesta en torno a un 30%.
En los pacientes con AN podemos describir, en términos generales, dos tipos de patrón alimentario sobre los que podemos desarrollar diferentes acciones educativas con distintas características, objetivos y unidades didácticas para trabajar, tal como se resume en la Figura 4. Aspectos como el tiempo de evolución de la enfermedad, tratamientos previos y actuales recibidos, el contexto familiar y social en el que se encuentra, sus conocimientos previos en materia de nutrición, y sus principales mitos y temores deberán ser tenidos en cuenta y, a pesar de que este esquema de trabajo se adapta a la mayoría de los casos, resulta fundamental mantener la individualidad, ajustando cada estrategia a las necesidades del paciente 86.

Figura 4. Unidades temáticas recomendadas para trabajar en la educación nutricional de pacientes con anorexia nerviosa Modificado de: V. Loria Kohen y C. Gómez Candela. Manual teórico-práctico de Educación Nutricional en TCA. "Reaprendiendo a comer". Madrid: Editores Médicos; 2010.
1. Patrón alimentario tipo restrictivo en paciente motivado al cambio.
Las unidades didácticas, cuando existe un patrón alimentario con estas características, tienen como finalidad que el paciente conozca en qué consiste una alimentación saludable y equilibrada y comprenda que esto no significa "engordar".
Se deberá trabajar de forma muy paulatina, preferentemente con un grupo de alimentos cada vez, trabajando qué alimentos lo incluyen, qué nutrientes aportan, los mitos y errores en relación a ellos y las raciones recomendadas de cada grupo en función de nuestro objetivo nutricional.
Después de indicar las raciones recomendadas de cada grupo, se deberán contrastar con las raciones consumidas por el paciente, visualizadas a través del registro alimentario. Esto permitirá que el enfermo, de una forma muy práctica y concreta, sea consciente en cuanto se aleja de la recomendación.
El paciente debe comprender que la finalidad de este trabajo es lograr un patrón alimentario que le conduzca a una alimentación equilibrada y saludable, que a su vez le permitirá tener una mejor calidad de vida.
A partir de aquí, se pactarán "deberes" o "compromisos" para ir logrando un aumento gradual del número o tamaño de las raciones. Estos pactos o compromisos con el paciente deben ser lentos, graduales, y adaptados a la motivación y la capacidad de cambio del paciente; si le proponemos pasos muy bruscos probablemente se asuste y se sienta incapaz de llevarlos a cabo.
En aquellos pacientes en los que se suman comportamientos purgativos, como vómitos o un exceso en la práctica de ejercicio físico, resultará muy útil trabajar sobre las consecuencias que los mismos tienen sobre su salud y su recuperación, promoviendo un aumento de la ingesta muy gradual que pueda ser tolerado por el paciente.
2. Patrón alimentario sumamente restrictivo.
La labor educativa en esta etapa es muy limitada, ya que con una ingesta energética tan reducida nos encontramos con un paciente incapaz de mantener la concentración, el interés y la motivación para realizar cambios.
Lo ideal es trabajar sobre el registro alimentario, negociando pequeños cambios que muchas veces se limitan a un yogur desnatado o un par de galletas más.
En ocasiones, se hace indispensable recurrir al empleo de suplementos nutricionales, ya que, a pesar de ser rechazados, es prioritario mantener una ingesta mínima. Cuando es necesaria la suplementación, es igualmente útil trabajar sobre pequeños cambios sobre el registro alimentario, ya que los suplementos no deben desplazar a los alimentos, sino servir como complemento mientras que la alimentación continúe siendo peligrosamente reducida.
En algunos casos, y cuando el estado nutricional del paciente junto con la baja ingesta representan un riesgo vital, será necesario plantear un ingreso hospitalario, y suspender la EN hasta que el paciente logre avanzar.
Ruiz-Prieto y cols. (2013) evaluaron la modificación en la calidad de la alimentación tras un año de EN promovida por nutricionistas en 31 pacientes con AN. Tras el año de intervención, los pacientes mejoraron su estado nutricional, redujeron los tiempos para seleccionar el menú, mejoraron la ingesta total de energía, el porcentaje de hidratos de carbono y de grasas consumido, aunque la evolución mostró un retroceso en los últimos 3 meses. Esto indicaría el desarrollo de una mayor habilidad para seleccionar su dieta y el conocimiento sobre alimentación saludable 74.
Nuestro grupo desarrolló un programa de EN con visitas semanales/quincenales durante 4-6 meses, en el que cada paciente recibió de 15 a 20 sesiones llevadas a cabo por una dietista, empleando material didáctico de diseño propio que incluyó medidas caseras, fotografías y formas de alimentos 87. Se desarrolló un estudio longitudinal para evaluar su utilidad, en el que se incluyeron 89 pacientes con TCA (59% con diagnóstico de AN). El programa demostró ser útil para mejorar el estado nutricional de estos pacientes, tanto en lo referente a la evolución de los parámetros antropométricos como de su ingesta dietética. Al mismo tiempo, los pacientes mejoraron su actitud y comportamiento en relación a la comida, su patrón alimentario y redujeron las conductas compensatorias 82.
Waisberg & Woods (2002) realizaron un estudio piloto en pacientes con AN, conducido por dietistas y psicólogos con el objetivo de lograr la recuperación del peso corporal a través de la normalización de la alimentación. La duración fue de 8 semanas tras las que se observó un aumento significativo del peso corporal, una mejora de la puntuación del cuestionario EAT26, así como una mayor ingesta calórica de hidratos de carbono, grasas y proteínas 88.
Steinglass y cols. (2014) proponen un nuevo modelo de confrontación con los alimentos basado en el control de la ansiedad generada por los mismos. La evaluación del mismo mostró una mayor ingesta calórica y una mejoría en las escalas de ansiedad 89.
Si bien la efectividad de la EN en pacientes con AN se encuentra poco documentada, existen evidencias que indican que desarrollar la capacidad de propiciar una selección de alimentos basada en el concepto de alimentación saludable, mejora la elección y el comportamiento en relación a la comida, favorece la recuperación nutricional y reduce las recaídas 74,83,89. Los programas de EN llevados a cabo por profesionales cualificados y expertos deben formar parte del tratamiento de los TCA, junto al seguimiento médico y psicológico, y dentro del marco de la interdisciplinariedad y el trabajo en equipo.
SUPLEMENTOS NUTRICIONALES ORALES
Cuando no resulta posible cubrir las necesidades energético-proteicas con la alimentación habitual, se debe valorar la recomendación de nutrición artificial, que estaría indicada cuando la alimentación oral ha sido (o se espera que sea) insuficiente (menos del 50-60% de los requerimientos) durante más de 7-10 días en pacientes bien nutridos y con escaso estrés, o de 3 a 5 días en pacientes desnutridos y/o con importante estrés (nivel de evidencia B: evidencia aportada por trabajos clínicos randomizados y controlados de muestra pequeña o controlados no randomizados o de cohortes o de caso control aleatorizados). La nutrición artificial disminuye la morbilidad en pacientes malnutridos (evidencia A: evidencia apoyada por uno o más trabajos randomizados y controlados prospectivos de alta calidad o metaanálisis de muestra grande y alta calidad) 90.
Los suplementos nutricionales orales (SNO) son fórmulas químicamente definidas que contienen cantidades importantes de nutrientes en un volumen pequeño, y han sido diseñadas para complementar una alimentación insuficiente para así cubrir las necesidades nutricionales. En una revisión reciente de la Cochrane en la que se evalúa el uso de la SNO en pacientes pediátricos con enfermedades crónicas, se concluye sobre la falta de evidencia que permita establecer la efectividad de su uso y destaca la necesidad de realizar estudios que permitan dilucidar su utilidad en diferentes patologías 91. En lo que respecta a población adulta, la revisión de la literatura existente en determinados contextos clínicos (como geriatría u oncología), evidencia que los SNO reducen la aparición de complicaciones, tanto de la patología de base como del estado de desnutrición, y favorecen la reducción de la estancia hospitalaria y de la mortalidad 92.
En el caso de los TCA, existen escasos estudios sobre la utilización de los SNO. En un estudio realizado en 40 pacientes con AN, a nivel ambulatorio se observó que aunque todos los pacientes aumentaron de peso de manera significativa (3,2 kg el grupo con SNO y 2,2 kg el grupo sin SNO, p < 0,0001), solo en aquellos que recibieron SNO se documentó un aumento significativo de IMC (pasando de 16,2 a 17,4 kg/m2, p < 0,01), de pliegue tricipital, de la circunferencia muscular del brazo, de la albúmina y del recuento total de linfocitos, por lo que los autores concluyeron que los SNO son una herramienta fundamental para la recuperación de muchos pacientes con AN que acceden a consumirlos 93.
Numerosos motivos complican el desarrollo de ensayos metodológicamente adecuados en estos casos. Existe un grave inconveniente ético a la hora de randomizar, ya que quedarían sin recibir la suplementación pacientes desnutridos que la requieren, o dificultad en la selección del placebo, así como en la cuantificación de la verdadera ingesta realizada en pacientes no hospitalizados.
En otro estudio realizado en 84 pacientes se compara la ganancia de peso lograda y la duración del tratamiento en este mismo tipo de pacientes a nivel ambulatorio, en función de que consuman o no SNO. Los pacientes que los consumieron eran los que lograban una mayor ganancia de peso y los que precisaron un tratamiento más breve. Estos autores sugieren que el uso de suplementos hipercalóricos durante la primera mitad del tratamiento aporta beneficios adicionales a una dieta normal, ya que permite una ganancia de peso más rápida y, en algunos casos, acorta el tiempo necesario de tratamiento. No obstante, recomiendan que la sustitución se realice apoyada de un tratamiento psicoterapéutico; la utilidad y la duración deben ser aclaradas y pactadas con el paciente. El uso de SNO, en todo caso, no debería reemplazar a la instrucción de incrementar la ingesta de alimentos 94.
En lo que respecta a los métodos de realimentación durante el ingreso hospitalario, Hart y cols., en 2013, tras una revisión de 26 estudios, observaron que la mayor ganancia de peso se logra a través del empleo de nutrición enteral (peso medio ganado 8,4 kg), y que la indicación de SNO, junto con la alimentación oral conseguida, permitió una ganancia media de 4,3 kg. Entre los beneficios del uso de SNO, estos autores destacan la ventaja de conseguir aportar una gran parte de los requerimientos energéticos necesarios para la ganancia de peso en un volumen menor y que, además, son útiles para los pacientes que luchan contra la rápida aparición de saciedad y que pueden ser considerados por el paciente como un medicamento (que trata la desnutrición), favoreciendo el cumplimiento de la pauta indicada. El único efecto adverso a considerar podría ser que su uso frecuente evitara el esfuerzo de los pacientes en progresar en su alimentación, reforzando sus conductas de evitación de alimentos, o que pudiera fomentar la dependencia de fuentes de alimentación artificiales. Estos autores destacan y recomiendan la realización de estudios randomizados que permitan conocer con mayor certeza la eficacia de su empleo 95.
Algunos autores consideran que el uso de SNO ha mostrado utilidad, sobre todo en las primeras etapas del proceso de realimentación, y que debe ser siempre una opción considerada en pacientes embarazadas, tras la retirada de nutrición artificial, y como complemento de la alimentación en pacientes con excesiva saciedad 60.
Si bien el uso de SNO puede no resultar siempre útil, su uso puede ser de un apoyo adecuado sobre todo a corto plazo 96.
La revisión de la literatura evidencia la necesidad de realizar más estudios con la metodología adecuada, en los que se tenga en cuenta la cantidad indicada y la ingerida por el paciente, y que valore el efecto sobre la calidad de vida, así como su coste-efectividad en pacientes con TCA.
Aunque en algunos casos se hace imprescindible la indicación de los SNO, tenemos que tener siempre presente que los efectos fisiológicos y psicológicos que proporciona la alimentación habitual no se consiguen con los suplementos, y en el caso específico de estos pacientes, en ocasiones son empleados para lograr un "control" sobre su alimentación, dada la información nutricional suministrada en los envases.
Para evitar que desplacen a otros alimentos, se deberían aportar a los pacientes algunas recomendaciones de consumo:
- Recordarles que se pueden tomar fríos o calientes y que se pueden mezclar también con otros alimentos, e incluso cocinar con ellos.
- Se pueden beber por la mañana, a continuación del desayuno.
- También entre las comidas (preferentemente 60 minutos antes y nunca antes de comenzarla), para recuperar el apetito para la comida siguiente.
- O en pequeñas tomas (de unos 50 ml) a lo largo de día.
- Incluso antes de acostarse, que suele ser el momento en que menos se interfiere al resto de la alimentación.
- Las manipulaciones sobre los SNO (tirarlos, sustituir su contenido por agua, etc.) son frecuentes y de lo más creativas, por lo que en determinados casos debe indicarse que su consumo se haga bajo supervisión.
De acuerdo con su composición nutricional, existen diferentes tipos de suplementos. Los hipercalóricos y normoproteicos (1,5-2 kcal/mL, menos del 20% de proteínas con respecto al valor calórico total) y los hipercalóricos e hiperproteicos (1,5-2 kcal/mL y más del 20% de proteínas) suelen ser los más indicados en estos pacientes. El uso de envases de volumen reducido (de unos 125 mL) puede ser de gran utilidad.
Sin embargo, y a pesar de los cuadros tan severos de desnutrición que llegan a padecer los pacientes con AN, este diagnóstico no consta entre los subsidiarios de recibir NE oral ni por sonda en nuestro Sistema Nacional de Salud, y se niega la financiación de estos tratamientos, lo cual genera un significativo agravio comparativo frente a otras patologías.
Tan pronto como el estado nutricional y una ingesta razonable lo permitan, los SNO deben reemplazarse por alimentos para no demorar la tarea de reincorporación de los mismos y la vuelta a un patrón de alimentación saludable.
En la Tabla VII se recoge el consenso de los autores en cuanto a indicación de SNO en la AN. En la Tabla VIII se resumen los beneficios esperables de su empleo y sus potenciales efectos adversos.
Tabla VII. Indicación de suplementos nutricionales orales en pacientes con anorexia nerviosa que acceden a recibir el tratamiento, junto con la alimentación pactada

Deben indicarse para un determinado periodo de tiempo, junto con recomendaciones de consumo.
MANEJO DE LA ANOREXIA NERVIOSA EN EL PACIENTE HOSPITALIZADO
No existen criterios basados en la evidencia que establezcan qué pacientes necesitarán hospitalización, por lo que, tanto los signos y síntomas médicos, como los psiquiátricos, o la propia evolución de la enfermedad, deben ser tenidos en cuenta como criterios de ingreso en pacientes con AN.
De forma clásica se han definido como parámetros de gravedad, y por tanto como criterios de ingreso hospitalario, los siguientes 65:
- Peso inferior al 70% del peso ideal o bajo IMC. Por una parte, hay discrepancias sobre si considerarlo per se criterio de ingreso hospitalario. Por otra, entre quienes consideran un bajo IMC un criterio, existe controversia sobre el punto de corte a considerar. Hay tendencia a elegir un punto de corte de IMC "más bajo" en aquellos centros que disponen de hospital de día y especialmente en pacientes de mayor tiempo de evolución (IMC < 12 o 13 kg/m2) y puntos de corte "más altos" en aquellos donde no se dispone de este recurso, y en pacientes de reciente diagnóstico (IMC < 14 o 15 kg/m2).
- Pérdida de peso aguda independientemente del IMC, con fracaso del manejo ambulatorio.
- Negativa a la ingesta.
- Complicaciones médicas graves, tales como: bradicardia (frecuencia cardiaca < 40 lpm), taquicardia (frecuencia cardiaca >100 lpm), hipotensión (presión arterial < 90/60 mmHg), hipotermia (temperatura < 35,5 °), hipoglucemia, hipopotasemia (potasio < 3 meq/l), hiponatremia (Na < 130 mmol/l), hipofosfatemia, deshidratación, fallo orgánico (hepático, renal o cardiovascular), alteraciones en el electrocardiograma (arritmias, QT prolongado, cambios en el ST), enfermedad médica aguda intercurrente (p. ej. pancreatitis, rotura gástrica, hematemesis, diabetes mellitus descompensada), alteración del nivel de conciencia o alteración hematológica grave (leucocitos < 1.500/mm3, neutrófilos < 1.000/mm3, plaquetas < 50.000/mm3).
- Abuso incontrolado de laxantes o diuréticos.
- Pérdida de control en los episodios de voracidad y/o purgas.
- Falta de colaboración y fracaso del manejo ambulatorio.
- Intento autolítico o ideación suicida.
- Patología psiquiátrica aguda (psicosis, manía...).
El ingreso hospitalario del paciente con AN puede ser voluntario o involuntario. Este último debe considerarse solo en casos seleccionados cuando otras medidas han fracasado y existe compromiso vital. La legislación actual permite realizar ingresos involuntarios en aquellos pacientes en los que la situación comprometa su integridad física. De hecho, muchos de los pacientes con AN ingresados y tratados de forma involuntaria reconocen posteriormente la necesidad de dicho ingreso 97.
Los pacientes con AN que requieren ingreso hospitalario deben hacerlo en unidades multidisciplinares específicas para ello. No obstante, dado que este tipo de unidades no siempre existen en todos los centros, en su ausencia, convendría que dichos pacientes ingresasen a cargo del servicio de psiquiatría. Se reserva el ingreso a cargo de unidades médicas (tales como los servicios de endocrinología y nutrición o medicina interna) a aquellas situaciones en las que el manejo y/o monitorización de las complicaciones médicas no sean posibles en las unidades de hospitalización de psiquiatría.
OBJETIVOS DEL INGRESO HOSPITALARIO
- Normalización de las constantes vitales, corrección de los trastornos hidroelectrolíticos y resolución de otras comorbilidades médicas asociadas.
- Inicio del restablecimiento del peso corporal.
- Reorganización de la conducta alimentaria con resolución de las principales cogniciones alteradas con respecto al peso e imagen corporal.
- Desarrollo de un mejor ajuste social y confianza personal.
- Tratamiento de la comorbilidad psiquiátrica.
- Planificación para el tratamiento después del alta que contemple la prevención de la recaída.
MONITORIZACIÓN DEL PACIENTE INGRESADO CON AN
El paciente ingresado por AN debe ser evaluado de forma exhaustiva al ingreso y posteriormente monitorizado de forma estrecha con el fin de poder optimizar el tratamiento nutricional y detectar y tratar precozmente la aparición de complicaciones (especialmente el SR). Esta evaluación y monitorización debe incluir:
-
Al ingreso (65, 98):
- Constantes vitales (tensión arterial, frecuencia cardiaca, temperatura, saturación de oxígeno) y exploración física por aparatos y sistemas que incluyan el grado de hidratación y presencia de ascitis o edemas.
- Antropometría: peso, talla, IMC, circunferencia muscular del brazo, pliegue tricipital.
- Registro de la ingesta en los días previos al ingreso, así como posibles conductas purgantes o abuso de alcohol o fármacos (laxantes o diuréticos).
- Análisis bioquímicos que incluyan: glucosa, iones (sodio, potasio, cloro, fósforo, magnesio), función renal (urea, creatinina), perfil hepático (bilirrubina, GOT, GPT, GGT), amilasa, albúmina, prealbúmina, proteína C reactiva, hemograma, INR, vitamina B12, ácido fólico, hierro, ferritina, vitamina D, PTH, vitamina A, vitamina E, zinc y cobre.
- Electrocardiograma (ECG).
- En función de la sintomatología, pueden ser necesarias otras pruebas como: radiografía de tórax, ecografía abdominal, etc.
-
Durante la hospitalización:
- Constantes vitales de forma diaria: se debe prestar especial atención a la frecuencia cardiaca, ya que la taquicardia constituye un signo alarma de síndrome de realimentación. De hecho, incrementos mayores a 20 lpm sobre la frecuencia cardiaca basal del paciente (alrededor de 80-90 lpm) deben ser tomados en consideración 65.
- Exploración física por aparatos y sistemas que incluya el grado de hidratación y presencia de ascitis o edemas: de forma diaria los primeros 15 días y posteriormente de forma periódica según la situación del paciente, y siempre que existan signos clínicos o analíticos de realimentación.
- Registro de la ingesta (ya sea vía oral, enteral o parenteral), hábito intestinal y aporte de líquidos de forma diaria 99.
- Peso: inicialmente o, si existe alteración en el balance hídrico, de forma diaria. Posteriormente puede realizarse 2-3 días por semana. Se recomienda una ganancia de peso entre 0,5-1 kg/semana 8.
-
- Análisis bioquímicos que incluyan 98:
-
Otros aspectos a considerar 98:
- Vigilancia de la actividad física. Será aconsejable el reposo en cama en los pacientes más desnutridos vigilando el riesgo de la aparición de úlceras por presión.
- Supervisión de las duchas y baños para garantizar la seguridad y reducir el riesgo de sobreingesta de líquidos.
- Las salidas del área de hospitalización estarán restringidas, o en los casos autorizados, se harán con personal acompañante.
SOPORTE NUTRICIONAL EN EL PACIENTE HOSPITALIZADO
El tratamiento nutricional estará enmarcado en el tratamiento multidisciplinar que requieren estos pacientes.
El gasto energético se calculará a partir de las ecuaciones de Harris-Benedict o Mifflin. La primera, que ha sido la más utilizada, nos indicará el gasto energético en reposo (GER) o bien, si se dispone de ella, se medirá con calorimetría indirecta. Este GER debe corregirse por el factor actividad que puede oscilar entre un 10 a 60% adicional dependiendo del grado de actividad. Estos requerimientos energéticos deberán ser recalculados a lo largo del proceso de renutrición en función de la evolución ponderal, pues en algunos casos no se alcanza el peso marcado y es preciso incrementar la energía aportada 43.
El régimen de renutrición óptimo en estos pacientes no está bien definido, pero habitualmente se ha recomendado el inicio de la alimentación por vía oral. Con el fin de evitar el SR, las recomendaciones para la renutrición se basan en un inicio con bajo aporte energético entre 600-1.200 kcal/día, e incrementarlo lentamente, con un aporte proteico situado en el rango de 1-1,5 g/kg/día. En la mayor parte de los pacientes es seguro iniciar la alimentación con 1.000-1.600 kcal/día (30-40 kcal/kg/día) y posteriormente aumentar progresivamente alrededor de unas 200 kcal cada 48 h según ganancia de peso y evolución clínica 65,98, pudiendo alcanzar temporalmente 70-80 kcal/kg/día para conseguir el objetivo de incremento ponderal deseado.
Se deben reservar las pautas de inicio más estrictas para aquellos pacientes con factores de alto riesgo de SR. En estos pacientes, debe iniciarse a 5-10 kcal/kg/día con incremento a 20-25 kcal/kg/día en las siguientes 48 horas, siempre que la situación clínica del paciente no lo contraindique 98,99. A partir de la primera o segunda semana de hospitalización, el objetivo de incremento de peso está entre 0,5-1 kg/semanal 8.
Estas pautas de renutrición no evitan la aparición del SR, por lo que en los últimos años diferentes estudios en población adolescente demuestran que un mayor aporte energético en la dieta desde el ingreso predice una más rápida recuperación ponderal y menor tiempo de estancia hospitalaria sin incremento del SR 100,101.
El tratamiento dietético con alimentación oral es el tratamiento de elección por ser el método menos invasivo, seguro y más terapéutico, pues contempla la introducción de todos los grupos de alimentos para conseguir una dieta balanceada y ajustada a las necesidades energéticas del individuo. Se procurará pactar con el paciente una ingesta moderada de líquidos a lo largo del día. La distribución de las ingestas será fraccionada en 3 comidas principales y 1-3 tentempiés. La composición de la dieta no será negociable con el paciente. Si es posible se establecerá un tiempo de duración de las comidas, que serán supervisadas por el personal de la planta y hasta unos 30 minutos después.
Para aumentar el aporte energético y poder alcanzar el incremento de peso deseado, la suplementación nutricional oral con fórmulas líquidas es una estrategia efectiva. Se utilizarán fórmulas saborizadas hipercalóricas, en una pauta que se ajustará a la tolerancia individual y al objetivo terapéutico.
En determinadas circunstancias, por la gravedad del paciente o por la falta de colaboración del mismo, será necesario buscar alternativas a la alimentación oral mediante nutrición artificial. Los criterios para la indicación de nutrición artificial serán:
- Paciente reticente o incapaz de colaborar con la alimentación oral.
- Pérdida de peso > 40% del peso ideal con riesgo vital.
- Empeoramiento del estado físico o psicológico a pesar de los tratamientos indicados.
En estas situaciones, la nutrición enteral será la técnica de elección de soporte nutricional frente a la nutrición parenteral. Se colocará una sonda nasogástrica de silicona o poliuretano de 8-12 F y, excepcionalmente, si se prevé una larga duración del soporte, por gastrostomía endoscópica percutánea, aunque esta modalidad es poco utilizada. Se administrarán fórmulas poliméricas normo o hipercalóricas según las necesidades y tolerancia del paciente.
La forma de administración puede ser continua en 24 h o cíclica. La forma de administración cíclica nocturna puede ser útil como complemento a la alimentación oral diurna en los casos con una lenta o difícil recuperación ponderal.
Hay pocos estudios sobre la eficacia de la nutrición enteral a largo plazo. Un estudio de tratamiento con infusión cíclica durante 2 meses seguidos, durante un año de seguimiento, concluye que la nutrición enteral es útil para la recuperación ponderal, no interfiere con la terapia de la conducta alimentaria y no provoca recaídas más precoces 102.
El uso de la nutrición parenteral es más controvertido, y en general estará restringido a las situaciones de gravedad o riesgo vital del paciente, o cuando la renutrición por vía digestiva (oral o enteral) está contraindicada o ha fracasado. Por otra parte, supone mayor riesgo de complicaciones tanto metabólicas (SR) como infecciosas o mecánicas.
SÍNDROME DE REALIMENTACIÓN
El SR es una complicación potencialmente fatal que acontece en el contexto de una repleción nutricional agresiva en pacientes previamente desnutridos y/o sometidos a una situación de ayuno prolongado 103.
Este síndrome ocurre cuando, partiendo de un estado de ayuno y/o desnutrición (donde existe un estado de hipoinsulinismo y gluconeogénesis, junto con un déficit de vitaminas, especialmente de tiamina), se pasa a un estado anabólico en el que la liberación de insulina promueve la captación intracelular de potasio, fósforo y magnesio, así como un incremento del consumo de vitaminas y un desbalance de fluidos, dando lugar a un cuadro de afectación multiorgánica 103.
Los pacientes con AN constituyen un colectivo de riesgo para el desarrollo de este síndrome, pudiendo contribuir a su aparición: la presencia de alteraciones electrolíticas previas (hipofosfatemia, hipopotasemia e hipomagnesemia), el aporte de cantidades elevadas de glucosa en relación al resto de nutrientes (especialmente administrada de forma endovenosa), el ayuno prolongado o ausencia de ingesta por más de 10 días, o el antecedente de consumo de alcohol, diuréticos o laxantes, entre otros 104.
El diagnóstico del SR se establece en aquellos pacientes con riesgo de desarrollar SR 99,105 (Tabla IX) que presenten hipofosfatemia severa (acompañado de hipopotasemia e hipomagnesemia) y alteración del balance de fluidos, junto con la presencia de alteraciones neurológicas, cardiorrespiratorias, digestivas y hematológicas graves, durante los primeros días tras el inicio de la reposición nutricional (103). El mayor riesgo de desarrollo del síndrome ocurre en los primeros 15 días del inicio de la restauración nutricional.
Se debe realizar profilaxis del SR en los pacientes con AN en riesgo que precisen ingreso hospitalario. Dicha prevención debe contemplar:
- Inicio cuidadoso de la repleción nutricional. Existen múltiples pautas de restauración nutricional en pacientes adultos con AN, sin embargo, no hay evidencia de que unas sean mejores que otras. Tradicionalmente, se ha establecido que el riesgo de SR es menor si se inicia la nutrición con aportes bajos y aumentos progresivamente lentos de nutrientes 43.Sin embargo, esta pauta conlleva el riesgo de "prolongar" la situación de desnutrición 98,105 y tampoco ha demostrado la prevención de SR en pacientes con elevado riesgo 104. Probablemente tenga una mayor importancia el grado de desnutrición y la restricción del aporte de glucosa (que debe ser menor al 40% del aporte energético total), que la restricción energética per se 106.
- Monitorización estrecha de los niveles de fósforo, potasio y magnesio 107. Debe considerarse su determinación diaria durante los primeros 7 a 14 días y posteriormente, cada 4-7 días.
-
Administración profiláctica de vitaminas:
Tiamina: 200-300 mg/día, iniciándose la primera dosis intramuscular 30 minutos antes del inicio de la alimentación y manteniendo su administración durante 10 días, preferentemente por vía oral 99.
Complejo vitamínico B de alta potencia de forma diaria 99.
Complejo multivitamínico que cubra el 200% del DRI de forma diaria 99,103.
Complejo mineral que cubra el 100% del DRI de forma diaria. No se aconseja suplementar con hierro durante la primera semana 103.
-
- Suplementación profiláctica de electrolitos:
En general, se aconseja no retrasar el inicio del soporte nutricional a la espera de corregir las alteraciones iónicas para evitar prolongar la desnutrición y sus efectos deletéreos 99,105. Sin embargo, puede valorarse su retraso en casos graves seleccionados, siempre que no implique una demora importante en el inicio de la alimentación.
Se recomienda suplementar de forma profiláctica el fósforo (con alrededor de 0,3-0,6 mmol/kg/día de fosfato vía oral), así como valorar la suplementación de potasio y magnesio 99,103. Dicha suplementación debe realizarse siempre de forma individualizada, teniendo en cuenta la función renal y los niveles analíticos iniciales, evitando la suplementación profiláctica si existen niveles elevados basalmente.
Evitar la sobrecarga de volumen (20-30 ml/kg/día) y restringir el aporte de sodio (< 1 mmol/kg/día) 103,107.
El tratamiento del SR ya establecido puede requerir ingreso en unidad de cuidados intensivos en cuyo caso consiste en 43,107:
- Reducir el aporte nutricional. En casos muy severos, se recomienda suspender el soporte nutricional de forma temporal y reiniciar tras la adecuada estabilización del paciente (al 50% del aporte previo y con una progresión lenta).
- Corregir las alteraciones electrolíticas y descartar otras posibles causas que las justifiquen.
- Restablecer un adecuado balance hídrico.
- Tratamiento de las manifestaciones clínicas (neurológicas, cardiacas, respiratorias, etc.).
- Mantener los aportes de tiamina y multivitamínicos.
- Monitorización estricta del paciente.
CRITERIOS DE ALTA HOSPITALARIAEN EL PACIENTE INGRESADO CON AN
El hecho de que los criterios de ingreso hospitalario en el paciente con AN puedan estar motivados tanto por cuestiones médicas (complicaciones médicas agudas, pérdida de peso, etc.) como psiquiátricas (intento autolítico, ideación suicida, psicosis, etc.), es un aspecto a tener en cuenta a la hora de plantear el alta hospitalaria del paciente con AN, ya que determinará los criterios de aquella.
De esta forma, salvo cuando el motivo de ingreso sea exclusivamente psiquiátrico, en cuyo caso los criterios de alta dependerán de la resolución de dicho cuadro, en el resto de casos deberán cumplirse los siguientes:
- Presentar una situación médica estable y resolución de las complicaciones agudas.
- Recuperación razonable del peso. No existe un objetivo de IMC válido para todos los pacientes sino que este debe ser siempre individualizado. En algunos centros se pacta al ingreso el peso "objetivo". Sin embargo, otros utilizan un valor mínimo de IMC (por ejemplo IMC ≥ 16 kg/m2 mantenido durante 7-10 días sin aporte enteral a través de sonda nasogástrica) o un porcentaje determinado del peso real respecto del ideal (p. ej., alrededor del 80%).
- Control significativo de las alteraciones conductuales y resolución de la psicopatología aguda si la hubiera.
- Asegurar el seguimiento y cumplimiento de objetivos en post-alta.
En algunos centros se establecen programas de transición, con salidas del hospital algunas tardes inicialmente, y durante un fin de semana completo después, con el fin de valorar la readaptación del paciente cuando está fuera del centro.
TRATAMIENTO DE LA ANOREXIA NERVIOSA EN EL HOSPITAL DE DIA
El hospital de día para TCA (HDTCA) es una modalidad de tratamiento de los TCA, a medio camino entre el tratamiento ambulatorio tradicional (consultas, terapia individual y grupal) y la hospitalización completa. El HDTCA surge como una alternativa que podría ser útil en el manejo de algunos pacientes con TCA que necesitan un tratamiento más intensivo que el ofrecido por los regímenes ambulatorios, pero sin los inconvenientes de la hospitalización. Los pacientes reciben cuidados durante el día, incluyendo tratamiento médico, terapia nutricional (comidas acompañadas/vigiladas), EN, atención psiquiátrica y psicológica en modalidad individual y/o grupal, terapia ocupacional y apoyo social. El objetivo principal del HDTCA es realizar un abordaje multidisciplinario e intensivo, tratando de educar, recuperar pautas y hábitos alimentarios de los pacientes y sus familiares, conseguir la recuperación ponderal en los pacientes con bajo peso, controlar los síntomas y los ciclos de control/descontrol de los mismos, detectar y tratar los factores mantenedores o perpetuantes del trastorno y promover la integración laboral y/o académica y social de nuestros pacientes con AN.
El horario habitualmente abarca desde antes del desayuno hasta la tarde en todos los días laborables 108. Existen distintos modelos de HDTCA que tienen en cuenta distintas orientaciones 108. Algunos se orientan a tratamientos de corta duración (algunas semanas), dirigidos fundamentalmente al control de los síntomas del trastorno y la obtención de una mejora ponderal; y otras veces contamos con HDTCA más dirigidos al tratamiento integral del paciente, trabajando aspectos psicodinámicos, habilidades interpersonales y psicosociales, conocimiento de los síntomas y con un objetivo de recuperación del estado nutricional más gradual, lo que implica una duración más prolongada (de varios meses).
Los requisitos más habituales para poder ingresar en un HDTCA suelen ser:
- Tener un diagnóstico de AN establecido de acuerdo con los criterios actuales.
- Fracaso continuado en el régimen de tratamiento ambulatorio.
- Como continuación tras un episodio de hospitalización y transición hacia el manejo ambulatorio.
- Ausencia de un índice de masa corporal extremadamente bajo y de una rápida pérdida de peso que podrían obligar a realizar un ingreso hospitalario.
- Ausencia de complicaciones graves que aconsejen hospitalización completa médica o psiquiátrica.
- Motivación para el cambio y compromiso del paciente con el cumplimiento, para lo cual se precisa de una adherencia adecuada, debiendo acudir a todas las sesiones tanto grupales como individuales programadas. Para ello, se suele negociar un contrato terapéutico donde todas las condiciones de ingreso, mantenimiento en el programa y alta estén escritas.
En cualquier caso, y sea cual sea su modalidad, la forma de funcionar de los HDTCA debe seguir un protocolo definido y pactado entre las partes, con un programa estructurado que asegure las actividades de valoración y tratamiento por parte de un equipo multidisciplinar (psiquiatras, psicólogos, endocrinólogos, nutricionistas, enfermeras, terapeutas ocupacionales y trabajadores sociales) que desarrolle todas las actividades pertinentes, tanto individuales como grupales y que conduzca al tratamiento integral de los pacientes. Estos protocolos deben incluir todas las consultas, actividades, ingestas y terapias que se realizan, junto con los horarios de las mismas y las condiciones para su adecuado cumplimiento (Tabla X).
Tabla X. Propuesta de posibles actividades terapéuticas en el HDTCA según la disponibilidad de cada centro*

*Según recursos de profesionales y espacio.
En nuestro país suelen ser los médicos especialistas en endocrinología y nutrición los encargados de realizar la valoración clínica y del estado nutricional de los pacientes, la planificación del tratamiento dietético-nutricional, la corrección de las deficiencias nutricionales, la prevención y el tratamiento de las complicaciones médicas, todo ello en colaboración con el resto de profesionales, trabajando todos unívocamente para obtener la mejoría del paciente. Y allí donde trabajan dietistas, estos serán los encargados de la EN.
En cuanto a los criterios de alta de los pacientes desde el HDTCA, habitualmente se requiere conseguir y mantener el objetivo ponderal que se haya establecido en cada caso, corregir los comportamientos alimentarios inadecuados, los pensamientos irracionales, y asegurar un soporte socio-familiar adecuado que permita el pertinente seguimiento ambulatorio. En todo caso, si en algún momento se constata que el programa de HDTCA establecido no se está siguiendo correctamente o que surgen complicaciones, el paciente debería ser transferido a otra modalidad terapéutica más apropiada a su caso.
Respecto del seguimiento posterior de los pacientes tras el alta del HDTCA, existe variabilidad en las visitas ambulatorias, con frecuencias que varían de pocos días o semanas a mensuales. Lo ideal es individualizar el manejo y la frecuencia de visitas de seguimiento en función de las necesidades de cada paciente.
Un estudio observacional examinó la efectividad a corto plazo del tratamiento de un hospital de día estructurado, y valoró la estabilidad de los efectos a corto plazo en pacientes con AN y BN 109. Se evaluaron 83 pacientes, 47 con AN y 36 con BN, al inicio del tratamiento y al final, aproximadamente un año después del mismo. Las medidas de resultado fueron el IMC, las actitudes perturbadas y los comportamientos alimentarios evaluados con el Eating Disorder Inventory, la frecuencia de atracones y purgas, y la psicopatología general (evaluada con el Symptom Checklist-90). Al final del tratamiento, en el hospital de día se podían encontrar mejoras significativas en todas las variables de resultado. Los efectos fueron generalmente de gran tamaño (0,74 > d < 2,44) y se mantuvieron o mejoraron durante todo el seguimiento (18 meses). En el seguimiento, el 40,2% de los pacientes con AN y el 40,4% de los pacientes BN pudieron clasificarse como en remisión. Concluyen que en el tratamiento de la AN, el HDTCA es útil en el manejo de estos pacientes, resultando coste-efectivo, tanto como tratamiento inicial en casos seleccionados, como formando parte del manejo integral de los pacientes, y en muchas ocasiones como espacio terapéutico intermedio entre el manejo ambulatorio y la hospitalización completa.
ABORDAJE EN EL PACIENTE CRÓNICO
Aunque en los últimos años se ha reducido el número de pacientes con AN que se cronifican, gracias en buena medida a la mayor precocidad y a la mejora de los tratamientos (enfoque multidisciplinar, hospitales de día, unidades especializadas, etc.), se estima que el 10-20% de los pacientes con AN tienen un curso crónico 38, bien manteniendo un perfil anoréxico o bien evolucionando a otras formas de TCA en el transcurso de los años 110.
Si bien en la mayoría de los estudios de seguimiento a largo plazo, cuanto más prolongado es el mismo, menor es el porcentaje del total de pacientes en los que la enfermedad no se ha resuelto, los resultados sugieren que al cabo de 7 a 12 años de evolución es poco probable que pacientes con AN consigan una recuperación completa. Se admite que una paciente con AN tiene un curso crónico si pasados 10 años del diagnóstico persiste una incapacidad para mantener el peso, está presente la depresión de forma crónica, persiste la obsesión y hay retraimiento social 65. En el estudio Delphi se definen como criterios de cronicidad la presencia de patrones de restricción alimentaria y de cogniciones anoréxicas arraigados, el que la identidad personal permanezca ligada a la anorexia y el mantenimiento de un IMC < 17,5 durante años 111.
Los pacientes con AN crónica precisan un seguimiento en el que los diferentes profesionales implicados actúen de forma coordinada. Además de un control ambulatorio mantenido en el tiempo, como con frecuencia sufrirán recaídas y reagudizaciones, pueden necesitar hospitalizaciones repetidas a tiempo completo o parcial. Los hospitales y centros de día, los pisos asistidos, o incluso en casos extremos la atención institucionalizada, deben completar la red de asistencia a estos pacientes. A lo largo de los años van a requerir actuaciones sobre las patologías y complicaciones orgánicas y seguir recibiendo tratamiento psicoterápico y psicofarmacológico 112.
Los objetivos generales del tratamiento de estos pacientes se centran en establecer programas de prevención terciaria. Este tipo de prevención pretende mejorar la calidad de vida y la funcionalidad de los pacientes, tratando de evitar, retrasar o paliar las complicaciones severas derivadas de la desnutrición, minimizando el riesgo de yatrogenia, disminuyendo la morbilidad y mejorando la supervivencia 113. No debemos olvidar que las tasas de mortalidad de la AN oscilan según las series entre un 4 y un 20%, siendo dos veces superior en pacientes con el subtipo compulsivo purgativo frente al subtipo restrictivo 114.
Por todo ello, el seguimiento de estos pacientes resistentes al tratamiento se debe realizar desde una perspectiva global y multidisciplinar, fijando metas realistas y pactadas que se puedan alcanzar y mantener, evitando situaciones de riesgo, y centrándose fundamentalmente en la motivación y en la calidad de vida del paciente.
CONTROL DEL ESTADO ORGÁNICO
Seguimiento nutricional
En el caso del paciente crónico, el objetivo ponderal se debe centrar en evitar la desnutrición extrema y conseguir un peso "seguro" más que un peso "saludable" 65, intentando minimizar la restricción y las conductas purgativas si están presentes, y estructurando y equilibrando en lo posible la ingesta a través de una EN continuada. Con ello mejorará el estado físico y la capacidad funcional del paciente, y disminuirá el riesgo de complicaciones por déficit inmunitario. Se intentarán evitar en la medida de lo posible y se corregirán cuando aparezcan los desequilibrios hidroelectrolíticos, sobre todo en pacientes con conductas de purga. Se sustituirán los déficits vitamínicos y minerales que surjan a lo largo de la evolución 115, y se recurrirá al soporte nutricional oral o enteral cuando las circunstancias así lo recomienden.
Ejercicio físico
Es recomendable la realización de un ejercicio saludable, moderado y controlado, siempre que las condiciones físicas del paciente lo permitan. Un programa supervisado, con combinación de ejercicios aeróbicos y de resistencia, ha demostrado en algunos ensayos controlados y randomizados un efecto positivo sobre la fuerza muscular, el IMC y el porcentaje de grasa corporal. El ejercicio aeróbico moderado, el yoga y la fisioterapia parecen tener además un efecto positivo sobre los síntomas depresivos y las conductas anoréxicas 116.
Control de las complicaciones somáticas
Dentro de este apartado destacaremos las que se exponen a continuación.
Trastornos hormonales
Dentro de los trastornos hormonales que se describen en la AN, el que tiene una mayor trascendencia clínica si se prolonga en el tiempo es el hipogonadismo, que en la mujer se manifestará con anovulación, trastornos menstruales, infertilidad, síntomas de déficit estrogénico y efecto deletéreo sobre la densidad mineral ósea 113,117. Teniendo en cuenta la cronicidad del proceso, se debe valorar el tratamiento sustitutivo con esteroides sexuales de forma individualizada, aunque la evidencia científica sobre la eficacia de estos tratamientos en pacientes con AN es limitada 118 y las hemorragias por deprivación cíclicas pueden provocar en el paciente una falsa sensación de tranquilidad.
Densidad mineral ósea
La AN se asocia con una alta prevalencia de osteoporosis (38%) y osteopenia (92%) 119 debido a una combinación de diferentes mecanismos anabólicos y catabólicos: deficencia estrogénica, hipercortisolismo, déficit de IGF1, etc. 120.
Aunque se ha demostrado que el mejor tratamiento de esta complicación es la recuperación ponderal y la reinstauración de las menstruaciones 121, dado que en los pacientes crónicos no se dan estas circunstancias, habrá que considerar tratamientos alternativos.
Los resultados de algunos trabajos recientes apuntan a que el tratamiento sustitutivo con estrógenos en mujeres anoréxicas con amenorrea reduciría la pérdida de densidad mineral ósea a nivel de columna lumbar, pero no hay evidencia suficiente de mejoría a nivel de cuello femoral ni de reducción del riesgo de fractura 118. La administración transdérmica de 100 µg de 17 -estradiol con 100-200 g de progesterona micronizada por vía oral de forma cíclica durante 12 días al mes se ha demostrado más eficaz que las preparaciones orales en mujeres jóvenes 122.
La suplementación sistemática de calcio y vitamina D no ha demostrado un aumento de la densidad mineral ósea 123, pero dado los efectos fisiológicos de estos micronutrientes en la mineralización ósea es importante optimizar su ingesta y evaluar periódicamente los niveles de vitamina D, suplementándola farmacológicamente si son bajos 124.
El tratamiento con difosfonatos se ha mostrado efectivo en pacientes adultas con AN 125, al contrario de lo que ocurre en adolescentes 126. La larga vida media de estos fármacos constituye también un problema para su utilización en mujeres en edad fértil dada su teratogenicidad 127. Se necesitan estudios a más largo plazo sobre la eficacia y seguridad de los difosfonatos en este tipo de pacientes, pero es un tratamiento a considerar en anoréxicas crónicas adultas con osteoporosis, sobre todo si ya han presentado alguna fractura 124,128.
El teriparatide ha demostrado su eficacia en el tratamiento de la osteoporosis en mujeres postmenopáusicas y recientemente se ha publicado un ensayo con buenos resultados en mujeres adultas mayores con AN 129. De cualquier forma, dada la limitada experiencia de uso y el riesgo de sarcoma, no es en estos momentos un tratamiento a considerar en la práctica habitual. Sobre otros fármacos como el denosumab se carece de experiencia en pacientes con AN.
Seguimiento cardiológico
En el 80% de los pacientes con AN aparecen manifestaciones cardiacas como bradicardia, hipotensión arterial, alteraciones electrocardiográficas en relación con trastornos hidroelectrolíticos, que a su vez predisponen al desarrollo de arritmias, disminución de la contractilidad y de la distensibilidad ventricular, prolapso de la válvula mitral e insuficiencia cardiaca 130,131.
La patología cardiovascular es una de las causas orgánicas de fallecimiento de estos pacientes, que presentan un riesgo por este motivo dos veces superior al de la población general 132. De hecho, la bradicardia, junto con la alteración de las enzimas hepáticas, se han propuesto como biomarcadores de progresión de la enfermedad 133.
Se debe hacer un seguimiento clínico, ecocardiográfico y de los posibles desequilibrios hidroelectrolíticos, fundamentalmente la hipopotasemia y la hipomagnesemia, y evitar la administración de fármacos cuyos efectos secundarios puedan afectar la función cardiaca 8,64.
Control de los síntomas digestivos
El estreñimiento es un síntoma particularmente frecuente que se intentará controlar con medidas dietéticas, evitando siempre el uso de laxantes. El reflujo gastroesofágico y la esofagitis por reflujo son comunes en pacientes vomitadoras. Además de intentar minimizar la frecuencia de los episodios de vómito, se prescribirán inhibidores de la bomba de protones de forma individualizada. Debe hacerse un seguimiento periódico de las pruebas de función hepática, ya que puede aparecer disfunción como parte de la evolución tórpida de la enfermedad, a consecuencia de los tratamientos farmacológicos o por la presencia de adicciones o infecciones intercurrentes. El riesgo de fallecimiento por cirrosis hepática es cinco veces superior en AN respecto a la población general 132, por lo que es fundamental, entre otros, el evitar el consumo de alcohol.
Control hematológico e inmunitario
Periódicamente, se debe realizar hemograma, y si se detecta anemia, determinar los micronutrientes más directamente implicados (Fe, B12, fólico, Cu) y suplementarlos si hay déficit.
La leucopenia y las alteraciones de la inmunidad celular son consecuencia de una desnutrición grave y suponen un importante riesgo vital para el paciente, por el aumento de la susceptibilidad a las infecciones y una peor respuesta al tratamiento de las mismas. Estos pacientes tienen un riesgo diez veces superior al de la población general de fallecer por neumonías o pielonefritis 132. La mejoría de la situación nutricional es la única medida eficaz para disminuir este riesgo.
Control de posibles complicaciones neurológicas
En los pacientes con AN, como en otros TCA, pueden aparecer complicaciones a nivel de sistema nervioso central, con deterioro cognitivo y disfunciones neuropsicológicas, afectando fundamentalmente a la atención, la memoria y las funciones ejecutivas, y en menor medida al procesamiento visual y a las aptitudes verbales. Estos pacientes presentarían además una mayor dificultad para reconocer estados mentales ajenos que puede interferir en su conducta social. El deterioro cognitivo sería mayor y sobre todo la flexibilidad cognitiva se encontraría más alterada en pacientes de larga evolución 134,135. Algunos autores proponen estrategias terapéuticas de rehabilitación, denominadas terapias de remediación cognitiva, que entrenarían procesos cerebrales básicos, por medio de la proliferación y refinamiento de conexiones neurales, y enseñarían estrategias adaptativas, mejorando el procesamiento del pensamiento e influyendo en el funcionamiento global de los pacientes 136.
A nivel del sistema nervioso periférico, y en relación con el déficit de micronutrientes, sobre todo de vitaminas del grupo B, pueden aparecer neuropatías que precisarán tratamiento farmacológico con suplementación de los mismos, fisioterapia y otras terapias de rehabilitación.
Cuidado bucodental
La patología bucodental es frecuente sobre todo en el grupo de pacientes con actitudes purgativas. Las más habituales son la erosión y descalcificación del esmalte así como el aumento en la incidencia de caries por la presencia de una mayor acidez en el medio y por una disminución del flujo salival. Pueden presentar además sensibilidad dental a estímulos térmicos y alteraciones en la mucosa bucal y tejidos periodontales. Aspectos importantes de la prevención en estos pacientes incluyen: revisiones periódicas y protección del esmalte con fluoruro. Si el paciente vomita, se recomienda el empleo diario de soluciones neutras en forma de enjuague de fluoruro de sodio (0,05%). El tratamiento restaurativo será rutinario como en cualquier paciente odontológico con este tipo de lesiones bucales 137.
CONTROL DEL ESTADO MENTAL
A día de hoy el grado de evidencia científica sobre el efecto de las diferentes intervenciones dirigidas a los casos crónicos de AN es escasa 138. Recientemente se publicó el primer ensayo controlado y randomizado focalizado específicamente en AN crónica, comparando dos tipos de tratamientos psicológicos adaptados a este grupo de pacientes: el Cognitive Behaviour Therapy (CBT-SE) y el Specialist Supportive Clinical Management (SSCM-SE) 139. El objetivo prioritario era mejorar la calidad de vida de los pacientes y, aunque ambos tipos de tratamiento resultaron útiles, el grupo que recibió CBT-SE consiguió mejores tasas de recuperación.
De cualquier forma, el manejo de un paciente con AN crónica requiere una serie de particularidades que lo hacen diferente de una psicoterapia convencional 113. Se precisa establecer con el paciente vínculos y alianzas, negociar y establecer pactos, valorar expectativas y calcular las metas. Se deben revisar los tratamientos anteriores y reconsiderar los actuales en un proceso dinámico que tiene que adaptarse a la evolución de la enfermedad, sin olvidar la prevención del intento de suicidio, ya que el mismo es responsable de la mitad de los fallecimientos en la anorexia.
Es muy importante intentar establecer rutinas de actividad social, aunque sean mínimas, con el fin de prevenir el aislamiento y la invalidez; motivar al paciente en la realización de actividades intelectuales y en el desarrollo de hobbies y de cualquier actividad que pueda resultarle estimulante y placentera 112.
La evidencia científica sobre la eficacia del tratamiento farmacológico en el curso de la enfermedad es insuficiente, centrándose su utilidad fundamentalmente en el control de los síntomas psicológicos comórbidos 140,141,142.
Existen algunas técnicas en investigación para el tratamiento de pacientes crónicos, refractarios a otros tratamientos y con una evolución tórpida de la enfermedad, como son la estimulación cerebral profunda y la estimulación magnética transcraneal 133.
PACTO DE CONDUCTAS
Se pueden pactar con el paciente alternativas saludables a conductas perjudiciales como las adicciones o la impulsividad, y el compromiso de acudir con regularidad a las revisiones programadas. En el ámbito familiar se debe pactar la aceptación de algunas conductas y llegar a un acuerdo en otras, intentando conseguir una mejor adaptación del paciente y de la familia a la situación, evitando en la medida de lo posible los conflictos y el deterioro del marco familiar. La familia debe ser entrenada para identificar el reinicio de actitudes anómalas, conductas de riesgo, posibles adicciones, etc.
MEDIDAS DE REINSERCIÓN SOCIALY LABORAL
La rehabilitación psicosocial tiene como objetivo la normalización de la vida del paciente en todas sus facetas, corrigiendo conductas patológicas, aumentando el autocontrol y el grado de autonomía, mejorando las relaciones interpersonales y consiguiendo la incorporación al área formativa y laboral 143. En ello juegan un papel primordial la familia, los amigos, los dispositivos y recursos asistenciales, los servicios sociales y las asociaciones de autoayuda, pero también es necesaria la colaboración de las instituciones académicas y del mundo empresarial 144.
En resumen, para el seguimiento de estos pacientes se necesitan equipos multidisciplinarios y flexibles, con profesionales bien formados y motivados; desarrollar protocolos de tratamiento consensuados, con adecuación a los cambios clínicos y a la comorbilidad, y establecer una buena coordinación entre los diferentes niveles asistenciales 145. La cronicidad no debe ser sinónimo de irreversibilidad, independientemente de los años transcurridos y de los fracasos terapéuticos previos. Con programas adecuados se puede conseguir un incremento de la supervivencia, una disminución de las recaídas y un aumento de las tasas de recuperación parcial, con mejoría significativa de la capacidad funcional y de la calidad de vida 146. Además, se debe disponer de los recursos asistenciales necesarios para proporcionar tratamientos a largo plazo y seguir la evolución de estos pacientes, y contar con el apoyo de la sociedad para reducir la discapacidad que toda enfermedad crónica genera 147 (Tabla XI).
EVALUACIÓN DE RESULTADOS
Hay poca evidencia clínica para evaluar los resultados tanto clínicos como en costes de la eficacia de los distintos tratamientos en la AN. La mayoría de las recomendaciones en las distintas guías están basadas en consenso de expertos. En este apartado haremos referencia fundamentalmente a las Guías NICE (The National Institute for Health and Care Excellence) y a las Guías Australianas 8,62, sin señalar en cada caso el grado de evidencia científica pues, como hemos dicho en la mayoría de los puntos, las recomendaciones se hacen por consenso de expertos.
La AN es la tercera enfermedad crónica más frecuente en chicas adolescentes con una tasa de mortalidad en adultos del 5% y en adolescentes del 2%. La tasa de mortalidad es 18 veces mayor que en mujeres no afectadas con la misma edad 148. La AN tiene un profundo efecto sobre la salud y la calidad de vida, y el tratamiento precoz de la enfermedad mejora el pronóstico y la calidad de vida de los pacientes. Pero en cualquier etapa de la evolución de la enfermedad, los cuidados médicos son claves para disminuir la mortalidad.
La Guía NICE 8 recomienda que todos pacientes con trastornos de la alimentación sean evaluados y que deben recibir tratamiento de forma precoz. Y el tratamiento precoz es especialmente importante en aquellos pacientes con riesgo de emaciación que deben ser atendidos de forma prioritaria.
Existen una serie de variables que se relacionan con mal pronóstico de la enfermedad al inicio del tratamiento y estos son: IMC bajo, deterioro físico previo al inicio del tratamiento, subtipo purgativo de AN (en particular con presencia de vómitos), tratamientos previos en el curso de la enfermedad, problemas de personalidad o conflictos interpersonales, problemas familiares, alteraciones de la imagen corporal y deseos de muy bajo peso y, finalmente, edad de presentación por encima de los 20 años.
Y los factores de mal pronóstico tras el inicio del tratamiento incluyen: padecer otras enfermedades psiquiátricas tales como alteraciones de la personalidad, ganancia de peso inadecuada durante el tratamiento, desear un peso bajo, continuar con conductas dirigidas a adelgazar, mantenerse con dieta restrictiva y la dificultad para integrarse socialmente.
Según la guía australiana 62, los buenos resultados guardan relación con:
- Ausencia de severa emaciación (IMC > 17 kg/m2).
- Ausencia de serias complicaciones médicas.
- Alta motivación para cambiar comportamientos.
- Buen soporte familiar y social.
Y los resultados más pobres guardan relación con:
- Vómitos en pacientes severamente desnutridos, particularmente cuando son muy frecuentes y casi automáticos.
- Comienzo en la etapa juvenil y no en la adolescencia.
- Coexistencia de enfermedad psiquiátrica o desórdenes de la personalidad.
- Relaciones familiares patológicas/conflictivas.
- Larga duración de la enfermedad.
EQUIPOS TERAPÉUTICOS
Se recomienda la participación de equipos multidisciplinar para un tratamiento óptimo. La restauración del peso es fundamental, pero no existe evidencia de que actuar en una sola dirección sea suficiente. No se conoce cuál es la composición del equipo ideal, pero posiblemente debería incluir siempre especialistas en nutrición, psiquiatría, psicología, personal de enfermería y dietistas.
El tratamiento incluye la recuperación del estado nutricional, para lo que se utilizarán programas dietéticos supervisados y, cuando sea necesario, suplementos nutricionales o nutrición enteral, y el soporte psicológico a través de un psicoterapeuta con una adecuada relación de empatía con el paciente, con terapia cognitivo-conductual.
Se aconseja que la intervención psicológica esté acompañada de monitorización regular del estado físico del paciente, incluyendo peso e indicadores específicos de las complicaciones físicas propias de la AN. Es importante tener conciencia de la elevada morbilidad de la AN y, por tanto, de la necesidad de monitorización continuada del estado físico-nutricional de estos pacientes, por los que es necesario el trabajo en equipo:
- El objetivo del tratamiento nutricional es reducir riesgos, aconsejando ganancia de peso y hábitos de alimentación saludables, para reducir síntomas relacionados y facilitar la recuperación psíquica y física.
- Las terapias psicológicas a considerar en el tratamiento de la AN incluyen la terapia cognitiva analítica, la terapia cognitiva conductual, psicoterapia interpersonal, terapia psicodinámica focal y terapia familiar.
- El consejo dietético no debe ser utilizado como único tratamiento en la AN.
- Hacer una valoración multidisciplinar.
- En caso de que el paciente precise hospitalización, se recomienda, siempre que esto sea posible, que se realice en una unidad específica de TCA. Si no fuera posible, el paciente sería ingresado en plantas de psiquiatría o médicas con consulta a un especialista en TCA. Si existe un riesgo vital, el ingreso debe realizarse en plantas médicas hasta la estabilización del paciente y entonces ser transferidos a una unidad especial de TCA para continuar con el tratamiento nutricional y psiquiátrico. El alta hospitalaria debe producirse cuando el paciente está estable clínicamente y tiene un estado nutricional adecuado para revertir el deterioro cognitivo producido por el ayuno y se pueda beneficiar entonces de tratamiento en hospital de día o ambulatorio.
- No existe evidencia sobre cuál es el mejor tratamiento para mantener el peso cuando el paciente está en tratamiento ambulatorio tras un alta hospitalaria. El consejo nutricional no debe ser el único tratamiento. El tratamiento multidisciplinario que incluya terapia cognitivo-conductual y consejo nutricional parece ser la mejor opción a falta de más estudios que así lo demuestren.
- El seguimiento y evaluación del tratamiento deben incluir parámetros nutricionales, clínicos y psicológicos. En todas las etapas del tratamiento es fundamental la relación estrecha con los terapeutas para mejorar la adhesión al tratamiento.
- Aportar soporte con educación terapéutica (psicoeducación) en todas las fases del tratamiento y de forma más intensa cuando el paciente está estabilizado clínicamente y se ha recuperado de los efectos del ayuno sobre la función cognitiva.
- El seguimiento a largo plazo por equipos multidisciplinares disminuye la tasa de recaídas y la necesidad de ingresos hospitalarios.
De un documento elaborado por la Agencia Americana de Investigación y Calidad (AHRQ), que valora la evidencia y la calidad en el manejo de los desórdenes de la alimentación, se extraen algunas de la siguientes conclusiones 140:
No existe evidencia de que el tratamiento farmacológico tenga algún resultado en el tratamiento de la AN. En relación con el tratamiento psicológico, la terapia cognitivo-conductual evita las recaídas en pacientes adultos con AN después de la restauración del peso, pero no existe evidencia de que este resultado se pueda extender al momento en el que el paciente esté con bajo peso.
No existe un soporte de evidencia para recomendar terapia familiar para adultos con AN. En niños y jóvenes la terapia familiar focalizada en el control parental de la renutrición es eficaz. Se ha demostrado que la terapia familiar fue superior a la terapia individual para adolescentes con duración corta de la enfermedad con un grado de evidencia moderada.
No existen estudios bien diseñados que evalúen la eficacia de tratamientos combinados con medicación y psicoterapia. Son necesarios, por tanto, futuros estudios dirigidos a la combinación de distintos tratamientos para individuos con AN.
Los resultados de la literatura muestran de forma clara y consistente que el riesgo de muerte es significativamente mayor en la población con AN comparando con la población general. Pero el riesgo de muerte de estos pacientes no solo se relaciona con el bajo peso y otros problemas físicos, sino también con el elevado riesgo de suicidio.
La intervención multidisciplinar en pacientes ingresados, en hospital de día o en seguimiento ambulatorio, no queda reflejada en los estudios. La mayoría de los estudios se realizan en actuaciones con un equipo único y no multidisciplinar. Y cuando la actuación es multidisciplinar, este componente fue una variable para la que los pacientes no fueron randomizados. Se necesitan estudios dirigidos a los posibles efectos terapéuticos beneficiosos del trabajo de los equipos multidisciplinares.
Otro aspecto que no se ha tenido en cuenta en los distintos estudios realizados en AN es distinguir cuándo se hace tratamiento en pacientes, antes o después de la recuperación del peso, y tampoco se ha valorado cuál es el mejor tratamiento para la renutrición. Además, tampoco se sabe si la medicación y la terapia comportamental tienen diferentes resultados dependiendo del estado nutricional del paciente. Dado que el bajo peso y la desnutrición pueden interferir con la eficacia de la medicación y la capacidad cognitiva para administrar psicoterapia, sería deseable realizar estudios que nos permitieran conocer cuál es el momento óptimo para administrar medicación y psicoterapia según la recuperación del peso y el estado nutricional.
ÁMBITO DE TRATAMIENTO
El ámbito para el abordaje terapéutico de los pacientes con TCA sigue siendo controvertido; existe escasa evidencia sobre cuál es el ámbito de tratamiento adecuado en cada caso. La mayoría de las guías y consensos de expertos coinciden en que el tratamiento ambulatorio debe ser la primera línea de tratamiento 8,62. La hospitalización en la AN se debe llevar a cabo en situaciones de inestabilidad aguda tales como hipotermia, anormalidades electrolíticas, arritmia cardiaca, y en esta situación la hospitalización es esencial para prevenir la mortalidad asociada a AN 149. La decisión acerca de cuál es el ámbito de tratamiento adecuado en los TCA dependerá del tipo de trastorno, del nivel de riesgo, de las complicaciones físicas y psicológicas, y de las preferencias del paciente.
El tratamiento debe plantearse de forma escalonada entre los distintos niveles asistenciales. Existe aún mucho debate sobre la necesidad de tratamiento de algunos o de todos los pacientes en unidades especializadas en TCA.
Muchos pacientes con AN requerirán tratamiento por largos periodos de tiempo y se moverán entre distintos niveles asistenciales (atención primaria y especializada), de consultas externas a hospitalización, entre servicios médicos y psiquiátricos, entre unidades de adolescentes y servicios de adultos. Es importante que los puentes de unión y la comunicación sean buenos entre los distintos servicios y niveles asistenciales y que exista una clara delimitación de responsabilidades. En general, podemos decir que el tratamiento debe desarrollarse en el ámbito menos restrictivo posible y que mejor se adapte a las preferencias de nuestros pacientes.
Las guías australianas 62 aconsejan:
- El tratamiento se debe desarrollar en el ambiente menos restrictivo posible. La mayoría de los pacientes pueden ser tratados de forma ambulatoria.
- El tránsito entre distintos niveles asistenciales y servicios se debe de hacer de forma escalonada y coordinada.
- La hospitalización se reserva para complicaciones médicas con riesgo para la vida, pérdida severa de peso y otras complicaciones incontroladas.
La Guía NICE 8 aconseja:
- La mayoría de los pacientes con AN deben ser tratados en consulta externa.
- El tratamiento en el medio hospitalario o en el hospital de día debe ser considerado en aquellos pacientes que no mejoran con el tratamiento en consulta externa o para aquellos con riesgo de suicidio o autolesiones.
- Si el tratamiento debe ser en el hospital, han de tenerse en cuenta las distancias para que los padres y cuidadores puedan seguir implicados en el tratamiento, así como para mantener vínculos sociales y ocupacionales que eviten problemas en la transición entre servicios de atención primaria y secundaria. Esto es particularmente importante en el tratamiento de niños y adolescentes.
- El tratamiento hospitalario en niños y adolescentes con AN debe hacerse en centros con servicios separados para estas edades y con capacidad para ofrecer programas educacionales.
Existen pocos estudios que comparen los resultados del tratamiento de la AN en distintos ámbitos: consulta externa, hospital de día y hospitalización. En un metaanálisis que integra 57 estudios, no se encontró diferencia significativa en los efectos de distintos tipos de tratamiento y el lugar/ámbito del tratamiento 150. En otra revisión sistemática que evalúa ensayos clínicos controlados aleatorios publicados hasta julio de 2015 151 en diferentes ámbitos de tratamiento (pacientes hospitalizados, hospitalización parcial y ambulatoria), se identificaron cinco estudios: dos comparando el tratamiento hospitalario frente al tratamiento ambulatorio, un estudio que comparó diferentes duraciones del tratamiento hospitalario, uno comparando el tratamiento de pacientes hospitalizados frente al hospital de día y el último comparó hospital de día frente al tratamiento ambulatorio. No hubo diferencia en los resultados del tratamiento entre los diferentes ámbitos y diferentes duraciones del tratamiento hospitalario. Tanto el tratamiento ambulatorio como el tratamiento en hospital de día fueron significativamente más baratos que el tratamiento hospitalario. El tratamiento hospitalario breve seguido de atención ambulatoria también era más barato que la atención hospitalaria prolongada para la normalización del peso. Existen, por tanto, razones para indicar un tratamiento en entornos menos restrictivos, pero se necesita más investigación para identificar cuál es el mejor escenario para este tratamiento.
Un informe sobre evaluación de tecnología sanitaria publicado en el 2010 152 evalúa la efectividad clínica y el coste-efectividad de los tratamientos para adolescentes con AN realizados en hospitalización vs. consulta externa con tratamiento en unidades generales de salud mental, frente al tratamiento en unidades especializadas, incluyendo la aceptación del paciente. La adherencia al tratamiento fue menor en los pacientes hospitalizados. El tratamiento ambulatorio especializado es el más coste-efectivo comparado con las otras dos modalidades. La satisfacción del tratamiento fue mayor con el tratamiento especializado tanto en consulta externa como en hospitalización.
Estos hallazgos son consistentes con los publicados en la mayoría de las guías para la AN, que sugieren que el tratamiento en consulta externa debe ser el ofrecido a la mayoría de los pacientes y solo considerar ingresos cortos seguidos de tratamiento domiciliario en aquellos pacientes que presenten complicaciones médicas agudas. El análisis económico sugiere que la AN debe ser manejada en servicios especializados con expertos y que además tengan experiencia. Las unidades generales de psiquiatría podrían manejar solo los casos más leves de AN.
Existe otro estudio en el que el tratamiento en hospital o ambulatorio especializado no muestra ventajas sobre el tratamiento ambulatorio en unidades generales de salud mental. En un estudio multicéntrico randomizado 153 que valora la efectividad del tratamiento en 167 adolescentes con AN, comparando por intención de tratar, el tratamiento con ingreso hospitalario, frente a tratamiento ambulatorio en servicios generales de salud mental o en servicios psiquiátricos especializados, no mostró diferencias significativas en los resultados con cualquiera de las modalidades de tratamiento al año y a los dos años. La tasa de adherencia en los pacientes hospitalizados fue menor (50%).
En otro estudio realizado 154 en 14 unidades del Reino Unido (12 de adultos y 2 de adolescentes) en una cohorte de 177 pacientes que se siguió durante 3 años, se comparó tratamiento en hospitalización vs. tratamiento en hospital de día. En el grupo de pacientes hospitalizados la respuesta al tratamiento fue modesta, en particular en el grupo de pacientes con formas prolongadas y severas de la enfermedad. Los adolescentes tenían una mejor respuesta. Aunque el tratamiento de pacientes hospitalizados produce una mejora en la salud física, en los TCA y en el estado de ánimo no hubo diferencias respecto al otro grupo de tratamiento. El comportamiento del cuidador puede influir en la respuesta a la atención hospitalaria, ya que puede mejorar el funcionamiento social y la confianza para el cambio.
En definitiva, con los estudios de los que disponemos no podemos extraer conclusiones definitivas en este terreno y se necesitan más trabajos bien diseñados para ello. En general, podemos decir que los tratamientos ambulatorios siempre que sea posible son preferibles. El ingreso debe reservarse para conseguir una recuperación física y ponderal en situaciones de mayor riesgo o para el tratamiento de complicaciones agudas.
ESTUDIOS DE COSTE-EFECTIVIDAD
La naturaleza de los trastornos alimentarios, con posibles comorbilidades y complicaciones hace que estos pacientes necesiten tratamientos multidisciplinares y que sean grandes consumidores de cuidados médicos y sociales. Los estudios sobre el impacto de los costes en estos casos en los servicios de salud son muy limitados, y, sin embargo, es de gran importancia conocer las opciones de tratamiento más coste-efectivas para cada grupo de pacientes.
En los servicios generales de psiquiatría, el tiempo de estancia hospitalaria es importante en las políticas de salud mental según la Cochrane. En una revisión se sugiere que una estancia corta bien planificada disminuye los reingresos en pacientes con enfermedad mental grave 155. En un informe sobre tecnología sanitaria, que hace una revisión sistemática de la efectividad del tratamiento en distintos ámbitos en pacientes con enfermedades psiquiátricas severas 156, se observa que el tratamiento en el hospital de día es más barato que el tratamiento intrahospitalario con una reducción de costes del 21% al 37%. No hubo evidencia sobre si el tratamiento ambulatorio fue mejor o peor en algún resultado en relación a tratamiento en hospital de día, aunque algunos datos sugieren que el tratamiento en el hospital de día puede ser más caro. En esta revisión se sugiere que son necesarios más estudios bien diseñados sobre coste-efectividad en distintos ámbitos de tratamiento.
En un informe sobre tecnología sanitaria basado en un estudio multicéntrico randomizado sobre coste-efectividad en el tratamiento de adolescentes con AN 152, los resultados muestran que en adolescentes con AN moderada a severa, el tratamiento ambulatorio desde servicios especializados psiquiátricos y médicos es el tratamiento más coste-efectivo. El tiempo de estancia hospitalaria se relaciona inversamente con coste-efectividad.
El tratamiento ambulatorio y en hospital de día es más barato que el tratamiento intrahospitalario. El tratamiento intrahospitalario corto, seguido por tratamiento ambulatorio fue también más barato que el tratamiento intrahospitalario prolongado, continuado por cuidados ambulatorios 151.
La cronicidad y la complejidad de la AN en muchos casos tienen también un importante coste social y familiar. Un estudio realizado en Australia investigó la carga económica de los TCA en los hogares y los costes de la no adherencia al tratamiento 157 a través de un estudio multicéntrico prospectivo y observacional utilizando un cuestionario estructurado. Se reclutaron 90 participantes de dos ámbitos: una clínica en Nueva Gales del Sur y un centro de la comunidad. Cabe destacar que el patrón de gasto varió según el diagnóstico, asociándose la BN con un gasto total más alto (durante tres meses). El 96,7% de los participantes informó de dificultades económicas y el 17,8% presentaba falta de adherencia en relación a los costes. Las personas más propensas a reportar no adhesión relacionada con los costes llevaban más tiempo desde el diagnóstico. Todo ello se asoció a una peor calidad de vida, una percepción más amenazante del impacto de la enfermedad y una mala percepción sobre su estado de salud. Este estudio es el primero en examinar empíricamente y cuantitativamente el incremento de la carga económica que suponen en los hogares los TCA desde la perspectiva del paciente. Esta carga puede contribuir al mantenimiento de la enfermedad para aquellos que experimentan no adhesión relacionada con los costes e influyendo negativamente en los resultados de salud. Las iniciativas actuales para implementar modelos sostenibles e integrados de atención a los TCA deben esforzarse por reducir al mínimo el impacto económico del tratamiento en las familias (Tabla XII). Finalmente comentar que de forma excepcional se han descrito algunas técnicas neuroquirúrgicas, como la estimulación cerebral profunda o como tratamiento experimental en casos muy graves, pero todavía la información al respecto es muy escasa 158.