INTRODUCCIÓN
Los biopéptidos son fracciones derivadas de la hidrólisis enzimática de proteínas 1,2, los cuales, además de cumplir su función nutrimental, son capaces de ejercer efectos biológicos beneficiosos para el ser humano 3. En este sentido, han presentado propiedades antioxidantes, antitrombóticas y antimicrobianas 4. De igual forma, algunos se han considerado como una alternativa para el control de la diabetes mellitus tipo 2 (DM2) 5. Se han desarrollado técnicas para la obtención, identificación y cuantificación de nuevos biopéptidos a partir de proteínas alimentarias, mediante digestión enzimática in vitro, empleando enzimas proteolíticas de origen vegetal, animal y microbiano 6. Los péptidos activos son cadenas de dos, tres y hasta 20 aminoácidos, unidos mediantes enlaces peptídicos. Estas moléculas pueden llegar a presentar diversas funciones en el organismo 7. En este sentido, considerando el control de los niveles glucémicos, se han encontrado diferentes mecanismos de acción por los que aminoácidos, péptidos, hidrolizados proteicos y proteínas ejercen esta función. Entre estos mecanismos se encuentran la inhibición de α-amilasas y α-glucosidasas 5. Los inhibidores de α-glucosidasas retrasan la digestión de carbohidratos por inhibición competitiva de estas enzimas 8. Otros agentes terapéuticos, actualmente usados en el control posprandial de la hiperglicemia causada por la DM2 son los inhibidores de la α-amilasa. Diversas proteínas, particularmente cereales, como el arroz, el trigo y leguminosas como la soya, pueden actuar como inhibidores de estas enzimas 9. Diferentes especies vegetales han sido utilizadas para inhibir los efectos de la diabetes o, por lo menos, presentar una alternativa al consumo o disminución de la ingesta de fármacos. De esta manera, el consumo de semillas como la chía (Salvia hispanica) ha demostrado efectos benéficos en el índice glucémico 10,11, por lo que la finalidad de esta investigación fue evaluar el efecto in vitro de fracciones peptídicas de semillas de Salvia hispanica sobre las enzimas α-amilasa y α-glucosidasa para su potencial uso como antihiperglucemiante en pacientes con DM2 y/o el uso de estas fracciones para la elaboración de alimentos funcionales.
MATERIALES Y MÉTODOS
MATERIALES
Las semillas de chía (Salvia hispanica, L.) fueron obtenidas en un supermercado en el estado de Yucatán, México. Se procesaron 9 kg de semilla entera, limpia y sellada a vacío. Los reactivos fueron de grado analítico, proporcionados por J. T. Baker (Phillipsburg, NJ, USA), Sigma (Sigma Chemical Co., St. Louis, Mo, USA), Merck (Darmastadt, Germany) y Bio-Rad (Bio-Rad Laboratories, Inc. Hércules, CA, USA). Las enzimas Alcalasa® 2.4 L FG y Flavourzima® 500MG fueron obtenidas de Novo Laboratories (Copenhague, Dinamarca). Pepsina y pancreatina fueron de grado analítico y proporcionadas por Sigma (Sigma Chemical Co., St. Louis, Mo, USA).
OBTENCIÓN Y TAMIZADO DE LA HARINA
Para la obtención de la harina, se utilizó la metodología reportada por Vázquez-Ovando y cols. 12. Las semillas fueron trituradas utilizando un procesador de alimentos marca Moulinex® modelo AR9868. La muestra fue desgrasada mediante un sistema Friedrich (Travilab, Yucatán, México) empleando hexano como solvente a 55 °C; se secó a 50 °C durante cinco horas y se trituró. La harina obtenida se sometió a un fraccionamiento en seco. Se utilizó un sistema de agitación y tamizado tipo Ro-Tap® (Laval Lab Inc., Quebec, Canadá) provisto de un tamiz tipo Tyler con una malla 100 (partículas > 140 µm), durante 20 minutos para obtener dos fracciones de diferente granulometría. La menor a los 140 µm fue considerada como la fracción rica en proteína (FRP), la cual fue utilizada para la obtención de los biopéptidos y una fracción rica en fibra (FRF).
HIDRÓLISIS ENZIMÁTICA DE LA FRACCIÓN RICA EN PROTEÍNA
Se utilizaron dos sistemas enzimáticos secuenciales (SES). Para ambos, la concentración fue del 4% de proteína. La hidrólisis del primer SES se realizó mediante una modificación de la metodología reportada por Pedroche y cols. 13, que consistió en una digestión durante 45 minutos a 50 °C con la enzima Alcalasa® (pH 8) seguida de una incubación con el mismo tiempo y la misma temperatura con la enzima Flavourzima® (pH 7, 50 °C, 45 minutos). Para la hidrólisis del segundo SES se empleó una modificación de la metodología reportada por Megías y cols. 14. Se realizó una primera digestión con la enzima pepsina (pH 2), seguida de una digestión con pancreatina (pH 7.5) durante 45 minutos a 37 °C para cada enzima. Las reacciones fueron detenidas por calentamiento a 80 °C durante 20 minutos. El hidrolizado se dejó enfriar y fue centrifugado a 10,947 x g, 5 °C durante 20 minutos. La porción soluble fue ultrafiltrada para obtener las diferentes fracciones peptídicas de diferentes masas moleculares.
DETERMINACIÓN DEL GRADO DE HIDRÓLISIS
El grado de hidrólisis (GH) se determinó según lo reportado por Nielsen y cols. 15, basado en la determinación de grupos amino libres con o-ftaldialdehído (OPA) respecto al total de enlaces peptídicos. Se prepararon una solución de L-serina (1.004 mg/ml) y una curva de calibración con el reactivo OPA. A la FRP se le añadieron 6 ml de HCl 6 N y se incubó durante 24 horas; se añadieron 1,5 ml de reactivo OPA, se agitó y se leyó en un espectrofotómetro VELAB®, modelo VE-5100UV a 340 nm. Se aplicó la siguiente fórmula %GH = (h/htot) x 100, en donde h = concentración de grupos amino libres y hhot = número total de enlaces peptídicos presentes.
FRACCIONAMIENTO POR ULTRAFILTRACIÓN
La porción soluble fue fraccionada mediante un equipo provisto de una celda de ultrafiltración de alto rendimiento (Modelo 2000, Millipore). Se separaron, de acuerdo a Cho y cols. 16, cinco fracciones para cada SES, considerando el PM de las membranas de corte (MWCO): 10 kDa, 5 kDa, 3 kDa y 1 kDa. La muestra pasó a través de una membrana de permeación de 10 kDa, con la ayuda de presión positiva a base de gas N2 y agitación constante. La fracción retenida y la permeada fueron colectadas por separado. La fracción retenida en 10 kDa fue recirculada hasta el máximo de capacidad permitido y filtrada a través de la membrana de 5 kDa. Este proceso de repitió para cada membrana, obteniéndose las fracciones peptídicas ultrafiltradas (FPU): > 10 kDa, 5-10 kDa, 3-5 kDa, 1-3 kDa y < 1 kDa. Las muestras fueron secadas en una liofilizadora (Labconco®, FreeZone, 4.5 USA).
DETERMINACIÓN DEL CONTENIDO PROTEICO DE LAS FRACCIONES PEPTÍDICAS DE CHÍA
A cada fracción ultrafiltrada se le determinó el contenido proteico según Lowry y cols. 17. Las muestras fueron diluidas en agua y adicionadas con NaOH; se agregó un complejo de Na2CO3, CuSO4 y KNaC4H4O6. Se adicionó el reactivo de Folin-Ciocalteu y se realizó una curva de calibración. Se empleó en un espectrofotómetro Velab®, modelo VE-5100UV, a 750 nm de absorbancia para la lectura.
ENSAYO IN VITRO DE LA INHIBICIÓN DE Α-AMILASA
Para evaluar el efecto in vitro de las fracciones sobre la enzima α-amilasa se utilizó la metodología reportada por Dineshkumar y cols. 18. Se consideraron Ac+, control positivo; Ac-, control negativo; As+, muestra con enzima; Ab-, muestra sin enzima (fracción peptídica, 10 mg/ml); AAs+, inhibidor con enzima; y AAb-, inhibidor sin enzima (acarbosa, 2 mg/ml). Se incubaron 200 μl de almidón al 10% a 100 °C durante cinco minutos en un baño de agua VWR® Heating Circulator. A los tubos control se les adicionaron 200 μl de dimetil sulfóxido (DMS) al 50%. A los otros se les adicionaron 200 μl de muestra. Adicionalmente, a los tubos marcados como positivos (+) se les adicionaron 200 μl de la enzima α-amilasa y a los tubos marcados como negativos (-) se les adicionaron 100 μl de buffer (TRIS-Neutro y CaCl2 en agua desionizada). Posteriormente, fueron incubados diez minutos a 37°C y adicionados con 500 μl del ácido 3,5-dinitrosalicílico (DNS) al 0,1%. Se incubaron a 100 °C durante diez minutos más y se les adicionó 1.000 μl de amortiguador. Las muestras fueron leídas a 540 nm de absorbancia, en un espectrofotómetro UV-Vis Thermo Scientific®, modelo Evolution 300. Se utilizó la fórmula: inhibición de la α-amilasa (%) = [(Ac+) - (Ac-) - (As - Ab)] / [(Ac+) - (Ac-)] x 100. Para determinar el IC50 se utilizó una ecuación de regresión lineal, considerando el ajuste de los datos respecto al porcentaje de inhibición vs. las concentraciones de las muestras empleadas. Se utilizó la siguiente fórmula: IC50 = (50-b)/m, donde: 50 = 50% de la inhibición; b = ordenada al origen; m = pendiente de la recta.
ENSAYO IN VITRO DE LA INHIBICIÓN DE ß-GLUCOSIDASA
Se empleó una modificación de la metodología reportada por Dineshkumar 18. Se consideraron las mismas condiciones de los grupos empleados en la inhibición de α-amilasa. La concentración de las fracciones fue de 20 mg/ml y de la acarbosa, de 2 mg/ml. El ensayo consistió en colocar 100 μl de la enzima α-glucosidasa (2 U/ml) a todos los tubos marcados como positivos (+). Por otra parte, se adicionaron 100 μl de la muestra únicamente a los tubos correspondientes a los grupos 2 y 3. Posteriormente, todos fueron incubados en un baño de agua Cole-Parmer® durante cinco minutos a 37 °C; se colocaron 100 μl de p-nitrofenilglucopiranósido N7006-1G Sigma® en todos los tubos de ensayo y se volvieron a incubar a 37 °C durante una hora; se dejaron enfriar y se les adicionó 250 μl de Na2CO31.0 M. Se leyó la absorbancia a 405 nm en un espectrofotómetro UV-Vis Thermo Scientific®. Para calcular la actividad inhibitoria de la α-glucosidasa, así como su IC50, se utilizaron las mismas ecuaciones empleadas en la determinación de α-amilasa.
ANÁLISIS ESTADÍSTICO
Los resultados fueron analizados por triplicado utilizando estadística descriptiva con medidas de tendencia central y de dispersión. Para evaluar el efecto in vitro de las fracciones se utilizó un ANOVA de una vía. La variable independiente fue el tamaño de la fracción peptídica y la variable de respuesta, el porcentaje de inhibición sobre las enzimas α-amilasa y α-glucosidasa. Se empleó una prueba de rangos múltiples de Duncan para identificar diferencias significativas. Los resultados fueron calculados de acuerdo a lo establecido por Montgomery 19 y procesados con el programa estadístico Statgraphics Plus 5.1.
RESULTADOS Y DISCUSIÓN
RENDIMIENTO DE LA HARINA Y CONTENIDO PROTEICO DE LAS FRACCIONES DE CHÍA
Se obtuvieron dos fracciones por vía seca de la harina de chía. La fracción retenida en el tamiz de malla 100 (partículas > 140 µm) fue denominada como la fracción rica en fibra (FRF) y la que atravesó el tamiz (partículas < 140 µm), como la fracción rica en proteína (FRP). Esta última presentó un rendimiento del 10,15% con un contenido proteico del 49,51% en base seca. Adicionalmente, el contenido proteico determinado a partir del filtrado y del retenido para ambos SES puede observarse en la Figura 1. Para las fracciones hidrolizadas con Alcalasa®-Flavourzima®, el mayor contenido fue para la fracción de 10 kDa con 0,679 mg/ml de proteína. La fracción que presentó el menor contenido fue la de < 1 kDa (0,474 mg/ml); sin embargo, no se encontró diferencia estadísticamente significativa (p > 0,05) con las tres fracciones precedentes. Por otra parte, no se encontraron diferencias estadísticamente significativas entre las dos primeras fracciones para pepsina-pancreatina, siendo estas las que presentaron el mayor contenido proteico (0,909 y 0,938 mg/ml) respecto a las fracciones menores y a lo obtenido con Alcalasa®-Flavourzima®.

Figura 1. Contenido proteico de los hidrolizados enzimáticos de Alcalasa®-Flavourzima® y de pepsina-pancreatina, así como de las fracciones peptídicas ultrafiltradas, a partir del concentrado de semillas de S. hispanica. Variable independiente, tamaño de la fracción peptídica (kDa); variable de respuesta, contenido proteico (mg/ml). a-c Letras diferentes en un mismo sistema enzimático, demuestran diferencia significativa (p < 0.05).
El contenido proteico de las fracciones de chía fue mayor que lo reportado por Sandoval-Peraza y cols. 20, quienes experimentaron con fracciones del mismo tamaño a partir de la leguminosa Phaseolus lunatus. Los resultados obtenidos en el estudio con P. lunatus presentaron valores de proteína que fluctuaron entre 0,640 mg/ml para la fracción de > 10 kDa y 0,015 mg/ml para la de < 1 kDa, indicando contenidos menores respecto a los datos presentados en la investigación actual con biopéptidos de chía. De igual manera, Herrera-Chalé y cols. 21, quienes trabajaron con péptidos de Mucuna pruriens, obtuvieron valores de proteína en un rango de 0,280 a 0,088 mg/ml en las fracciones de 5-10 kDa hasta < 1 kDa con pepsina-pancreatina. Estos resultados presentan menor contenido proteico que las mismas fracciones de chía. Los resultados de Herrera-Chalé y cols. 21 presentaron un mayor contenido proteico (1,810 mg/ml) para la fracción de > 10 kDa respecto a la investigación actual. Sin embargo, es importante hacer notar que la chía posee un buen balance de aminoácidos y una calidad proteínica incluso mejor que algunos cereales, semillas oleaginosas 22 y algunas leguminosas, lo que indica que es una buena fuente para obtención de péptidos con actividad biológica. En este sentido, al presentar las semillas de chía los nueve aminoácidos esenciales 23, las fracciones peptídicas que se generan son de buena calidad y los polipéptidos, tripéptidos, dipéptidos y aminoácidos libres que se obtienen pueden ejercer efectos beneficiosos sobre órganos diana.
Los resultados del grado de hidrólisis demostraron que existió diferencia estadísticamente significativa (p < 0,05) en el valor del GH entre los hidrolizados de ambos SES, siendo de 45,70% para Alcalasa®-Flavourzima® y de 63,53% para pepsina-pancreatina. Estos resultados indicaron que el mayor GH fue para este último sistema. Los valores del GH generados por ambos SES indican que los hidrolizados de proteína de chía son considerados extensivos debido a que presentan un valor mayor al 10% de enlaces peptídicos escindidos por hidrólisis enzimática, permitiendo así la obtención de fracciones peptídicas con actividad biológica 13. Esto sugiere que son una fuente potencial de biopéptidos activos. Los mayores valores de pepsina-pancreatina respecto a Alcalasa®-Flavourzima® pudieran deberse a que, según lo establecido por Vioque y cols. 24, tanto la pepsina como la pancreatina están presentes en el tracto digestivo, siendo la pepsina la encargada de degradar proteínas durante la digestión. Su función la efectúa hidrolizando por el extremo del C-terminal de los aminoácidos aromáticos residuales, como el Tyr y Phe. Estos aminoácidos están presentes en el grano entero de la chía en cantidades de 6,10 y 11,61 g/kg, respectivamente 25. Adicionalmente, la pancreatina es una proteasa que incluye las enzimas tripsina, quimotripsina y elasteasa. Estas últimas son consideradas serinoproteasas 21 y poseen en su sitio activo el aminoácido serina, el cual está presente en 9,40 g/kg en la Salvia hispánica 25. La quimotripsina y la elasteasa presentan actividad de endopeptidasas, ya que hidrolizan enlaces internos de los péptidos 26, por lo que estas dos enzimas generaron el mayor GH respecto al obtenido del SES Alcalasa®-Flavourzima®. Los resultados del GH del estudio actual fueron mayores a lo presentado por la especie vegetal M. pruriens 21 para pepsina-pancreatina (40,15%), lo que indicaría que este sistema pudo hidrolizar una mayor cantidad de enlaces peptídicos de la proteína de chía durante el tiempo de reacción, en comparación con los enlaces peptídicos hidrolizados de la leguminosa mencionada. Según el contenido proteico de las fracciones obtenidas, el SES Alcalasa®-Flavourzima® fracciona en dos tamaños: los de cadenas con mayor contenido de aminoácidos, es decir, los retenidos en fracciones de > 10 kDa, y los de cadena más pequeña, que son aquellos péptidos con secuencias de aminoácidos que atraviesan esta membrana. Este comportamiento se debe, probablemente, a que la hidrólisis proteica con exopeptidasas y endopeptidasas, como la Alcalasa® y la Flavourzima® pudieran estar produciendo en su mayoría péptidos pequeños de chía con un peso molecular < 2 kDa 27,28.
INHIBICIÓN IN VITRO DE LA Α-AMILASA
La inhibición in vitro de las fracciones peptídicas (> 10, 5-10, 3-5, 1-3 y < 1kDa) de la chía sobre la enzima α-amilasa puede observarse en la Figura 2. Los resultados demostraron que existió diferencia significativa (p < 0,05) entre las fracciones para un mismo sistema enzimático. Estos valores fueron comparados con acarbosa como inhibidor de referencia. Para el SES Alcalasa®-Flavourzima®, la mayor inhibición (39,90%) fue con la fracción > 10 kDa; sin embargo, esta fue menor a lo obtenido por la acarbosa (93,42%) con la concentración de 2 mg/ml. La menor inhibición (8,29%) fue la presentada por la fracción (< 1 kDa) de este sistema. Los datos demostraron que no existió diferencia significativa (p < 0,05) en las fracciones mayores (> 10 y 5-10 kDa), generadas por pepsina-pancreatina, siendo estas las que presentaron una mayor actividad (85,61 y 79,19%, respectivamente) sobre la α-amilasa. Esto sugiere que, para una mejor inhibición de los biopéptidos de chía, se requiere una determinada secuencia de aminoácidos o que las cadenas polipeptídicas sean más largas, como sucede en el estudio reportado por Zhipeng y cols. 29 con albúmina de huevo, donde se obtuvieron fracciones de cinco o más aminoácidos como QITKPN, AEAGVD y NVLQPS.

Figura 2. Inhibición de la enzima a-amilasa, en fracciones peptídicas, derivadas de la hidrólisis de los SES de S. hispanica. Variable independiente, tamaño de la fracción peptídica (kDa); variable de respuesta, porcentaje de inhibición (%). a-e Letras diferentes, demuestran diferencia significativa (p < 0.05). nd Efecto no detectado a la concentración evaluada (10g/ml para muestras y 2mg/ml para inhibidor).
A pesar de que no se encontraron diferencias estadísticamente significativas en el valor numérico del porcentaje inhibitorio de las fracciones > 10 y 5-10 kDa de chía respecto al efecto causado por la acarbosa (93,52%), es importante señalar que este inhibidor estaba presente en una concentración de 2 mg/ml, mientras que las fracciones de > 10 y de 5-10 kDa presentaron actividad con 10 mg/ml (cinco veces mayor que la acarbosa). Lo anterior indicó que la actividad inhibitoria de los biopéptidos de Salvia hispanica está condicionada por la concentración utilizada, por lo que, al igual que la acarbosa, las fracciones peptídicas de la chía suprimirían la actividad enzimática de la α-amilasa, retrasando por lo tanto el aumento de la glucosa sanguínea 30. Es relevante resaltar que se realizó la evaluación experimental de la inhibición de amilasa a diferentes concentraciones (2, 4, 6, 8, 10 mg/ml), pero únicamente se encontraron efectos inhibitorios para α-amilasa con la concentración de 10 mg/kg, esto es, que a concentraciones menores no se observó inhibición enzimática. Los valores de IC50 para las fracciones peptídicas más promisorias de cada SES fueron seleccionadas de acuerdo al mayor efecto inhibitorio producido. Por lo tanto, el valor de IC50 obtenido reveló que la concentración de las fracciones peptídicas de la chía para causar el 50% de la inhibición enzimática fue de 0,089 mg/ml para la fracción de > 10 kDa del SES pepsina-pancreatina. Para la mayor fracción de Alcalasa®-Flavourzima®, el IC50 fue de 0,543 mg/ml, valor que fue mayor a lo presentado por el anterior SES. Estos resultados sugieren que el mejor tratamiento sería para el sistema pepsina-pancreatina, debido a que el menor valor de IC50 presentado por este sistema indicaría una mayor afinidad de la enzima por los biopéptidos de la chía, los cuales estarían efectuando un mecanismo de acción similar a un inhibidor competitivo.
Un estudio referente a la inhibición enzimática de α-amilasa y α-glucosidasa a partir de extracto acuoso de semillas de uva 30 reveló un valor de IC50 de 0,008 mg/ml para la enzima α-amilasa. De igual manera, una investigación realizada con algas pardas Spatoglossum asperum 31 demostró un IC50 de 0,055 mg/ml, el cual es menor a lo presentado en el estudio actual (0,089 mg/ml), lo que indica que tiene mejor efecto inhibitorio respecto a las fracciones de chía. Una de las ventajas de las fracciones peptídicas de la chía respecto a los extractos de uva y algas anteriormente mencionados radica en que la chía es considerada un grano alimenticio de fácil acceso y amplio consumo, el cual no modifica el sabor de los alimentos. Este efecto es opuesto a lo presentado por las algas S. asperum, que podrían llegar a presentar sabores intensos y desagradables para algún sector de la población. Por otra parte, las semillas de uva no son consumidas directamente como alimento y requerirán estudios de adicionales, por ejemplo, de citotoxicidad para su eventual uso.
INHIBICIÓN IN VITRO DE LA α-GLUCOSIDASA
Los resultados demostraron que existió diferencia significativa (p < 0,05) entre las fracciones peptídicas analizadas, presentando un efecto inhibitorio sobre la enzima α-glucosidasa (Fig. 3). Para el SES Alcalasa®-Flavourzima® se presentó mayor inhibición (33,75%) en la fracción 1-3 kDa, utilizando una concentración de 20 mg/ml de la fracción peptídica de chía. Para el sistema pepsina-pancreatina, los resultados demostraron que la fracción de 1-3 kDa presentó la mayor inhibición (96,91%), que fue estadísticamente diferente (p < 0,05) con las otras. El valor presentado por la acarbosa fue de 46% con una concentración de 2 mg/ml. Esto indicó que fue necesario utilizar una concentración diez veces mayor de los biopéptidos de 1-3 kDa (20 mg/ml) para poder observar el efecto. Esto significa que respecto a la acarbosa, el efecto inhibitorio de las fracciones péptidicas resulta ser menor. De manera análoga a la inhibición de amilasa, se realizó la evaluación experimental de la inhibición de α-glucosidasa a concentraciones de 2, 4, 10, 12, 15, 20 mg/ml, pero solo se encontró actividad inhibitoria a los 20 mg/ml.
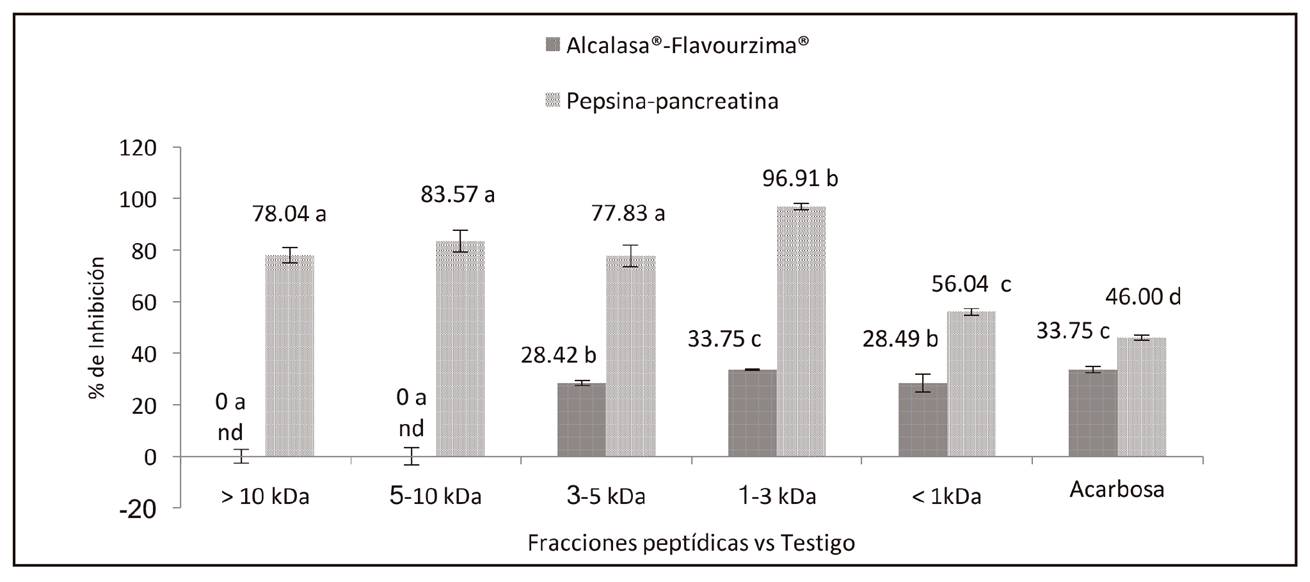
Figura 3. Inhibición de la enzima α-glucosidasa, en fracciones peptídicas, derivadas de la hidrólisis de los SES, de S. hispanica. Variable independiente, tamaño de la fracción peptídica (kDa); variable de respuesta, porcentaje de inhibición (%). a-d Letras diferentes, demuestran diferencia significativa (p < 0.05). nd Efecto no detectado a la concentración evaluada (10g/ml para muestras y 2mg/ml para inhibidor).
El efecto inhibitorio de la α-glucosidasa generado por las fracciones peptídicas de bajo PM posiblemente se deba a la hidrólisis con pepsina-pancreatina. Después de este proceso, las propiedades moleculares de las proteínas cambian, produciéndose una disminución del PM, el aumento de la carga y la liberación de grupos o aminoácidos hidrofóbicos 14. Los aminoácidos apolares como la leucina (1,37 g/kg), isoleucina (0,80 g/kg), tirosina 0,56 (g/kg) y fenilalanina (1,01 g/kg) 23, así como valina, prolina, glicina y metionina 32 presentes en la proteína de la Salvia hispánica pueden interaccionar con la enzima α-glucosidasa en su sitio activo, retrasando la digestión de carbohidratos. En consecuencia, la absorción de la glucosa es completada en un periodo más largo y la hiperglicemia posprandial es reducida 33,30, por lo que las fracciones peptídicas de Salvia hispanica actuarían como inhibidores competitivos de las α-glucosidasas, localizadas en el borde de cepillo de los enterocitos en la luz de las vellosidades intestinales.
Por otra parte, el valor de IC50 para las fracciones de 1-3 kDa obtenidas a partir del hidrolizado con pepsina-pancreatina fue de 5,34 mg/ml, el cual fue ligeramente menor a lo presentado por las fracciones de Alcalasa®-Flavourzima® (5,87 mg/ml). En este contexto, el mayor efecto inhibitorio de las fracciones peptídicas 1-3 kDa de la chía sobre la enzima α-glucosidasa a partir de pepsina-pancreatina concuerda con lo establecido por Bertrand 27 debido a que los biopéptidos obtenidos son de bajo peso molecular, presentando cadenas peptídicas de unos cuantos aminoácidos. El bajo IC50 (5,34 mg/ml) de las fracciones peptídicas a partir de pepsina-pancreatina representa una inhibición de α-glucosidasa ligeramente mayor respecto a Alcalasa®-Flavourzima® (IC50 = 5,87 mg/ml). Sin embargo, si se compara con lo reportado por Yilmazer-Musa y cols. 30 considerando un extracto de semillas de uva (IC50 = 0,001 mg/ml), el efecto inhibitorio de la α-glucosidasa con pepsina-pancreatina resulta ser menor. Por otra parte, un estudio con extracto metanólico a partir de algas pardas Spatoglossum asperum 31 presentó un IC50 = 0,057 mg/ml, lo que indica que estos extractos resultaron ser más potentes en la inhibición enzimática de α-glucosidasa respecto a las fracciones de chía. Lo antes mencionado indica que cada materia prima presenta diferentes actividades biológicas y que el efecto inhibitorio de las fracciones peptídicas de chía es dependiente de la concentración de las mismas.
CONCLUSIONES
El grado de hidrólisis obtenido de los hidrolizados de Salvia hispanica fue considerado como extensivo debido a la cantidad de fracciones peptídicas generadas, representadas por un valor superior al 10%. El efecto inhibitorio de los biopéptidos de la chía se podría atribuir al tamaño de las cadenas aminoacídicas, obtenidas durante la hidrólisis enzimática de los sistemas Alcalasa®-Flavourzima® y pepsina-pancreatina. El mayor efecto de las fracciones peptídicas de la chía sobre la enzima α-amilasa fue con las fracciones mayores obtenidas de la ultrafiltración. En contraste, el mayor porcentaje de inhibición sobre la enzima α-glucosidasa se presentó con las fracciones peptídicas de cadenas con bajo peso molecular.














