INTRODUCCIÓN
Las heridas crónicas son un problema de salud mundial. Solo en los Estados Unidos, 6,5 millones de personas padecen úlceras crónicas, y se estima que existen 7,4 millones de pacientes con úlceras por presión en el mundo 1. En el proceso de curación, un mecanismo de defensa natural del huésped es la secreción de péptidos en la piel. Se ha comprobado que algunos de estos péptidos y proteínas poseen propiedades farmacológicas, entre las que destacan cicatrizante, antimicrobiana e inmunomoduladora 2,3.
La cicatrización de manera natural comienza con la hemostasis, que es seguida por la inflamación, prerrequisito para las fases siguientes como la reepitelización, la formación del tejido de granulación y la contracción de la herida. Los factores de crecimiento, citoquinas y proteasas regulan las funciones celulares durante el proceso de curación de heridas. Entre los procesos más importantes se incluyen modulación en la producción de citoquinas, acción microbicida, migración y proliferación celular, síntesis de colágeno, quimiotaxis y angiogénesis, entre otros 3. Las alteraciones en la producción de estos derivados proteicos son más comunes en padecimientos como la diabetes, las enfermedades venosas o arteriales y las infecciones microbianas que podrían favorecer el establecimiento de heridas crónicas 4.
La mayoría de las investigaciones recientes se han enfocado a la búsqueda de compuestos peptídicos con funciones antimicrobianas e inmunomoduladoras 5,6. Sin embargo, poco se ha estudiado sobre su propiedad cicatrizante de heridas. En general, las fuentes naturales de péptidos con esta característica han sido los anfibios, insectos, mamíferos y, recientemente, plantas 7,8,9. Las semillas de estas últimas son una fuente adecuada de proteína. Entre estas se encuentra la familia de las leguminosas, ya que sus semillas contienen más de 20 g de proteína en 100 g de masa seca 10.
Phaseolus lunatus es una leguminosa conocida comúnmente como frijol lima. Esta especie se consume abundantemente en México y se cultiva en América del Norte, América del Sur, Europa, África oriental y occidental y el sureste de Asia 11. Las semillas contienen aproximadamente 240 g kg-1 de proteína y 630 g kg-1 de almidón 12. El frijol lima (Phaseolus lunatus) ha sido punto de partida para el aislamiento de péptidos y de proteínas como lunatusin de 7 kDa, lunatin de 24.3 kDa y una metalo-glucoproteína de 128 kDa de tipo lectina. Todos estos presentan algunas actividades biológicas, entre las que se encuentran la antimicrobiana, antifúngica, antioxidante, inmunomoduladora contra células cancerígenas y gastroprotectora 13,14,15.
De estas propiedades, la antibacteriana y antioxidante se han conservado y potenciado después de la hidrólisis enzimática y su posterior ultrafiltración, a partir del concentrado proteico. Por ejemplo, se ha comprobado la capacidad antioxidante en mezclas de polipéptidos y péptidos de bajo peso molecular proveniente de la hidrólisis secuencial de pepsina-pancreatina 16. También se ha reportado que las fracciones proteicas menores que 10 kDa del hidrolizado con pepsina poseen actividad antibacteriana contra los microorganismos S. aureus y S. flexneri 17.
Las propiedades ya mencionadas de Phaseolus lunatus y la escasa información sobre la actividad cicatrizante de péptidos de origen vegetal motivó el desarrollo de la presente investigación, la cual consiste en evaluar el efecto cicatrizante in vivo (en ratones) de hidrolizados enzimáticos empleando pepsina, pancreatina, el sistema secuencial pepsina-pancreatina y las fracciones peptídicas de cada hidrolizado, mayores y menores de 10 kDa.
MATERIALES Y MÉTODOS
Las semillas secas de Phaseolus lunatus variedad large fueron compradas en un mercado local de Yucatán, México. Las enzimas usadas fueron Pepsina(r) (P7000) actividad ≥ 250 U.mg-1 y Pancreatina(r) (P3292), actividad ≥ 100 U.mg-1. Las enzimas y los estándares fueron provistos por Sigma-Aldrich (Sigma Chemical Co., St. Louis, MO, Estados Unidos). Los otros productos químicos grado reactivo fueron provistos por JT Baker (Phillipsburg, NJ, Estados Unidos) y Merck (Darmstadt, Alemania).
CONCENTRADO PROTEICO
El concentrado proteico fue obtenido por fraccionamiento en húmedo y precipitación isoeléctrica 18. La harina de Phaseolus lunatus fue disuelta en agua deionizada en proporción 1:6 (m/v). Después de ajustar el pH a 11 con NaOH 2M, la mezcla se agitó durante una hora a 350 rpm (Heidolph, Silent Crusher RZ-1). Posteriormente, la mezcla se filtró para eliminar la fibra con una malla de acero inoxidable de 80 (177 μm) y 100 (147 μm). La mezcla se dejó reposar para la sedimentación de los sólidos (aproximadamente 30 minutos). La proteína soluble se recuperó por decantación y el pH fue ajustado al punto isoeléctrico (4.5) con HCl 2M. La solución fue centrifugada a 1.317 × g por 20 minutos (Mistral 3000i) y el precipitado se secó a -45 °C y 13 × 10-3 mbar. Finalmente, la cantidad de proteína del concentrado fue determinada por el método Lowry.
HIDROLIZADO PROTEICO Y ULTRAFILTRACIÓN
Los hidrolizados enzimáticos del concentrado proteico fueron preparados por digestión individual y secuencial in vitro usando pepsina y pancreatina 19. La proporción enzima/substrato (E:S) fue 1:10 (m/m) en una dispersión acuosa (4% m/v); la dispersión realizada con la enzima pepsina (pH 2) fue ajustada con HCl 2M y la enzima pancreatina (pH 7.5) fue ajustada con NaOH (2M). La temperatura de trabajo fue 37 °C (Tabla 1). El tiempo usado para la reacción de hidrólisis enzimática individual fue de diez minutos y cinco minutos para cada enzima, respectivamente, para la hidrólisis secuencial. La reacción enzimática fue detenida por calentamiento a 80 °C durante 20 minutos. El sobrenadante fue separado por centrifugación a 10 000 × g por 20 minutos a 4 °C (Thermo Scientific(tm) Sorvall RC 6+) y fue dividido en tres partes. Una de ellas fue secada en un liofilizador (Labconco(tm)). Las dos partes restantes se ultrafiltraron bajo atmósfera de nitrógeno utilizando una membrana de 10 kDa. Las fracciones así obtenidas fueron secadas en una liofilizadora (Labconco(tm)) para el subsecuente análisis.
GRADO DE HIDRÓLISIS
El grado de hidrólisis (GH) se calculó por el método espectrofotométrico propuesto por Nielsen 20. Las absorbancias fueron empleadas para hallar los equivalentes de aminos primarios liberados por la hidrólisis. El número total de grupos amino fue determinado en una muestra de aislado proteico, al hidrolizar este último con HCl 6N durante 24 horas a 120 °C en una estufa Fisher Imperial(tm).
El grado de hidrólisis se calculó usando la ecuación de %GH = (h)(100)/htot,
donde:
h = concentración de grupos aminos libres expresada como meq/g de proteína.
htot = número total de aminoácidos del concentrado proteico.
INDUCCIÓN DE HERIDAS Y CICATRIZACIÓN
Las cinéticas de cicatrización se obtuvieron analizando ratones (Mus musculus) CD1, variedad albinos, machos de 2-3 meses de edad, con un peso entre 30-40 gramos, provenientes del Bioterio de la Universidad Autónoma de Morelos (UAEM). Todos los protocolos experimentales fueron aprobados por el Comité Institucional de cuidado Animal de la Facultad de Medicina de la UAEM (número de aprobación: 005/2016) y cumplen con la Norma Oficial Mexicana (NOM-062-ZOO-1999) "Especificaciones Técnicas para el Cuidado y Uso de Animales de Laboratorio" y con todas las regulaciones federales e institucionales aplicables. Todos los ensayos en animales se realizaron de acuerdo con las directrices para el cuidado y uso de animales de experimentación de la Directiva 86/609/CEE del Consejo de la Comunidad Europea. El modelo que se siguió fue el reportado por Gutiérrez Samperio 21, con algunas modificaciones. Se formaron diez grupos al azar de cinco ratones y se alojaron en jaulas separadas. Estos tuvieron acceso al alimento y agua ad libitum. Cada ratón fue anestesiado mediante una inyección de Pentobarbital(r) (vía intraperitoneal) y se dejó reposar hasta que la anestesia hizo efecto (aproximadamente 15 minutos). Después se procedió a rasurar el dorso y se hizo una incisión en forma de círculo con un perforador metálico calibrado en 2 mm de diámetro. Una vez que se indujo la herida, se le aplicó a cada grupo por separado 10 ml de solución de 5,0 mg/ml de un derivado proteico: PanF1 (fracción mayor de 10 KDa proveniente de la hidrólisis con pancreatina), PanF2 (fracción menor de 10 KDa proveniente de la hidrólisis con pancreatina), PanH (hidrolizado con pancreatina), PepF1 (fracción mayor de 10 KDa proveniente de la hidrólisis con pepsina), PepF2 (fracción menor de 10 KDa proveniente de la hidrólisis con pepsina), PepH (hidrolizado con pepsina), Pep-PanF1 (fracción mayor de 10 KDa derivada de la hidrólisis secuencial pepsina-pancreatina), Pep-PanF2 (fracción menor de 10 KDa derivada de la hidrólisis secuencial pepsina-pancreatina). Se utilizaron agua destilada (vehículo) y Kitos Cell(r) como control negativo y positivo, respectivamente. Posteriormente, se revisó la herida desde el día de aplicación de la muestra (día cero) a los días 1, 3, 6, 8 y 10, tomando fotos con una cámara digital acoplada a un estereomicroscopio (Stemi DV4, marca Zeiss(r)), hasta que las heridas hubieron cerrado. La serie de fotografías se analizó y se midió el área de la herida con el programa Image J. Además, se realizaron el análisis de los datos y las gráficas del proceso de cicatrización en el programa Origin.
COMPOSICIÓN DE AMINOÁCIDOS
Los aminoácidos fueron determinados por cromatografía de líquidos de alta resolución (HPLC). Las muestras fueron hidrolizadas con HCl 6N durante 24 h a 110 °C en viales cerrados manteniendo atmósfera de N2. Después de secar la muestra, los aminoácidos se determinaron por HPLC (Agilent 1100 series) y columna en fase reversa (Nova-Pak(r) C 18, 4 mm, Waters, 300 mm × 3,9 mm) a 20 °C. Los solventes usados fueron acetato de sodio (25 mM), conteniendo 0,02% de azida de sodio a pH 6 y acetonitrilo. El flujo de la columna fue de 0,9 ml/min. El triptófano fue determinado por hidrólisis alcalina del concentrado proteico de acuerdo con el método publicado por Yust y cols. 22.
ANÁLISIS ESTADÍSTICO
La evaluación en ratones fue analizada por quintuplicado y las demás pruebas, por triplicado. El análisis de varianza (ANOVA) de una vía se usó para evaluar los grupos experimentales. Las comparaciones de medias múltiples se realizaron utilizando la prueba de Tukey. Los datos fueron expresados como media ± desviación estándar. El software empleado fue Minitab 16 Inc.
RESULTADOS Y DISCUSIÓN
GRADO DE HIDRÓLISIS
El grado de hidrólisis (GH) estima el porcentaje de enlaces peptídicos rotos durante la reacción enzimática y permite una máxima reproducibilidad en la obtención de la bioactividad de los péptidos hidrolizados.
Como se puede observar en la tabla I, los grados de hidrólisis (GH) al utilizar las enzimas pepsina, pancreatina y el sistema secuencial fueron 9,6 ± 1,98, 15,97 ± 3,07 y 10,58 ± 2,34, respectivamente. Estos resultados concordaron con los obtenidos por Bojorquez-Balam y cols. 17, quienes usaron un procedimiento similar al realizado en este trabajo. El menor grado de hidrólisis se observó para pepsina 5,5%, el mayor para pancreatina 8,3% y para el sistema secuencial se obtuvo un valor intermedio de 7,8%.
Al comparar el GH del sistema secuencial pepsina-pancreatina con el reportado por Polanco y cols. 12 se observa un resultado similar al obtenido en esta investigación (GH 12,25%), usando un porcentaje de enzima de 4% con respecto al sustrato. Por otro lado, Sandoval-Peraza y cols. 23 reportaron un GH de 25,12% usando condiciones experimentales similares en un tiempo mayor de 90 minutos. Esto concuerda con lo encontrado por Chel-Guerrero y cols. 24, ya que el GH aumenta al incrementar el tiempo de exposición de la enzima con el sustrato.
EVALUACIÓN MACROSCÓPICA DE LA LESIÓN CUTÁNEA EN RATONES
En esta investigación se estudiaron los efectos en la cicatrización de heridas de los hidrolizados proteicos y fracciones peptídicas de Phaseolus lunatus. Un análisis cualitativo preliminar se muestra en las series de imágenes de la figura 1, donde al día 3 se observa que las heridas con menor diámetro fueron las correspondientes a Pep-PanF1, PanH y PanF1. Aunque el tratamiento con Pep-PanF1 redujo inicialmente el tamaño de la herida de manera considerable, a partir del día 6 no mostró la misma tendencia de reducción. De manera general, el día 6 las heridas que mostraron mayor reducción y que se observaron casi cerradas fueron las tratadas con PanH y PanF1. Por último, el día 10 todas las heridas habían cerrado.

Figura 1 Análisis macroscópico de heridas cutáneas. Los días 0, 3, 6 y 10 con los tratamientos: A. control (agua destilada); B. PanF1; C. PanF2; D. PanH; E. PepF1; F. PepF2; G. PepH; H. Pep-PanF1; e I. Pep-PanF2.
Con el fin de llevar a cabo el análisis cuantitativo del proceso de cicatrización, se midió el área de las heridas mediante el programa Image J. Cada curva de cicatrización fue normalizada respecto a su área basal (en el tiempo 0). En la figura 2 se muestran las curvas ajustadas del área de las heridas con respecto al tiempo, tratadas inicialmente con el hidrolizado de pepsina (PepH) y sus derivados provenientes de la hidrólisis (Fig. 2A): fracción mayor de 10 kDa (PepF1) y menor de 10 KDa (PepF2). Estas se comparan con el control negativo (vehículo: agua destilada) y el agente cicatrizante Kitos Cell(r) (pirfenidona). Este último, como indican Ávila y cols. 25), es un medicamento que bloquea la acción de las citocinas encargadas de regular el proceso de producción de tejido fibrótico (TNFα y TGFβ) y son las responsables de la producción de fibroblastos. Así mismo, disminuye el número de las células inflamatorias.
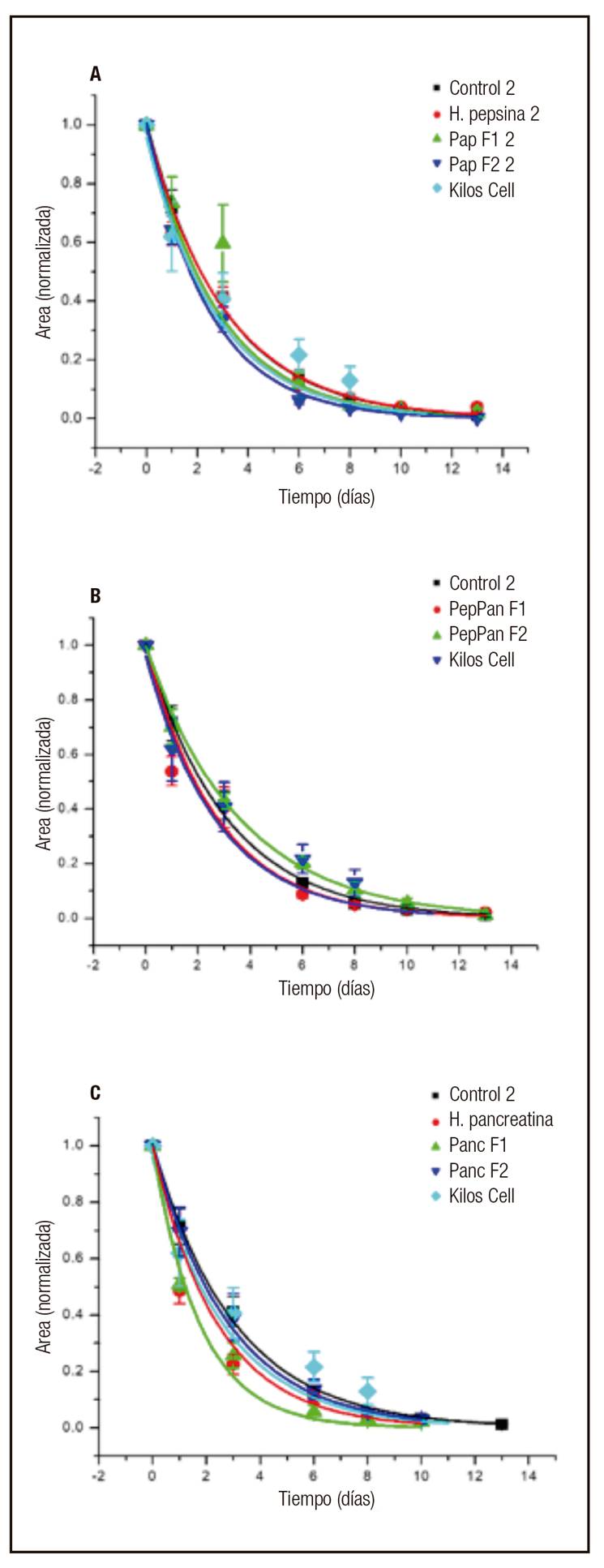
Figura 2 Comportamiento del área de las heridas con respecto al tiempo. Los tratamientos evaluados fueron: A. HPep, pepF1, PepF2; B. Pep-PanF1, Pep-PanF2; y C. HPan, PanF1, PanF2. En cada gráfica se incluye Kitos Cell(r) y el control negativo.
La curva de la fracción PepF2 es la que se encuentra por debajo de todas y, en consecuencia, representa la mayor tasa de reducción del área de la herida en el proceso de cicatrización comparada con los otros tratamientos. Por otro lado, las curvas correspondientes al PepH y al control negativo son las que muestran la menor tendencia de reducción de la herida, y ambas curvas coincidieron en este comportamiento.
En la figura 2B se muestra que la curva de la fracción mayor de 10 KDa (Pep-PanF1) tuvo una tasa semejante a la del control positivo (Kitos Cell(r)); ambas muestran una mayor tasa de reducción del área de la herida y las curvas están por debajo de las que corresponden al control negativo y Pep-PanF2. Esta última fracción mostró la menor tasa de reducción de área respecto a los demás tratamientos.
La figura 2C muestra que la herida tratada con la fracción PanF1 es la que presentó mayor tasa de reducción. Así mismo, la correspondiente al hidrolizado PanH es la más cercana a la fracción PanF1, teniendo en los primeros días medidas de área muy cercanas entre sí. Ambas curvas están por debajo del control positivo. Por el contrario, PanF2 mostró una menor tasa de reducción del área de cierre de la herida con respecto al control positivo. Esta misma tendencia fue observada por Tomioka 26 al evaluar el porcentaje de área de la herida con respecto al tiempo en un modelo en ratas con un área inicial de las heridas de 2 cm, donde se encontró que el péptido SR-0379 acelera la cicatrización, cuya área fue aproximadamente menor del 10% con relación al control a los 13 días.
Para cada grupo se analizó el tiempo en que las heridas redujeron su tamaño en un 80%; los resultados se pueden observar en la figura 3. La comparación de medias de cada tratamiento se realizó con la prueba de Tukey al 95% de confianza. En este análisis, el PanH o hidrolizado de pancreatina fue el tratamiento cuyo grupo presentó mayor velocidad de cicatrización, que fue de 2,86 días y mostró diferencia significativa (p < 0,05) con respecto al control negativo de 5,04 días. Así mismo, la fracción mayor de 10 kDa (PanF1) presentó un resultado similar (3,03 días) al hidrolizado de pancreatina. Los grupos tratados con panH y PanF1 cicatrizaron en un tiempo menor que el control positivo, Kitos Cell(r), aunque estos no presentaron diferencia significativa entre sí (p > 0,05).

Figura 3 Tiempo de cicatrización al 80% de reducción de la herida. Las barras indican ± SE. *PanH presentó diferencia significativa con respecto al control negativo: agua destilada (p < 0,05).
Este comportamiento, de acuerdo con Chalamaiah y cols. 27), pudo deberse a la secuencia aminoacídica de los péptidos resultantes provocada por la hidrólisis de pancreatina. Esta enzima presenta una actividad óptima a pH de 7.5 a 8.0. A este pH se evitan las dificultades relacionadas con la neutralización del medio de reacción y los indeseables cambios en los aminoácidos 28. La enzima pancreatina es, a su vez, un grupo de cuatro enzimas de las cuales tres son peptidasas, tripsina, quimiotripsina y elastasa. Estas enzimas seccionan enlaces peptídicos formando péptidos que en sus residuos terminales contienen en su mayoría aminoácidos hidrofóbicos y básicos, aunque la bioactividad de los péptidos obtenidos dependerá, en gran parte, de su composición aminoacídica, carga, hidrofobicidad, longitud, secuencia y estructura 29. Se ha comprobado que los péptidos originados por la hidrólisis con pancreatina, o algunas de las enzimas que la componen, pueden favorecer la actividad celular en la respuesta inmune, siendo esta característica indispensable durante la cicatrización de heridas. Lo anteriormente expuesto explica el comportamiento obtenido con los hidrolizados de Phaseolus lunatus con pancreatina obtenidos en este estudio. Tal como ha sido reportado en el caso de los péptidos elaborados a partir de la hidrólisis de la proteína del suero de leche con tripsina y quimiotripsina, estos pudieran estar estimulando alguna de las actividades mencionadas por Saint Sauveur 30, como son la proliferación de esplenocitos y la secreción de citoquinas. Otro mecanismo probable de la acción cicatrizante es el reportado por Morris y cols. 31 con el hidrolizado proteico de la microalga Chorella vulgari, obtenido con la enzima pancreatina, que aumenta la actividad de macrófagos, la hematopoyesis y el número de leucocitos y células de exudado y estimula las funciones humoral y celular en ratones.
RESIDUOS AMINOACÍDICOS
La actividad cicatrizante de péptidos ha sido relacionada con la actividad antioxidante y secuestrante de radicales libres 32,33, inmunomoduladora 27,34 y antibacteriana 35. Este hecho se ha adjudicado, entre otros, a los residuos aminoacídicos. Tal es el caso de los aminoácidos histidina, tirosina y glicina que fueron encontrados en péptidos con actividades antioxidante y cicatrizante 33. El primero es un aminoácido básico, el segundo es aromático polar, ambos con características antioxidantes, y el último es un aminoácido hidrofóbico con actividad secuestrante de radicales libres. El hidrolizado de pancreatina y PanF1 contiene estos aminoácidos en porcentajes importantes. El panH contiene 2,88 g de Histidina, 5,39 g de glicina y 4,73 g de tirosina en 100 g de proteína. La fracción F1 de pancreatina contiene 13,14 g de histidina, 6,42 g de glicina y 9,03 g de tirosina en 100 g de proteína (Tabla 2). Otros aminoácidos hidrofóbicos como isoleucina y valina se han localizado en péptidos inmunoactivos y antioxidantes 36.
Tabla II Perfil de aminoácidos de la fracción > 10 kDa (PanF1) y el hidrolizado (PanH) de pancreatina
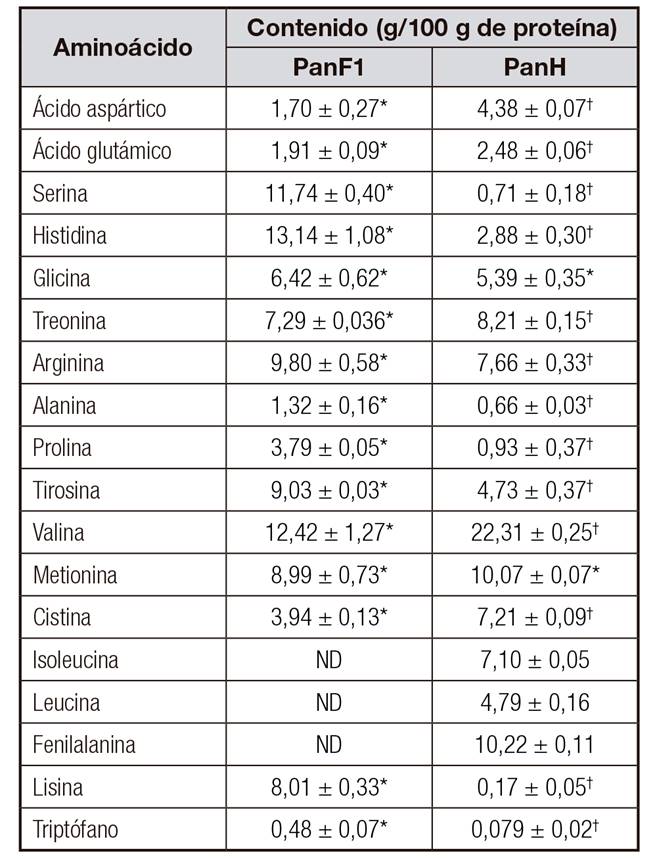
*†Símbolos diferentes en la misma fila indican diferencia significativa (p < 0,05). ND: no detectado. Datos de contenido de aminoácidos en PanF1 (*) estadísticamente diferentes a los datos de PanH (†).
Estos aminoácidos se encuentran en PanH en concentraciones de 7,10 y 22,31 g por 100 g de proteína, respectivamente. Sin embargo, en la fracción mayor de diez, el aminoácido valina se obtuvo en una concentración de 12,42 g por 100 g de proteína y no se encontró isoleucina. Esto último puede explicar el hecho de la mayor actividad del PanH con respecto a su fracción mayor de 10 (PanF1). Por último, los aminoácidos lisina, arginina (aminoácidos básicos) y leucina (hidrofóbico) se han hallado de manera repetida en las cadenas peptídicas con actividad antioxidante 36 antibacteriana y cicatrizante 37. Como se puede observar en la tabla 2, el hidrolizado de pancreatina contiene lisina, leucina y arginina en 0,17, 4,79 y 7,66 g por 100 g de proteína, respectivamente, y en la fracción PanF1 el contenido de lisina es de 8,01 g y el de arginina, de 9,80 g por 100 g de proteína.
De los aminoácidos mencionados anteriormente, histidina, glicina, arginina, tirosina y lisina se encuentran en mayor cantidad en la fracción mayor de 10 con respecto al hidrolizado. Esto puede indicar que forman parte de péptidos de alto peso molecular en el hidrolizado y en la fracción retenida (> 10 kDa). Como en el hidrolizado (PanH) y en la fracción > 10 kDa se obtuvo la mayor velocidad de cicatrización, se cree que los péptidos de alto peso molecular que contienen aminoácidos con características antioxidantes, antimicrobianas e inmunomoduladoras influyen en la cicatrización de heridas. Este resultado coincide con el obtenido por Roblet C y cols. 38, donde se encontró que los hidrolizados y las fracciones de peso molecular alto de proteína de soya presentaron un efecto antiviral al observar inactivación del virus murine norovirus-1 (MNV-1) e inmunomodulador al producir citocina en células no estimuladas. De acuerdo a la literatura, las propiedades antioxidantes destacan en los aminoácidos tirosina e histidina. Aunque el mecanismo de estos no ha sido dilucidado y definido perfectamente, la actividad de la histidina puede ser atribuida a la habilidad donante de hidrógeno y/o quelación de los iones metálicos del grupo imidazol 39. Por otro lado, el mecanismo propuesto para la capacidad antioxidante de la tirosina plantea al secuestro de radicales libres vía donación de un átomo de hidrógeno del grupo hidroxilo 40.
A pesar de su diferente secuencia de aminoácidos, la vasta mayoría de péptidos con características antimicrobianas comparten carácter catiónico, debido a la prevalencia de residuos básicos como lisina y arginina 41 y una estructura anfipática imitando el ambiente de membrana. El mecanismo de acción antimicrobiana puede ser debido a una interacción electrostática con los fosfolípidos de membrana 3 seguido de la desintegración/perturbación de la membrana y resultando en muerte celular 42. Otros mecanismos antimicrobianos han sido propuestos tomando como clave el proceso celular. Estos incluyen la síntesis de ADN y de proteína, plegamiento de proteína, actividad enzimática y síntesis de la pared celular 43.
En el hidrolizado PanH y en la fracción mayor de 10, los aminoácidos glicina y metionina se encuentran en cantidades sin diferencia significativa. Es decir, que estos pueden encontrarse tanto en péptidos de alto peso molecular como en péptidos < 10 kDa. Los residuos de glicina pueden acomodarse en el interior hidrofóbico de las proteínas, lo cual le confiere flexibilidad en el pliegue de las proteínas con tendencia a formar hélices y permite versatilidad en la estructura de los receptores 44. De hecho, los péptidos antimicrobianos con baja citotoxicidad requieren un ambiente membranoso para inducir el plegamiento adecuado y a menudo tienen un pliegue inducido por prolina o glicina en el medio de la hélice 43. Los residuos más frecuentes encontrados en los péptidos con actividad inmunomoduladora son aminoácidos hidrofóbicos como glicina (Gly), valina (Val), leucina (Leu), prolina (Pro), fenilalanina (Fen), aminoácidos cargados negativamente, ácido glutámico (Glu) y el aminoácido aromático, tirosina (Tir) 36,45,46.
Aunque el mecanismo preciso del efecto inmunomodulador de los péptidos provenientes de alimentos no está totalmente entendido, se sabe que estos ocurren principalmente a través de la activación de los macrófagos, la simulación de la fagocitosis, el incremento en la cuenta de leucocitos, el aumento de la inducción de los moduladores inmunes como las citoquinas, inmunoglobuinas y óxico nitroso (NO), la estimulación de las células NK (asesinas naturales), el efecto estimulatorio de células de esplenocitos, la activación de la transcripción del factor nuclear-kappa B (NF-κB), la activación mitogénica de la vía dependiente de la proteína quinasa (MAPK) y la inhibición en los mediadores proinflamatorios 27,47.
En un estudio realizado por Matilla y cols. 44) en 2002 se observó el efecto del aminoácido glicina como reductor en la producción de especies reactivas de oxígeno. Al analizar los resultados en un grupo de ratas, después de provocar shock hemorrágico y posterior reinfusión, se observó la prevención en el descenso de la actividad de las enzimas hepáticas antioxidantes superóxido dismutasa (SOD), glutatión peroxidasa (GPx) y catalasa (CAT). Asimismo, revirtió el incremento de los ARNm de las mismas. El efecto de la glicina sobre las actividades de las enzimas antioxidantes podría derivarse del bloqueo ejercido por este aminoácido sobre la activación de las células de Kupffer, productoras de radicales libres tanto de oxígeno como de nitrógeno y de citoquinas, cuyas concentraciones se incrementarían en condiciones de daño por isquemia/reperfusión provocado por shock hemorrágico agudo. Dicho bloqueo impediría la actuación de estos factores sobre las enzimas antioxidantes.
Los aminoácidos que solamente se encuentran en el hidrolizado y no en la fracción mayor de 10 kDa fueron isoleucina, leucina y fenilalanina. Así mismo, los aminoácidos ácido aspártico, ácido glutámico, treonina, valina y cistina se observaron en mayor concentración en el PanH que en la fracción F1 de Pan. Esto hace referencia a aminoácidos que podrían encontrarse mayormente en los péptidos menores de 10 kDa. De estos aminoácidos anteriormente mencionados, los aminoácidos hidrofóbicos ramificados como isoleucina, leucina y valina tienen propiedades antioxidantes y de cicatrización de heridas 36,39,40. Por otro lado, los residuos de ácido glutámico, ácido aspártico, cisteína y fenilalanina facilitan las actividades inmunomoduladoras 27. Los péptidos de PanH que contienen los aminoácidos antes mencionados, de peso molecular menor de 10 kDa, podrían haberse expresado junto con los péptidos mayores de 10 kDa activos y ejercer un efecto cicatrizante ligeramente superior que la fracción PanF1.
CONCLUSIÓN
En los ensayos in vivo de los hidrolizados del concentrado proteico de Phaseolus lunatus obtenidos de pancreatina y pepsina, sus fracciones peptídicas mayores y menores de 10 kDa y las fracciones del sistema secuencial pepsina-pancreatina, se encontró que las que presentaron mayor actividad cicatrizante fueron el hidrolizado de pancreatina y la fracción mayor de 10 kDa de pancreatina. Así mismo, se determinó una presencia importante de aminoácidos, principalmente residuos hidrofóbicos y básicos, que pueden contribuir a la cicatrización de heridas y que también han sido asociados con potencial actividad antioxidante y antibacteriana.















