INTRODUCCIÓN
El nacimiento prematuro supone una interrupción brusca del suministro de nutrientes a través de la placenta que garantizaba el crecimiento fetal durante la vida intrauterina.
Existe controversia y una importante variabilidad entre las distintas unidades neonatales en relación a la forma de nutrir al recién nacido prematuro (RNPT) 1,2. Sin embargo, cada vez más estudios están demostrando que la ingesta de nutrientes debe restablecerse lo más precozmente posible tras el nacimiento, sobre todo en los RNPT más inmaduros, principalmente aquellos de 32 o menos semanas de gestación (SEG) y/o peso de recién nacido (PRN) menor o igual a 1.500 gramos, mediante estrategias de nutrición parenteral (NP) precoz y agresiva que pretenden evitar el estado catabólico que acontece en los primeros días de vida 3,4,5.
La tendencia actual es intentar conseguir un aporte de nutrientes para alcanzar un crecimiento extrauterino similar al que hubiera tenido dentro del útero durante el tercer trimestre de la gestación, ya que se ha visto que una velocidad de crecimiento adecuada en las primeras semanas de la vida implica un mejor neurodesarrollo y crecimiento posterior. Sin embargo, conseguir este ritmo de crecimiento habitualmente es difícil durante las primeras semanas de vida, al verse limitado por la inmadurez del sistema metabólico y digestivo y por las morbilidades asociadas. Así, la mayoría de RNPT, a pesar de nacer con un percentil de peso adecuado a su edad gestacional, son dados de alta hospitalaria con un percentil inferior 5,6.
Cada vez existe menos controversia sobre la seguridad del inicio precoz de la nutrición enteral. Además, se ha demostrado que la ausencia de alimento en el tubo digestivo puede producir atrofia de la mucosa y las vellosidades 7,8,9. De esta manera, el objetivo nutricional debe ser alcanzar lo más precozmente posible una nutrición enteral completa (140-160 ml/kg/día) durante los primeros días de vida (9,10), manteniendo el soporte parenteral hasta lograr dicho objetivo. Lo que se intenta es encontrar un equilibrio entre minimizar la NP para disminuir los riesgos asociados a su mantenimiento prolongado y a la presencia de catéteres centrales y no realizar aumentos enterales demasiado rápidos que pudieran, hipotéticamente, incrementar el riesgo de enterocolitis necrosante (ECN) 9,11,12.
En los últimos años, diversos estudios han demostrado que el incremento rápido de volumen de nutrición enteral (20-35 ml/kg/día) comparado con el incremento lento (menos de 20 ml/kg/día) no aumenta el riesgo de ECN 10,13,14.
En la etiopatogenia de la ECN se ha implicado la alimentación con fórmula artificial, cada vez menos frecuente debido a la extensión de los bancos de leche materna, así como otros factores como la isquemia (principalmente asociada a asfixia perinatal, insuficiencia placentaria en pacientes con restricción del crecimiento intrauterino, pacientes con shock hemodinámico o ductus arterioso persistente), el sexo masculino, la ingesta materna de tóxicos como cocaína, la ingesta de soluciones hiperosmolares, etc. 15,16.
En el ductus arterioso persistente (DAP), la isquemia producida por una disminución del flujo diastólico a nivel intestinal y el tratamiento farmacológico (ibuprofeno o indometacina) podrían ser, entre otros, los factores implicados en un aumento del riesgo de ECN y una peor tolerancia a la nutrición enteral 17,18.
En los últimos años, se ha estudiado la utilidad de algunos biomarcadores, entre ellos el propéptido nautriurético cerebral (proBNP), en el diagnóstico y la evolución del DAP, y se ha encontrado también una asociación con diferentes morbilidades que clásicamente se han asociado a DAP, como la displasia broncopulmonar (DBP) o la retinopatía de la prematuridad (ROP) 19,20,21,22,23.
En base a estos resultados, el objetivo del presente estudio es analizar la posible asociación de los niveles de proBNP como marcador bioquímico de la repercusión del DAP con la tolerancia enteral del RNPT, el riesgo de ECN y la ganancia ponderal en las primeras semanas de vida.
PACIENTES Y MÉTODOS
Se realizó un estudio retrospectivo observacional, descriptivo y analítico, que incluyó RNPT de menos de 1.500 g de peso al nacimiento y/o menos de 32 SEG, ingresados en la Unidad de Cuidados Intensivos Neonatales del Hospital Infantil Miguel Servet de Zaragoza (España) entre el 1 de junio de 2013 y el 31 de mayo de 2016. Desde 2013, se determinan de forma sistemática en nuestra unidad los niveles de proBNP de forma paralela al cribado ecocardiográfico del DAP.
El protocolo de actuación para el despistaje del DAP en nuestra unidad incluye la realización de estudio ecocardiográfico en las primeras 48-72 horas de vida en todos los recién nacidos con menos de 28 SEG y/o PRN menor a 1.000 g y en aquellos que, con mayor edad gestacional o peso, presentan sospecha clínica (empeoramiento de la situación hemodinámica o respiratoria con aumento de necesidad de soporte ventilatorio, soplo a la auscultación, acidosis metabólica) o factores de riesgo pre o posnatales de DAP como sobrecarga hídrica, ausencia de maduración con corticoides, hijo de madre diabética o sepsis. Asimismo, incluye la realización de extracción analítica previa al inicio del tratamiento, con determinación de hematimetría, iones, creatinina y proBNP, coincidiendo en el tiempo con el estudio ecocardiográfico. Las muestras se analizan con el kit NT-proBNP (Roche Diagnostic(r)) y los resultados se expresan en pg/ml. La determinación de proBNP no precisa incrementar la cantidad de muestra sanguínea realizada habitualmente para la determinación bioquímica de rutina.
Fueron excluidos los RNPT a los que no se les realizó la evaluación ecocardiográfica y bioquímica (por fallecimiento previo al despistaje del DAP o por ser mayores de 28 SEG y 1.000 g sin sospecha clínica de DAP), aquellos que presentaban otra patología cardiaca importante que generase sobrecarga circulatoria (salvo el DAP), aquellos con signos ecocardiográficos de hipertensión pulmonar que contraindicaban el tratamiento en el momento de la evaluación ecocardiográfica y los que presentaron sepsis clínica-analítica en el momento del estudio cardiológico y analítico. Se definió sepsis clínica-analítica como el aumento de marcadores de infección acompañado de síntomas (alteraciones en la temperatura, vómitos, irritabilidad, taquipnea o taquicardia y episodios recurrentes de apnea). El motivo de exclusión se debe a que los niveles de proBNP pueden encontrarse aumentados en situaciones de infección sistémica sin presentar DAP.
El protocolo de estudio fue aprobado por el Comité Ético de Investigación Clínica de Aragón.
Para la obtención de los datos se realizó una revisión de las historias clínicas de los pacientes, recogiendo variables antenatales y del periodo neonatal inmediato (tipo de embarazo [único o gemelar], sexo, motivo del parto, administración de corticoides prenatales, edad gestacional, antropometría al nacimiento, test de Apgar, reanimación en la sala de partos, administración de surfactante endotraqueal), variables de evolución neonatal (soporte respiratorio y hemodinámico, desarrollo de DBP, hemorragia intraventricular [HIV], insuficiencia renal, sepsis tardía, ROP y exitus), variables de evolución nutricional (días para alcanzar la nutrición enteral total, días de NP, desarrollo de ECN, perforación intestinal, cirugía de ECN, ganancia ponderal), datos de ecografía cerebral y determinaciones analíticas (hemograma, iones, creatinina y niveles seriados de proBNP).
ANÁLISIS ESTADÍSTICO
Todos los datos se incluyeron en una base de datos con el paquete estadístico SPSS Statistics 21.0.
Se realizó un estudio descriptivo para conocer frecuencias, medidas de tendencia central y medidas de dispersión. El estudio analítico se realizó mediante el test de Kolmogorov-Smirnov y el test de Saphiro-Wilk se empleó para análisis de normalidad de las variables cuantitativas. Para la comparación de dichas variables entre los subgrupos se utilizaron el test de la U de Mann-Whitney (dos muestras con datos independientes), el test de Wilcoxon (dos muestras con datos relacionados) y el test de Kruskal-Wallis (varias muestras con datos independientes). Para las variables cualitativas se utilizó el test de Chi-cuadrado o test exacto de Fisher.
Con las variables que resultaron significativas en el análisis univariante se realizó posteriormente un análisis multivariante mediante regresión logística.
RESULTADOS
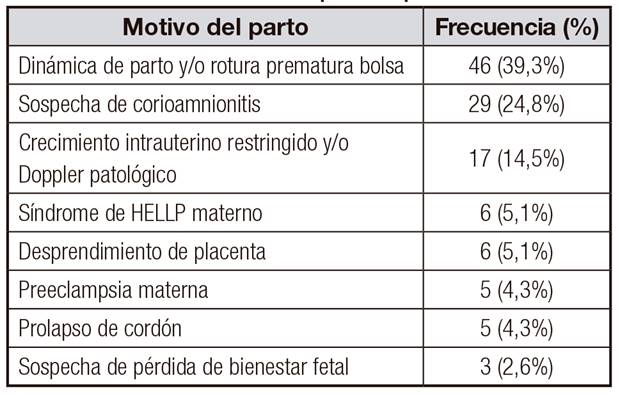
Se obtuvo una muestra de 117 pacientes, con una edad gestacional media de 27,79 semanas (rango 24-35,14) y un PRN de 949,71 g (470-1.700). Las causas del parto prematuro y las características descriptivas de la muestra se exponen en las Tabla 1 y Tabla 2.
Tabla II Características descriptivas de la población a estudio. Expresado en n (%)
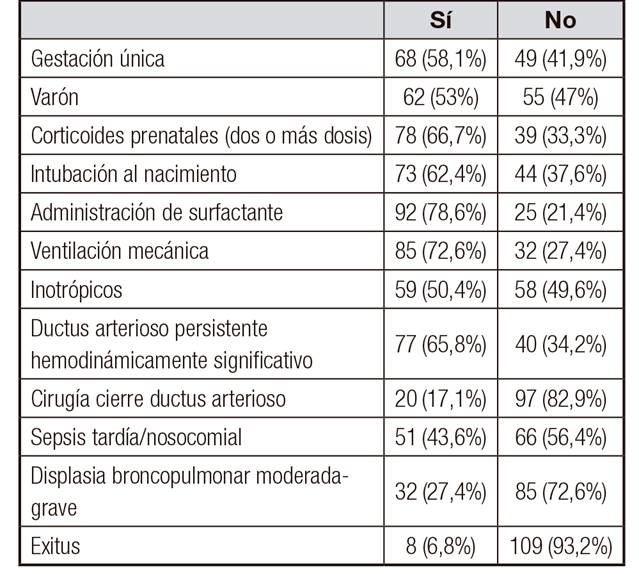
Displasia broncopulmonar moderada-grave: necesidad de soporte respiratorio u oxígeno a las 36 semanas de edad posmenstrual.
El tiempo medio necesario para alcanzar la nutrición enteral total y suspender la NP fue de 18,6 días (rango 8-122). Los pacientes que requirieron ventilación mecánica (VM) precisaron más tiempo para alcanzar la tolerancia enteral completa (VM 23,07 días [8-108]; no VM 8,68 días [8-38]; p < 0,001), así como los que recibieron ventilación de alta frecuencia oscilatoria (VAFO) (VAFO 33,48 días [6-108]; no VAFO 14,32 días [8-64]; p < 0,001). No se encontró asociación entre el tiempo para alcanzar la nutrición enteral y el resto de variables de evolución neonatal.
En 31 pacientes (26,5%) hubo una sospecha inicial de ECN por episodios de distensión abdominal con afectación de la tolerancia digestiva que motivó dejar a dieta absoluta, iniciar antibioterapia y reiniciar o prolongar la NP. Se confirmó la sospecha de ECN por imagen radiológica, afectación analítica o por requerimiento de cirugía abdominal en once de estos pacientes (9,4%). De los pacientes con ECN, siete (63,6%) precisaron intervención quirúrgica (seis presentaron perforación intestinal y uno, empeoramiento clínico-analítico a pesar de tratamiento antibiótico).
Se analizó si existía asociación entre la ECN y otras variables de evolución neonatal, y se halló de forma estadísticamente significativa con el PRN (no ECN 977,5 gramos, rango 470-1.700; ECN 680 gramos, rango 520-890; p < 0,001), con la edad gestacional (no ECN 28 semanas, rango 24,29-35,14; ECN 26 semanas; rango 24-28; p < 0,001), con el soporte inotrópico previo (inotrópicos 16,9%; no inotrópicos 1,7%; p = 0,003), con la necesidad de VM (sí 12,9%; no 0%; p = 0,032) y con la necesidad de VAFO (sí 21,2%; no 4,8%; p = 0,004).
Se estudió si existían diferencias estadísticamente significativas entre los pacientes que presentaron un DAP hemodinámicamente significativo (DAP-HS) y los que no, en las variables relativas a la evolución de la tolerancia enteral y enterocolitis necrotizante. Los resultados se muestran en la Tabla 3.
Tabla III Evolución digestiva del grupo con ductus arterioso persistente hemodinámicamente significativo (DAP-HS) frente al grupo sin DAP-HS. Variables cualitativas expresadas en n (%) y cuantitativas en mediana (rango)

Asimismo, se analizó la relación entre estas variables y los valores de proBNP a las 48-72 horas de vida y se hallaron diferencias estadísticamente significativas en la sospecha inicial de ECN (no sospecha: 14.747 pg/ml, rango 654-171.753; sospecha: 56.597,35 pg/ml, rango 3.013-247.986; p < 0,001) y en la ECN confirmada (no ECN 12.189,5 pg/ml, rango 654-247.986; ECN 41.445 pg/ml, rango 15.275-166.172; p < 0,001) (Fig. 1). No se encontró asociación entre el resto de variables de evolución gastrointestinal y los valores de proBNP.
Mediante curva ROC se calculó el punto óptimo de corte para identificar los pacientes con mayor riesgo de ECN, que fue de 22.384,5 pg/ml (área bajo la curva 0,848; sensibilidad 90,9%; especificidad 68,7%).
Por último, se realizó un análisis multivariante de regresión logística y se encontró que las variables relacionadas de forma independiente con la ECN fueron la edad gestacional (OR 2,151; IC 95% 1,183-3,910; p = 0,012) y los niveles de proBNP superiores a 22.400 pg/ml (OR 13,386; IC 95% 1,541-116,262; p = 0,019).
DISCUSIÓN
A pesar de la realización de protocolos de NP y enteral en las unidades de neonatología, sigue existiendo una gran variabilidad en la evolución de la tolerancia enteral, la duración de la NP y las curvas de peso entre diferentes centros que, a priori, no difieren mucho en sus incidencias de complicaciones y morbilidades relacionadas con la prematuridad.
La fisiopatología de la intolerancia digestiva y de la ECN en el RNPT no está del todo clara, pero se piensa que pueden estar influenciadas por diferentes factores, entre otros la inmadurez de la mucosa intestinal, cierto grado de isquemia o hipoxia tisular, la introducción de la alimentación enteral, especialmente fórmulas artificiales, y un sistema inmune inmaduro que hace al RNPT especialmente vulnerable a la presencia de agentes infecciosos.
Diversos estudios han relacionado la persistencia del ductus arterioso con una disminución de la saturación regional de oxígeno a nivel mesentérico, que podría favorecer una isquemia relativa a nivel intestinal 24,25. A su vez, la alteración en el flujo sanguíneo de la arteria mesentérica superior se ha relacionado con una peor tolerancia digestiva en los RNPT y un mayor riesgo de ECN 26,27,28, lo que podría explicar a nivel fisiopatológico la relación entre estas alteraciones digestivas y el DAP.
Sin embargo, aunque la intolerancia digestiva y el riesgo de ECN se han relacionado con el DAP-HS, la administración de ibuprofeno o indometacina para su cierre también pueden disminuir el flujo mesentérico, lo que a veces dificulta averiguar si su verdadero origen está más relacionado con el grado de afectación hemodinámica o con el tratamiento empleado 17,18,29.
Previamente, en un primer estudio analizamos si los niveles de proBNP determinado en las primeras 48-72 horas de vida podía ser un marcador útil para valorar la significación hemodinámica del DAP, encontrando que los niveles elevados se asociaban con el grado de repercusión ecográfica. Este hecho fue constatado por otros grupos 19,20,30. En segundo lugar, valoramos si este marcador podía ser un predictor de peor evolución respiratoria a largo plazo y, al igual que en el grupo de Sellmer y cols., se encontró una asociación entre los niveles de proBNP en los primeros días de vida y la disminución de la supervivencia libre de displasia broncopulmonar 21,22.
Dada la relevancia que en los últimos años está adquiriendo la nutrición del RNPT extremo, en este trabajo nos hemos planteado si este biomarcador, ampliamente utilizado en especialidades de adultos pero cuyo uso todavía no se ha generalizado en pediatría y que se ha asociado con otras morbilidades propias de la prematuridad 20,21,22,23, podría tener también un papel como biomarcador ligado a la evolución digestiva.
En el presente estudio, hemos evidenciado que el DAP-HS se asocia a un tiempo más prolongado para alcanzar la nutrición enteral completa y, por tanto, a mayor duración de la NP, al desarrollo de ECN y a una ganancia ponderal menor respecto a los pacientes sin DAP o con un DAP no ecográficamente significativo.
Los niveles de proBNP no se han relacionado con la duración de la NP y la ganancia ponderal, lo que sugiere que la intolerancia digestiva y el aumento más paulatino de la alimentación probablemente están más relacionados con la inestabilidad respiratoria, la necesidad de ventilación mecánica y el temor a aumentos rápidos ante la persistencia y el tratamiento del DAP, y no tanto con la propia afectación hemodinámica producida por este.
Sin embargo, sí hemos observado una relación entre niveles de proBNP más elevados y el riesgo de desarrollar ECN. De hecho, el análisis multivariante demostró que, en nuestra población, la menor edad gestacional y unos niveles de proBNP superiores a 22.400 pg/ml en las primeras 72 horas se asociaba al desarrollo de ECN, con un riesgo relativo de 13,38 e independientemente del resto de variables, incluido el DAP-HS.
Este hecho podría confirmar que el grado de afectación hemodinámica producida por el DAP puede tener más importancia en la fisiopatología y el desarrollo de la ECN que no la sola persistencia del ductus arterioso.
Los niveles de proBNP, al igual que se ha relacionado con otras morbilidades propias de la prematuridad, como la displasia broncopulmonar o la retinopatía de la prematuridad 21,22,23, también podrían ser un buen marcador del riesgo de patología digestiva grave en el RNPT.
Sin embargo, debemos ser cautelosos con los resultados y tener en cuenta que se trata de un estudio retrospectivo y en el que no se ha analizado la relación entre la patología digestiva y el tipo de tratamiento empleado para lograr el cierre del ductus.
El hecho de que la determinación de los niveles de proBNP se realice a las 48-72 horas de vida hace pensar que el daño producido a nivel intestinal por esta afectación hemodinámica es muy precoz, pero tampoco se ha estudiado si la consecución o el fracaso en el cierre del ductus tras su tratamiento se relacionan con mayor o menor riesgo de ECN.
Sería razonable la realización de estudios prospectivos y con mayor tamaño muestral, en los que se analicen todos estos aspectos que no han sido estudiados en el presente estudio, para poder extraer conclusiones más sólidas respecto a la posible utilidad de este marcador en la valoración del riesgo de patología digestiva en los recién nacidos más inmaduros.