INTRODUCCIÓN
No existe una definición unánime de ácido graso trans (AGT) que concierna a toda la comunidad científica. La European Food Safety Authority (EFSA) los define como "todos aquellos ácidos grasos monoinsaturados y poliinsaturados que tengan al menos un doble enlace en configuración trans" 1. Sin embargo, la Comisión Mixta FAO/OMS 2 del Codex Alimentarius tiene una visión más restrictiva y considera AGT solo aquellos "ácidos grasos insaturados que contienen uno o varios dobles enlaces aislados (no conjugados) en una configuración trans" coincidiendo con la definición que algunos países como Estados Unidos, Canadá y Dinamarca dan de estos componentes en su legislación 3. Esta restricción es importante puesto que la grasa láctea es de los pocos alimentos que poseen cantidades apreciables de ácidos grasos poliinsaturados (PUFA) con dobles enlaces conjugados, algunos de ellos con configuración trans, y el valor nutricional de los mismos puede ser relevante, tal y como se expondrá posteriormente.
En términos generales, los ácidos grasos (AG) insaturados de las grasas de origen vegetal y buena parte de origen animal poseen dobles enlaces provistos de configuración geométrica cis. Sin embargo, los AGT también se encuentran de forma natural en alimentos derivados de rumiantes, como la carne, el queso o la leche. Desde el punto de vista estructural, un doble enlace cis produce una acodadura en la cadena hidrocarbonada, formando un ángulo de 30°, a diferencia de la configuración trans, que se asemeja a una estructura lineal característica de las cadenas saturadas. Estas diferencias estructurales derivadas de la configuración de los dobles enlaces condicionan las propiedades físicas y químicas de los AG presentes en los distintos alimentos.
ORIGEN DE LOS ÁCIDOS GRASOS TRANS
Las dos principales fuentes de AGT en los alimentos son los procesos de hidrogenación industrial (HI) de grasas vegetales ricas en AG insaturados y la biohidrogenación ruminal (BHR) que ocurre en el tracto digestivo de los animales rumiantes. La HI se desarrolló a principios del pasado siglo y consiste en introducir gas hidrógeno en aceites vegetales ricos en AG insaturados, bajo condiciones variables de presión y temperatura, en presencia de un metal como catalizador. Mediante esta tecnología, los AG insaturados se hidrogenan parcial o totalmente generando grasas sólidas o semisólidas menos susceptibles a la oxidación. Si el producto se hidrogena a saturación, se obtiene una grasa completamente saturada y de alto punto de fusión, libre de isómeros cis y trans. Si la HI se realiza bajo condiciones controladas (hidrogenación parcial), se obtiene una mezcla de AG saturados, monoinsaturados, y pequeñas cantidades de PUFA, con isomería cis y trans. Dado que la configuración trans es más estable, en este proceso la mayoría de los dobles enlaces de los AG se transforman de cis a trans o cambian de posición dentro de la cadena hidrocarbonada. Los contenidos de AGT y de isómeros formados en la HI son muy variables y dependen de parámetros como el tipo de AG insaturados presentes en el aceite de partida, la naturaleza del catalizador y las condiciones de hidrogenación. Los AG que se forman son, principalmente, isómeros geométricos y posicionales del ácido oleico (cis-9 18:1). El perfil isomérico de los AGT de estos productos se atiene a una distribución gaussiana con los contenidos más elevados para las moléculas trans-9, trans-10, trans-11 y trans-12 18:1 (Fig. 1), siendo el ácido elaídico (trans-9 18:1) el más estable y más abundante.

Figura 1 Distribución de los isómeros trans 18:1 en grasa láctea de vaca (A) y grasa vegetal hidrogenada (B). El eje de abscisas muestra la posición del doble enlace en la cadena hidrocarbonada. Tomada con permiso de Gómez-Cortés y cols. 10.
El proceso de BHR se produce de forma natural en el rumen, la principal cavidad digestiva de las especies animales poligástricas. Es el resultado de la acción de enzimas de la microbiota digestiva que transforman los AG insaturados de la dieta en saturados, siendo los AGT intermediarios de estas reacciones enzimáticas. La BHR es un mecanismo de defensa de los microorganismos contra la toxicidad que para ellos representa la presencia de PUFA. Debido a la BHR, la mayor parte de los ácidos oleico, linoleico y α-linolénico aportados por la dieta se terminan transformando en ácido esteárico (18:0). Sin embargo, el proceso no es completamente eficiente y resulta en la acumulación ruminal de numerosos AG mono- y poliinsaturados característicos (isómeros cis y trans de los ácidos oleico, linoleico y α-linolénico) que pasan al torrente sanguíneo y se transfieren a la glándula mamaria. Es importante destacar que su presencia en la grasa láctea se relaciona directamente con los AG insaturados mayoritarios presentes en la ración de los animales 4,5,6.
Alimentos como la leche, el queso y la carne de rumiantes contienen entre 1-5% de AGT de forma natural. Entre estos, los AG monoinsaturados de 18 átomos de C son los más abundantes. El trans-11 18:1, también conocido como ácido vacénico (AV), es el isómero cuantitativamente más importante y constituye en torno al 50% de los ácidos trans 18:1 totales. En menor proporción estarían los isómeros desde el trans-4 hasta el trans-16 18:1 (Fig 1). En definitiva, las grasas producidas por HI y BHR presentan isómeros trans comunes, pero las proporciones individuales de cada uno de ellos varían sustancialmente.
Los AGT en la dieta también pueden tener su origen en los procesos de desodorización, tras el refinado de aceites vegetales o de pescado, o en el calentamiento de los aceites a altas temperaturas, en general en niveles del 0,2 al 1%. Se ha documentado que a 150 °Cse iniciaba la formación de AGT y se incrementaba significativamente a temperaturas superiores a 220 °C, siendo el contenido en AGT dependiente también del tiempo de calentamiento 3,7,8.
ORIGEN DEL ÁCIDO LINOLEICO CONJUGADO
CLA, derivado del inglés conjugated linoleic acid, es el acrónimo que comprende el grupo de isómeros de ácido linoleico con dobles enlaces conjugados con distinta posición y geometría (cis o trans). La mayor fuente de CLA en la dieta humana es casi exclusivamente la carne de rumiante y, principalmente, los productos lácteos a los que no se ha separado la grasa 9. La concentración total de CLA en leche proveniente de rumiantes no sometidos a regímenes especiales de alimentación oscila entre el 0,3 y el 1,0% del total de AG 10.
Los isómeros conjugados del ácido linoleico en los productos derivados de rumiantes presentan posiciones de los dobles enlaces de 7-9 a 12-14 y cubren las cuatro configuraciones geométricas posibles (cis-cis, cis-trans, trans-cis y trans-trans). El principal isómero es el ácido ruménico (cis-9, trans-11 18:2, AR), que representa al menos el 75% del CLA total. Otros isómeros como el trans-10 cis-12 18:2 también están presentes de forma natural en la fracción lipídica de los productos lácteos, pero en cantidades muy bajas (Tabla 1).
Tabla I Contenido mínimo y máximo (% de ácidos grasos totales) de isómeros del ácido linoleico conjugado individuales en leche de vaca, oveja y cabra

Los datos han sido tomados de Ferlay y cols. 6* y Shingfield et al. 5†. NR: no reportado.
Las dos vías de síntesis del AR en rumiantes son las que parten de los ácidos linoleico y α-linolénico presentes en la dieta del ganado (Fig. 2). Una parte del AR se genera directamente en el rumen por isomerización directa del ácido linoleico. Sin embargo, la mayoría del AR que finalmente termina en la grasa láctea se sintetiza de forma endógena en la glándula mamaria. El AR se forma por desaturación del doble enlace del carbono 11 del AV generado en el rumen, gracias a la enzima ∆-9 desaturasa (Fig. 2). Se ha estimado que el porcentaje de AR de origen endógeno es, al menos, el 60% del total presente en la leche 11.
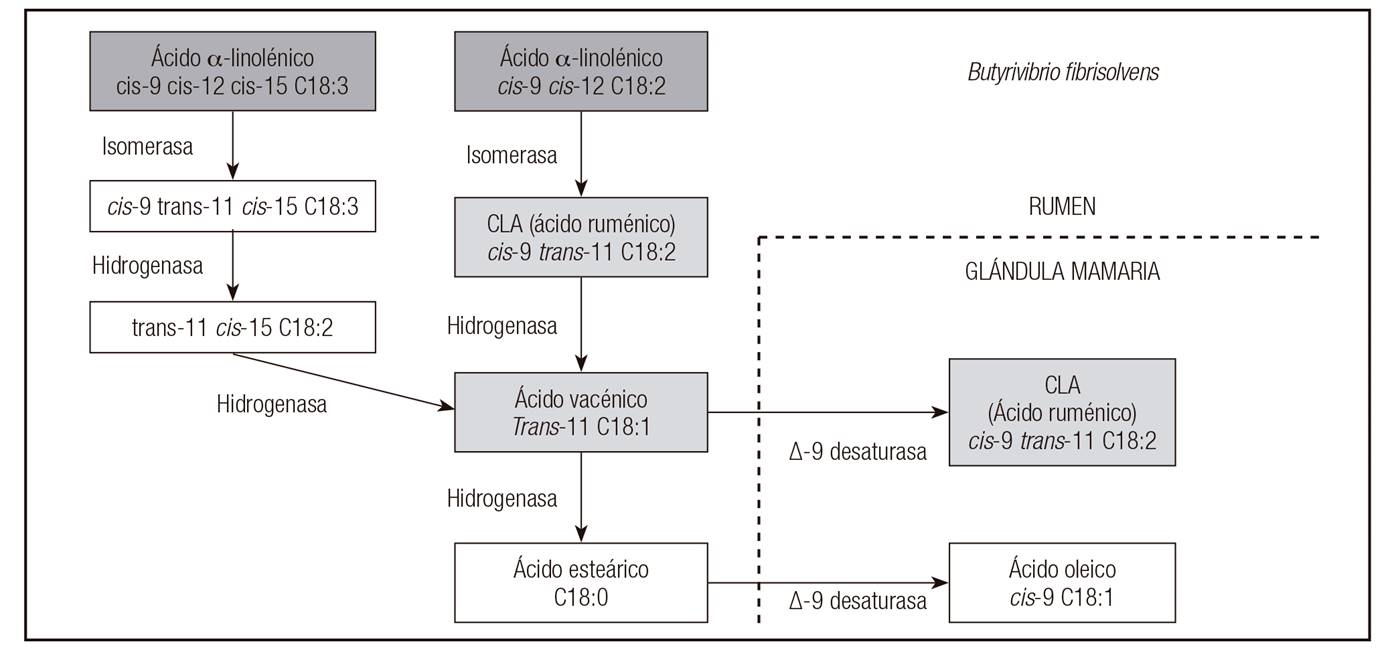
Figura 2 Rutas metabólicas de formación de cis-9 trans-11 18:2 (ácido ruménico) en grasa láctea de rumiantes a partir de ácido linoleico y ácido α-linolénico. Tomada de De la Fuente y Juárez 56.
ÁCIDOS GRASOS TRANS Y SALUD. EVIDENCIAS CIENTÍFICAS
CONSIDERACIONES GENERALES
Desde que Mensink y Katan 12 reportaron por primera vez que la ingesta de AGT favorecía el incremento de las lipoproteínas de baja densidad (LDL-colesterol) y disminuía las de alta densidad (HDL-colesterol) en plasma humano, se han realizado multitud de estudios dirigidos a evaluar la incidencia de estos AGT en las enfermedades cardiovasculares (ECV). La EFSA 1 concluyó que existe una alta correlación entre ambos y la Comisión Europea 13 proporcionó información sobre la presencia de grasas trans en los alimentos y en la dieta general de la población de la Unión Europea y describió la relación entre el consumo de grasas trans y el riesgo de ECV.
Mozaffarian y cols. 14 observaron que una ingesta diaria de AGT superior al 2% de la energía total de la dieta incrementa significativamente la incidencia de ECV. Este aumento es directamente proporcional a la cantidad de AGT ingerida en un amplio intervalo de ingesta, de 1,3 a 16,1 g/día.
La Organización Mundial de la Salud recomienda consumir no más del 1% de AGT sobre la ingesta diaria total de energía 15. En Europa, las recomendaciones para AGT oscilaron entre ≤ 2 E% (Francia, Reino Unido) y ≤ 1E% (Bélgica, Países Bajos, Alemania-Austria-Suiza, España) 1,8. Las directrices más recientes de las asociaciones profesionales en Europa (Sociedad Europea de Cardiología) y Estados Unidos (American Heart Association; American Diabetes Association) y el United States Department of Agriculture (USDA) indican que el consumo de TFA debe ser lo más bajo posible (citadas en referencia 8). Todo lo anterior y la reformulación de alimentos con procesos tecnológicos mejorados están facilitado la comercialización de productos de origen industrial con bajo contenido de AGT.
En cualquier caso, es importante especificar el origen de los AGT, ya que los efectos podrían depender del contenido en los distintos isómeros individuales que, como se ha indicado anteriormente, varían con cada tipo de grasa.
La fuente principal de AGT en la dieta humana son, en general, las grasas vegetales parcialmente hidrogenadas pese a que, como se ha indicado, están también presentes en la grasa de los alimentos de rumiantes 16. Actualmente el contenido medio de AGT en alimentos está disminuyendo y su aporte, frente al conjunto de la ingesta total de energía, se encuentra en torno al 1% 17. Además, distintas evidencias científicas apuntan que el consumo de cantidades moderadas de AGT procedentes de la grasa de leche no contribuiría a aumentar los riesgos cardiovasculares por la ingesta de productos lácteos 18.
Se ha argumentado que el bajo impacto negativo de los AGT de origen lácteo en la salud sería una consecuencia de la ingesta limitada de este tipo de grasa en la dieta. Un ensayo clínico documentó que niveles muy altos de AV (diez veces más que la cantidad que se consume normalmente) tuvieron efectos similares sobre los factores de riesgo de ECV a los que producían los AGT de origen industrial 19. Más recientemente, un informe de la EFSA 8 sugiere que las evidencias disponibles son insuficientes para establecer si existe una diferencia entre los AGT de origen natural e industrial consumidos en cantidades equivalentes en relación con el riesgo de ECV. Sin embargo, la mayoría de los estudios declaran que la asociación positiva entre el consumo de AGT y el riesgo de ECV se explica por la ingesta de AGT de origen industrial 20,21,22. Una revisión más reciente relacionada con los AGT de rumiantes deja claro que no se les puede atribuir ningún efecto fisiológico adverso convincente y que solo un consumo extremadamente alto causaría efectos negativos sobre los lípidos del plasma 23.
EFECTOS ESPECÍFICOS DE ISÓMEROS TRANS-18:1 INDIVIDUALES
Las conclusiones de los estudios anteriormente mencionados están basadas en el supuesto de la existencia de dos grupos diferenciados de AGT, según procedan de la HI o de la BHR. Sin embargo, durante mucho tiempo, los efectos en la salud de los AGT han ignorado el papel de los isómeros individuales, probablemente debido a su dificultad de análisis y falta de patrones comerciales. Vahmani y cols. 24,25 describieron en dos estudios, en adipocitos de ratón y células hepáticas humanas, que los isómeros trans-18:1 se metabolizan de manera diferente y tienen distintas propiedades lipogénicas, en las que la posición del doble enlace desempeñaría un papel esencial. El AV y el isómero trans-13, por ejemplo, mostraron una mayor afinidad por la enzima ∆-9 desaturasa, mientras que el isómero trans-9 18:1 favorecía la expresión de distintos genes lipogénicos.
Field y cols. 26 revisaron la información publicada sobre los efectos del AV en distintas líneas celulares, modelos animales y humanos. Concluyeron que los estudios hasta esa fecha no avalaban una relación entre el AV y las ECV, la resistencia a la insulina o la generación de procesos inflamatorios. Desde entonces, diversas investigaciones han atribuido una serie de efectos positivos para la salud específicamente al AV. Un ensayo de toxicidad oral aguda en ratas alimentadas con una grasa láctea fuertemente enriquecida en AV disminuyó significativamente el contenido de TG en plasma sanguíneo, sin generar efectos metabólicos perjudiciales ni influir negativamente en los biomarcadores lipídicos 27. Otros estudios más recientes con modelos animales han acumulado nuevas evidencias sobre las ventajas metabólicas de la presencia de AV en la dieta 28,29,30.
Aparentemente, la importancia del AV radica en su papel como precursor de AR, uno de los compuestos bioactivos más relevantes presentes en la grasa de la leche (ver la siguiente sección). Inicialmente, se creía que la síntesis endógena de AR solo se producía en la glándula mamaria de rumiantes, pero se ha demostrado que este isómero de CLA también se sintetiza en tejidos humanos gracias a la acción de la enzima ∆-9 desaturasa 9. Además, hay evidencias crecientes que sugieren que el AV sería un AG bioactivo por sí mismo, independiente de su papel como promotor o sustrato enzimático para la formación de AR. Por ejemplo, se ha documentado que el AV suprime la proliferación de células MCF-7, indicando que este isómero ejercería un efecto anticancerígeno 31. Otros trabajos en modelos animales han revelado también potenciales propiedades antiinflamatorias de VA, que podrían ser desempeñadas al margen de su papel como sustrato para la síntesis de AR 32,33.
Los isómeros trans monoinsaturados distintos de 18:1 también se pueden encontrar en la grasa de la leche en pequeñas cantidades 34, pero sus efectos en la salud humana son muy poco conocidos. Solo el trans-9 16:1, un biomarcador natural de grasa de leche, ha merecido cierta atención. La presencia de este isómero en humanos se ha asociado con la menor incidencia de diabetes 35,36, la menor mortalidad relacionada con la ECV y la disminución de muerte súbita cardiaca 37. Estas evidencias indican el interés de más investigación sobre el mismo en el futuro.
EL CLA COMO COMPONENTE BIOACTIVODE LA LECHE. ÁCIDO RUMÉNICO
Desde la identificación del CLA como un compuesto capaz de inhibir la carcinogénesis 38, la investigación sobre este grupo de AG ha experimentado un crecimiento exponencial. Los efectos potencialmente beneficiosos atribuidos al CLA en la literatura científica son múltiples (Fig. 3). Entre ellos, cabe destacar su papel como agente antitumoral 39,40,41 y antiarterioesclerótico 42,43,44. La mayoría de estas propiedades bioactivas se han relacionado con dos isómeros, el trans-10 cis-12 y el AR. Como ya se expuso previamente, el primero es muy escaso en leche mientras que el segundo es abundante en dicho alimento.
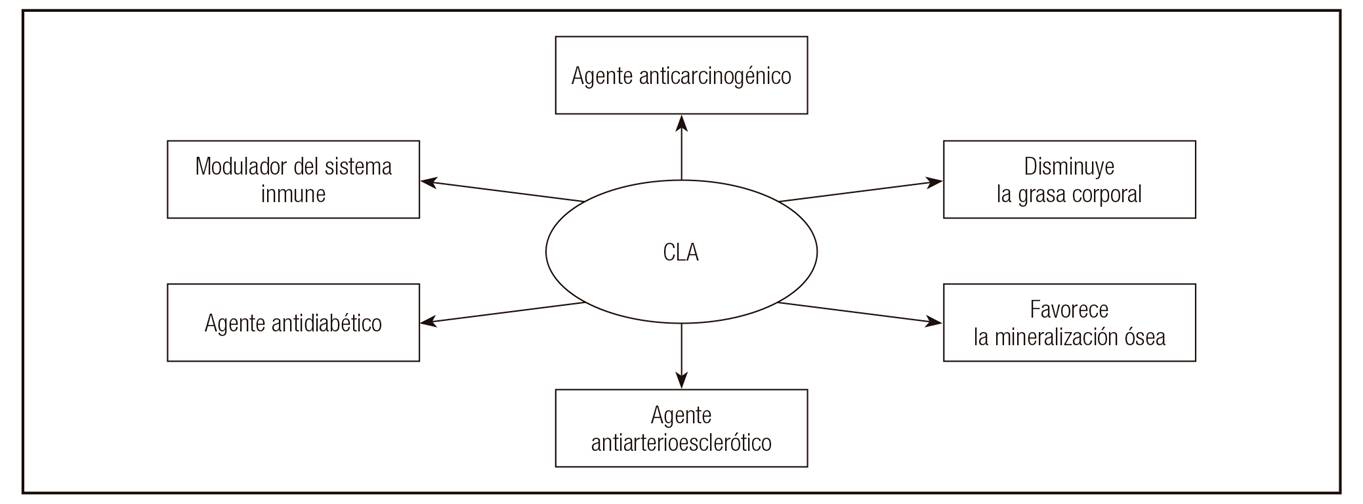
Figura 3 Efectos beneficiosos del ácido linoleico conjugado (CLA) observados en experimentos in vitro y con modelos animales. Tomada de De la Fuente y Juárez 56.
Los distintos efectos bioactivos observados para el AR y el trans-10 cis-12 18:2 pueden ser atribuidos a las diferencias estructurales entre las dos moléculas que son derivadas de la posición y la geometría de los dos dobles enlaces (Fig. 4). El trans-10 cis-12 18:2 se oxida más eficientemente que el AR 45 porque sus dobles enlaces están más expuestos y, como resultado, su papel se relaciona con procesos catabólicos como la lipolisis o la oxidación de grasas. En contraste, el AR se ha asociado mayoritariamente a efectos anabólicos y antiinflamatorios 6,46,47.
Los procesos inflamatorios celulares subyacen en la patogenia de las ECV, la diabetes, las infecciones virales o el cáncer y el AR ha demostrado un gran número de efectos positivos contra la respuesta inflamatoria en distintos modelos in vitro y animales 48. Esta actividad antiinflamatoria estaría vinculada a dos vías metabólicas que concurren en las células, la plasmática y la nuclear.

Figura 4 Estructura química del trans-11 18:1, cis-9 trans-11 18:2 y del trans-10 cis-12 18:2. Tomada de Gómez-Cortés y De la Fuente 57.
En la vía plasmática, el AR intervendría disminuyendo la síntesis de eicosanoides (citoquinas, tromboxanos, prostaglandinas) proinflamatorios que se originan a partir del metabolismo del ácido araquidónico (20:4 n-6) y su precursor celular, el ácido linoleico. El AR competiría con estos AG por las mismas rutas enzimáticas. En primer término, el AR dificultaría la síntesis de 20:4 n-6 a partir de linoleico. Por otro lado, el AR contribuiría a disminuir la formación de eicosanoides proinflamatorios generados a partir de 20:4 n-6, compitiendo por las mismas ciclooxigenasas y lipoxigenasas. Globalmente la producción de eicosanoides conjugados estaría relacionada con la prevención de procesos de inflamación, vascularización, promoción de tumores y respuesta inmune 49,50.
En la vía nuclear, el AR operaría como un ligando de alta afinidad de los denominados receptores activados por proliferadores peroxisómicos (PPAR, por sus siglas en inglés). Aquellos PPAR activados por el AR actuarían como reguladores negativos de genes diana implicados en la modulación de la inflamación, carcinogénesis, adiposidad, diabetes y generación de enfermedades cardiovasculares 48,50,51.
En comparación con los resultados observados en modelos animales, los efectos positivos de la ingesta de CLA en ensayos en humanos son más limitados. Una posible explicación es que, en animales, los ensayos se han realizado con concentraciones más altas de CLA y la dosis en la dieta sería un factor determinante. Desafortunadamente, hasta la fecha, los estudios de intervención en la dieta humana que evalúen el consumo de productos lácteos enriquecidos en AR son muy escasos. Tricon y cols. 52 no detectaron modificaciones significativas en los biomarcadores inflamatorios después del consumo de diferentes productos lácteos enriquecidos en AR (1,40 g/día), mientras que Sofi y cols. 53) observaron una reducción significativa de las citoquinas inflamatorias tras la ingesta de queso de leche de oveja enriquecido en AR (0,14 g/día). Penedo y cols. 54 midieron también disminuciones de interleuquinas proinflamatorias en adultos tras el consumo de mantequillas enriquecidas en AR (1,00 g/día). Por su parte, Jaudszus y cols. 55 observaron en un ensayo piloto que la suplementación dietética con AR purificado disminuía moderadamente la respuesta inflamatoria a nivel celular en niños con asma. Aunque esta información proviene de un número limitado de estudios, son evidencias prometedoras que sugieren que el consumo de AR sería útil para reducir la respuesta inflamatoria y así prevenir ciertas patologías de nuestro tiempo relacionadas con el proceso inflamatorio.
CONCLUSIONES
El consumo de AGT presentes en los alimentos se ha relacionado con una mayor incidencia en ECV, frente al consumo de otros AG mono o poliinsaturados. Aunque las fuentes principales de AGT en los alimentos, grasas vegetales parcialmente hidrogenadas y productos derivados de rumiantes, carne y productos lácteos contienen AGT comunes, los contenidos de los distintos isómeros difieren sustancialmente. Las últimas evidencias científicas disponibles sobre los efectos del AV, el isómero predominante en alimentos derivados de rumiantes, en la salud no indican una asociación con ECV o procesos inflamatorios.
La carne de rumiantes y la leche y los productos lácteos, con grasa, son la principal fuente natural del CLA en la dieta. Aunque los ensayos clínicos en humanos son limitados, los resultados de investigación disponibles evidencian una asociación positiva en ECV, reducción de inflamación y otras enfermedades.














