INTRODUCCIÓN
La obesidad constituye uno de los principales factores de riesgo modificables para el desarrollo de patologías crónicas, entre ellas, la diabetes mellitus II (DMT2) 1. Estudios epidemiológicos evidencian que alrededor del 80% de los individuos con esta patología presentan sobrepeso u obesidad, lo que origina una serie de alteraciones fisiopatológicas que contribuyen a su desarrollo 2. Este escenario ha motivado la introducción del término "diabesidad", que hace referencia a la estrecha relación entre estas dos patologías. En Chile, la vinculación entre la obesidad y la DMT2 se verifica a partir de los resultados de la Encuesta Nacional de Salud 2016-2017, donde se observa una prevalencia de un 12,3% y 31,2%, respectivamente 3, datos mayores que lo reportado en encuestas anteriores 4. Estos índices ubican a Chile como uno de los países con mayor prevalencia de obesidad y DMT2 en Latinoamérica 5.
Un estilo de vida poco saludable, caracterizado por una excesiva ingesta energética sostenida en el tiempo y falta de actividad física (AF), es uno de los principales factores asociados al aumento de la obesidad y sus comorbilidades 1,6,7. No obstante, estudios de concordancia fenotípica de gemelos revelan, además, un importante componente genético, estimado en un 70% para la obesidad y en un 35% para la DMT2 8. Hasta ahora, los polimorfismos de nucleótido único (SNP) en el primer intrón del gen FTO (fat mass and obesity associated gene) se han definido como las variantes genéticas que confieren mayor riesgo de obesidad. En esta región se han identificado más de diez polimorfismos, entre los que destacan los SNP rs9939609 y rs3751812, correspondientes a transversiones de A por T y G por T, respectivamente 9.
Investigaciones previas han verificado ampliamente la asociación entre el SNP rs9939609 del gen FTO y obesidad en diversas poblaciones, incluida la chilena 10,11. Sin embargo, para otros SNP como el rs3751812, se reporta un reducido número de estudios de asociación 12. Similar situación ocurre con marcadores metabólicos relacionados con DMT2, los cuales se han asociado al SNP rs9939609 del gen FTO en numerosas poblaciones, pero en menor medida con el SNP rs3751812 13,14,15. Considerando la ausencia de estudios de asociación de este polimorfismo del gen FTO con marcadores metabólicos en Chile, el objetivo de este estudio fue investigar la asociación del SNP rs3751812 del gen FTO con marcadores de adiposidad y metabólicos en población adulta chilena.
MATERIALES Y MÉTODOS
La muestra seleccionada comprende a 409 individuos pertenecientes al estudio GENADIO, genotipificados por SNP rs3751812 en el gen FTO. El proyecto GENADIO fue realizado en Chile entre los años 2009-2011 con el objetivo de evaluar la prevalencia de factores de riesgo de enfermedades cardiovasculares en Chile. La población estudiada estuvo compuesta por 409 individuos, seleccionados con un rango de edad entre 20 y 60 años, de ascendencia mapuche o europea de las regiones del Biobío, Los Ríos y Metropolitana, sin historial médico de enfermedad metabólica o cardiovascular y sin prescripción de antihipertensivos ni hipoglicemiantes 16. Para la selección de participantes de ascendencia mapuche o europea y el descarte de individuos de ancestría mestiza, se incluyeron solo aquellos cuyos apellidos paterno y materno fuesen de origen mapuche o europeo, respectivamente. Además, para la selección de mapuches, se descartaron aquellos cuyo grupo sanguíneo fuese distinto al grupo O. El reclutamiento de los participantes se realizó mediante invitaciones abiertas a la comunidad o por intermedio de organizaciones comunitarias como centros de atención de salud primaria, centros educacionales o clubes sociales. El estudio contó con la aprobación de los comités de Ética de la Universidad de Chile, Universidad de Concepción y Universidad de Glasgow en Reino Unido. Todos los participantes firmaron su consentimiento informado previo a la recolección de datos.
DETERMINACIÓN DE VARIANTES ALÉLICAS DEL GEN FTO
Para la genotipificación del SNP rs3751812, del gen FTO, se obtuvo ADN genómico desde leucocitos periféricos mediante el kit QIAamp® DNA Blood Midi Kit (QIAGEN, Ltd., UK). La discriminación alélica se realizó mediante polymerase chain reaction (PCR) de tiempo real en termociclador ABI 7900-HT. La detección del polimorfismo rs3751812 se realizó por la metodología TaqMan® Pre-Designed SNP Genotyping Assay con sondas específicas para el SNP. Los análisis fueron realizados en duplicado, con un 98% de éxito en la determinación del genotipo.
MARCADORES DE ADIPOSIDAD
La evaluación antropométrica se realizó por personal capacitado utilizando protocolos estandarizados 17. El peso corporal y la talla fueron determinados con una balanza electrónica (Tanita® TBF 300A, USA) y tallímetro (Seca® A800, USA) con una precisión de 100 g y 1 mm, respectivamente. El perímetro de cintura (PC) fue medido con una cinta métrica no distendible (Seca® Modelo 201, USA). El estado nutricional fue clasificado en base a los puntos de corte del índice de masa corporal (IMC) de la Organización Mundial de la Salud (OMS) para adultos: bajo peso: < 18,5 kg/m2; normal: 18,5-24,9 kg/m2; sobrepeso: 25,0-29,9 kg/m2; y obesidad: ≥ 30,0 kg/m2 (18. Los valores utilizados para definir obesidad central fueron los siguientes: PC ≥ 102 y ≥ 88 cm en hombres y mujeres, respectivamente. La composición corporal se determinó mediante la medición de cuatro pliegues cutáneos (bicipital, subescapular, suprailiaco y tricipital) según los protocolos sugeridos por la Asociación Internacional de Cineantropometría (ISAK) 16. El algoritmo de Durnin y Womersley fue aplicado según el protocolo ISAK para la estimación del porcentaje de masa grasa 19.
MARCADORES METABÓLICOS Y PRESIÓN ARTERIAL
Las muestras sanguíneas fueron obtenidas por punción venosa tras 10-12 horas de ayuno. La glicemia basal, el colesterol total (CT), el colesterol HDL (cHDL) y los triglicéridos (TG) se analizaron por métodos enzimáticos de punto final (Roche Diagnostics GmbH, Mannheim, Alemania) y las enzimas hepáticas gamma-glutamiltransferasa (GGT) y alanina aminotransferasa (ALT) se determinaron mediante ensayos de cinética enzimática (Randox Laboratories Ltd., Co. Antrim, Irlanda). El colesterol LDL (cLDL) se determinó usando la ecuación de Friedewald 20. La insulina y la leptina fueron determinadas por ELISA (Diagnostic System Labs, TX, Estados Unidos, y Linco Research Inc, St. Louis MO, Estados Unidos) y el Homeostasis Model Assessment of Insulin Resistance (HOMAIR) fue determinado a través de la fórmula: insulinemia en ayunas (µU/ml) x glicemia en ayunas (mg/dl)/405. La proteína C reactiva ultrasensible (PCRus) se midió mediante inmunoturbidimetría (Kamiya Biomedical, Seattle, Estados Unidos). Cada determinación fue realizada en duplicado y se registró el promedio. Las presiones arteriales sistólica (PAS) y diastólica (PAD) fueron tomadas con un tensiómetro automático en posición supina después de un periodo de diez minutos de descanso (Omron M10-IT Healthcare UK Limited, Milton Keynes, Reino Unido).
VARIABLES SOCIODEMOGRÁFICAS Y DE ESTILO DE VIDA
Los datos sociodemográficos (edad, sexo, zona de residencia, nivel educacional, ingresos económicos, etnia) y los datos asociados con estilos de vida, como el tabaquismo, fueron recolectados mediante encuestas validadas 16. La medición de fitness cardiorrespiratorio se realizó mediante Chester Step Test y el resultado de la prueba fue en metabolic energy equivalents (METs), siguiendo las recomendaciones descritas por Buckley et al. 21. Los niveles de AF y el tiempo sedente fueron estimados por acelerometría de movimiento (Actigraph GTM1, Estados Unidos). La intensidad de la AF y el gasto energético se determinaron mediante el algoritmo de Freedson 22).
ANÁLISIS ESTADÍSTICO
Los datos de caracterización de la población estudiada son presentados como promedio y desviación estándar (DE) para variables continuas y como porcentaje para variables categóricas.
Para investigar la asociación entre el polimorfismo rs3751812, del gen FTO y los marcadores de adiposidad (peso corporal, IMC, PC, y % de masa grasa), se realizó un análisis de regresión lineal. El mismo análisis fue realizado para investigar su asociación con marcadores metabólicos (glicemia, insulina, HOMAIR, CT, cHDL, cLDL, TG, ALT, GGT, PCRus y leptina) y presión arterial (PAS y PAD).
El genotipo del SNP rs3751812, del gen FTO, fue categorizado siguiendo un modelo genético aditivo (0 = GG - homocigoto para el alelo protector; 1 = GT - heterocigoto para el alelo de riesgo; 2 = TT - homocigoto para el alelo de riesgo) y, posteriormente, mediante análisis de regresión lineal, se estimó el incremento en la variable de adiposidad por cada copia adicional de la variante de riesgo (alelo T). Estos resultados fueron presentados como promedio o coeficiente beta con su respectivo intervalo de confianza del 95% (95% IC).
Para determinar qué marcadores presentaban una mayor asociación con el SNP del gen FTO estudiado, todas las variables fueron estandarizadas a z-score; por ello, estos resultados fueron presentados como coeficiente beta estandarizado y sus respectivo 95% IC por cada copia adicional del alelo de riesgo del gen FTO.
Los datos de marcadores de adiposidad fueron ajustados por variables de confusión mediante la utilización de tres modelos estadísticos: modelo 0, sin ajustar; modelo 1, ajustado por edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico y zona de residencia (urbano/rural); y modelo 2, ajustado por el modelo 1, pero también por AF, tiempo sedente y tabaquismo. Para los datos de marcadores metabólicos (incluida la presión arterial) se realizaron ajustes adicionales mediante los siguientes modelos: modelo 3, ajustado por el modelo 2, pero también por IMC. La distribución del equilibrio de Hardy-Weinberg, de los alelos del gen FTO, fue evaluada mediante el test Chi-cuadrado. Para todos los análisis se utilizó el programa Stata SE v14. El nivel de significancia fue definido como p < 0,05.
RESULTADOS
En la Tabla 1 se presentan las características generales de la población según genotipo (GG, GT, TT). No se observan diferencias en las variables sociodemográficas, de estilo de vida ni en cuanto a los parámetros de AF entre los individuos con alelos de riesgo (GT y TT), respecto a individuos con el genotipo protector GG.
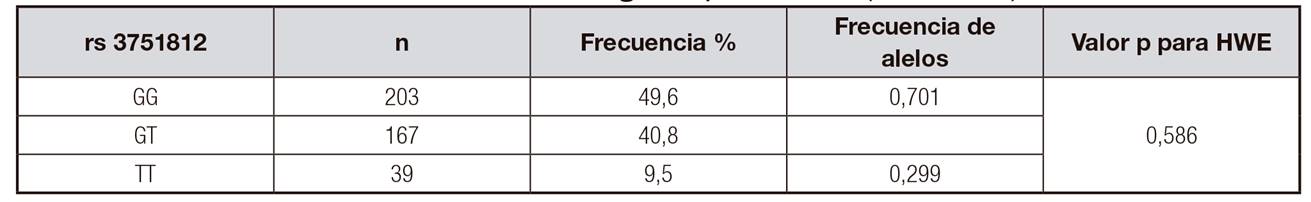
Tabla I. Características de la población según el genotipo FTO (rs3751812)
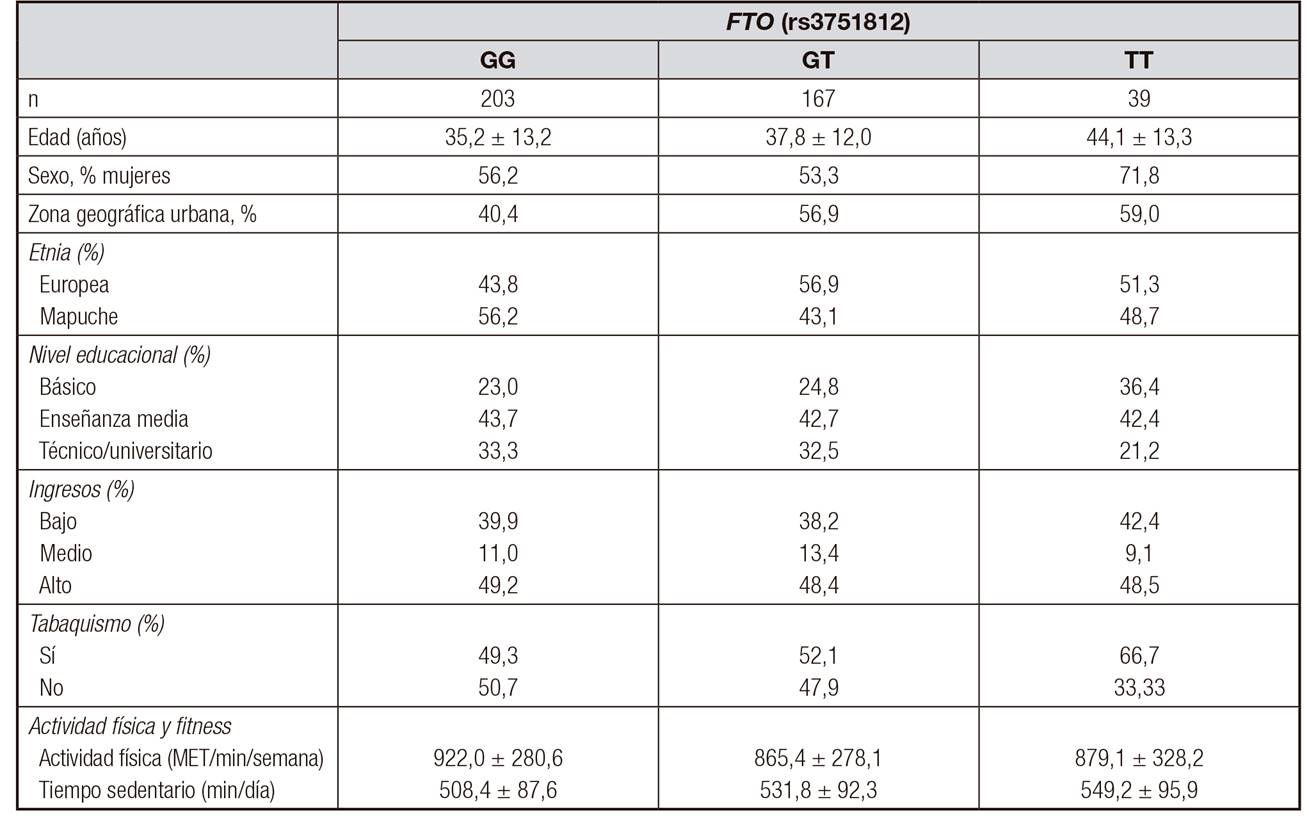
Datos presentados como promedio y desviación estándar (DE) para variables continuas y como % para variables categóricas. MET: metabolic energy equivalents.
Por otro lado, y tal como se observa en la Tabla 2, la frecuencia de los alelos del gen FTO en la población se distribuye según el equilibrio de Hardy-Weinberg, correspondiente a 0,701 para el alelo G y de 0,299 para el alelo T (2 = 0,586).
Los resultados de la asociación entre el SNP rs3751812, del gen FTO, y variables de adiposidad se presentan en la Tabla 3 y en la Figura 1. Estos resultados revelan que, en el modelo no ajustado, todos los marcadores de adiposidad incrementan significativamente por cada copia extra del alelo de riesgo (T) del gen FTO (p < 0,0001). El incremento en los marcadores de adiposidad, por cada copia del alelo de riesgo, fue equivalente a 3,88 kg para peso corporal, 1,58 kg/m2 para IMC, 2,98 cm para PC y 1,27% para masa grasa. Tras ajustar por las variables de confusión (modelos 1 y 2), la asociación entre el polimorfismo estudiado y estos marcadores de adiposidad se mantuvo estadísticamente significativa (Fig. 1).
Tabla III. Asociación entre el genotipo del FTO (rs3751812) con marcadores de adiposidad

Datos presentados como promedio y 95% IC según genotipo. El modelo genético aditivo indica el promedio de incremento en la variable de adiposidad por cada copia adicional de la variante de riesgo (T). El efecto aditivo y su respectivo 95% IC fueron determinados mediante regresión lineal. Los análisis fueron ajustados por: modelo 0, sin ajustar; modelo 1, ajustado por edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico y zona de residencia (urbana/rural); modelo 2, ajustado por el modelo 1 pero también por actividad física, tiempo sedente y tabaquismo.

Figura 1. Asociación entre el genotipo del FTO (rs3751812) con marcadores de adiposidad. Datos presentados como diferencias entre el alelo protector (G) y los genotipos con la variante de riesgo (T) y sus respectivos 95% IC. El modelo genético aditivo indica el promedio de incremento en la variable de adiposidad por cada copia adicional de la variante de riesgo (T). Los análisis fueron ajustados por: edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico, zona de residencia (urbana/rural), actividad física, tiempo sedente y tabaquismo
Los resultados de la asociación del SNP rs3751812, del gen FTO, con marcadores metabólicos se presentan en la Tabla 4. Las asociaciones encontradas pueden ser categorizadas en tres grupos: a) marcadores cuya asociación con FTO es independiente de todos los factores de confusión (Fig. 2); b) marcadores que presentan asociación con FTO, pero que no permanece significativa al ajustar por IMC; y, finalmente, c) marcadores que no presentan asociación alguna con FTO, incluso en el modelo no ajustado.
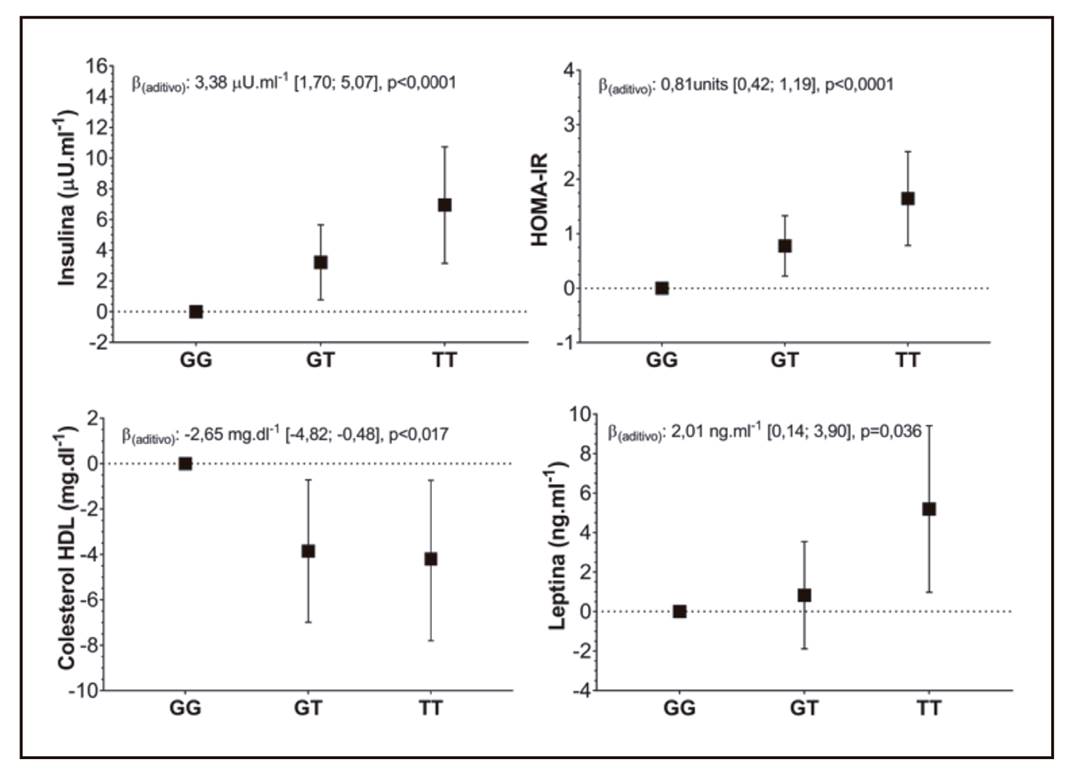
Figura 2. Asociación entre el genotipo del FTO (rs3751812) con marcadores metabólicos. Datos presentados como diferencias entre el alelo protector (G) y los genotipos con la variante de riesgo (T) y sus respectivos 95% IC. El modelo genético aditivo indica el promedio de incremento en la variable metabólica por cada copia adicional de la variante de riesgo (T). Los análisis fueron ajustados por edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico, zona de residencia (urbana/rural), actividad física, tiempo sedente, tabaquismo e IMC. HOMAIR: homeostatic model assessment
Entre los marcadores metabólicos que presentan asociación independiente de todos los factores de confusión, incluidos en los modelos 1 al 3, se encuentran: insulina, leptina, HOMAIR y cHDL (Fig. 2). La asociación se mantiene significativa para estos marcadores incluso cuando se ajusta por PC o % de masa grasa (datos no mostrados). En el modelo más ajustado (modelo 3), la presencia de cada copia del alelo de riesgo aumenta los niveles de insulina en 3,38 U/ml, lo que se traduce en un incremento de insulina sobre el rango normal para el genotipo con dos alelos de riesgo (TT). Consistentemente con lo anterior, el HOMAIR presenta un aumento de 0,81 unidades por cada copia del alelo de riesgo del gen FTO, elevándose sobre el rango normal con la presencia de solo un alelo de riesgo (genotipos GT y TT). Respecto a la leptina, se observó un aumento de 2,01 ng/ml por cada copia del alelo de riesgo. Por su parte, el cHDL presentó una asociación negativa con FTO, observándose una reducción de 2,65 mg/dl por cada copia del alelo de riesgo, conduciendo a niveles bajo el rango normal para hombres y mujeres. Entre los marcadores metabólicos que presentan una asociación con el polimorfismo que se pierde tras ajustar por IMC (modelo 3), se encuentran: CT, TG, cLDL, ALT, GGT y PCRus. Por último, en el grupo de los marcadores que no presentan asociación alguna con FTO se encuentran glicemia, PAS y PAD (Tabla 4).
Tabla IV. Asociación entre el genotipo del FTO (rs3751812) con marcadores metabólicos

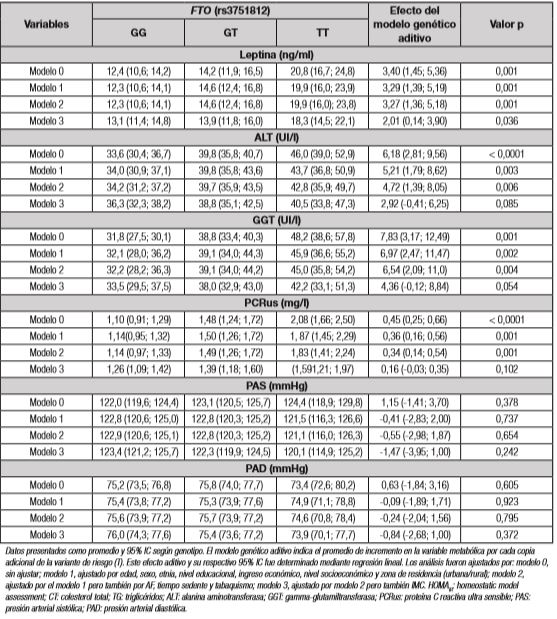
Datos presentados como promedio y 95% IC según genotipo. El modelo genético aditivo indica el promedio de incremento en la variable metabólica por cada copia adicional de la variante de riesgo (T). Este efecto aditivo y su respectivo 95% IC fue determinado mediante regresión lineal. Los análisis fueron ajustados por: modelo 0, sin ajustar; modelo 1, ajustado por edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico y zona de residencia (urbana/rural); modelo 2, ajustado por el modelo 1 pero también por AF, tiempo sedente y tabaquismo; modelo 3, ajustado por modelo 2 pero también IMC. HOMAIR: homeostatic model assessment; CT: colesterol total; TG: triglicéridos; ALT: alanina aminotransferasa; GGT: gamma-glutamiltransferasa; PCRus: proteína C reactiva ultra sensible; PAS: presión arterial sistólica; PAD: presión arterial diastólica.
Finalmente, para comparar la fuerza de asociación del polimorfismo con los marcadores estudiados, se calcularon los coeficientes beta estandarizados para todos los marcadores luego de ajustar por todas las variables de confusión (Fig. 3). Se observa que la magnitud de las asociaciones de los marcadores que se asocian con el polimorfismo del gen FTO, independiente de todos los factores de confusión, decrece en el siguiente orden: peso corporal (0,37 unidades de DE), IMC (0,36 unidades de DE), HOMAIR (0,29 unidades DE), insulina (0,28 unidades de DE), PC (0,23 unidades DE), % de masa grasa (0,23 unidades DE), cHDL (-0,18 unidades DE) y leptina (0,16 unidades de DE).

Figura 3. Coeficientes beta estandarizados entre la asociación del gen FTO (rs3751812) y marcadores de adiposidad y metabólicos. Datos presentados como coeficiente beta estandarizados y 95% IC según genotipo. El modelo genético aditivo indica el promedio de incremento en la variable metabólica por cada copia adicional de la variante de riesgo (T). Los análisis fueron ajustados por edad, sexo, etnia, nivel educacional, ingreso económico, nivel socioeconómico, zona de residencia (urbana/rural), actividad física, tiempo sedente, tabaquismo e IMC. HOMAIR: homeostatic model assessment; CT: colesterol total; TG: triglicéridos; ALT: alanina aminotransferasa; GGT: gamma-glutamiltransferasa; PCRus: proteína C reactiva ultrasensible; PAS: presión arterial sistólica; PAD: presión arterial diastólica
DISCUSIÓN
Los principales resultados de este estudio demuestran una asociación entre el SNP rs3751812, del gen FTO, con peso corporal, IMC, % de masa grasa, PC y con los marcadores metabólicos insulina, HOMAIR, leptina y cHDL. Un estudio anterior, realizado por este equipo de investigadores en la misma cohorte, reportó una asociación del SNP rs9939609 con los mismos marcadores de adiposidad señalados (10). En este contexto, estos datos sugieren que ambos polimorfismos constituyen un grupo de ligamiento que confiere riesgo elevado de obesidad en los portadores. Además, al comparar la fuerza de asociación del genotipo de riesgo de FTO (grFTO) con los diversos parámetros estudiados mediante el coeficiente beta estandarizado, observamos que peso corporal, IMC, HOMAIR e insulina presentan la mayor magnitud de asociación (en orden decreciente de importancia), lo cual revela una estrecha vinculación del grFTO con alteraciones en obesidad y en el metabolismo glucídico. No obstante, se identificó que la presencia del alelo de riesgo está asociada a niveles de insulina y leptina sobre los rangos normales para la población chilena 23. Por lo tanto, nuestros datos establecen una clara asociación del grFTO con resistencia a la insulina y leptina, lo que sugiere un riesgo elevado de desarrollar DMT2 en edades más avanzadas.
Estudios realizados en diversas poblaciones han evidenciado la asociación del gen FTO con DMT2, observándose una correlación positiva en los metaanálisis realizados 13,14. En una revisión sistemática previa, que incluyó un análisis de autocorrelación espacial, se observó que la asociación de grFTO con DMT2 es altamente dependiente de la localización geográfica, identificándose asociaciones entre los SNP rs9939609 y rs8050136 con DMT2 en poblaciones asiáticas, pero no en poblaciones norteamericanas 15. Este trabajo destaca la importancia de contar con estudios de asociación de grFTO en poblaciones con diversa etnicidad y que habitan en distintos lugares geográficos, tal como la presente investigación, que corrobora por primera vez la relación entre el polimorfismo rs3751812 del gen FTO y alteraciones metabólicas asociadas al desarrollo de DMT2 en población chilena.
Numerosos estudios han reportado que el gen FTO se expresa en el hipotálamo y tendría un rol como sensor del nivel plasmático de nutrientes y control de la ingesta energética, lo cual da luces sobre la relación entre los polimorfismos del gen FTO y el mayor riesgo de obesidad 24. En contraste, la evidencia que vincula a FTO con el metabolismo glucídico es limitada, aunque existen algunos estudios in vitro y en modelos animales que muestran que FTO participa en el control glicémico reprimiendo la expresión de enzimas regulatorias de la gluconeogénesis en respuesta a la hiperglicemia e hiperinsulinemia 25. En la misma línea, se reportó que la sobreexpresión del gen FTO en el hígado de ratones provoca desensibilización del receptor de leptina hepático debido a alteraciones inducidas por FTO en la vía de señalización JAK/STAT3, lo que conduce a una respuesta compensatoria de hiperleptinemia e hiperinsulinemia 26. Es probable que una alteración equivalente pueda ocurrir en humanos portadores del grFTO, debido a que se ha encontrado una mayor expresión del alelo de riesgo respecto al alelo normal en sangre y en fibroblastos de individuos heterocigotos para el gen FTO 27. Los niveles elevados de insulina y leptina en portadores del grFTO encontrados en nuestro estudio concuerdan con la evidencia actual y apoyan la noción de que el gen FTO representa un determinante molecular común para obesidad y DMT2 en virtud de los distintos roles que cumpliría en tejidos nervioso y hepático.
LIMITACIONES
Una limitación de nuestro estudio es la selección de una población sin historial de enfermedades metabólicas y con un promedio de edad inferior a los 40 años, lo cual impide establecer una asociación del gen FTO con DMT2 y con síndrome metabólico. No obstante, los datos obtenidos sugieren la existencia de tal asociación, ya que, además de las alteraciones encontradas en el metabolismo glucídico y en marcadores de adiposidad, se encontraron niveles disminuidos de cHDL en los portadores de grFTO. En la literatura, la asociación entre el gen FTO y el síndrome metabólico ha sido reportada para diversas poblaciones 28, encontrado algunos de ellos que la asociación es más frecuente en mujeres 29,30. El tamaño muestral de este análisis tampoco permitió realizar estudios comparativos entre sexos, pero sí fue suficiente para demostrar una asociación del SNP rs3751812 del gen FTO con alteraciones en el metabolismo glucídico y lipídico en una población joven, lo cual sugiere que el gen FTO podría constituir un marcador genético de riesgo temprano a enfermedades metabólicas.
CONCLUSIÓN
El presente estudio permite concluir que el SNP rs3751812, del gen FTO, está asociado a alteraciones metabólicas como hiperinsulinemia e hiperleptinemia, que podrían predisponer al desarrollo de DMT2 y síndrome metabólico. Dada la estrecha relación existente entre obesidad y DMT2, son esenciales todas las iniciativas orientadas a mitigar el aumento de la prevalencia de estas patologías en Chile. Hasta ahora, los esfuerzos desplegados para mejorar los estilos vida asociados a obesidad y DMT2 aún no logran revertir el aumento sostenido de los índices de estas patologías a nivel mundial 31, por lo cual resulta pertinente explorar enfoques complementarios para mejorar las guías usadas en la prevención de la DMT2 y la obesidad, entre ellas, la identificación de nuevos marcadores de predisposición genética a enfermedades metabólicas.