INTRODUCCIÓN
La nutrición parenteral a domicilio (NPD) consiste en la administración de nutrientes por vía intravenosa en el domicilio del paciente con fracaso intestinal (FI) 1. Se introdujo en España en la década de los 80. Es un tratamiento eficaz para mejorar el estado nutricional y la calidad de vida de los pacientes candidatos. Es una técnica compleja cuyo resultado depende de su correcta indicación, la preparación de las bolsas de nutrientes y la educación sanitaria específica del paciente, junto al cuidado estricto del catéter. Todo ello requiere de la colaboración de un equipo multidisciplinario.
Los pacientes candidatos a NPD presentan un FI que comporta una disminución de la funcionalidad intestinal reduciendo de manera significativa la capacidad de absorción de nutrientes, agua y electrolitos, y requiriendo de suplementos intravenosos para mantener la salud y/o el crecimiento 2. El FI sin tratamiento acarrea desnutrición, complicaciones metabólicas (deshidratación o insuficiencia renal) e incluso la muerte. Principalmente, esta situación ocurre en el síndrome de intestino corto (SIC). El FI en el SIC puede ser transitorio o crónico, según el tiempo de evolución, la longitud del intestino delgado residual, la continuidad del colon, la etiología del trastorno y la funcionalidad de las mucosas del remanente intestinal. La enfermedad subyacente que conduce más frecuentemente al FI crónico (FIC) es la enfermedad vascular mesentérica, incluidas también enfermedades intestinales inflamatorias como la enfermedad de Crohn, la pseudoobstrucción intestinal crónica, las fístulas intestinales, la enteritis por radiación y otras complicaciones derivadas de una neoplasia generalmente del aparato digestivo, ginecológico o de cirugía abdominal 3.
La NPD es el tratamiento de elección para el FIC. Sin embargo, su uso no está exento de riesgos. Una de sus complicaciones principales es el desarrollo de infecciones locales y sistémicas en relación con la vía de acceso utilizada para su administración. Otras complicaciones son la trombosis venosa y la pérdida del acceso venoso, la hepatopatía asociada a NPD (que puede conducir al deterioro progresivo de la función hepática e incluso a insuficiencia hepática) y la enfermedad metabólica ósea. En adultos, la esteatosis es más común y se presenta en el 40-55% de los pacientes con SIC, de los cuales el 5-15% desarrollará insuficiencia hepática 2. El intestino tiene una capacidad inherente para adaptarse tanto funcional como morfológicamente, siempre que la nutrición por vía digestiva (oral/enteral) sea posible, generalmente en los dos primeros años 4. En alrededor del 50% de los casos dependen de la continuidad del colon y la etiología subyacente. El trasplante intestinal (TI) es una alternativa para pacientes con alto riesgo de muerte debido a las complicaciones de la NPD, en casos de SIC grave o para aquellos que no pueden hacer frente al manejo de la NPD. Sin embargo, a pesar de su relativa seguridad y eficacia, el TI no ha demostrado mejorar la supervivencia de los pacientes respecto a mantener la NPD 5,6.
La edad del paciente y la enfermedad subyacente son factores pronósticos para la dependencia a la NPD y la supervivencia del paciente. La causa de muerte en estos pacientes no establece una clara relación con la duración de la NPD. Sin embargo, los estudios realizados hasta la fecha se han limitado a cortos periodos de seguimiento, no tienen establecida claramente una tasa de retirada de la NPD y tampoco han descrito la causa de muerte 3. El objetivo del presente estudio es aportar la experiencia de 32 años de nuestro grupo en el programa de NPD, con la descripción de las características clínicas y la evolución de los pacientes incluidos.
MATERIAL Y MÉTODOS
Se ha realizado un estudio longitudinal retrospectivo descriptivo de una cohorte de 61 pacientes que han recibido NPD iniciada en un hospital de tercer nivel, el Hospital Universitario de Bellvitge, L'Hospitalet de Llobregat (Barcelona), desde el 1 de enero de 1985 hasta el 31 de diciembre de 2017.
Los datos de cada paciente del estudio se obtuvieron de la revisión de la historia clínica y del registro del grupo NADYA-SENPE (www.nadya-senpe.com). Los datos incluyeron: variables demográficas (sexo y edad), fecha de inicio y fin de la NPD, tipo de NPD (parcial o total), tipo de catéter empleado, diagnóstico de la enfermedad primaria, causas de FI, complicaciones infecciosas relacionadas con el catéter y su etiología microbiana y enfermedad hepática derivada de la NPD.
En cuanto a la composición de las fórmulas de NPD, las emulsiones lipídicas utilizadas en estos años han ido evolucionando, desde el inicio con las emulsiones a base de aceite de soja (Intralipid®) o las mezclas de MCT/LCT al 50% (Lipofundin® MCT/LCT). A partir de su comercialización se incorporaron las emulsiones a base de aceite de oliva (Clinoleic®) y en los últimos años se han sustituido por las emulsiones tipo SMOFlipid®. También cabe destacar que nuestro grupo siempre ha seguido la línea de mantener aportes moderados de glucosa (3-5 g/kg/d) y evitar la hiperalimentación.
Se estableció la fecha de inicio de la NPD en el mismo centro hospitalario. La fecha de finalización de la NPD se determinó cuando hubo paso a dieta oral o nutrición enteral exclusivas o exitus del paciente. La NPD pudo ser total o parcial, es decir, combinada con dieta oral o exclusiva como soporte nutricional. El tipo de catéter empleado fue el venoso tunelizado, el implantado con reservorio subcutáneo o el catéter central de inserción periférica (PICC).
Se contabilizaron las infecciones por catéter asociadas a bacteriemia que desarrollaron los pacientes, diagnosticadas mediante cultivos del catéter o hemocultivos, con su etiología microbiana. Se detallan los casos donde el tratamiento para la infección fue el sellado con antibiótico del catéter y aquellos en los que se empleó taurolidina de forma profiláctica. Para prevenir las complicaciones asociadas a la NPD se realizó educación sanitaria durante el ingreso a todos ellos.
ANÁLISIS ESTADÍSTICO
Todos los pacientes fueron seguidos hasta la retirada de la NPD por mejoría o fallecimiento. La duración de la NPD fue calculada como la diferencia de tiempo entre el inicio de NPD y su retirada. Se hicieron comparaciones del subgrupo de menos de 40 años con el resto, así como del grupo con más de cinco años de tratamiento y el resto, usando la prueba de Chi-cuadrado. Medianas, desviaciones estándar y frecuencias fueron utilizados como estadísticas descriptivas. El paquete estadístico empleado para dichos análisis fue el Stata/PC para Windows, versión 14. Un valor p de dos colas < 0,05 se consideró como estadísticamente significativo.
RESULTADOS
CARACTERÍSTICAS DE LOS PACIENTES
Las características de los pacientes se muestran en la Tabla 1. El estudio contiene una muestra de 61 pacientes compuesta por 29 mujeres y 32 hombres, con una mediana de edad de 51,2 años (20 a 74). Se subdivide en dos subpoblaciones de edad, con lo que se obtienen once pacientes con menos de 40 años al inicio de NPD y 50 pacientes mayores de 40 años al inicio del tratamiento. Recibieron NPD parcial con alimentación vía oral 45 pacientes (73,7%) y NPD total 16 de ellos (26,2%). El catéter más empleado fue el venoso tunelizado tipo Hickman (88,5%), seguido por el implantado con reservorio subcutáneo (9,8%). Únicamente en un caso se utilizó PICC. En lo que se refiere a la situación actual de la NPD, 20 pacientes (32,8%) la suspendieron por paso a vía oral, 26 (42,6%) fallecieron y 15 (24,6%) la mantienen (Fig. 1). No se pudieron obtener datos de forma homogénea del estado nutricional y de hidratación de los pacientes.
Tabla I. Características de nuestra serie

NPD: nutrición parenteral a domicilio; CVC: catéter venoso central; PICC: catéter central de inserción periférica; SIC: síndrome de intestino corto.
En el estudio hemos realizado la distinción entre indicación de NPD, patología de base causante de FI y causas de muerte por cualquier causa, como veremos a continuación.
La indicación de NPD se clasificó en cinco categorías patogénicas: SIC, obstrucción intestinal, malabsorción, fístula intestinal y desnutrición por caquexia cardiaca. El SIC fue la principal (71%) (Fig. 2). Dentro de este subgrupo de pacientes con SIC, en 18 (42%) la enfermedad subyacente más frecuente fue la isquemia mesentérica (Fig. 3).
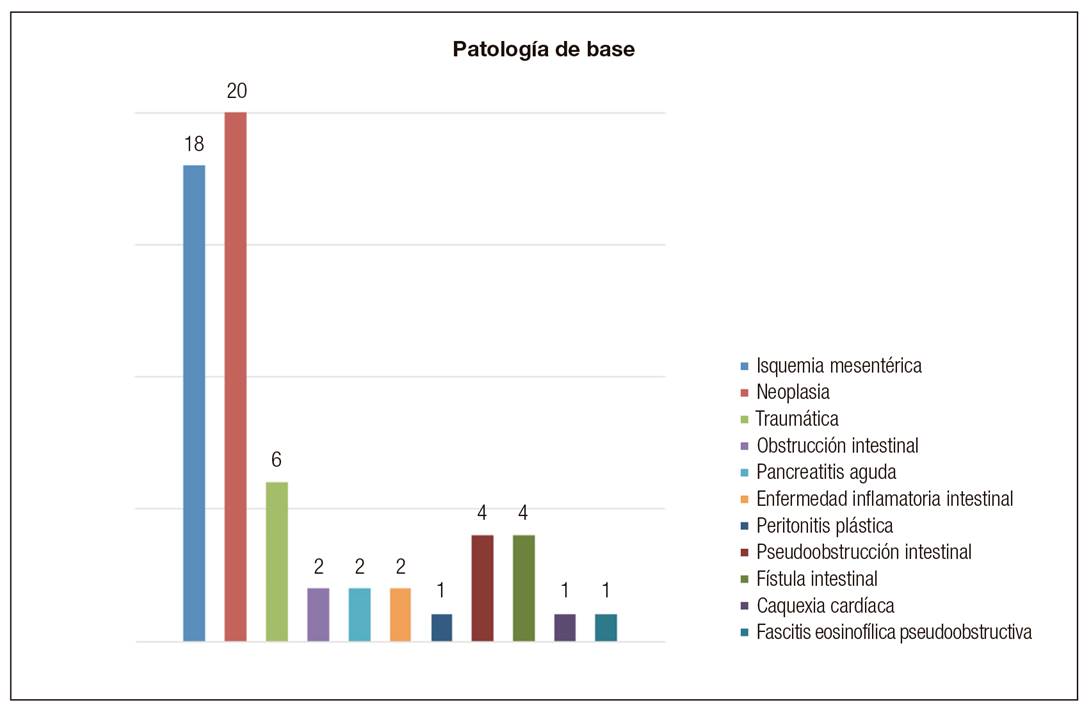
Las patologías de base causantes de FI fueron: isquemia mesentérica, neoplasia, enfermedad inflamatoria intestinal (Crohn o colitis ulcerosa), pseudoobstrucción intestinal, traumatismo abdominal o complicación quirúrgica de cirugía abdominal. De ellas, la más frecuente de la serie fue la neoplasia, con un total de 20 pacientes (33%) y en segundo lugar la isquemia mesentérica, presente en 18 (29,5%) (Fig. 4). La necesidad de NPD secundaria a neoplasia fue por enteritis rádica en seis pacientes (30%) y como tratamiento paliativo en cuatro (20%). El 50% restante inició NPD por SIC consecuencia de cirugía con intención radical. Las neoplasias diagnosticadas con necesidad de NPD por diferentes motivos fueron: colorrectal (seis), ginecológicas (tres), intestinal (dos), gástrica (dos), síndrome de Gardner (dos), VIPoma (una), linfoma intestinal (una), páncreas (una), esófago (una) y mesotelioma peritoneal (una).
La causa más frecuente de muerte fue por neoplasia en 12 pacientes (46,2%) y el motivo de indicación de NPD en este subgrupo de pacientes fue por SIC en diez de ellos. La segunda causa de muerte fue la hepatopatía asociada a NPD, que tuvo lugar en cuatro (15,4%) pacientes. Cabe destacar que, de los pacientes que desarrollaron hepatopatía con insuficiencia hepática, ninguno de ellos podía recibir nutrición por vía digestiva. Fueron exitus antes de los cinco años del inicio de la NPD 18 pacientes, 69,2% de los fallecidos, once de los cuales tenían neoplasia.
DURACIÓN DE NPD
La duración mediana de la NPD fue de 25 meses (1-394) y en 24 pacientes (39,3%) fue mayor a cinco años. En este subgrupo donde la NPD duró más de cinco años, actualmente 15 continúan en tratamiento activo, ocho han fallecido y a uno se le retiró la NPD por mejoría con tratamiento mediante el análogo del péptido similar al glucagón 2 (GLP-2), teduglutida. Solamente en uno de los ocho fallecidos la enfermedad subyacente fue la oncológica no relacionada con la NPD y en el resto fue por enfermedad cardiovascular, renal o infecciosa. La mediana de duración de la NPD de todos los pacientes de este subgrupo de más de cinco años es de 12,5 años (cinco a 24).
En el subgrupo que inició la NPD antes de los 40 años no se objetivan diferencias estadísticamente significativas comparadas con el resto respecto a la duración de la NPD (mayor de cinco años) y tampoco respecto a la muerte. Sin embargo, de los once pacientes de este subgrupo, destacamos que en tres de ellos la enfermedad subyacente fue una neoplasia y fallecieron antes de los cinco años.
En los 37 pacientes en los cuales la duración de la NPD fue inferior a cinco años, esta se retiró en 14 en el primer año, en ocho durante el segundo año, en ocho en el tercer año, en cuatro en el cuarto año y en tres en el quinto año. En 18 de ellos el motivo de retirada fue por fallecimiento (12 de ellos los dos primeros años) y el resto, por paso a vía oral o enteral tras reconstrucción quirúrgica del tránsito digestivo y adaptación intestinal. La retirada por dicha mejoría en nuestra cohorte ocurrió en ocho el primer año, en dos el segundo, en tres el tercero, en cuatro el cuarto y en dos el quinto año. Se observó que a nueve pacientes se les retiró la NPD por mejoría después de los dos años de seguimiento. La indicación de NPD en estos casos fue el SIC y la patología de base fue: traumatismo, isquemia mesentérica, fístula intestinal, neoplasia de colon-sigma, enfermedad de Buerger, trombosis mesentérica y complicaciones de cirugía abdominal.
COMPLICACIONES INFECCIOSAS DEL CATÉTER
Las infecciones como la bacteriemia asociada a catéter representan una de las principales complicaciones en pacientes portadores de NPD. En nuestra serie se objetivaron 105 infecciones de catéter en 35 pacientes (54%) con más de un episodio en 24 de ellos (72,7%), con una tasa global de infección de 1,04 por 1.000 días de cateterización en todo el periodo de seguimiento (Fig. 5).

Figura 5. Evolución a lo largo de los 30 años del número de infecciones y el número de pacientes incluidos de nuestra serie
La principal etiología microbiana es de origen cutáneo, aislándose Staphylococcus coagulasa negativo en el 46%, seguido de bacilos Gram negativos (30%): Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae y Serratia liquefaciens. Un 9% de las infecciones fueron por Staphylococcus aureus y un 15% corresponden a un subgrupo donde englobamos Candida (guillermondii, parapsilosis, glabrata), Staphylococcus hominis y Mycobacterium chelonae (Fig. 6).
En nuestra serie se inició el sellado antibiótico del CVC en 2009 y se han tratado seis pacientes permitiendo mantener el uso del catéter. El sellado presentó una duración media de 11,9 días y se emplearon los siguientes antibióticos: gentamicina, vancomicina, amikacina y daptomicina. Dos pacientes realizaron el tratamiento a domicilio, mientras que el resto precisó ingreso hospitalario, con una estancia media de 29,4 días. Fue una técnica efectiva, con un 77,8% de curación.
También se ha incorporado la taurolidina como tratamiento para prevención primaria y secundaria, empleándose en cinco pacientes. Se han establecido dos perfiles de paciente para su empleo: aquellos con alto riesgo de sepsis por inmunodeficiencia o presencia de ostomía y aquellos con alta tasa de infecciones asociadas a catéter previo. Se observó una disminución de la incidencia de complicaciones sépticas en prevención secundaria en tres pacientes, con una reducción de los episodios (pre/postaurolidina) de 1/0, 24/1 y 11/0. Por otro lado, en los dos pacientes en los cuales se instauró de forma profiláctica simultánea al inicio de la NPD no se ha producido ninguna infección.
DISCUSIÓN
La NPD es un tratamiento complejo que se está utilizando desde hace más de 30 años en nuestro hospital y en toda España 3,6. El número de pacientes que recibe este tratamiento está creciendo. Un estudio europeo informó de una prevalencia de 2-40 por millón de habitantes y una incidencia de 4-6 por millón/año de NPD en pacientes con enfermedades primarias benignas, con un 35% por SIC 7. En España, los datos recogidos en el registro NADYA-SENPE en 2016 recopilan 286 pacientes (54,2% mujeres), 34 niños y 252 adultos, con una tasa de prevalencia de 6,16 pacientes/millón de habitantes/año. El diagnóstico más frecuente en adultos fue el oncológico paliativo (25,8%). En niños, fueron las alteraciones de la motilidad con seis casos (17,6%), la enfermedad de Hirschsprung y la enterocolitis necrotizante, ambos con cinco casos (14,7%). El primer motivo de indicación fue el SIC tanto en niños (64,7%) como en adultos (37,3%), seguido de la obstrucción intestinal, 28,6% en adultos y 14,7% en niños. Durante este periodo, finalizaron 71 episodios en adultos cuya causa de finalización principal fueron el fallecimiento (57,7%) y el paso a ingesta oral (31%) 8.
Iniciar NPD es una experiencia estresante y se asocia con un coste económico considerable para los sistemas de salud. Cuando se considera su indicación, los equipos médicos deben tener en cuenta aspectos como el apoyo familiar, la calidad de vida que puede lograrse y, en pacientes con cáncer, las posibilidades (o el tiempo estimado) de supervivencia 7. El presente estudio describe el seguimiento de una cohorte de 61 pacientes adultos inscritos en el programa de NPD de un hospital terciario universitario para el tratamiento del FI de diferentes etiologías. En nuestros resultados, el SIC en adultos sigue siendo la principal causa de FI (70,5%) con dos principales etiologías: la isquemia mesentérica (42%) y las consecuencias del tratamiento activo de la neoplasia (32%). En nuestra serie, el catéter tunelizado fue el más empleado, seguido del reservorio, que coincide con los estándares en España 9. El catéter tunelizado es la primera opción para pacientes con afección benigna subyacente, mientras que el catéter de reservorio es una opción válida en pacientes con cáncer porque permite la compatibilidad de acceso por vía intravenosa de quimioterapia 9,10. Sin embargo, existen estudios que defienden/recomiendan el uso de PICC en pacientes oncológicos 11. Asimismo, también está creciendo el uso de PICC no solamente para pacientes oncológicos sino como alternativa al catéter tunelizado, como un paciente de nuestra serie.
Del mismo modo que para otros estudios, describimos un alto grado de dependencia de la NPD, ya que registramos una mediana de duración de 12,5 años en los 24 casos que superaron los cinco años de NPD. Probablemente, estas cifras son debidas a que la mayoría de dichos pacientes han presentado una patología benigna. Por otro lado, del subgrupo de 37 pacientes que finalizaron la NPD antes de los cinco años, en 18 casos fue por exitus (12 antes de los dos años). Esto corresponde al 48,6% del subgrupo, lo que muestra la relevancia de la enfermedad subyacente como factor pronóstico. Por otro lado, destaca que se retiró la NPD por mejoría el primer año en ocho pacientes (21,6%) de este subgrupo por tratarse de pacientes con FIC que recuperaron su autonomía con la reconstrucción del tránsito intestinal 2.
La retirada de la NPD y la rehabilitación intestinal después de la resección masiva han sido ampliamente estudiadas en poblaciones con SIC. Se han identificado predictores de ello: la longitud remanente del intestino delgado, la presencia de colon en continuidad, la enfermedad subyacente y la tasa de complicaciones. Después de una reducción masiva del intestino delgado, este muestra cambios funcionales y morfológicos para compensar la pérdida de su función absortiva. Cabe recordar que la adaptación intestinal es específica del SIC. Se ha descrito que una adaptación intestinal completa puede lograrse a los dos años en pacientes adultos con colon en continuidad 4. Sin embargo, en nuestra cohorte, a nueve pacientes se les retiró la NPD por mejoría entre 2-5 años después de su inicio, lo que indica que la adaptación intestinal es un proceso continuo que puede durar más tiempo. Por ello, en nuestra cohorte, donde encontramos causas mixtas de FI, objetivamos que a pesar de que la capacidad de adaptación intestinal generalmente se alcanza a los dos años, existe la posibilidad de retirada de la NPD dentro de los cinco años iniciales de tratamiento, lo que indica que la rehabilitación puede ocurrir durante un periodo más prolongado de tiempo. Este dato es concordante con otras publicaciones 4 que también establecen un margen más amplio para dicha adaptación, ya que el periodo de tiempo propuesto más habitualmente se ha situado (establecido) alrededor de los dos años.
Como estudio retrospectivo, existen limitaciones en la obtención de todos los datos, como la longitud exacta del intestino remanente y del colon. Estos diferentes aspectos explican por qué no hemos podido evaluar con mayor precisión los factores predictivos. Sin embargo, encontramos que la retirada de la NPD no debida a exitus fue más frecuente en pacientes con isquemia intestinal 7 en primer lugar, en segundo lugar por neoplasia no avanzada 6 y en tercer lugar por fístula intestinal 4. El seguimiento específico que asocia el manejo nutricional, el tratamiento quirúrgico con reconstrucción del tránsito intestinal y el tratamiento de las complicaciones permiten recuperar autonomía por vía digestiva. Por lo tanto, habrá un grupo de pacientes que a priori presentan FIC que alcanzan la autonomía nutricional, por lo que acabaría siendo un FI transitorio gracias a la atención por un equipo multidisciplinar de expertos 7. Sin embargo, la mitad de los pacientes con FIC, por sus condiciones clínicas, sigue dependiendo de NPD a los cinco años a pesar del equipo multidisciplinar que les acompaña.
En nuestra cohorte se muestra que la supervivencia de los pacientes con NPD se predice por la enfermedad subyacente y no por la edad al inicio de NPD, como ya describe literatura previa, donde no hay diferencias entre pacientes de mayor o menor edad sin enfermedad crítica que reciban nutrición parenteral 5,12. Se entiende que la edad puede ser un factor determinante debido al riesgo de comorbilidades, como demuestran otros estudios 3. Sin embargo, el diseño de este trabajo no permite especificar las comorbilidades y su gravedad. Por tanto, parece necesario evaluar en futuros estudios precisamente esas comorbilidades que siguen siendo uno de los principales elementos que pueden determinar el pronóstico.
Como ya se ha comentado, el riesgo de muerte fue más alto en los primeros cinco años (69,2%) y la mayoría de estas muertes fueron debidas a una neoplasia subyacente (66,7%). En nuestro centro, las consecuencias que se derivan de su tratamiento (como la radioterapia o la cirugía) fueron la causa más común para iniciar NPD, a diferencia de otros estudios 7.
Nuestro trabajo confirma que las complicaciones de la NPD no representaron una causa principal de muerte en los primeros cinco años. Esto probablemente esté relacionado con la creación de equipos multidisciplinares 13. Como describe la literatura reciente 14, en nuestra serie se observa que a medida que han transcurrido los años se ha reducido el número de infecciones relacionadas con la NPD, probablemente debido a los mejores cuidados y a la incorporación de una enfermera para la educación sanitaria de la NPD. Otro factor que ha favorecido dicha disminución ha sido el uso de taurolidina como antiséptico profiláctico, que aún no se ha establecido de forma habitual en las guías de práctica clínica 1. Recientemente se ha descrito un mayor beneficio en el uso de taurolidina como prevención secundaria 15, y en nuestra experiencia también se obtuvo un beneficio excelente. Para la conservación del CVC, el tratamiento de la infección aguda de catéter con sellado antibiótico ha supuesto una buena alternativa para la resolución de la infección con conservación de los accesos venosos 16,17. En nuestra serie, el sellado ha supuesto una opción terapéutica efectiva con un 77,8% de curación, lo que ha permitido mantener los accesos venosos centrales y prevenir nuevas complicaciones asociadas a la reinserción del CVC. Nuestros resultados refuerzan el uso del sellado del catéter o la taurolidina 18,19, siendo ambas estrategias beneficiosas tanto para el tratamiento como para la profilaxis. El origen de la sepsis por catéter suele relacionarse con la inadecuada manipulación del mismo, por ello la principal etiología microbiana es de origen cutáneo 20. Así que la educación sanitaria en el manejo del catéter es un elemento clave, de tal manera que en las guías ESPEN de FIC el grado de recomendación es fuerte 21.
La enfermedad hepática como complicación metabólica de la NPD fue la causa de exitus en cuatro casos de nuestra cohorte (15,4% de los fallecidos), de los cuales ninguno recibía nutrición por vía digestiva debido a su patología de base. Además, dichos pacientes, como se comenta en el apartado referido a material y métodos recibieron emulsiones lipídicas a base aceite de soja o mezcla de MCT/LCT al 50%. La prevalencia de anomalías hepáticas, como por ejemplo esteatosis o colestasis, en las series de NPD de la década de 1970 fue alta 9. De ellos, progresaron a enfermedad hepática avanzada (cirrosis o insuficiencia hepática) el 15-40% de casos. La relación entre esta complicación y la afección subyacente o el reposo intestinal (es decir, pacientes sin ingesta oral) no se encontró. Sin embargo, esta asociación ha sido descrita por otros autores 22,23,24. En estudios recientes, el uso de emulsiones lipídicas que contienen diversas fuentes de ácidos grasos ha resultado en la disminución de la incidencia de enfermedad hepática y una mejor evolución clínica 6,25, así como el uso de la vía digestiva concomitantemente ha demostrado ser un factor decisivo 22,24. Además, la presencia de fitoesteroles en las emulsiones lipídicas de origen vegetal se ha relacionado con la aparición de alteraciones de los parámetros de la función hepática 26. Las emulsiones lipídicas registradas en el mercado farmacéutico español contienen cantidades variables de fitoesteroles en función de la marca comercial y el lote. La determinación del contenido de fitoesteroles, actualmente no declarados, permitiría desarrollar estrategias para prevenir o tratar la aparición de estas alteraciones 27.
Cabe destacar que en nuestra serie no se ha realizado ningún TI, probablemente por la alta complejidad y los resultados limitados de esta opción terapéutica. Sin embargo, también es infrecuente o tiene una baja indicación en el resto de Europa, dada la buena supervivencia de los pacientes con NPD, lo que muestra que es esencial identificar a los pacientes que realmente pueden beneficiarse de él 5. Además, el desarrollo de tratamientos nuevos y prometedores para el SIC, como la teduglutida, puede reducir aún más las indicaciones de TI por su efecto trófico sobre la mucosa intestinal, aumentando la absorción intestinal y de ahí, causando una reducción en la dependencia de NPD, como en un caso de nuestra serie 28,29,30.
Otra limitación del estudio, al tratarse de un análisis retrospectivo, es que las complicaciones no infecciosas no han podido ser reflejadas.
Este trabajo confirma que el manejo de pacientes con FIC requiere un abordaje multidisciplinar para reducir el riesgo de complicaciones y mortalidad asociadas a la NP. Además, se muestra que la NPD per se no es la principal causa de mortalidad, ya que es determinante la enfermedad subyacente. Sobre todo en la etapa inicial del tratamiento, es primordial la estimulación de la vía enteral para lograr una mayor adaptación intestinal y reducir las necesidades e incluso una posible retirada de la NP 4. Asimismo, es fundamental mantener los equipos multidisciplinares que se van consolidando para reducir la tasa de complicaciones e identificar las posibles comorbilidades.
En resumen, la NPD es una estrategia terapéutica útil en pacientes con FIC, aunque es importante mantener el estímulo de la alimentación oral. El SIC por neoplasia o isquemia mesentérica es la indicación más frecuente de NPD. Será la patología de base, como la neoplasia, lo que marcará un peor pronóstico. Dada la frecuencia de infecciones de catéter, creemos necesario hacer hincapié en la educación sanitaria y la profilaxis antiséptica para mejorar la tasa de complicaciones.