INTRODUCCIÓN
La obesidad es una pandemia que afecta a más de 300 millones de personas en todo el mundo. Según datos de Unicef, México ocupa el segundo lugar a nivel mundial en obesidad en adultos y el primer lugar en niños 1,2. Este padecimiento se ha asociado a múltiples enfermedades metabólicas, como diabetes mellitus (DM), hipertensión arterial (HTA), dislipidemias 3,4 y, recientemente, a la enfermedad periodontal (EP) 5,6,7,8,9,10,11, que en México se considera también un problema de salud pública, ya que se estima que el 90% de la población mayor de 45 años presenta algún grado de EP 12; a nivel mundial, la OMS la coloca como la segunda enfermedad bucal más prevalente 12,13.
La EP se describe de forma general como gingivitis y periodontitis. Es producida principalmente por agentes infecciosos de la placa dentobacteriana (PDB) 14,15. En ambos casos se inicia un proceso de inflamación y producción de especies reactivas de oxígeno (ERO), pero en la segunda existe pérdida de tejido de soporte dental ocasionada por la activación de enzimas proteolíticas llamadas metaloproteinasas (MMP), capaces de contribuir a la destrucción del periodonto 14,16,17,18. Se ha reportado la activación de estas moléculas en enfermedades sistémicas crónicas como DM, HTA y dislipidemias 3,4. Estas proteínas forman parte de una superfamilia de enzimas con actividad proteolítica que rompen las cadenas de colágeno intersticial tipos I, II y III. Normalmente intervienen en el remodelado de tejidos; sin embargo, en procesos patológicos, como en la periodontitis crónica (PC), afectan a las fibras periodontales y al tejido adyacente responsable de mantener al órgano dental en el alveolo 19. Algunas de las más estudiadas en esta enfermedad son las colagenasas (MMP - 1, MMP-3, MMP-8 y MMP-V) 14,19. El tratamiento de la EP consiste en el control de PDB, en la remoción manual del cálculo dental, raspado y alisado radicular, y, en casos avanzados, en el injerto de hueso o encía, esto acompañado en algunas ocasiones de antibióticos locales y antioxidantes 20. Sin embargo, a pesar de la terapia, algunos pacientes no responden adecuadamente, lo que lleva a pensar que existen factores intrínsecos del huésped que contribuyen a la mala respuesta al tratamiento.
Las enfermedades crónico-degenerativas y la enfermedad periodontal en la mayoría de los casos tienen como factor común la obesidad 5,21,22. Está demostrado que la acumulación de grasa produce un estado proinflamatorio crónico sistémico mediado por adipocinas e interleucinas capaces de activar MMP 23,24,25, lo que podría estar propiciando la mala respuesta al tratamiento periodontal. Dentro de las guías de tratamiento para estos padecimientos, se indica la disminución del índice de masa corporal (IMC) mediante dieta y ejercicio, con lo que se obtiene mejoría en las patologías asociados a la obesidad 26, pero no existe farmacoterapia bien establecida en los casos en que esta intervención no funcione adecuadamente. La OMS sugiere como terapia adyuvante el manejo con metformina 26. Este fármaco mejora la sensibilidad a la insulina mediante la optimización del uso de glucosa en tejidos como el hígado o el músculo, lo que evita la generación de productos finales de la glicación, que están implicados en la degeneración y el daño de tejido periodontal 27,28. También aumenta la lipólisis y la beta-oxidación en el tejido adiposo blanco, lo que reduce la acumulación de triglicéridos, con lo que se disminuye la producción de citocinas y el estado proinflamatorio 29,30. También se ha demostrado que tiene un efecto antioxidante sistémico 29,31,32, con lo que disminuye la adhesión de neutrófilos y la quimiotaxis, evitando así el daño oxidativo local y el general 27.
El objetivo de este trabajo fue evaluar el efecto del control de la obesidad de clase I con metformina sobre la actividad de las MMP en el periodonto de pacientes con periodontitis crónica.
MATERIAL Y MÉTODOS
POBLACIÓN DE ESTUDIO
Se realizó un estudio clínico controlado en 68 mujeres entre 40 y 45 años que asistieron a la clínica Dr. Salomón Evelson Guterman de la Facultad de Odontología de la Universidad Nacional Autónoma de México, que fueron diagnosticadas con PC en al menos un cuadrante bucal y que, además, tuvieran diagnóstico de obesidad de clase I, sin tratamiento médico previo, sin otras alteraciones metabólicas o médicas y que hubieran firmado el consentimiento informado. Se excluyeron del estudio pacientes que no cumplían con dichos criterios. Este estudio cumplió con los lineamientos del Consolidated Standars of Reporting Trials (CONSORT). El protocolo fue controlado y autorizado por el comité de ética e investigación de la Facultad de Odontología de la Universidad Nacional Autónoma de México.
DIAGNÓSTICO DE OBESIDAD DE CLASE I
El diagnóstico de obesidad de clase I se realizó mediante la medición de peso, talla y el cálculo del IMC, tomando como referencia el parámetro de 30 a 34,9 kg/m2 como obesidad de clase I, según criterios de la OMS. Todos los datos se tomaron por triplicado y fueron verificados por un médico especialista. Todas las pacientes incluidas en el estudio se remitieron al departamento de nutrición para iniciar un programa adecuado a sus necesidades de alimentación y ejercicio.
EXAMEN BUCAL
El diagnóstico de enfermedad periodontal fue realizado por un cirujano dentista y un especialista en periodoncia que tomó como parámetros el índice de placa dentobacteriana (IPDB) y la profundidad de sondeo (PS), considerando el índice de inflamación gingival (IIG) de Löe y Silness 33. El criterio utilizado para el diagnóstico de periodontitis generalizada y localizada está basado en los criterios de la Academia Americana de Periodontología (AAP) en su International Workshop for Classification of Peiodontal Diseases and Conditions de 1999. En base a su extensión se divide en: periodontitis localizada a la presencia de la enfermedad en ≤ 30% de los dientes presentes y periodontitis generalizada en ≥ 30,1% de los dientes presentes.
DESARROLLO DEL ESTUDIO
Todas las pacientes recibieron tratamiento periodontal, que consistió en el registro de periodontograma y medición del índice de inflamación gingival (IIG), control de placa dentobacteriana (PDB) y toma de muestra inicial de tejido periodontal de 2 mm de diámetro. Posteriormente, se dividieron en 4 grupos: 2 grupos control, 1 con periodontitis crónica localizada (PCL) y otro con periodontitis crónica generalizada (PCG); 2 grupos con tratamiento de 850 mg de metformina cada 24 horas 29 durante seis semanas, 1 grupo con PCL y otro con PCG (ambos grupos fueron aleatorizados con su grupo control). Una vez que se logró disminuir el índice de placa dentobacteriana al 10% de la inicial, se realizó raspado y alisado radicular y se recolectó la segunda muestra de tejido durante el procedimiento. Las muestras fueron procesadas mediante zimografía en gel de acrilamida y los resultados fueron escaneados y analizados mediante densitometría 34. En todos los grupos se midió el índice de placa dentobacteriana (IPDB), IIG y IMC cada semana durante las 6 sesiones que duró el estudio.
TOMA DE MUESTRAS
Después de realizar asepsia del área en la que se tomó la muestra, se anestesió de forma regional para evitar que el anestésico tuviera contacto directo con el tejido a recolectar (la toma de muestra de la encía se hizo mediante la presión de una cuchilla cilíndrica). Posteriormente, se retrajo el tejido con pinzas de disección y se cortó con hoja de bisturí 35. Las muestras fueron almacenadas en RNAlater®, que mantiene la estructura de las proteínas. No se utilizó inhibidor de proteasas para evitar que interfiriera con la actividad de MMP. La muestra fue congelada y almacenada a -20 ˚C 35,36. El procedimiento se realizó por segunda vez durante el raspado y el alisado radicular.
TÉCNICA DE ZIMOGRAFÍA
Para la realización de la técnica de zimografía se prepararon geles de acrilamida, que consistían en dos fases:
1. Gel de separación (resolving). Para su preparación se utilizó buffer Tris 0,36 M a pH 8,8, SDS al 0,01% (dodecilsulfato sódico), acrilamida-bis acrilamida (25%), grenetina 0,1%, APS al 0,06% (persulfato de amonio) y TEMED al 0,13% (tetrametiletilendiamina).
2. Gel de concentración (stacking). Se preparó con buffer Tris (0,06 M) a pH 6,8, SDS (0,1%), acrilamida-bis acrilamida (12%), APS (0,1%) y TEMED (0,13%). Posteriormente se colocaron 25 μg de proteína en los geles y se corrió una electroforesis vertical durante 120 minutos a 100 mv. A continuación, fueron incubados a 37 °C durante 48 horas en buffer para MMP (Tris [0,25 M], NaCl [1 M] y CaCl2 [0,025 M]), que contiene una mezcla iónica que favorece la actividad enzimática. Finalmente se tiñeron con azul de metileno para su análisis y lectura mediante densitometría tomando como referencia el peso molecular correspondiente a 54 kd al que corresponden las MMP 1, 3, 8 y V 17,19 con el programa Image Processing and Analysis in Java (ImageJ), diseñado por el National Institutes of Health (Estados Unidos) 37,38.
ANÁLISIS ESTADÍSTICO
El tamaño de la muestra se calculó mediante la fórmula de comparación para dos proporciones. Se obtuvo una muestra de 17 pacientes por grupo. Se realizó estadística descriptiva y se analizó con t de student para muestras relacionadas y no relacionadas, dependiendo de los grupos, así como ANOVA de una vía, con una prueba post hoc de Tukey. Para el análisis del índice de inflamación gingival se utilizó U de Mann Witney, considerando una diferencia estadísticamente significativa cuando p < 0,01. Se realizó una regresión lineal asociando las variables IMC y actividad de MMP.
RESULTADOS
El promedio de edad de las pacientes fue de 43 años para ambos grupos. El índice de masa corporal fue de 34,8 kg/m2 para el grupo control, de 34,6 kg/m2 y de 34,1 kg/m2 para los grupos tratados con metformina y con periodontitis generalizada y localizada, respectivamente. No se encontró diferencia estadísticamente significativa entre grupos (p = 0,079, ANOVA, Tukey).
El grupo de pacientes control tuvo de promedio un IMC de 34,8 ± 0,2 kg/m2, que se mantuvo constante durante las seis semanas de tratamiento, mientras que en los grupos con periodontitis generalizada y localizada tratados con metformina 850 mg cada 24 horas 29 el índice de masa corporal disminuyó de promedio 1,6 kg/m2 respecto a la media inicial, con una diferencia significativa (p = 0,0087 ANOVA de una vía, Tukey) (Fig. 1).
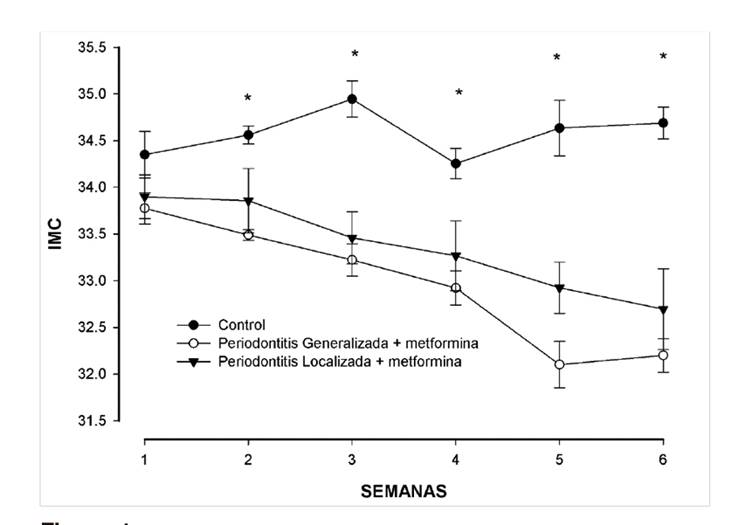
Figura 1. Indice de masa corporal (IMC) de los pacientes con periodontitis crónica local y generalizada tratados con metformina en comparación con el grupo control (solo tratamiento estándar)
En la Figura 2 puede observarse que existe reducción del índice de placa dentobacteriana con diferencia estadística entre el inicio y el final del tratamiento, pero sin diferencia entre el grupo control y los grupos tratados con metformina (p = 0,63 t de Student para muestras no relacionadas) (Fig. 2).

Figura 2. Índice de placa bacteriana dental (PDB) en pacientes tratados con metformina en comparación con el grupo control
En el grupo de pacientes con tratamiento periodontal coadyuvado con metformina se observó mayor disminución del IIG; esto comparado con el grupo de pacientes con tratamiento periodontal sin la administración del fármaco, con diferencia estadísticamente significativa (p = 0,023, U de Mann-Whitney) (Fig. 3).

Figura 3. Grado de inflamación (medido como el índice de inflamación, de acuerdo con Löe y Silness) en pacientes solo con tratamiento periodontal frente a pacientes con tratamiento periodontal + metformina
En la Figura 4 puede observarse en la primera barra el promedio de la actividad basal de las MMP de los pacientes control, estableciendo este valor como el 100% de la actividad enzimática en periodonto. En las barras posteriores puede apreciarse en todos los casos la disminución de la actividad enzimática, con diferencia significativa con respecto a la basal. Por otro lado, se observa entre los grupos de PCG y PCL tratados con metformina una disminución del 65% de la actividad con respecto a la basal, mientras que los grupos sin metformina (PCG-C y PCL-C) mostraron una disminución del 25% con este punto de referencia. Esta diferencia fue significativa entre los dos grupos control y los grupos con tratamiento.

Figura 4. Actividad de las metaloproteinasas de la matriz (MMP) 1,3,8 por grupo de tratamiento (todos los grupos recibieron tratamiento periodontal estándar): control de periodontitis generalizada (PCG-C), periodontitis generalizada con tratamiento con metformina (PCG+ M), (PCL) periodontitis localizada y (PCL+M) con tratamiento con metformina. Se encontró una diferencia estadísticamente significativa entre el valor inicial y los grupos tratados con metformina (p = 0,0067, t de student diferencia entre grupo, así como los grupos control (p = 0,0089 ANOVA, Tukey). **Diferencia entre grupo; ***Valor inicial
Al realizar la correlación lineal entre el IMC y el tanto por ciento de actividad de MMP, se observa que al disminuir el IMC baja también el porcentaje de actividad de MMP, con una r2 = 0,870582 (esto depende del número de semanas de tratamiento con metformina de las pacientes estudiadas) (Fig. 5).
DISCUSIÓN
En México, la obesidad es uno de los principales problemas de salud pública 1. Su manejo es muy complejo debido a su asociación con enfermedades sistémicas y locales 5,22. El estado proinflamatorio que promueve es el responsable de desencadenar una serie de reacciones bioquímicas, entre ellas la activación de las MMP, capaces de afectar tejidos de soporte como los dientes.
En 1994, Reynolds demostró que estas enzimas se activaban por el proceso inflamatorio provocado por la microbiota local del periodonto 39, lo que lleva a la pérdida de la inserción de los dientes. Pero no fue hasta 2009 cuando Saito y cols. asociaron la PC con enfermedades como DM, HTA y su relación con la obesidad. Sin embargo, hasta el momento el principal tratamiento de la PC se ha encaminado hacia la resolución del proceso infeccioso a través del alisado y del raspado radicular 40,41, y no se ha considerado la posibilidad de un manejo multidisciplinario que controle el entorno proinflamatorio sistémico del paciente con estas patologías. Así, el presente trabajo se planteó la hipótesis de que el tratamiento adecuado de la obesidad como factor común de la mayoría de las enfermedades crónico-degenerativas podría modificar de manera favorable la respuesta al tratamiento de la periodontitis crónica y romper con el ciclo de inflamación, ya que las MMP se activan en ambas patologías y son las responsables de la pérdida dental. Por lo tanto, resulta de gran interés medir cómo los diferentes tratamientos modifican la actividad proteolítica.
De forma similar a lo reportado en la literatura 30, en el presente trabajo se observó que el tratamiento con metformina mejora la respuesta al tratamiento higiénico dietético en pacientes con obesidad de clase I, seguramente por las propiedades descritas con anterioridad, y, como era de prever, el uso de metformina no modificó la cantidad de la placa dentobacteriana, ya que este fármaco no tiene actividad antimicrobiana administrado de forma tópica o sistémica 42.
Un aspecto interesante de este trabajo es que el grupo experimental presenta un grado menor de inflamación en el periodonto que el grupo control después del tratamiento, lo que sustenta la hipótesis de que, aunque la EP se produce principalmente por la microbiota nociva del periodonto, los factores intrínsecos de los pacientes -como el estado proinflamatorio sistémico producido por la obesidad- contribuyen al mantenimiento de la EP y a la mala respuesta al tratamiento. Al vigilar los problemas metabólicos y al colaborar de manera sistémica al control de la inflamación, los signos clínicos de EP disminuyen considerablemente.
Finalmente, como está descrito en la literatura, se observó que los pacientes con obesidad de clase I tenían un aumento local en la actividad de las MMP 1,3,8 y V 43,44; sin embargo, esta actividad disminuyó en ambos grupos después del tratamiento, y fue más significativa en el grupo tratado con metformina, lo que confirma la necesidad de brindar a los pacientes un tratamiento multidisciplinario para el manejo de esta enfermedad. Por el contrario, el tratamiento de EP también es necesario para el control y el manejo del paciente diabético, hipertenso y obeso, ya que el estrés local también podría contribuir al estrés sistémico, lo que complica el manejo de las enfermedades metabólicas.
Sería muy interesante determinar si existe alguna selectividad de la metformina en la inhibición de esta familia de enzimas, ya que en el presente estudio solo fueron identificadas mediante el peso molecular, lo que deja la incertidumbre sobre la participación de otras MMP, y de este modo determinar cómo la inflamación local contribuye al estrés sistémico. Sin embargo, la información proporcionada por este trabajo es útil, ya que demuestra la interrelación entre la obesidad y la EP, la importancia en su tratamiento multidisciplinario y, finalmente, la necesidad de personal altamente cualificado que brinde un tratamiento integral a una comunidad en la que se pronostica un aumento muy significativo de este tipo de enfermedades.
Este estudio apoya con los resultados obtenidos a recientes estudios en los que se ha demostrado la influencia de factores sistémicos para el desarrollo de la enfermedad periodontal y da la pauta para seguir investigando la participación del entorno sistémico en el desarrollo de este padecimiento. Asimismo, resalta la importancia del manejo multidisciplinario del paciente obeso.















