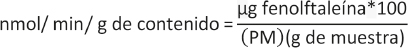INTRODUCCIÓN
El cáncer de colon rectal (CCR) es uno de los tumores gastrointestinales más comunes. A nivel mundial, es el segundo tipo de cáncer que se presenta en mujeres y el tercero en hombres (1). En los últimos años, el tratamiento preventivo y curativo de los pacientes con cáncer de colon ha mejorado y se han llevado a cabo diversos protocolos que incluyen fármacos y cambios en el estilo de vida, incluida la dieta (2). El almidón resistente (AR), al ser parcialmente digerido, se fermenta en el colon, por lo que disminuye el pH intestinal, ya que se producen ácidos grasos de cadena corta (AGCC), lo cual es beneficioso para la salud del colon y para la prevención y el tratamiento del CCR. Además, actúa como fibra soluble, por lo que su consumo se asocia a generar niveles bajos de glucosa, colesterol y triglicéridos en sangre, influyendo de manera benéfica en el tratamiento de padecimientos tales como la obesidad, las enfermedades cardiovasculares y la diabetes (3). Se obtiene almidón de los cereales, los frutos, los tubérculos y las raíces. Aunque el almidón se utiliza ampliamente en la industria alimentaria, en su forma nativa presenta limitaciones para su procesamiento, por lo que se modifica mediante métodos físicos, químicos y enzimáticos que provocan cambios estructurales y en sus propiedades fisicoquímicas y funcionales (4). La aplicación secuencial de los procesos de pirodextrinización e hidrólisis enzimática a los almidones nativos produce maltodextrinas que son resistentes, debido a que contienen enlaces atípicos α (1,4), α (1,6), β (1,2) y β (1,3), y levoglucosanos, que se generan durante la pirodextrinización. Estos productos presentan baja viscosidad, alta solubilidad y actúan como AR. Se utilizan para preparar jugos, leches, sopas, fórmulas enterales y bebidas carbonatadas (5). Tomando en cuenta estudios previos sobre los efectos beneficiosos de la ingesta de AR y las ventajas potenciales que ofrece aplicar de manera secuencial los procesos de pirodextrinización e hidrólisis enzimática, en el presente trabajo se evaluó el efecto anticancerígeno ocasionado por el consumo de almidón nativo de banano (Musa cavendishAAA) y de su almidón modificado química y enzimáticamente en ratas tratadas con 1,2-dimetilhidrazina.
MATERIAL Y MÉTODOS
COMPUESTOS QUÍMICOS
Se utilizaron reactivos químicos de grado analítico (J. T. Baker; Phillipsburg, NJ, EE. UU.) y las enzimas se adquirieron a Sigma Co. (St. Louis, MO, EE. UU.). Para determinar el AR se utilizó un kit de Megazyme (K-RSTAR 05/2008 Megazyme©International Ireland Limited 2008). De Sigma Co. (St. Louis, MO, EE. UU.) se utilizó la 1,2-dimetilhidrazina (DMH) para llevar a cabo la inducción del cáncer en el colon. De la misma marca se utilizaron los estándares de ácidos de grado cromatográfico para la evaluación de los AGCC, y los gases fueron provistos por Grupo Infra®.
MATERIAL BIOLÓGICO
El banano verde fue recolectado en Teapa, Tabasco, México. La producción, manejo y cuidado de las ratas se realizó en la Unidad de Producción, Cuidado y Experimentación Animal (UPCEA), ubicada en la División Académica de Ciencias de la Salud (DACS) de la Universidad Juárez Autónoma de Tabasco (UJAT), bajo condiciones medioambientales controladas de temperatura (21 ± 1 ºC) y humedad relativa (55 %), ciclos de 12 h de luz y oscuridad, y acceso a agua purificada (AP) y alimento a libre demanda (dieta convencional proporcionada por Harlan Teklad para roedores con 18 % de proteína) durante la fase experimental. Se utilizaron 25 ratas macho destetadas, variedad Sprague Dawley, con peso de 80 a 90 g y cuatro semanas de edad (6).
DIETAS EXPERIMENTALES
La extracción de almidón nativo (AN) de banano (M. cavendishAAA), así como las modificaciones de pirodextrinización e hidrólisis enzimática se realizaron bajo condiciones previamente publicadas (7).
EXTRACCIÓN DE ALMIDÓN
Los bananos fueron pelados, lavados (agua a 40 ºC con 0,3 % de ácido cítrico), molidos y tamizados (malla n.º 100). El sedimento fue separado y secado en una estufa de aire a 50 ºC durante 24 h.
ALMIDÓN MODIFICADO: PIRODEXTRINIZACIÓN E HIDRÓLISIS ENZIMÁTICA
Para llevar a cabo la pirodextrinización se utilizó una proporción de almidón:ácido (ácido clorhídrico 2,2 M) de 160:1 (p/v). El ácido fue dispersado sobre el almidón para llevar a cabo la reacción y se dejó a temperatura ambiente por 16 h. Posteriormente se colocó en un horno de convección por 1 h a 90 ºC.
Para realizar la hidrólisis enzimática, la pirodextrina se suspendió en una solución al 30 % (p/v), ajustada a pH 6. La mezcla se colocó en un baño de agua con agitación constante a 95 ºC. Para llevar a cabo la hidrólisis se utilizó un 0.01 % de la enzima α-amilasa EC. 3.2.1.1 (Sigma A-3306, 4000 unidades/ml) durante 10 min.
El AN, la pirodextrina y la maltodextrina resistente se molieron, tamizaron (malla n.º 100) y almacenaron.
DETERMINACIÓN DEL ALMIDÓN RESISTENTE
Tanto el AN como la pirodextrina y la maltodextrina que se utilizaron se evaluaron de acuerdo con la técnica descrita en el kit para el análisis del almidón resistente que provee Megazyme (K-RSTAR 05/2008 de Megazyme©International Ireland Limited 2008), el cual ha sido aceptado y avalado por los métodos oficiales de la AOAC International (2002.02) y la AACC International (32-40.01). Las muestras se incubaron con agitación (Ovan, OL30-ME, España) con α-amilasa pancreática y amiloglucosidasa durante 16 h a 37 ºC. El AR se recuperó tras centrifugar la muestra a 1500 x g en una centrífuga (Science Med, DM0412, Finlandia) y se disolvió en KOH 2 M en un baño con agitación (Ovan, OL30-ME, España). La solución se neutralizó con búfer de acetato y el almidón se hidrolizó cuantitativamente en glucosa por acción enzimática de la amiloglucosidasa. La D-glucosa se cuantificó con un reactivo de glucosa-oxidasa/peroxidasa (Spinreact, España), obteniéndose la cantidad de AR presente en la muestra. El cálculo del almidón resistente se obtuvo con la siguiente fórmula:
Donde:
F (factor) = concentración del estándar/absorbancia del estándar = 100/absorbancia del estándar (correspondiente a 100 µg de D-glucosa).
W = peso seco de la muestra analizada = (100-humedad)/100) (100 es el factor para representar el contenido de AR como porcentaje del peso de la muestra).
90 = factor a convertir de D-glucosa libre (según lo determinado) a anhidro-D-glucosa como ocurre en el almidón.
MICROSCOPÍA ELECTRÓNICA DE BARRIDO
El análisis morfológico se realizó en un microscopio electrónico (JEOL, JSM-7610F FESEM, EE. UU.) con resolución de 1 nm, ampliación de 500 X con micrografía de 10,3 mm, acelerador de voltaje de 5 kV y corriente de sonda de hasta 200 nA. Las muestras de AN, pirodextrina y maltodextrina se colocaron sobre papel conductor de carbono y se metalizaron con una aleación de oro-platino durante 1 min con la ayuda de un revestidor giratorio (Quorum, Q150R ES, Reino Unido); posteriormente se analizaron en el microscopio electrónico para determinar los cambios de tamaño, forma y estructura granular por efecto de los tratamientos (8).
ENSAYO EN ANIMALES
El protocolo experimental fue aprobado por la Comisión para el Cuidado y Uso de los Animales de Laboratorio (CCUAL) de la Facultad de Medicina de la Universidad Autónoma del Estado de Morelos (UAEM) (número de aprobación: 006/2015) de acuerdo con la Norma Oficial Mexicana (NOM-062-ZOO-1999), la Guía Internacional para el Cuidado y Uso de Animales de Laboratorio y las normas federales e institucionales requeridas.
Durante la primera semana del estudio, los animales estuvieron en proceso de adaptación. Posteriormente se dividieron en cinco grupos de cinco animales cada uno y se seleccionaron de manera aleatoria para su inclusión en uno de los siguientes grupos experimentales: CP (control positivo), CN (control negativo), AN (almidón nativo), PI (pirodextrina) y MER (maltodextrina resistente). Durante 4 semanas, los animales recibieron AP y dieta convencional para roedores con 18 % de proteína, ambos a libre demanda. Las ratas de los grupos AN, PI y MER recibieron a través de una sonda gástrica sus correspondientes dietas a una dosis de 2 g/kg de peso corporal (9). Ambos controles (CN y CP) recibieron solamente AP mediante la misma vía de administración y durante el mismo período (cuatro semanas). Para inducir el CCR en las ratas se utilizó el carcinógeno 1,2-dimetilhidrazina. Los grupos CP, AN, PI y MER recibieron 4 inyecciones s.c. (subcutáneas) de 1,2-DMH (40 mg/kg) dos veces a la semana durante las semanas experimentales 3 y 4 (6). El grupo CN recibió por la misma vía una inyección de EDTA con pH 6. La ganancia de peso corporal se monitorizó de manera semanal con una balanza (Ohaus Defender®, Triple Beam, EE. UU.) y el consumo de agua y alimento se registró diariamente.
PRUEBAS FISIOLÓGICAS Y SACRIFICIO
Al término de las 4 semanas, los animales se sometieron a un ayuno de 12 h para ser sacrificados en una cámara de CO2con el fin de extraer el intestino grueso en dos porciones (ciego y colon). Se recolectó el contenido fecal en crioviales de 2 ml con tapa de rosca que se almacenaron en un congelador (Torrey, CHC-80C, México) a -70 ºC para su posterior análisis. Las porciones del colon se lavaron con solución fisiológica y se fijaron en formol al 10 % para su estudio histopatológico. Para esto se ataron con un hilo en cada extremo y se inyectaron con formol. En las heces se llevaron a cabo las siguientes determinaciones: pH, actividad enzimática de β-glucuronidasa y cuantificación de AGCC por cromatografía de gases (CG).
pH CECAL Y COLÓNICO
Inmediatamente después de la recolección se colocó una pequeña porción de muestra en la punta de una microespátula para disolverla en 5 ml de agua destilada; después se midió el pH de las muestras con un potenciómetro (Hanna®Instruments, HI222102, EE. UU.).
ACTIVIDAD ENZIMÁTICA DE β-GLUCURONIDASA
La actividad enzimática de la β-glucuronidasa se determinó usando el conjugado β-D-glucurónido de fenolftaleína como sustrato (10). La enzima presente en la muestra hidrolizó el conjugado y la fenolftaleína liberada se monitorizó por el cambio de color. El extracto fecal se obtuvo utilizando 0,5 g de muestra (contenido de ciego y de colon por separado) a los cuales se le adicionaron 10 ml de solución amortiguadora de fosfatos 0,2 M a pH 7; posteriormente se homogenizó en un vórtex (Ohaus Defender®, VXMNFS, EE. UU.) y se centrifugó en un equipo (Science Med, DM0412, Finlandia) a 25,000 x g durante 20 min a 4 ºC, recolectándose el sobrenadante. Para la mezcla de la reacción se tomaron 0,8 ml de solución amortiguadora de fosfatos 0,02 M, 0,1 ml de β-D-glucurónido de fenolftaleína 1 mM y 0,1 ml del extracto fecal y se colocó todo ello en una incubadora (Ovan, OL30-ME, España) durante 1 h a 37 ºC. La reacción de la enzima se detuvo con la adición de 2,5 ml de glicina alcalina, 1 ml de ácido tricloroacético al 5 % y 1,5 ml de agua. Después de reposar durante 10 min a temperatura ambiente, la muestra se leyó a 540 nm en un espectrofotómetro (Thermo Fisher Scientific™, Genesys 10, EE. UU.). La actividad enzimática total de la β-glucuronidasa se expresó en nmol/min por g de contenido fecal empleando la siguiente ecuación:
Donde:
µg fenolftaleína = µg de fenolftaleína liberada.
100 = factor de dilución.
PM = peso molecular de la fenolftaleína.
CUANTIFICACIÓN DE ÁCIDOS GRASOS DE CADENA CORTA POR CROMATOGRAFÍA DE GASES
Se utilizaron como estándar ácido acético glacial al 99,8 %, ácido propiónico el 99,8 %, ácido butírico al 99,5 % y ácido 2-etilbutírico al 99 %. Los gases utilizados fueron helio, hidrógeno y nitrógeno con purezas del 99,998 %, 99,999 % y 99,998 % para CG, además de aire grado cero (Grupo Infra®). El análisis cromatográfico se llevó a cabo usando un cromatógrafo (Agilent®, 7890A GC, EE. UU.) equipado con un detector de ionización de flama (FID) y con una columna capilar (Nukol™, DB-WAX, EE: UU.) de 15 m x 0,53 mm.
La extracción se llevó a cabo suspendiendo 1 g de heces en 5 ml de agua, homogeneizándose posteriormente la suspensión durante 3 min en un vórtex (Ohaus Defender®VXMNFS, EE. UU.). Se ajustó el pH entre 2 y 3 con ácido clorhídrico 5 M y se mantuvo a temperatura ambiente por 10 min con agitación ocasional (11). La suspensión se colocó en una centrifuga (Science Med, DM0412, Finlandia) a 4 ºC durante 20 min a 26.000 x g. El sobrenadante se separó y filtró con membranas de 0.45 µm. El ácido 2-etilbutírico se adicionó como estándar interno al sobrenadante filtrado en una concentración final de 2 mM; posteriormente se inyectó en el CG para su análisis. Los AGCC se identificaron en los cromatogramas por sus tiempos de retención. La concentración de cada ácido se obtuvo mediante una curva de calibración por cada ácido, utilizando como señal analítica el área del pico cromatográfico, y se expresó en µmoles/g de contenido de ciego y de colon.
El análisis de la muestra se llevó a cabo utilizando las siguientes condiciones instrumentales: helio como gas acarreador a un flujo de 1 ml/min, hidrógeno, nitrógeno y aire (40 ml/min, 30 ml/min y 450 ml/min, respectivamente). La mezcla hidrógeno/aire se utilizó para la flama y el nitrógeno se utilizó como gas auxiliar. La temperatura inicial del horno fue de 60 ºC, incrementándose a razón de 20 ºC/min hasta llegar a los 180 ºC y manteniendo 1 min esa temperatura. La temperatura del detector y del inyector fue de 210 ºC. El volumen de inyección fue de 0,2 µL (12).
ESTUDIO HISTOPATOLÓGICO
Las secciones de tejido se fijaron durante 24 h en formalina al 10 % con pH de 7,4 en una proporción de una parte de tejido por 10 de fijador. Una vez realizados los cortes primarios se procedió de acuerdo con el método habitual de inclusión en parafina. Posteriormente se realizaron cortes de 5 µm de grosor, desparafinados y teñidos con la tinción de rutina de hematoxilina-eosina (HE) (13) para su posterior observación microscópica en un equipo (Motic Plan Acromatic, BA-200, EE. UU.) con aumentos de 400 y 1000 X.
REGISTROS Y MORFOLOGÍA DE LAS LESIONES MICROSCÓPICAS
Para registrar las lesiones microscópicas de los tejidos se observaron diez campos al azar con 40 X. Se tomaron en cuenta los siguientes criterios: tipo de lesión, componente celular predominante y grado de la lesión, que se clasificó en tres categorías: ligero (lesión que abarca un tercio del tejido), moderado (lesión que incluye dos tercios del tejido) y severo (lesión que compromete la totalidad del tejido) (14). Las fotomicrografías se tomaron con un microscopio (Motic Plan Acromatic, BA-200, EE. UU.) con aumentos de 400 y 1000 X.
ANÁLISIS DE LOS RESULTADOS
Las variables de respuesta utilizadas para evaluar el efecto producido en las ratas tratadas con 1,2-DMH por la ingesta de AN de M. cavendishAAA, y sus modificaciones, fueron las siguientes: pH intestinal, actividad enzimática de β-glucuronidasa, concentración de AGCC y presencia de displasia. Los resultados se expresaron como media aritmética ± error estándar de la media. Se realizó un análisis de la varianza de una sola vía para cada uno de los modelos, con un nivel de significación de p < 0,05. Para determinar las diferencias entre las medias de los tratamientos se aplicó la prueba de Duncan. Para identificar las lesiones y los tumores en el colon de las ratas, así como el grado de inflamación, se utilizó la estadística descriptiva. Para el análisis del tipo de enteritis y la presencia de displasia se llevó a cabo una prueba de Kruskal-Wallis con un nivel de significación de p < 0,05.
RESULTADOS
DETERMINACIÓN DE ALMIDÓN RESISTENTE EN LAS DIETAS
El contenido de AR presente en el AN de M. cavendishAAA fue del 70,51 %, y después de los tratamientos de pirodextrinización e hidrólisis enzimática fue del 63,84 % y 11,04 %, respectivamente.
MICROSCOPÍA ELECTRÓNICA DE BARRIDO
Los gránulos del AN (Fig. 1A) presentaron una forma irregular, elongada y, en algunos casos, esferoidal con un tamaño de 11 µm a 71 µm. Se puede observar en la figura 1Bla imagen de la pirodextrina seleccionada, en donde algunos gránulos de AN fueron resistentes al tratamiento químico de la pirodextrinización y no mostraron cambio alguno. Esto demuestra que el tratamiento debilitó el gránulo pero, a nivel molecular, este no se hidrolizó totalmente. En la figura 1Cse puede observar que, en la MER, la hidrólisis enzimática con α-amilasa provocó un cambio drástico en la pérdida de la estructura granular.
ACTIVIDAD ENZIMÁTICA DE β-GLUCURONIDASA Y pH EN HECES FECALES
En la Tabla Ise muestran los resultados sobre el pH y la actividad enzimática de β-glucuronidasa en heces fecales, tanto de ciego como de colon, de los grupos AN, PI y MER. El tratamiento con AN redujo el pH tanto en ciego como en colon (p < 0,05) con respecto al grupo CP. En el grupo PI se redujo el pH únicamente en el colon (p < 0,05) con respecto al CP. La concentración de la enzima β-glucuronidasa tanto en ciego como en colon disminuyó con todos los tratamientos dietéticos con respecto al grupo CP (p < 0,05).
Tabla I. Efecto del almidón nativo de M. cavendishAAA pirodextrinizado e hidrolizado enzimáticamente sobre diversos parámetros fecales de ratas tratadas con 1,2-dimetilhidrazina

Promedio ± error estándar de la media (n = 5). a-c Las letras diferentes entre columnas indican diferencias significativas (p < 0,05). CN: control negativo; CP: control positivo; AN: almidón nativo; PI: pirodextrina; MER: maltodextrina resistente.
CUANTIFICACIÓN DE ÁCIDOS GRASOS DE CADENA CORTA EN HECES FECALES
En relación a la producción de AGCC en las ratas tratadas con 1,2-DMH (Tabla I) se observó que el consumo de AN aumentó la concentración de ácido butírico en el colon con respecto al CP (p < 0,05), llegando a ser igual que en el CN (p | 0,05). Con respecto a los otros tratamientos modificados (PI y MER), el AN fue el tratamiento que produjo mayor concentración de ácido butírico en colon (p < 0,05). En el caso del ácido acético, en el ciego, el grupo MER presentó mayor concentración que el grupo CP (p < 0,05) y un nivel igual al del grupo CN (p | 0,05). En el colon, el grupo AN presentó mayor (p < 0,05) concentración de ácido acético con respecto al CP, siendo dicha concentración igual a la del CN (p | 0,05). Por último, en la cuantificación del ácido propiónico en el ciego, los tres tratamientos experimentales mostraron mayor producción que el grupo CP (p < 0,05). En el colon, la mayor producción de acético se observó en los grupos de los tratamientos con mayor proporción de AR (AN y PI; p < 0,05).
ESTUDIO HISTOPATOLÓGICO: REGISTROS Y MORFOLOGÍA DE LESIONES MICROSCÓPICAS
De manera general e independientemente del tratamiento, se observó la presencia de enteritis en los animales. La enteritis se categorizó en dos tipos: eosinofílica y linfoplasmocítica. El CN presentó enteritis eosinofílica, que está ligada a síntomas alérgicos sistémicos y elevaciones de la inmunoglobulina E (IgE). Por el contrario, los animales tratados con 1,2-DMH presentaron reacciones inflamatorias de subagudas a crónicas que sugieren reacciones inmunomediadas como la enteritis linfoplasmocítica, incluidos los tratados con dietas experimentales y el grupo CP, sin haber diferencias entre ellos (p | 0,05). Esta inflamación se presentó con o sin displasia adicional en el colon de las ratas.
El grupo AN presentó menor enteritis linfoplasmocítica que el grupo CP (p < 0,05), lo que significa que tuvo menor toxicidad. De acuerdo con el grado y el patrón de la enteritis observada en el colon de las ratas, los grupos que consumieron dietas experimentales presentaron menor proporción de severidad (40 %) que el CP (60 %), siendo el patrón difuso el que predominó. En lo referente al estudio microscópico, de manera general no se observaron cambios patológicos aparentes en el CN. Las vellosidades intestinales presentaron en el borde células poliédricas acilíndricas, principalmente enterocitos, y algunas vacuoladas en el citoplasma y con núcleo excéntrico, que son las células productoras de moco o globosas. En el centro de las vellosidades había células estromales y de tipo linfoide residente.
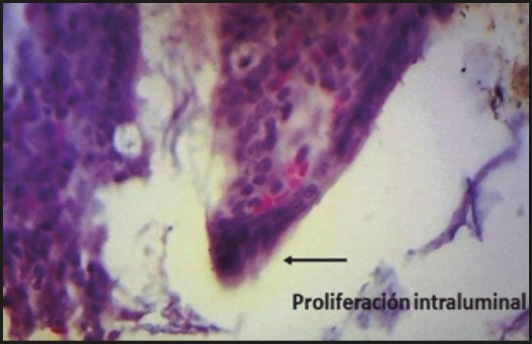
En la figura 2se presenta la fotomicrografía de un corte de colon de rata del grupo CP en donde se observa un carcinoma in situen la punta de la vellosidad, la cual exhibe cambios displásicos de los enterocitos como son: pérdida de la relación núcleo-citoplasma, pleumorfismo nuclear, núcleos hipercromáticos con nucléolos prominentes y algunas mitosis atípicas.
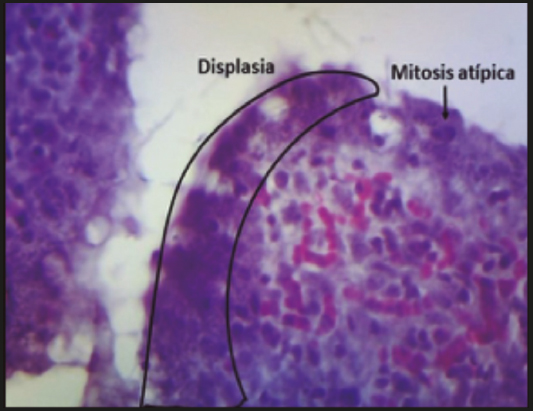
Figura 2. Corte del colon de una rata del grupo de control positivo. Fotomicrografía tomada con la técnica de tinción habitual de hematoxilina-eosina (HE) (1000 X).
En cuanto a la incidencia de displasia por efecto de la ingesta de AN de M. cavendishAAA y sus productos modificados, se observó que en el CP hubo evidencia de lesiones (displasia) en el 80 % de los casos, con células neoplásicas sin rebasar la membrana basal (carcinoma in situ). El grupo tratado con AN presentó la menor proporción de displasia (20 %; p < 0,05) con respecto al CP, incluso menor que la de los grupos que consumieron PI y MER (p < 0,05).
En el presente estudio se observa que, conforme mayor es la cantidad de AR presente en la dieta (70,51 % para AN, 63,84 % para PI y 11,04 % para MER), las células neoplásicas no avanzan más allá de la membrana basal. A este respecto, en la figura 3se observa el corte del colon de una rata del grupo MER con presencia de carcinoma in situexofítico, siendo el tratamiento con MER el que menor cantidad de AR presentó.
DISCUSIÓN
Aparentemente, el proceso de pirodextrinización del AN de M. cavendishAAA no provocó un efecto considerable, al no incrementar el contenido de AR. Sin embargo, los resultados de los cambios a nivel molecular se evidencian en la microscopía electrónica de barrido, donde se puede observar que el tratamiento de pirodextrinización debilitó el gránulo, que no obstante no resultó totalmente hidrolizado. Está reportado que el gránulo de esta variedad presenta crestas y una capa superficial espesa que puede impedir la acción de agentes químicos externos como sería el caso del HCl en la pirodextrinización; sin embargo, su superficie es suave y densa, lo que lo hace más susceptible a la modificación enzimática (4). Esto sugiere que la MER fue hidrolizada por la α-amilasa durante su proceso de hidrólisis y no por el tratamiento de pirodextrinización.
Resultados similares se reportaron previamente con el AN de M. cavendishAAA al realizar una hidrólisis con HCl (2,2 M), produciéndose una disminución del AR y un aumento del almidón de digestión lenta (ADL). El almidón fue resistente al tratamiento y a la pérdida de su estructura granular, formando residuos que podían contener material amorfo, lo que pudo provocar el incremento del ADL y la reducción del AR posterior al tratamiento de hidrólisis ácida (15). Este mismo comportamiento pudo haber ocurrido en el presente estudio ya que, posteriormente al proceso de pirodextrinización, la cantidad de AR disminuyó y, aunque el contenido de AR por efecto de las modificaciones (química y enzimática) no fue mayor que el que presentó el AN, la presencia de AR en los productos modificados hace suponer que la formación de enlaces atípicos durante la pirodextrinización se realizó en muy poca cantidad, con la posibilidad de que se incrementara la cantidad de ADL.
El efecto observado en los animales por la ingesta de los diferentes tratamientos muestra una disminución del pH y de la actividad enzimática de β-glucuronidasa, así como una mayor proporción de ácido butírico registrada en las heces de los animales que consumieron AN de M. cavendishAAA. Es posible considerar la posibilidad de que el AN fuera el tratamiento con la cantidad suficiente de AR para funcionar como fuente de carbono de las bacterias colónicas, lo que permitió la fermentación para producir AGCC (16), específicamente butírico, lo cual pudo haber favorecido la proliferación de las células integrantes de la mucosa sana a nivel del colon, contribuyendo a la reducción del pH intestinal (17). Se ha reportado que el consumo de AR produce un 41 % de ácido acético, un 21 % de ácido propiónico y un 38 % ácido butírico (18). En el presente estudio, los animales que consumieron AN presentaron tanto en ciego como en colon un 43 % de ácido butírico. Cabe mencionar que, aunque ciertos sustratos, como el AR, aparentemente presentan un efecto butirogénico en el colon, no se sabe en qué medida estimulan directamente la producción de este AGCC (19).
Con respecto al estudio histopatológico, la enteritis eosinofílica del CN fue de curso benigno, caracterizada por infiltración de eosinófilos en cualquiera de las capas del tracto gastrointestinal, con o sin hipereosinofilia sanguínea; su presencia está ligada a síntomas alérgicos sistémicos y elevaciones de la inmunoglobulina E (IgE). Esto sugiere una posible etiología en relación con reacciones alérgicas de origen alimentario (20). Sin embargo, todos los animales a los que se les aplicó 1,2-DMH presentaron reacciones inflamatorias de subagudas a crónicas, lo que sugiere una inflamación intestinal idiopática caracterizada por infiltración linfoplasmocítica del tracto gastrointestinal. Se ha reportado que esta infiltración puede variar ampliamente el estado de gravedad, ya que llega a estar acompañada de hiperplasia de células productoras de mucosa y atrofia o fibrosis, en donde el progresivo estadio puede incluso desencadenar la presencia de adenocarcinomas (21). El hecho de que los animales que consumieron AN hayan presentado menor enteritis linfoplasmocítica sugiere la presencia de menor toxicidad, lo que hace suponer que este efecto fue por la cantidad de AR presente en su dieta. El aumento del flujo sanguíneo colónico por la producción de ácido butírico contribuye a la disminución de la enfermedad inflamatoria intestinal, que es una condición de alto riesgo para el desarrollo de CCR (22). Esto coincide con los resultados de la presente investigación, ya que el AN produjo mayor cantidad de este ácido y, a la vez, disminuyó la toxicidad en los animales que consumieron esta dieta.
Es importante indicar que una limitante del presente estudio radicó en no tener los medios para evaluar el contenido de las fosas de las criptas aberrantes (FCA) en el colon de los animales. Sin embargo, otros estudios en ratas Wistar en los que se utilizó la misma dosis de 1,2-DMH empleada en el presente estudio han reportado la presencia de FCA, clásicas en el desarrollo temprano del CCR (6,23). Además, la evidencia de lesiones (displasia) en el 80 % de los casos, con células neoplásicas sin rebasar la membrana basal (carcinoma in situ), sugieren un efecto carcinogénico (24).
En este estudio se observó que, conforme mayor es la cantidad de AR presente en la dieta (70,51 % para AN, 63,84 % para PI y 11,04 % para MER), las células neoplásicas no avanzan más allá de la membrana basal, lo que sugiere que la cantidad de AR presente en la dieta es directamente proporcional al posible efecto protector o anticancerígeno celular. Los mecanismos precisos por los cuales el AR inhibe o promueve las lesiones preneoplásicas del colon no se conocen completamente. En general, el efecto anticancerígeno se ha atribuido principalmente a la fermentación de los AGCC luminales, particularmente el ácido butírico, que inhibe la proliferación celular, induce la diferenciación y mejora la apoptosis en las células del CCR.