INTRODUCCIÓN: ¿TIENE SENTIDO HABLAR DE NUTRICIÓN EN ONCOGERIATRÍA?
Hay distintos motivos por los que el estado nutricional debe ocupar un plano central en el manejo del anciano oncológico y se comentarán a continuación, aunque de forma muy breve.
Uno de ellos es la premisa de que la prevalencia de malnutrición en pacientes con cáncer es elevada 1 (Fig. 1) y se cumple con mayor intensidad en los individuos de edad avanzada 2,3. En la Tabla 1 4,5,6,7,8,9,10,11,12,13 se muestran las principales series en las que se evalúa la prevalencia de malnutrición en el anciano oncológico, así como los métodos empleados para evaluarla (pérdida de peso, índice de masa corporal [IMC], cuestionario Mini Nutritional Assessment [MNA], hipoalbuminemia).
Otro de los motivos por los que el estado nutricional tiene un papel tan importante en el anciano oncológico es el amplio abanico de repercusiones negativas que la malnutrición puede producir en estos pacientes 1,14,15,16,17,18,19,20. De entre todas estas repercusiones, en este artículo se hace una mención especial a una peor tolerancia del tratamiento 18,21 y a una menor eficacia del mismo 19 y, por ende, a un peor pronóstico en el anciano con cáncer 21.
¿POR QUÉ ES TAN HABITUAL LA MALNUTRICIÓN EN EL ANCIANO ONCOLÓGICO? VARIABLES RELACIONADAS CON EL TUMOR QUE INFLUYEN EN EL ESTADO NUTRICIONAL
En el anciano oncológico hay factores específicos, relacionados con el envejecimiento, tales como la presencia de comorbilidades y los cambios sensoriales, físicos y psicosociales 3,21,22, que aumentan el riesgo de malnutrición en este grupo poblacional. Sin embargo, existe otra serie de factores, asociados a la neoplasia y el tratamiento antitumoral, que también influyen en la alta prevalencia de malnutrición, como son:
La situación basal del mismo (prevalencia del 14,4% en individuos con ECOG-PS de 0 [Performance Status del grupo Eastern Cooperative Oncology Group], frente al 65,3% en pacientes con ECOG 4) 23.
El momento evolutivo de la enfermedad tumoral (prevalencia del 80-90% en la etapa final de la misma) 24,25.
El estadio tumoral (prevalencia del 2,7% en tumores en estadio I frente al 15,2% en tumores de estadio IV) (26).
El tipo de tumor (así, por ejemplo, en tumores gastroesofágicos en fases avanzadas la prevalencia es del 25,9%; en el cáncer de páncreas, del 24,2%; y en tumores genitourinarios, del 12,1%) 26.
Determinados tipos de tratamientos, tales como la cirugía (en especial, en neoplasias digestivas), la administración de radioterapia (concomitante o no a los citostáticos) y el tratamiento con quimioterapia y con otros fármacos antitumorales, influyen en el estado nutricional del paciente con cáncer. Así, por ejemplo, los citostáticos de bajo riesgo nutricional son metotrexate, 5-fluorouracilo en bolo y capecitabina en monoterapia; los de riesgo moderado son cisplatino, antraciclinas, taxanos, 5-fluorouracilo en infusión continua, ciclofosfamida, irinotecan y la poliquimioterapia; y, por último, la quimio-radioterapia concomitante en tumores de cabeza y cuello, en cáncer de pulmón o en tumores de localización pélvica representa la terapia antitumoral de alto riesgo nutricional 27.
¿CUÁLES SON LOS FACTORES RELACIONADOS CON LA NUTRICIÓN QUE SE ASOCIAN A UNA MAYOR TOXICIDAD DEL TRATAMIENTO SISTÉMICO EN EL ANCIANO ONCOLÓGICO Y CÓMO DETECTARLOS? RELACIÓN ENTRE EL ESTADO NUTRICIONAL Y LA TOXICIDAD DEL TRATAMIENTO ANTITUMORAL
El envejecimiento es un proceso multidimensional, a la vez que muy variable entre unos individuos y otros. Este proceso conduce a una serie de cambios fisiológicos que pueden modificar la tolerancia al tratamiento por parte de los sistemas y órganos, así como la farmacocinética y la farmacodinámica de los tratamientos, y por tanto, a un margen terapéutico más estrecho y a un aumento de la toxicidad de la quimioterapia en pacientes ancianos con cáncer, que supera en 3-10 veces el riesgo en individuos jóvenes 28,29.
En este sentido, la valoración geriátrica integral (VGI), la principal herramienta de trabajo en el ámbito de la Geriatría, permite evaluar todas las dimensiones de la vida del individuo de edad avanzada, incluida, entre otras, la valoración del estado nutricional 30,31,32.
La intervención sobre los mismos aumenta la posibilidad de que el paciente complete el tratamiento planificado inicialmente y disminuye la necesidad de tener que modificar dicha planificación 33. De ahí la enorme importancia de esta herramienta en Oncogeriatría 34,35,36 y que se recomiende que se lleve a cabo una VGI en todos los ancianos oncológicos 37,38.
La presencia de malnutrición es una de las variables detectadas mediante una VGI y está asociada a un mayor riesgo de toxicidad severa de la quimioterapia. En la Tabla 2 4,39,40,41,42 se muestran los estudios de ancianos oncológicos en los que se ha objetivado dicha asociación (modificado de 36).
Tabla II. Malnutrición y toxicidad de la quimioterapia en ancianos oncológicos (modificado de referencia 36)
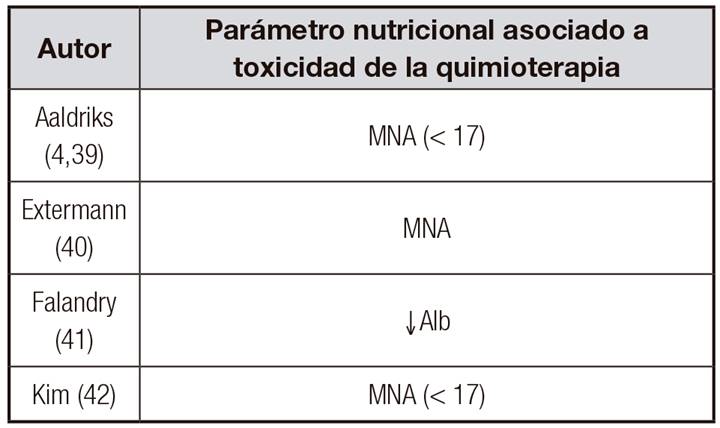
MNA: Mini Nutritional Assessment; ↓Alb: hipoalbuminemia.
Según el estudio de Extermann y cols., reflejado en dicha Tabla 2, el cuestionario MNA, utilizado para evaluar el estado nutricional, es uno de los ítems incluidos en su índice predictor de toxicidad (del total de ocho puntos posibles en el riesgo de toxicidad no hematológica, dos de ellos, es decir, el 25% de la puntuación de dicho riesgo, se deben al estado nutricional) 40. Existe otro índice predictor de toxicidad de la quimioterapia, creado por Hurria y cols., en el que, por el contrario, no se incluye el estado nutricional del anciano oncológico (no fue una variable con significación estadística) 43.
Hay otros parámetros relacionados con el estado nutricional que se asocian con la toxicidad de los fármacos antineoplásicos y que se describen a continuación.
PESO
El peso es una de las variables relacionadas con el estado nutricional que se utilizan de forma generalizada en el individuo con cáncer. Sin embargo, es erróneo considerar que el sobrepeso se asocia a un buen estado nutricional y viceversa. El estudio de Gioulbasanis y cols. mostró que el 41,9% de los pacientes metastásicos presentan sobrepeso y que, de estos, la mitad tiene riesgo de desnutrición y el 12% están desnutridos 44. El peso, por tanto, no permite determinar el estado nutricional del paciente oncológico, aunque es útil para calcular la dosis a administrar en gran parte de los fármacos antitumorales (dicha dosis suele calcularse, como se ha dicho, a partir del peso del paciente, expresado en kilogramos [kg] o bien mediante la superficie corporal [SC] del mismo, obtenida mediante el peso del individuo y la altura).
¿Cuál es la relación entre el peso del individuo, la superficie corporal y la toxicidad de los fármacos antineoplásicos?
Como se ha indicado en un párrafo previo, para la mayoría de los tratamientos quimioterápicos la dosis a administrar al paciente se determina utilizando la SC del mismo (a su vez, calculada a partir del peso del individuo). Inicialmente, diversos investigadores utilizaron la superficie corporal para estimar la dosis adecuada de cada fármaco antitumoral en los ensayos fase I basados en estudios preclínicos con animales 45).
De esta forma, la SC se estableció en la práctica clínica como la variable con la que calcular la dosis a administrar de quimioterapia, en gran parte, basada en un criterio dogmático y no en estudios que mostraran que la SC se asocia a cambios en la farmacocinética de los tratamientos entre un paciente y otro. Sin embargo, muchos estudios se cuestionan que la SC sea el mejor parámetro a utilizar en la selección de dosis de un tratamiento antitumoral 46,47,48,49.
En su última publicación, referente al año 2012, las guías de la Sociedad Americana de Oncología Médica (ASCO) recomiendan que, para calcular dicha SC, se emplee el peso total del individuo. En esta publicación, que sigue sin actualizarse a fecha de hoy, los autores reconocen las limitaciones de esta aproximación y sugieren la necesidad de diseñar ensayos prospectivos en los que se considere la composición corporal y no solo la SC 50.
En el paciente de edad avanzada, la determinación de la SC a partir peso total del individuo para calcular la dosis total del citostático es una práctica más cuestionable que en el individuo joven. Los cambios en la composición corporal asociados al envejecimiento (por ejemplo, la reducción de la masa muscular y el aumento de la masa grasa) influyen en la farmacocinética de los agentes citostáticos, por lo que tales parámetros de la composición corporal podrían tener un mayor peso en la evaluación de la toxicidad y en el cálculo de la dosis óptima del citostático, que la variable "peso" 51. Prado fue la primera autora que demostró que el cálculo de la dosis de los citostáticos basado en el peso total del individuo con cáncer no permite discriminar entre pacientes con alto o bajo riesgo de desarrollar una toxicidad limitante de dosis 52. El peso tampoco es útil para monitorizar los cambios que se están produciendo en la composición corporal del individuo anciano, pues puede permanecer estable aun en situaciones en las que se produzcan determinadas alteraciones (por ejemplo, si existe de forma conjunta un aumento de la masa grasa y una pérdida de masa muscular, el peso no se modificará). Por este motivo, parece más útil evaluar de forma periódica los cambios en la composición corporal que hacer un seguimiento secuencial del peso del individuo 53. Este dato es especialmente importante en el anciano oncológico sometido a tratamiento sistémico.
Algunos autores defienden que una baja masa muscular se asocia con dosis plasmáticas del fármaco más elevadas, lo que puede explicar, al menos en parte, el peor pronóstico que existe en los pacientes oncológicos con baja masa muscular 54. Esto abre el interrogante de la idoneidad de usar dicho parámetro (peso de la masa muscular) en el cálculo de la dosis total de quimioterapia. Por otro lado, los pacientes con mayor masa grasa podrían acumular los fármacos lipofílicos y experimentar más toxicidad 51. Estos hallazgos se han reproducido en una revisión sistemática publicada recientemente por Gérard y cols. 55.
PÉRDIDA DE PESO
La pérdida de peso es un parámetro de más interés que el peso actual en cuanto a la determinación del estado nutricional, ya que esta variable se asocia al deterioro de calidad de vida del paciente, a la toxicidad del tratamiento y a una menor supervivencia 3,56,57. Además, la pérdida de peso, asociada al IMC, forma un "dúo" con el que identificar grupos de pacientes oncológicos y estimar la supervivencia de aquellos 58.
MASA MUSCULAR
Como se ha indicado previamente, en los últimos años ha entrado en escena otro parámetro en el ámbito de la nutrición: la masa muscular. La trascendencia de la masa muscular queda patente en el último documento de consenso, el de los denominados criterios GLIM (Global Leadership Initiative on Malnutrition), como se explica en el primer artículo de este número especial 59.
La trascendencia de la masa muscular se extiende hasta el ámbito de la Oncología. Distintos estudios reflejan que la masa muscular disminuye durante el tratamiento con quimioterapia y este hecho se asocia a una mayor toxicidad 60,61,62.
¿Por qué es tan importante la masa muscular en el paciente oncológico y cuál es su relación con la toxicidad de los fármacos antineoplásicos?
Se entiende por sarcopenia aquel síndrome caracterizado por la pérdida progresiva y generalizada de masa muscular esquelética y de la fuerza o de la función muscular. Este síndrome se asocia a eventos adversos, tales como discapacidad física, mortalidad y deterioro de la calidad de vida del paciente 63,64,65,66.
Se trata de un síndrome muy prevalente en pacientes oncológicos 67,68,69,70 y se asocia a una serie de repercusiones serias en dicho grupo poblacional: a) deterioro de la situación funcional del paciente oncológico 51), situación que es especialmente limitante en pacientes ancianos; b) un mayor número de complicaciones posquirúrgicas 70; y c) es un factor de riesgo independiente de toxicidad a la quimioterapia 19,20,70 (constituye un factor sobre el que intervenir para minimizar la toxicidad del tratamiento sistémico en el paciente oncológico).
Uno de los primeros grupos de investigación que analizaron la asociación entre la sarcopenia y la toxicidad de la quimioterapia fue el grupo de Prado y cols. En una publicación inicial, los autores describieron la asociación entre la toxicidad de 5-fluorouracilo y la composición corporal en pacientes con cáncer de colon estadios II/III 52, donde se halló que, en mujeres, una baja masa magra es un predictor de toxicidad a dicho citostático.
Posteriormente, este mismo grupo publicó que el tratamiento con capecitabina en pacientes con cáncer de mama metastásico tratadas previamente con antraciclinas y/o taxanos se asociaba a mayor toxicidad en los casos con sarcopenia 71.
Más adelante, en el año 2011, este mismo grupo llegó a conclusiones similares con otro agente citostático, la epirrubicina 72.
Desde entonces, el número de estudios que se han publicado al respecto ha crecido de forma notable. Así, por ejemplo, Shachar y cols. hallaron que la presencia de sarcopenia en pacientes con cáncer de mama metastásico en tratamiento de primera línea con taxanos se asoció a la aparición de toxicidad severa (grados 3-4) 73, y en el estudio de Barret y cols. se encontró una asociación entre la sarcopenia y la toxicidad del tratamiento sistémico en pacientes con cáncer colorrectal metastásico 74.
La sarcopenia y/o determinados parámetros de la composición corporal también se han relacionado con la toxicidad de nuevos fármacos basados en dianas terapéuticas, tales como sorafenib 75, sunitinib 76,77 y everolimus 78.
A este respecto, ya se dispone de estudios a nivel nacional, como el proyecto ONCOSARCO, que intentan analizar la prevalencia de sarcopenia en ancianos que van a recibir tratamiento con quimioterapia y su relación con la toxicidad de la misma 79. Esta repercusión resulta tan importante y tan interesante, que abre un nuevo campo de investigación en la Oncogeriatría.
Por último, otra de las repercusiones de la sarcopenia en pacientes oncológicos es su capacidad para predecir supervivencia global en todo tipo de neoplasia y en cualquier estadio tumoral 70,80. Por tanto, resulta importante detectar la pérdida de masa muscular y detectar la sarcopenia en los pacientes oncológicos, en especial, en los individuos de edad avanzada.
¿CÓMO INFLUYE EL TRATAMIENTO ANTITUMORAL SISTÉMICO EN EL ESTADO NUTRICIONAL DEL PACIENTE MAYOR CON CÁNCER?
El tratamiento con quimioterapia se asocia a un deterioro del estado nutricional en individuos de edad avanzada con cáncer. Según el estudio de Bicakli y cols., la administración de quimioterapia a ancianos con tumores de origen gastrointestinal deterioró su estado nutricional (previo a la quimioterapia, la prevalencia de malnutrición en estos pacientes era del 37,9% y tras el primer ciclo de quimioterapia ascendió al 46,4%) 13.
Según este mismo estudio, tras la administración de quimioterapia, dos de los 42 pacientes con buen estado nutricional previo a dicho tratamiento se desnutrieron y seis quedaron en riesgo de desnutrición. Por otro lado, en este mismo estudio, 12 pacientes del total de 53 que tenían riesgo de desnutrición previo al inicio del tratamiento presentaron malnutrición tras el primer ciclo de quimioterapia. Estos datos muestran la influencia de los citostáticos sobre el estado nutricional del anciano con cáncer 13.
Por otro lado, en el estudio de Aaldriks y cols., en el que había un 33% de pacientes desnutridos o en riesgo de desnutrición previo a la quimioterapia, la prevalencia de malnutrición ascendió al 49% tras la administración de cuatro ciclos de tratamiento sistémico 4.
En este mismo estudio, la posibilidad de completar el tratamiento de quimioterapia era mayor en los pacientes con buen estado nutricional 4, dato del que se deriva que una intervención nutricional precoz favorecerá la tolerancia a la quimioterapia y, por tanto, aumentará las posibilidades de que se produzca una respuesta tumoral 81.
La estrecha relación entre el estado nutricional y la toxicidad de la quimioterapia aparece reflejada en la Figura 2.
¿PUEDE EL ONCÓLOGO MÉDICO MINIMIZAR EL IMPACTO DE LOS FÁRMACOS ANTITUMORALES SOBRE EL PACIENTE DE EDAD AVANZADA?
Como se ha indicado previamente, el individuo de edad avanzada tiene una reserva fisiológica reducida, por lo que presenta un mayor riesgo de sufrir complicaciones iatrogénicas. Además, se trata de pacientes con múltiples enfermedades y síndromes geriátricos, que consumen multitud de fármacos y que, normalmente, son vulnerables, tanto desde el punto de vista social como funcional. Estas peculiaridades implican que sea necesario que la evaluación del anciano con cáncer incluya cada una de esas variables (la denominada VGI). También el tipo de quimioterapia y/o de tratamiento sistémico que se utilice influirá en el riesgo de toxicidad. Como este artículo pretende centrarse principalmente en el estado nutricional, en la Figura 3 se resumen de forma gráfica los principales factores relacionados con la toxicidad de la quimioterapia y de otras terapias en el anciano oncológico sobre los que se puede intervenir.
Algunas publicaciones recientes están evaluando la posibilidad de ajustar la dosis de quimioterapia o de escalarla en función de la masa muscular del paciente oncológico 51 y, mediante dicho ajuste, prevenir las toxicidades limitantes de dosis de los fármacos antitumorales 82. Esta premisa se puede generalizar también a algunos de los fármacos nuevos, distintos de la quimioterapia, según indican distintas publicaciones al respecto 69,76,77,78.
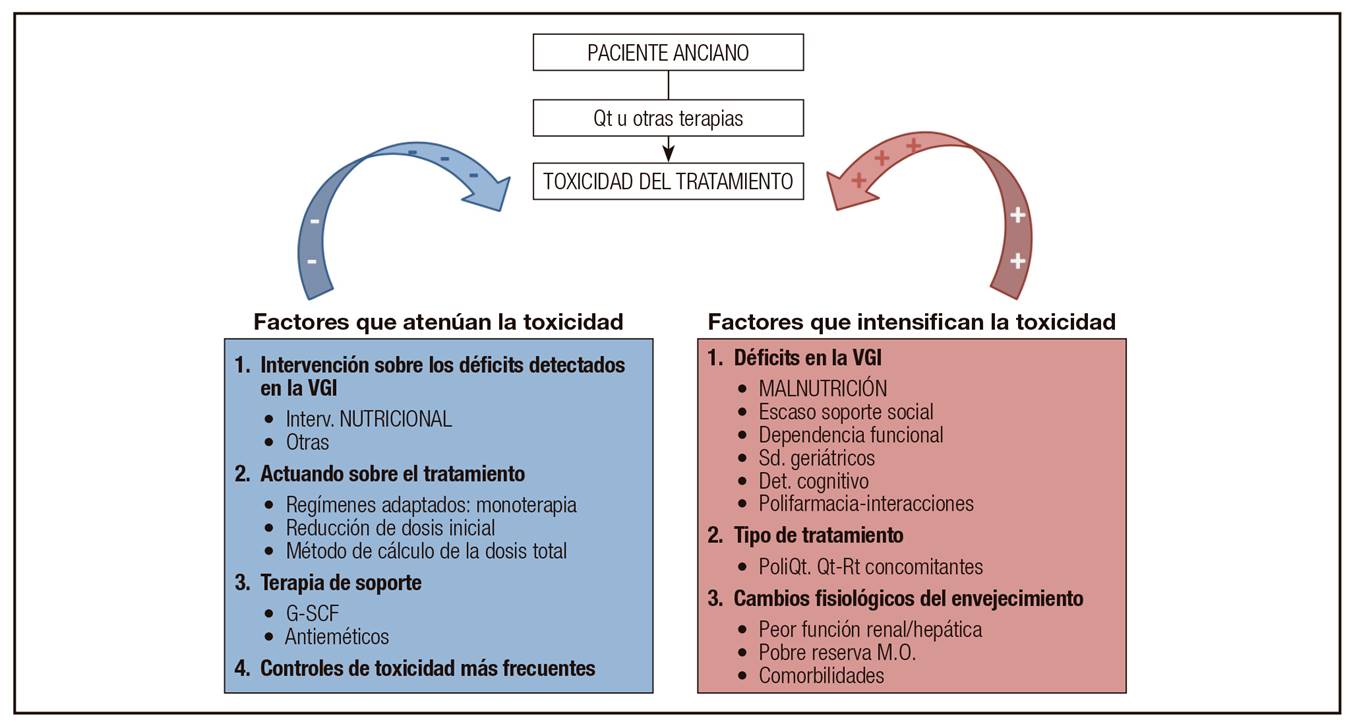
Figura 3. Factores "modulables" relacionados con la toxicidad de la quimioterapia y de otras terapias en el anciano oncológico (VGI: valoración geriátrica integral; Interv.: intervención; G-CSF: factor estimulante de colonias granulocíticas; Sd.: síndromes; Det.: deterioro; PoliQt: poliquimioterapia; Qt-Rt concomitantes: quimio-radioterapia concomitantes; M.O.: médula ósea).
Otras publicaciones se están centrando en la salud bucodental del anciano oncológico y en su importancia para garantizar un mejor estado nutricional en estos individuos. Así, por ejemplo, un artículo reciente muestra la relación entre la salud bucodental y/o la presencia de lesiones bucales con el estado nutricional en pacientes de edad avanzada con cáncer sometidos a tratamiento de quimioterapia 83. Una maniobra a considerar en esta población es la derivación al especialista en salud bucodental previo al inicio de dicho tratamiento.
Otra forma de determinar el estado nutricional del anciano oncológico es a través de determinados cuestionarios y escalas. Algunas de las más empleadas en la VGI para identificar la malnutrición o el riesgo de malnutrición en el anciano oncológico son el Malnutrition Screening Tool (MST), el Mini Nutritional Assessment (MNA), el Nutrition Risk Screening (NRS) y el Malnutrition Universal Screening Tool (MUST) 84. Una vez evaluado dicho estado nutricional, se debe intervenir si se objetiva algún déficit en el mismo 85 y, de esta forma, minimizar las repercusiones de la malnutrición en el anciano oncológico 3,86 y los posibles efectos tóxicos del tratamiento sistémico.
La intervención nutricional precoz puede mejorar la calidad de vida del paciente oncológico, la tolerancia al tratamiento 81 y el pronóstico en general, así como puede disminuir la tasa de complicaciones en estos pacientes, siendo necesario que exista una colaboración estrecha entre el oncólogo y el experto en nutrición 87. Dichas intervenciones se centran fundamentalmente en la realización de ejercicio 88,89 y en el uso de suplementos dietéticos ricos en ácidos grasos ω-3 20. Este tipo de suplementos se asocian a una ganancia de peso, a la reducción del perfil inflamatorio y a la estabilización del estado nutricional y del perfil inmune de los pacientes oncológicos 90, aunque no existe unanimidad entre los distintos estudios y se precisa confirmar su eficacia 91.
Otra maniobra nutricional se basa en que el uso de suplementos con glutamina parece mejorar la eficacia de la quimio-radioterapia, al reducir la toxicidad de los tejidos circundantes 91.
Sin embargo, se precisa investigar más acerca del impacto de tales intervenciones sobre la toxicidad y la eficacia de los fármacos antitumorales en el caso del anciano oncológico. El primer ensayo randomizado que evaluará la eficacia y la seguridad de la intervención multimodal (nutrición y ejercicio) en ancianos con cáncer avanzado inició el reclutamiento de pacientes en agosto de 2017 92. Los resultados de este ensayo aclararán múltiples cuestiones para las que aún no existe respuesta en cuanto a la intervención nutricional en ancianos oncológicos.
Las principales sociedades científicas han elaborado una serie de documentos de consenso y de recomendaciones prácticas en relación a la intervención nutricional 93.
Según Muscaritoli y cols., dado que el tratamiento antitumoral sistémico aumenta el riesgo de desnutrición en el paciente oncológico, la valoración nutricional y la intervención asociada a la misma se deben realizar de forma simultánea al planteamiento del tratamiento sistémico. De forma paralela al tratamiento antitumoral, una vez iniciado este, es preciso continuar evaluando el estado nutricional del paciente y llevando a cabo la intervención nutricional pertinente. De esta forma se reducirá la aparición de malnutrición (y de las repercusiones derivadas de la misma) en los pacientes oncológicos 94. Uno de los objetivos primarios de la intervención nutricional en Oncología es mejorar la tolerancia al tratamiento quimioterápico y, por ende, incrementar la posibilidad de la adherencia al tratamiento y de la respuesta tumoral. Por dicho motivo, como ya se ha mencionado, la intervención nutricional debe ser precoz y formar parte del tratamiento integral del paciente oncológico.
RESUMEN. IDEAS CLAVE
- Las repercusiones de la malnutrición son variadas y severas. Incluyen una mayor toxicidad a la quimioterapia y, por tanto, un peor cumplimiento del tratamiento antitumoral y, de forma secundaria, un peor pronóstico.
- El estado nutricional se deteriora en un porcentaje alto de los pacientes como consecuencia del propio tratamiento con quimioterapia. Asimismo, el uso de citostáticos y/o de otras terapias sistémicas se asocia al deterioro del estado nutricional en un porcentaje notable de ancianos con cáncer.
- En el plan de cuidado y de manejo de todo paciente oncológico, incluido el paciente de edad avanzada, se debe introducir la determinación del estado nutricional como parte de la VGI del mismo.
- La evaluación del estado nutricional ha de llevarse a cabo de forma precoz, en el momento del diagnóstico del tumor. Posteriormente, debe determinarse de forma periódica a lo largo del proceso de la enfermedad.
- El cuestionario MNA, ampliamente utilizado en Oncogeriatría para determinar el estado nutricional del anciano con cáncer, se ha asociado a la capacidad para completar el tratamiento con quimioterapia.
- El manejo óptimo del estado nutricional del paciente oncológico debe ser multidisciplinar y de inicio precoz y continuado a lo largo de la enfermedad. La combinación de soporte nutricional y ejercicio físico se prevé prometedora en ancianos oncológicos. Asimismo, la composición corporal basal y los cambios de la misma durante el tratamiento representan un amplio campo de investigación.

















