INTRODUCCIÓN
La hipercolesterolemia familiar (HF) se define como un grupo de defectos genéticos que dan lugar a elevaciones graves de las concentraciones de lipoproteínas de baja densidad (LDL). Se caracteriza por una transmisión autosómica dominante o codominante con un patrón de penetrancia mayor del 90 %, presentando la mayoría de las familias un patrón de transmisión heterocigótico. En raras ocasiones este patrón es homocigótico, dando lugar a elevaciones extremas del colesterol unido a LDL (cLDL). La prevalencia, en la forma heterocigótica (HFH), se sitúa en torno a 1/300-500 sujetos en la población general, mientras que en la forma homocigótica, mucho menos frecuente, está en torno a 1/450.000 individuos (1).
Esta elevación de cLDL está directamente relacionada con los eventos cardiovasculares y la mortalidad precoz, así como con el depósito extravascular de colesterol en forma de xantomas tendinosos o arco corneal (2). La elevada prevalencia y el incremento exponencial del riesgo de desarrollar una enfermedad coronaria prematura hacen de la HFH un problema de salud pública. Además, a pesar del elevado riesgo cardiovascular y de la existencia de tratamiento eficaz con escasos efectos secundarios, la mayoría de los pacientes se encuentran sin diagnóstico ni tratamiento adecuado (3).
Hasta el momento se han identificado más de 1700 mutaciones en el gen del receptor de LDL del cromosoma 19, expresando el 79 % de estas un fenotipo hipercolesterolémico. Con menos frecuencia se encuentran mutaciones en el gen de la apolipoproteína B (ApoB) y en el gen de la proproteína-convertasa subtilisina/kexina de tipo 9 (PCSK9), presentándose en el 5 % y en el 1 % de los casos de HF, respectivamente (4).
Existen diferentes herramientas para establecer el grado de sospecha clínica en los casos índice de HF; la más difundida, aprobada por la Organización Mundial de la Salud (OMS), es el test MedPed, con una escala de puntuación basada en los niveles de colesterol-LDL, en la historia personal y familiar, y en la exploración clínica, validado todo ello además con el diagnóstico genético. Además, la detección de la HF cumple los criterios de la OMS para el cribado sistemático de la enfermedad y para el estudio en cascada familiar, siendo este coste-efectivo para detectar nuevos casos (5).
La utilidad del diagnóstico genético se ha confirmado en numerosos estudios ya que identifica de manera precoz e inequívoca a los sujetos con riesgo cardiovascular elevado, facilita el consejo genético, estratifica el pronóstico de acuerdo con el tipo de mutación y mejora el cumplimiento del tratamiento (6). Sin embargo, cabe destacar que en torno al 50 % de los casos con diagnóstico clínico no presentan ninguna mutación causal detectable (7).
El objetivo del tratamiento hipolipemiante (estatinas, ezetimiba e inhibidores de PCSK9) persigue la reducción del cLDL, la estabilización de la placa lipídica y la regresión de la aterosclerosis. Pero no solo es necesario un tratamiento farmacológico sino que es esencial modificar el estilo de vida de forma que influya sobre el hábito tabáquico, el ejercicio físico y la adherencia a dietas cardiosaludables como es el caso de la dieta mediterránea. La dieta mediterránea, caracterizada por un elevado consumo de frutas, verduras, legumbres, frutos secos, cereales no refinados, pescados y aceite de oliva como principal fuente de grasa, con un consumo moderado de productos lácteos y bajo consumo de carnes rojas, juega un rol muy importante en la salud cardiovascular de la población, tanto a nivel de prevención primaria como a nivel de prevención secundaria (8-11).
El objetivo del presente estudio fue describir el grado de control metabólico, los antecedentes y el perfil cardiovascular, y la adherencia a estilos de vida cardiosaludables en una cohorte de pacientes con HFH, con diagnóstico genético, en seguimiento en una consulta de endocrinología y nutrición desde su inclusión como programa de salud pública en 2009 por parte de la Consejería de Sanidad.
MATERIAL Y MÉTODOS
Estudio de cohortes retrospectivo de los casos índices y familiares diagnosticados genéticamente de HFH en la Unidad de Lípidos del Servicio de Endocrinología y Nutrición del HCUV, desde la puesta en marcha del Programa de Salud Pública de Detección Precoz de la Hipercolesterolemia Familiar por la Consejería de Sanidad de Castilla y León en 2009.
Se analizaron los datos antropométricos (peso, talla e índice de masa corporal (IMC)), clínicos y analíticos [colesterol total, cHDL y triglicéridos mediante test enzimático colorimétrico en plataforma Cobas c701 (Roche Diagnostics®); cLDL por la fórmula de Friedewald; glucosa plasmática mediante test de radiación ultravioleta (método enzimático de referencia mediante hexoquinasa) en el analizador Cobas c701 (Roche Diagnostics®); estudio genético mediante la técnica de micromatrices de ADN (Lipochip®)], y el tipo de tratamiento hipolipemiante en el momento del diagnóstico y en la última visita de seguimiento. En esta última consulta se cumplimentó el cuestionario PREDIMED (12,13we assigned 7447 participants (55 to 80 years of age, 57 % women) de 14 preguntas para evaluar la adherencia a la dieta mediterránea.
Este estudio fue aprobado por el ComitéÉtico de Investigación Clínica del Área de Salud Este de Valladolid. Todos los participantes dieron su consentimiento informado por escrito, tanto para la realización del estudio genético como para su inclusión en esta investigación.
ANÁLISIS ESTADÍSTICO
La distribución normal de las variables se analizó con el test de Kolmogorov-Smirnov. Los resultados de las variables cuantitativas con distribución normal se han expresado como media y desviación estándar; para las cualitativas se ha utilizado el número de casos y el porcentaje.
Se han utilizado el test de la “t” de Student bilateral para comparar las variables cuantitativas y el coeficiente de correlación de Pearson para evaluar la asociación de las variables cuantitativas. Las variables categóricas se analizaron con el test del chi cuadrado.
La relación entre variables se ha considerado estadísticamente significativa si p < 0,05. El análisis estadístico se ha realizado con el paquete SPSS v.19 (IL, EUA).
RESULTADOS
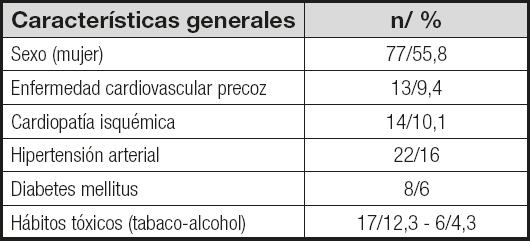
Se evaluaron un total de 138 pacientes con hipercolesterolemia y puntuación mayor o igual a 6 en el test MedPed, a los que se realizó un estudio genético. La edad media fue de 48,8 (17,7) años y el 55,8 % de la muestra fueron mujeres, con un tiempo medio de seguimiento de 7,6 (2,5) años.
La media de colesterol fue de 281,1 (68,4) mg/dl con un cLDL de 204 (65) mg/dl. El 72,4 % de los pacientes se encontraban en tratamiento farmacológico hipolipemiante en el momento de la primera evaluación.
Entre las características basales se encontraron antecedentes personales de enfermedad cardiovascular precoz (evento en varón menor de 55 años o mujer menor de 65 años) en el 9,4 % de los casos y cardiopatía isquémica en el 10,1 % (Tabla I).
Se encontró una mutación positiva para la HFH en el 55,8 % de los pacientes (n = 77), observándose un total de 41 mutaciones, todas ellas presentes en el receptor de LDL (rLDL). El tipo de mutación más frecuente fue por cambio de aminoácido. Un 45 % de los pacientes con mutación positiva se encontraban en tratamiento hipolipemiante de alta intensidad, coincidente con una dosis diaria definida (DDD) de tratamiento hipolipemiante OMS (14) de 3,4 (1,7).
Al comparar las características clínicas y analíticas de los pacientes con resultado positivo y negativo en el estudio genético se observó, en los pacientes con confirmación genética, una edad media menor, mayor puntuación en el test MedPed y niveles más elevados de cLDL al diagnóstico. Además se encontraron en los pacientes sin detección de mutación en el test genético niveles mayores de glucemia basal, triglicéridos y presión arterial (Tabla II).
Tabla II. Comparación de los resultados obtenidos entre los pacientes con mutación positiva y negativa para la HFH
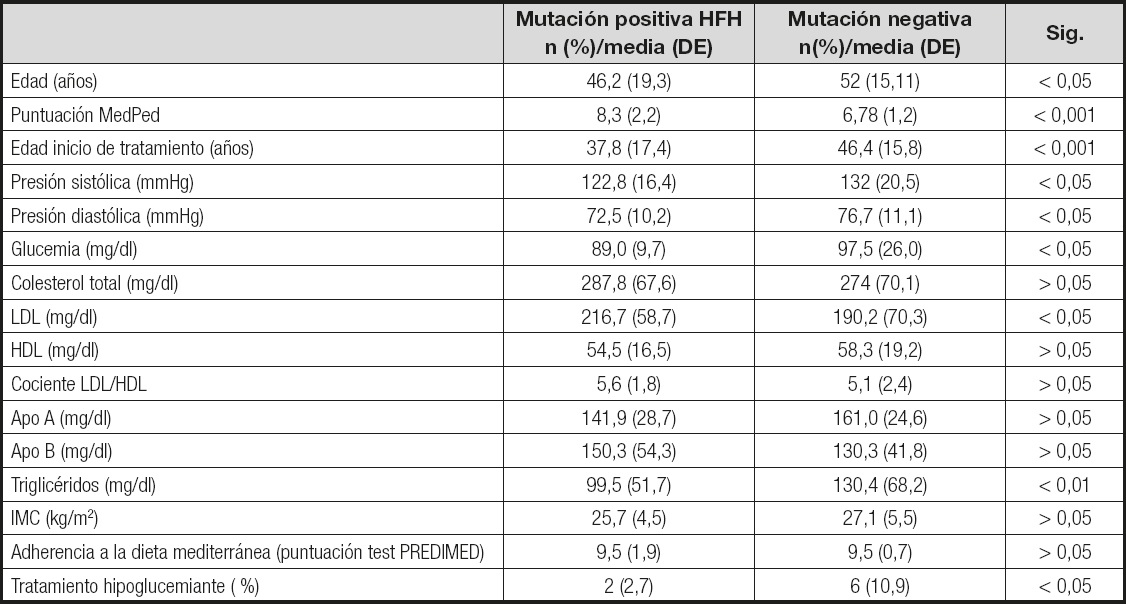
LDL: lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; IMC: índice de masa corporal; Apo A: apolipoproteína A; Apo B: apolipoproteína B.
La relación caso familiar/caso índice fue de 3,05. Entre los casos familiares (n = 19) se observó una menor edad media [32,89 (19,2) años vs. 50,3 (17,6) años, p < 0,001], lo que conlleva un inicio más temprano del tratamiento hipolipemiante [29,1 (17,6) años vs. 38,9 (16,7) años, p < 0,001], así como valores de cLDL inferiores en el momento del diagnóstico [181,9 (64,3) mg/dl vs. 226,8 (52) mg/dl, p < 0,005] en comparación con los casos índice.
Durante el seguimiento se obtuvo una reducción estadísticamente significativa de la mayor parte de los parámetros del perfil lipídico de los pacientes con HF confirmada (Tabla III). Además se observó un aumento del porcentaje de pacientes con cifras de cLDL dentro del objetivo desde el diagnóstico hasta la última consulta de seguimiento realizada (9,2 % vs. 31,6 %, p < 0,001).
Tabla III. Comparación de los resultados obtenidos en el perfil metabólico al inicio y tras el seguimiento de los pacientes con HFH con mutación positiva
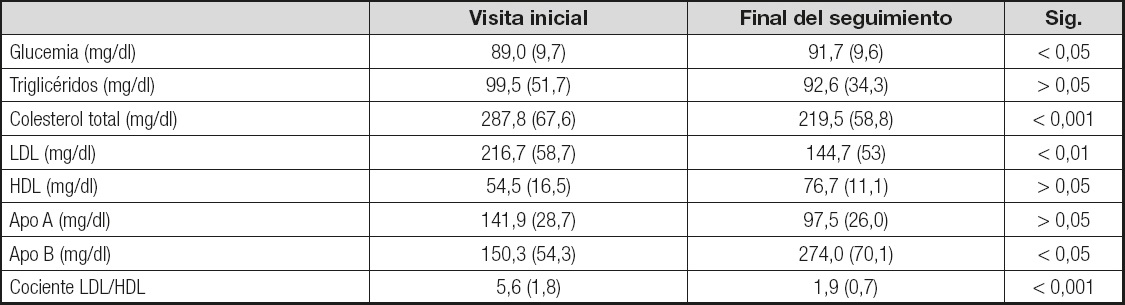
LDL: lipoproteínas de baja densidad; HDL: lipoproteínas de alta densidad; Apo A: apolipoproteína A; Apo B: apolipoproteína B.
Se evidenció una correlación positiva entre la DDD de tratamiento hipolipemiante OMS (14) y la reducción de los niveles de LDL (r = 0,254, p < 0,05) (Fig. 1).
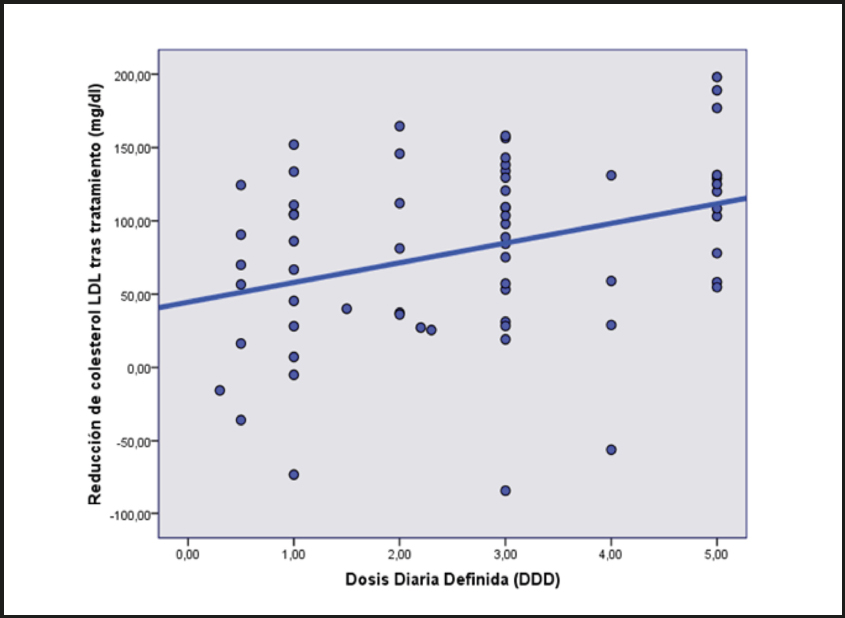
Figura 1. Relación entre la reducción de las LDL tras el tratamiento y la dosis diaria definida (DDD) en pacientes con mutación positiva.
Los pacientes con HF presentaron una adherencia media-alta a un patrón de dieta cardiosaludable como es la dieta mediterránea, con una puntuación media de 9,5 (1,9) en el test Predimed. Todos los pacientes presentaron puntuaciones por encima de 7 puntos y un 46,2 % valores iguales o superiores a 10. Las preguntas que se asociaron a un patrón de conducta con alta adherencia a la dieta mediterránea fueron aquellas relacionadas con la ingesta moderada de pescado-mariscos y frutos secos, y la baja ingesta de repostería comercial y bebidas azucaradas (p < 0,05).
DISCUSIÓN
La HFH es la enfermedad genética más frecuente en la población general y conlleva un elevado riesgo cardiovascular y de enfermedad coronaria temprana. De hecho, es la causa genética más habitual asociada con la enfermedad aterosclerótica y la mortalidad de causa cardiovascular (15,16). Su identificación y tratamiento precoz es, por tanto, esencial, habiéndose demostrado en numerosos estudios una disminución de la morbimortalidad con el tratamiento intensivo hipolipemiante asociado a estilos de vida cardiosaludables (17). Sin embargo, es común su diagnóstico y tratamiento tardío. Desde una perspectiva de Salud Pública, la detección en cascada de la HFH cumple con los criterios de eficacia y eficiencia para su diagnóstico precoz (18).
Los resultados de la presente cohorte son en parte similares a otros publicados con anterioridad: un 55,8 % de los pacientes evaluados presentaron una mutación identificable, todas en ellas en el gen del rLDL (19), en la micromatriz de ADN (Lipochip®), que presenta una especificidad y una sensibilidad globales del 99,7 % y el 99,9 %, respectivamente. Sin embargo, sigue siendo llamativo cómo, a pesar de una edad media cercana a los 50 años, tan solo un 10 % de la población estudiada presentaban enfermedad cardiovascular en la primera visita (20). Es más, en el momento de la confirmación diagnóstica, prácticamente el 75 % de los pacientes se encontraban en tratamiento farmacológico hipolipemiante sin calificación previa de HFH. Aunque el inicio de un tratamiento hipolipemiante precoz en ausencia de diagnóstico de HF puede retrasar las complicaciones cardiovasculares de la HFH y justificar en parte el bajo porcentaje de enfermedad cardiovascular al inicio del estudio, los objetivos de cLDL necesarios, así como la potencia hipolipemiante utilizada, suelen ser inferiores a los aconsejados en las guías clínicas e incluso pueden condicionar el retraso del diagnóstico de HFH, de su estudio genético y, por supuesto, de los beneficios de la detección precoz en los familiares (21). De hecho, en nuestra cohorte, a pesar de un importante incremento en el porcentaje de pacientes que logran los objetivos de cLDL, estos se alcanzan tan solo en un 31,6 % de los casos incluso tras el diagnóstico genético, porcentaje semejante al de otros estudios publicados (22). Esta reducción del cLDL está directamente relacionada con el grado de potencia del tratamiento hipolipemiante, como demuestra la correlación lineal en nuestro estudio. A pesar del tratamiento con estatinas de alta potencia y combinado, son necesarias otras opciones terapéuticas para el control de la HFH (23,24).
Por otro lado son llamativas las características compatibles con un síndrome metabólico que presentan los pacientes con hipercolesterolemia sin mutación confirmada, con mayor presencia de diagnóstico de diabetes mellitus, elevación de triglicéridos y/o glucemia plasmática que aquellos con diagnóstico genético positivo de HFH, lo que evidencia el solapamiento de ambas entidades en los pacientes con alto riesgo cardiovascular (25).
Además, los casos familiares diagnosticados tras el cribado en cascada comenzaron el tratamiento hipolipemiante a edades más tempranas que los casos índice, con menores niveles de LDL al diagnóstico. Esto apoya la importancia del estudio en cascada para lograr una intervención precoz y muestra la dificultad del diagnóstico de la HFH en los sujetos jóvenes con niveles aparentemente dentro del rango normal de colesterol plasmático (26). Resulta muy significativa la baja razón de detección de los casos familiares, con un bajo índice de casos familiares/casos índice a pesar de estar incluido el diagnóstico genético en un programa de detección precoz de la HF. Esta situación, sin embargo, es muy común en otros programas de detección precoz por diversos motivos (migración familiar, desconocimiento de la patología o mala información sobre la misma) (6).
Por último, resulta llamativo el alto grado de adherencia a la dieta mediterránea, ya que todos los pacientes presentaron valores por encima de 6 en el cuestionario PREDIMED, lo que indica una elevada adherencia (27). Al contrario de lo que cabría esperar, aquellos pacientes con mayor puntuación en el cuestionario presentaron mayores niveles de colesterol total circulante. Esta situación, a priori no esperable, podría estar justificada por el elevado grado de implicación y sensibilización de los pacientes con HF por esta patología y la importancia de un estilo de vida saludable (28).
A pesar de que refleja adecuadamente la práctica diaria en el diagnóstico de la HF y la influencia de los estilos de vida cardiosaludables, el presente estudio presenta ciertas limitaciones a señalar. En primer lugar, el 75 % de los pacientes evaluados ya se encontraban en tratamiento hipolipemiante en la primera visita, llamando también la atención la baja razón de detección de casos familiares/casos índices incluso en un programa de salud pública. Estas situaciones son comunes a muchos de los estudios de HF dada la migración familiar y la sensibilización a un inicio precoz del tratamiento hipolipemiante sin diagnóstico, entre otros motivos. Además, no se evaluó el cuestionario PREDIMED en la visita inicial. Por último, la utilización de micromatrices de ADN (Lipochip®) en el diagnóstico es un método exhaustivo y relativamente barato de diagnóstico genético pero no abarca la totalidad de las mutaciones asociadas a la HF, por lo que la positividad podría ser menor de lo esperable.
CONCLUSIONES
El estudio en cascada familiar de la HF heterocigótica facilita su diagnóstico en los sujetos jóvenes con niveles aparentemente dentro del rango normal de colesterol circulante, por lo que estos afectados reciben tratamiento hipolipemiante a edades más tempranas. Los pacientes con HF presentan una elevada adherencia a las dietas cardiosaludables como la dieta mediterránea. A pesar de todo ello, una parte importante de estos pacientes no logra alcanzar el objetivo de LDL aconsejado en las guías clínicas actuales.