INTRODUCCIÓN
La acumulación de grasa visceral generalmente resulta de un desequilibrio energético que implica la combinación de un exceso de calorías de la dieta junto con un gasto energético insuficiente. El aumento de la adiposidad visceral puede inducir resistencia a la insulina y conducir a la diabetes mellitus de tipo 2, la dislipidemia, la hipertensión y la enfermedad cardiovascular (1).
Las modificaciones del estilo de vida, en particular el manejo de la dieta, pueden ser útiles para controlar los factores de riesgo de la diabetes y la enfermedad cardiovascular. El uso de suplementos fitoterápicos se reconoce como terapia complementaria ya que los compuestos fitoquímicos poseen efectos antioxidantes que podrían mejorar la regulación del metabolismo lipídico y glucémico (2).
Muchos estudios han demostrado que el hígado desempeña un papel primordial en la regulación de la homeostasis de la glucosa durante el ayuno y el período posprandial. En este sentido, la elevación de las transaminasas se ve comúnmente en la diabetes mellitus de tipo II, siendo la glutamil-oxaloacético-transaminasa (GOT) y la glutamil-piruvato-transaminasa (GPT) marcadores fiables de daño hepático (3).
El propóleo es una sustancia resinosa de árboles y arbustos silvestres que las abejas extraen con el fin de taponar herméticamente la colmena e impedir que se produzca dentro de ella cualquier tipo de infección, manteniéndola así aséptica. Su composición química es compleja y varía según los cambios regionales, estacionales y las fuentes vegetales que visitan las abejas. Los constituyentes químicos más comunes del propóleo son principalmente flavonoides, compuestos fenólicos, ácidos cafeoilquínicos, derivados del ácido cinámico, ácido diterpenoico, lignano, ácido cumarínico y otros compuestos (4).
Además, el hígado es un órgano central en la homeostasis del organismo que está expuesto a productos bacterianos, toxinas y antígenos derivados de los alimentos, con una notable capacidad para el metabolismo de ácidos grasos, tanto propios como procedentes del tejido adiposo, influyendo así en el metabolismo glucídico y lipídico (5). El fallo hepático causa consecuencias críticas para la desintoxicación de metabolitos, la síntesis de proteínas, el metabolismo y el proceso digestivo (5). Las especies reactivas de oxígeno (ERO) oxidan las proteínas celulares, los lípidos y los ácidos nucleicos, lo que conduce a daño y disfunción celular general y puede iniciar la muerte celular a través de varias cascadas de señalización (6).
Teniendo en cuenta el papel clave del hígado como regulador de la glucemia y del metabolismo de los lípidos, y la influencia del estrés oxidativo en el desarrollo de diversas patologías, sería interesante evaluar el efecto de la suplementación oral con una sustancia antioxidante capaz de disminuir la agresión oxidativa y mejorar el perfil lipídico y glucémico. Por lo tanto, el propósito del presente estudio fue determinar si la suplementación con propóleo natural puede ser eficiente para regular el metabolismo lipídico y la actividad antioxidante hepática.
MATERIAL Y MÉTODOS
PROPÓLEO
Las muestras de propóleo fueron suministradas por Verbiotech I + D + i S.L. (Granada, España). El análisis de constituyentes revela que contiene aproximadamente 50 % de resina y bálsamo vegetal, 30 % de cera, 10 % de aceites esenciales y aromáticos, 5 % de polen y 5 % de otros compuestos. Los flavonoides son abundantes e incluyen la crisina, apigenina, luteolina, rutina, morina, quercetina, myricetina, kaempferol, quercetina, galangina, naringina, naringenina, hesperidina, daidzeína y genisteína.
ENSAYO DE COMPUESTOS FENÓLICOS TOTALES
Se pesó una muestra liofilizada de 0,5 g de propóleo crudo y se sometió a extracción de productos fenólicos y flavonoides con 50 ml de metanol acuoso al 80 % en un baño ultrasónico Modelo 2510 EMS (Hatfield, EE. UU.) durante 20 min. Una alícuota (1 ml) de los extractos se centrifugó a 14.000 rpm durante 5 min. El contenido fenólico total del propóleo se determinó mediante el ensayo de Folin-Ciocalteau (7). Los extractos se oxidaron con el reactivo de Folin-Ciocalteu y la reacción se neutralizó con carbonato de sodio. La absorbancia del color azul resultante se midió a 760 nm después de 60 min. El uso de ácido gálico como contenido fenólico total estándar (la curva estándar se preparó usando concentraciones de 2,5-50 mg/l) se expresó como mg de equivalentes de ácido gálico (GAE)/100 g de peso fresco. Los datos se obtuvieron por triplicado.
ENSAYO DE FLAVONOIDES TOTALES
El contenido total de flavonoides se midió mediante el ensayo colorimétrico de cloruro de aluminio (8). Se añadió una alícuota (1 ml) de extractos (0,5 g de propóleo en 50 ml de metanol acuoso al 80 %) o solución estándar de catequina (20, 40, 60, 80, 100 mg/l) a un matraz volumétrico con 4 ml de H2O bidestilada. Al matraz se añadieron 0,3 ml de NaNO2 al 5 %. Después de 5 min se añadieron 0,3 ml de AlCl3 al 10 %. Al sexto minuto se añadieron 2 ml de solución de NaOH 1 M y el volumen total se completó hasta 10 ml con H2O bidestilada. La solución se mezcló bien y se midió la absorbancia frente al blanco a 510 nm. El contenido total de flavonoides se expresó en mg de equivalentes de catequina (CE)/100 g de masa fresca. Las muestras se analizaron por triplicado.
ANIMALES, DISEÑO EXPERIMENTAL Y DIETAS
Para este estudio se utilizaron veinte ratas albinas Wistar macho (8 semanas de edad), con un peso medio de 215 ± 10 g, obtenidas en el Servicio de Animales de Laboratorio de la Universidad de Granada. Los procedimientos de cuidado animal y los protocolos experimentales fueron aprobados por el Comité de Ética de la Universidad de Granada de acuerdo con las directrices de la Comunidad Europea. Las ratas se dividieron en dos grupos de 10 animales cada uno y se sometieron a un período de 90 días en el que se alimentaron con dos tipos diferentes de dietas: una dieta estándar AIN-93M (9) para el grupo de control (dieta C) y dieta AIN-93M + 2 % de propóleo para el grupo de propóleo (dieta P). La tabla I muestra la composición de las dietas experimentales. Los animales se colocaron en jaulas metabólicas individuales en una habitación ambientalmente controlada con una temperatura constante de 22 ± 1 ºC, un ciclo de luz-oscuridad de 12 h y un 55 ± 10 % de humedad. La dieta y el agua bidestilada estaban disponibles ad libitum. En el día 90, todos los animales fueron sometidos a un periodo de ayuno durante la noche y luego anestesiados por inyección intraperitoneal de 5 mg de pentobarbital sódico/100 g de peso corporal (St Louis, MO, EE. UU.). Los animales se desangraron completamente mediante canulación aórtica y se analizaron alícuotas de sangre con EDTA para medir los parámetros hematológicos y bioquímicos. El resto de la sangre se centrifugó (1500 x g, 4 °C, 15 min) sin anticoagulante para separar los glóbulos rojos del suero y el posterior análisis del Fe, la TIBC, la ferritina y la hepcidina. Se extrajeron los hígados, se lavaron con solución salina y las fracciones citosólicas se prepararon frescas el mismo día mediante centrifugación diferencial con hemólisis hipotónica y centrifugaciones diferenciales sucesivas según el método de Hanahan y Ekholm (10), preservando estas fracciones citosólicas a -80 ºC para análisis adicionales de las enzimas antioxidantes catalasa (CAT), superóxido-dismutasa (SOD), glutatión-peroxidasa (GPx) y glutatión-reductasa (GR). El contenido de proteínas en las fracciones citosólicas se midió siguiendo el método descrito por Lowry y cols. (11).
Tabla I. Dietas ensayadas
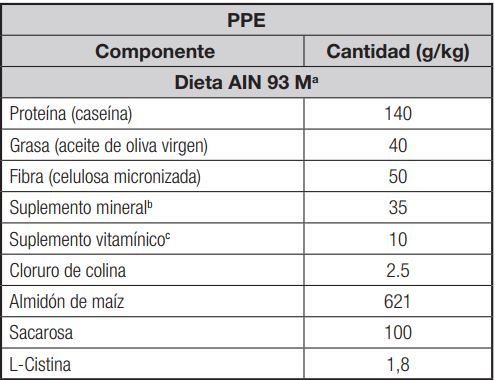
aA la dieta del grupo con propóleo (dieta P) se le agregó un 2 % de propóleo (que contenía 168,7 ± 3,9 mg de GAE/100 g como compuestos fenólicos totales y 31,7 ± 1,1 mg de CE/100 g como flavonoides totales). bEl suplemento mineral se preparó de acuerdo con las recomendaciones del Instituto Americano de Nutrición (9). cEl suplemento vitamínico se preparó según las recomendaciones del Instituto Americano de Nutrición (9).
PARÁMETROS BIOQUÍMICOS
La glucosa, la urea, la creatinina, el colesterol total, los triglicéridos, la glutamil-oxalacético-transaminasa (GOT), la glutamil-piruvato-transaminasa (GPT), la fosfatasa alcalina y la amilasa se determinaron utilizando kits comerciales (Spinreact, Barcelona, España) y siguiendo las instrucciones del fabricante.
DETERMINACIONES HEMATOLÓGICAS
Todos los parámetros hematológicos estudiados se midieron utilizando un analizador de hematología automático Mythic 22CT (C2 Diagnostics, Grabels, Francia).
HIERRO SÉRICO, CAPACIDAD DE UNIÓN TOTAL DE HIERRO (TIBC) Y SATURACIÓN DE TRANSFERRINA
Para calcular la tasa de saturación de transferrina se determinaron la concentración sérica de Fe y TIBC utilizando los reactivos Sigma Diagnostics Iron y TIBC (Sigma-Aldrich Co., St. Louis, Missouri, EE. UU.). La absorbancia de las muestras se leyó a 550 nm en un lector de microplacas (Bio-Rad Laboratories Inc., Hercules, California, EE. UU.). El porcentaje de saturación de transferrina se calculó usando la ecuación: Saturación de transferrina (%) = concentración sérica de Fe (μg/l) / TIBC (μg / L) x 100.
FERRITINA SÉRICA
La concentración de ferritina en suero se determinó usando el kit Rat Ferritin ELISA (Biovendor Gmbh, Heidelberg, Alemania). La absorbancia de la reacción se determinó a 450 nm usando un lector de microplacas (Bio-tek, Vermont, EE. UU.). La intensidad de color desarrollada fue inversamente proporcional a la concentración de ferritina sérica.
HEPCIDINA SÉRICA
La hepcidina 25 se determinó usando un kit DRG ELISA (DRG Instruments GmbH, Alemania). Este kit es un ensayo inmunoabsorbente ligado a enzimas en fase sólida (ELISA), basado en el principio de la unión competitiva. Los pocillos de microtitulación estaban recubiertos con un anticuerpo monoclonal (de ratón) dirigido hacia un sitio antigénico de la molécula de hepcidina-25. Después de la incubación, el conjugado no unido se retiró por lavado y se añadió un complejo de enzima estreptavidina-peroxidasa a cada pocillo. Después de la incubación, el complejo de enzima no unido se separó por lavado y se añadió el sustrato. La reacción se detuvo con la solución de detención y la microplaca se leyó a 450 nm con un lector de placas ((Bio-Rad Laboratories Inc., Hercules, California, EE. UU.). La intensidad del color desarrollada es inversamente proporcional a la concentración de hepcidina en la muestra.
ANÁLISIS ESTADÍSTICO
Los datos se muestran como medias ± error estándar de la media (SEM). Los análisis estadísticos se realizaron con el programa informático SPSS (versión 25.0, 2013, SPSS Inc., Chicago, Illinois, EE. UU.). Las diferencias entre el grupo alimentado con dieta de control (C) y el suplementado con propóleo (P) se evaluaron con la prueba de la t de Student. Se estableció el nivel de significación en el valor de p < 0,05. Se realizó un análisis de potencia para estimar el número de ratas necesarias para obtener un 80 % de potencia con un nivel de confianza del 95 %. Se requerirían ocho animales para obtener una diferencia del 8 % en los parámetros hematológicos entre las dietas. De forma similar, se requerirían 7 animales por grupo para obtener una diferencia del 10 % en los parámetros bioquímicos entre las dietas. Para garantizar la potencia estadística, se usaron 10 ratas por grupo.
ACTIVIDADES DE ENZIMAS ANTIOXIDANTES HEPÁTICAS
La actividad de la superóxido-dismutasa (SOD) se determinó de acuerdo con el método de Crapo y cols. (12), basado en la inhibición de la reducción del citocromo c, medido por espectrofotometría (Thermo Spectronic, Rochester, EE. UU.) a 550 nm.
La actividad de catalasa (CAT) se determinó siguiendo el método descrito por Aebi (13), monitorizando a 240 nm por espectrofotometría (Thermo Spectronic, Rochester, EE. UU.) la descomposición del H2O2 como consecuencia de la actividad catalítica de CAT.
La actividad de la glutatión peroxidasa (GPx) se midió por el método de Flohé y Gunzler (14), basado en la formación instantánea de glutatión oxidado durante la reacción catalizada por la glutatión-peroxidasa. La oxidación de NADPH a NADP+ se controló espectrofotométricamente (Thermo Spectronic, Rochester, EE. UU.) a 340 nm.
La actividad de la glutatión-reductasa (GR) se determinó utilizando el método de Worthington y Rosemeyer (15), basado en la oxidación de NADPH a NADP, catalizada por una concentración limitante de GR. En esta reacción, la reducción del glutatión oxidado se determinó indirectamente midiendo el consumo de NADPH espectrofotométricamente a 340 nm (Thermo Spectronic, Rochester, EE. UU.).
RESULTADOS
Después de la ingesta de la dieta C o P, no se encontraron diferencias significativas en los parámetros hematológicos estudiados (Tabla II).
Tabla II. Parámetros hematológicos en ratas alimentadas con dieta control o suplementada con propóleo

Hb: hemoglobina; VCM: volumen corpuscular medio; HCM: Hb corpuscular media; CHCM: concentracón de Hb corpuscular media; ADE: ancho de distribución de eritrocitos; Tf: Transferrina; TIBC: Capacidad total de fijación al Fe. *Diferencias estadísticamente significativas del grupo control (p < 0,001, test de la t de Student).
El suplemento de propóleo indujo una reducción de la glucosa (p < 0,01), el colesterol total (p < 0,001), la GOT (p < 0,05) y la GPT (p < 0,01), en comparación con el grupo control (sin propóleo) (Tabla III).
Tabla III. Parámetros bioquímicos en ratas alimentadas con dieta control o suplementada con propóleo
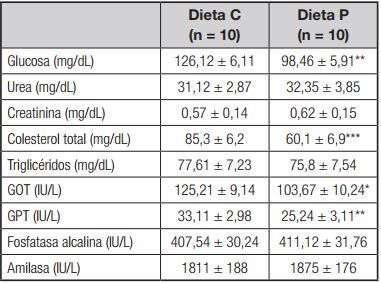
*Diferencia estadísticamente significativa del grupo C (p < 0,05).
**Diferencia estadísticamente significativa del grupo C (p < 0,01).
***Diferencia estadísticamente significativa del grupo C (p < 0,001).
Tras el consumo de la dieta con suplemento de propóleo, encontramos un incremento en la actividad hepática de la SOD (p < 0,001), CAT (p < 0,01) y la GR (p < 0,05) en comparación con el grupo control (Tabla IV).
Tabla IV. Enzimas antioxidantes hepáticas (U/mg proteína) en ratas alimentadas con dieta control o suplementada con propóleo

*Diferencia estadísticamente significativa del grupo C (p < 0,05).
**Diferencia estadísticamente significativa del grupo C (p < 0,01).
***Diferencia estadísticamente significativa del grupo C (p < 0,001).
DISCUSIÓN
En el estudio actual, hemos encontrado que el propóleo tuvo un efecto significativo, reduciendo los niveles de colesterol total y la glucemia, mientras que produjo un incremento de las enzimas antioxidantes hepáticas y una reducción en las transaminasas, sin embrago no tuvo ningún efecto sobre los parámetros hematológicos estudiados, en comparación con el grupo control.
El propóleo es efectivo para reducir la glucemia por diferentes mecanismos. Aga y cols. (16) han encontrado que el extracto de propóleo inhibe la resistencia a la insulina de adipocitos diferenciados in vitro. Estos resultados sugieren que el extracto de propóleo puede regular el metabolismo glucémico y lipídico, además de mejorar la sensibilidad a la insulina. Adicionalmente, otro estudio sugiere que el propóleo evita el desarrollo de resistencia a la insulina inducida en animales de experimentación que consumen elevadas cantidades fructosa (17). La mejora del perfil glucémico y presión arterial inducida por el propóleo es atribuible al ácido cafeoilquínico, uno de los principales componentes bioactivos de esta sustancia natural (18). Adicionalmente, Ueda y cols. (19) mostraron que el propóleo tiene el potencial de prevenir la hiperglucemia a través de la promoción de la translocación del transportador GLUT4 en el músculo esquelético.
Por otro lado, un estudio informó que la administración de propóleo redujo la proteína HMG-CoA reductasa, lo que sugiere que inhibió la síntesis de colesterol hepática (20). Otro posible mecanismo para reducir el colesterol total podría atribuirse a los compuestos resinosos presentes en el propóleo (21). Estos compuestos actúan como quelantes de las sales biliares en el intestino, aumentando así su eliminación fecal. Esto podría dar como resultado un aumento de la síntesis de sales biliares hepáticas a partir del colesterol para compensar las mayores pérdidas a través de la circulación enterohepática de las sales biliares. La combinación de estos efectos podría explicar el efecto hipocolesterolémico del propóleo. Otro estudio mostró que los polifenoles como del propóleo reducen los triglicéridos plasmáticos después del consumo de una dieta alta en grasas (22). Además, algunos componentes del propóleo atenúan la acumulación de grasa a través de la represión del receptor activado por proliferadores de peroxisomas gamma (PPARγ) en los adipocitos (20). Se ha demostrado que el agonista PPARγ aumenta la masa de tejido adiposo en ratas Wistar alimentadas con una dieta alta en grasas (23). Estos datos sugieren que PPARγ juega un papel importante papel en el tejido adiposo y su reducción por el suplemento de propóleo puede estar involucrado en la disminución de acumulación de grasa.
Uno de los índices más comunes para evaluar la función hepática son las transaminasas (24). La disminución marcada de estas dos aminotransferasas con el suplemento de propóleo indica que hay una menor liberación de las transaminasas intracelulares hepáticas a la circulación, en comparación con la dieta control (25). Sin embargo, hay que tener en cuenta que las enzimas hepáticas GOT y GPT, son marcadores frecuentemente utilizados para medir el daño hepatocelular y son muy útiles en el contexto de investigación con modelos animales, pero su valor al analizar el efecto de una intervención en hígados no patológicos es limitado. En este sentido, sería interesante validar cambios en los valores de estas enzimas en un modelo experimental de daño hepatocelular. Este trabajo pretende servir de modelo experimental basal para futuras líneas en las que evaluar el efecto de suplemento de propóleo (esteatosis, hiperlipidemia).
Por otra parte, la prevención del estrés oxidativo es un mecanismo clave para proteger el hígado de las lesiones inducidas por diversas sustancias. Para dilucidar el mecanismo del efecto protector del propóleo, determinamos SOD, CAT, GR y GPx, como índices para evaluar el estrés oxidativo (26). Las SOD cataliza la eliminación del anión superóxido y generan oxígeno molecular y peróxido de hidrógeno (27). En nuestro estudio, el suplemento de propóleo aumentó significativamente las actividades de SOD, CAT y GR. Estos hallazgos sugieren que el tratamiento con propóleo redujo el estrés oxidativo hepático, activando las enzimas antioxidantes. La actividad antioxidante del propóleo puede atribuirse al alto contenido de compuestos fenólicos y flavonoides en esta sustancia natural (28), hecho que incide de manera positiva en el aumento de las enzimas antioxidantes y la reducción de la liberación de transaminasas hepáticas.














