INTRODUCCIÓN
La fístula enterocutánea (FEC) se define como un trayecto anormal entre el tracto gastrointestinal y la piel. Estas fístulas pueden surgir espontáneamente en pacientes con malignidad subyacente, exposición a radiación o condiciones inflamatorias como la enfermedad inflamatoria intestinal, pero se desarrollan más comúnmente como complicación de la cirugía gastrointestinal. Las FEC pueden clasificarse con base en la anatomía de la zona de la fístula, incluyendo el sitio de origen y el volumen de gasto. Los defectos enterales pequeños (< 1 cm) y los trayectos fistulosos largos (> 2 cm) son condiciones que favorecen el cierre espontáneo, mientras que la falta de continuidad intestinal, la presencia de un absceso adyacente, la inflamación o estenosis intestinal, la radioterapia, la presencia de material extraño y la obstrucción distal son factores que se asocian a la ausencia de cierre espontáneo (1). La fístula enteroatmosférica se define como una conexión entre el tracto gastrointestinal y la atmósfera (es decir, cuando el intestino está expuesto), y representa un subtipo de FEC que casi nunca se cierra espontáneamente (2). La pérdida de líquido intestinal que se produce en los pacientes con FEC puede resultar considerable. No solo la de líquido, sino también la de electrólitos, minerales y proteínas, lo que contribuye a generar complicaciones tales como deshidratación, desequilibrio electrolítico y desnutrición. Existe una asociación entre la FEC de alto gasto (definida como aquella con un gasto superior a 500 ml en 24 horas) y las mayores tasas de mortalidad, si se compara con la FEC de bajo gasto (1,3).
El estándar de cuidado médico se centra en el control de la sepsis, el cuidado de la herida y la optimización de los líquidos, los electrólitos y el estado nutricional (3,4). Los pacientes con FEC a menudo se encuentran desnutridos debido a su diagnóstico de base, a la disminución de la ingesta calórica y al aumento de los requerimientos de proteína asociados a la inflamación sistémica y a la mayor pérdida de nutrientes asociada al gasto de la fístula. Los objetivos de la terapia nutricional son: proporcionar los requerimientos calóricos estimados, mantener el equilibrio de líquidos y electrólitos y mejorar el cierre espontáneo de la FEC siempre que sea posible. La nutrición parenteral (NP), en conjunto con el ayuno, se ha utilizado tradicionalmente para proporcionar la nutrición necesaria mientras se intenta reducir el gasto de la fístula, mantener el equilibrio de los líquidos y electrólitos, y promover el cierre espontáneo. Los análogos de la somatostatina también se han utilizado para tratar de reducir el gasto de la fístula y favorecer el cierre espontáneo. Dependiendo de la ubicación de la fístula y del volumen del gasto, el uso de una dieta oral o de la nutrición enteral (NE) se ha propuesto como medio para alimentar al paciente y preservar la integridad de la mucosa intestinal. Esto puede incluir la reinfusión del gasto desde un orificio fistuloso proximal a uno distal, exclusivamente o además de la infusión de una fórmula enteral través de un orificio fistuloso distal, lo que se conoce como fistuloclisis (2). El uso de la fistuloclisis se ha intentado en pacientes con fístula enteroatmosférica ya que el cierre espontáneo es poco probable (2). En lospacientes con fístulas que no cierran espontáneamente con el tratamiento médico estándar puede estar indicado el tratamiento quirúrgico. La cirugía, generalmente, no se recomienda hasta por lo menos 3 meses después de la lesión inicial, una vez que el paciente está mejor nutrido y se ha resuelto la respuesta inflamatoria aguda (3). Por lo tanto, los pacientes con FEC pueden requerir un manejo médico a largo plazo y, cuando sea posible, egresar del hospital con nutrición enteral y/o parenteral, monitoreo estrecho de líquidos y electrólitos, y cuidado de las heridas complejas mientras se esperan las condiciones óptimas para la intervención quirúrgica.
El manejo de los pacientes con FEC requiere un abordaje interdisciplinario y plantea un reto importante para los médicos, los nutricionistas, los especialistas en cuidados de heridas y estomas, los dietistas, los farmacéuticos y otros profesionales de la salud. Las guías para optimizar el estado nutricional en estos pacientes son a menudo vagas, basadas en estudios clínicos limitados, y por lo general dependen de la experiencia individual y, ocasionalmente, institucional. Dichas guías se enfocan hacia el manejo integral de la FEC, centrándose en el tratamiento médico y quirúrgico, mientras que la terapia nutricional se revisa solo superficialmente. Los requerimientos de nutrientes específicos, la vía de administración adecuada de la nutrición, el papel de la inmuno-nutrición y el uso de análogos de la somatostatina en el tratamiento de los pacientes con FEC no están bien definidos. El objetivo de esta guía clínica es desarrollar recomendaciones específicas para la terapia nutricional de los pacientes adultos con FEC.
METODOLOGÍA
Esta guía clínica se desarrolló bajo la dirección conjunta de los Consejos de Administración de la Sociedad Americana de Nutrición Parenteral y Enteral [American Society for Parenteral and Enteral Nutrition (ASPEN)] y la Federación Latino-Americana de Terapia Nutricional, Nutrición Clínica y Metabolismo (FELANPE). Ambas organizaciones asocian profesionales de la salud que representan las áreas de la medicina, la enfermería, la farmacia, la nutrición y la dietética. La misión de ambas sociedades es mejorar la atención al paciente a través del avance de la ciencia y la práctica de la especialidad de nutrición clínica y metabolismo; ambas trabajan eficazmente para respaldar la atención de calidad al paciente, la educación e investigación en los campos de la nutrición clínica y el soporte metabólico en todos los entornos sanitarios.
Estas guías clínicas se basan en el consenso general de profesionales de la salud que han equilibrado los beneficios potenciales de la terapia médica nutricional frente a los riesgos de la misma. Sin embargo, el juicio del profesional de la salud es el principal componente de toda atención médica de calidad. Debido a que las guías no pueden incluir cada variante de las circunstancias, el médico debe ejercer siempre el juicio profesional en su aplicación. Estas guías clínicas pretenden complementar, mas no reemplazar, la formación y el juicio profesional.
El proceso de creación de las guías de práctica clínica de la ASPEN ha adoptado los conceptos del grupo de trabajo GRADE (Grading Recommendations, Assessment, Development and Evaluation) (5-8). Ya se ha publicado una descripción completa de la metodología GRADE (9). Se desarrollaron 7 preguntas clínicas específicas sobre el manejo de la terapia nutricional en pacientes con FEC por parte de un grupo internacional de expertos que posteriormente identificaron los resultados clínicos relevantes.
Se realizó una búsqueda rigurosa de artículos entre enero de 1995 y junio de 2016 en la base de datos PubMed/MEDLINE, según la técnica descrita por McKeever et al. (10). Se utilizó como concepto médico de partida (MeSH: Medical Subject Heading) el término “Fistula” (Fístula) en la base de datos MEDLINE y se cruzaron las referencias con los conceptos médicos de partida (MeSH) “Nutritional support” (soporte nutricional), “Parenteral nutrition solutions” (soluciones de nutrición parenteral), “Enteral nutrition” (nutrición enteral), “Food” (comida), “Dietetics” (dietética), “Fat emulsions, intravenous” (emulsiones lipídicas, intravenosas) y “Parenteral nutrition, home” (nutrición parenteral, a domicilio). Estas citas se limitaron a las referencias cruzadas con el concepto médico de partida (MeSH) “Humans” (humanos). Posteriormente se realizó una búsqueda en la base de datos PubMed (no MEDLINE) utilizando los términos descritos en la figura 1. Para proteger la búsqueda contra términos no catalogados en MEDLINE, se realizó una búsqueda final en la misma base de datos (MEDLINE) basada solamente en citas con texto restringido que contuvieran dichos términos en su título o en el resumen. Posteriormente se realizaron estrategias de búsqueda análogas en otras 3 bases de datos no MEDLINE (EMBASE, CINAHL y Cochrane Central).

Figura 1. Términos de búsqueda utilizados en la base de datos PubMed (no MEDLINE). La inserción de una cita en el fragmento de búsqueda que se realizó en PubMed (no MEDLINE) requiere que contenga al menos una palabra de cada área en gris en por lo menos uno de sus campos de búsqueda. El símbolo * en la figura indica un término de búsqueda MeSH [Medical Subject Heading (concepto médico de partida)], que puede vincularse a cualquier palabra que contenga las letras antes del símbolo.
Los resúmenes obtenidos fueron revisados y analizados con base en el criterio de inclusión: “pacientes adultos con FEC”, publicados en inglés, español y portugués (lo que aumentó considerablemente el número de citas disponibles, gracias a la participación de expertos latinoamericanos que revisaron los artículos en español y portugués - Nota del autor). Se incluyeron los ensayos aleatorios controlados (“randomized controlled trials - RCT’s) y los estudios observacionales que incluyeran un grupo de control. Los resúmenes de los estudios que describieran fístulas relacionadas con la cirugía bariátrica, fístulas gástricas, esofágicas o pancreáticas, así como el abdomen hostil se excluyeron, ya que el cuidado de estas condiciones es sustancialmente diferente al de las fístulas de intestino o colon. Asimismo, se excluyeron los resúmenes referentes a la terapia nutricional en niños, ya que estas guías se orientan a pacientes adultos. Cada manuscrito publicado asociado con algún término incluido fue revisado independientemente por 2 autores, quienes realizaron una evaluación consensuada respecto a la calidad de la evidencia de cada estudio. Cuando los estudios reportaban resultados de manera similar, sus datos se incluyeron en el programa Review Manager 5.3 (The Cochrane Collaboration, Copenhague, Dinamarca) para crear gráficos del tipo de los diagramas de efectos (forest plots), agregando el tamaño del efecto para cada intervención y la evolución del paciente (11). Los diagramas de efecto (forest plots) que respaldan las recomendaciones se incluyen en el texto. La calidad de todo el conjunto de evidencias sobre una determinada intervención y su resultado se evaluó y clasificó dentro de un rango de muy baja a alta (12). Cuando la calidad de la evidencia es muy baja, cualquier estimación del efecto es muy incierto. Cuando la calidad de la evidencia es moderada, es probable que investigaciones posteriores afecten a la estimación del efecto y puedan cambiar la magnitud del mismo. Cuando la calidad de la evidencia es alta, es probable que investigaciones posteriores puedan modificar la magnitud del efecto. Las tablas con el resumen de evidencias se encuentran en el apéndice en línea (del artículo original en inglés – Nota del autor). Un equipo de autores redactó cada recomendación y su razonamiento. Estas afirmaciones se discutieron en conferencias telefónicas y se estableció un consenso mediante un modelo Delphi modificado y anónimo donde se precisaba al menos un 60 % de congruencia para establecer el consenso. Las opiniones disidentes respecto al consenso se discuten en el razonamiento de la recomendación. Se atribuyó un grado de recomendación de forma independiente al cuerpo de la evidencia (5). Se hace una recomendación “fuerte” (strong) cuando la calidad de la evidencia es alta y/o cuando el beneficio supera al daño. Se formulan recomendaciones “débiles” (weak) cuando la evidencia es de baja calidad o si existen ventajas y desventajas importantes para el paciente. En caso de no existir estudios disponibles que respondieran directamente a alguna de las preguntas planteadas por los autores de la guía, el proceso de consenso prosiguió con la anotación de que la recomendación se hizo sobre la base de un consenso de expertos, ya que no hay evidencia utilizable.
Esta guía clínica fue revisada por expertos clínicos tanto internos como externos de ambas organizaciones, en su versión original en inglés y en la presente traducción al español. Los equipos de autores y revisores de esta guía incluyeron miembros de cada uno de los grupos profesionales que utilizarán la guía (medicina, nutrición, dietética, enfermería, farmacia e investigación), así como la Junta Directiva de ASPEN y revisores de FELANPE. Todos los autores participaron en el proceso de elaboración de la guía de forma voluntaria. Las organizaciones que desarrollaron la guía clínica (ASPEN y FELANPE) no recibieron apoyo comercial para el proyecto. La revisión de esta guía clínica no está prevista hasta que se aporten nuevos datos de futuras investigaciones.
RESULTADOS
En total se revisaron 872 citas y resúmenes para ser incluidos (638 de PubMed/MEDLINE, 34 de EMBASE, 15 de CINAHL y 185 de Cochrane Central). De estas citas, 6 ensayos aleatorios controlados y 20 estudios observacionales controlados cumplieron con los criterios de inclusión. Otros artículos de revisión se utilizaron como respaldo para redactar los razonamientos o los antecedentes. Se encontraron ensayos aleatorios controlados para redactar solo una recomendación (pregunta 6). Cuatro recomendaciones se basaron en estudios observacionales controlados, y las 2 restantes en el consenso de expertos. Los autores no tuvieron opiniones disidentes en ninguna pregunta.
PREGUNTA 1: EN PACIENTES ADULTOS CON FEC, ¿QUÉ FACTORES DESCRIBEN MEJOR EL ESTADO NUTRICIONAL?
Recomendación: sugerimos lo siguiente:
– La desnutrición debe diagnosticarse con base en la historia nutricional, incluyendo la pérdida no intencionada de peso y la estimación de la ingesta calórica o de nutrientes, así como la exploración física.
– La evaluación nutricional deberá realizarse en el momento en que se hace el diagnóstico de FEC. En caso de que el paciente no se encuentre desnutrido en dicho momento, deberán realizarse evaluaciones nutricionales periódicas, ya que los pacientes con fístulas tienen una alta probabilidad de desnutrirse debido a la malabsorción de nutrientes, la pérdida de líquidos y electrólitos, y la sepsis.
– Pueden obtenerse las concentraciones de proteínas séricas antes y durante la terapia nutricional, ya que son indicadores pronósticos de la evolución; sin embargo, no son marcadores nutricionales sensibles.
Calidad de la evidencia: muy baja.
Razonamiento: la evaluación del estado nutricional en el momento del diagnóstico de FEC se puede realizar usando diversas herramientas, aunque ninguna ha sido validada específicamente para su uso en las FEC. La Valoración Global Subjetiva (VGS) clasifica a los pacientes en Nivel A (bien nutrido), Nivel B (desnutrición moderada o sospecha de desnutrición) o Nivel C (desnutrición severa) con base en la ingesta de alimentos, la pérdida de peso, la evaluación funcional y el examen físico (13). Los criterios de consenso publicados por la Academia de Nutrición y Dietética y ASPEN sugieren la identificación de 2 o más de las siguientes 6 características para detectar y diagnosticar la desnutrición: insuficiente consumo de energía, pérdida de peso, pérdida de masa muscular, pérdida de grasa subcutánea, acumulación de líquido localizada o generalizada que puede ocultar la pérdida de peso, y estado funcional disminuido, medido a través de fuerza de prensión de la mano (14). Aunque todas estas herramientas incluyen la evaluación de la pérdida de peso, es posible que fallen en el diagnóstico de desnutrición del paciente con sobrepeso u obesidad y en el de aquellos en situación de riesgo. Los pacientes obesos críticamente enfermos que están desnutridos pueden tener un riesgo mayor de muerte en comparación con los pacientes obesos sin desnutrición (15). Un historial completo del consumo de energía/nutrientes y la pérdida de peso son parámetros importantes de evaluación nutricional que deben obtenerse en todos los pacientes, incluyendo aquellos con un índice de masa corporal (IMC) alto.
Todos los estudios incluidos fueron de diseño observacional y utilizaron el IMC, la pérdida de peso y/o los niveles de proteína sérica para definir la desnutrición (Tabla suplementaria S1). Hubo variabilidad significativa entre los estudios respecto a la inclusión de los parámetros nutricionales. Solo un estudio (16) evaluó la desnutrición mediante la VGS. Ningún otro estudio utilizó una herramienta de evaluación nutricional validada.
Cuatro estudios examinaron la pérdida involuntaria de peso (17-20). Se desconoce si la pérdida de peso predispone al desarrollo de FEC o si es una consecuencia del curso clínico y el tratamiento de la enfermedad. No sería extraño que la pérdida de peso predispusiera a presentar una FEC dado el diagnóstico subyacente en los pacientes que las desarrollan (cáncer de tubo digestivo, traumatismos, obstrucción intestinal, enfermedad inflamatoria intestinal, enteritis por radiación). Sin embargo, en al menos un estudio retrospectivo de 53 pacientes en un período de 10 años, se observó pérdida de peso en el momento de presentar los síntomas en el 21,2 % de quienes presentaron cierre espontáneo y el 20 % de quienes no lo presentaron (19). En la práctica clínica es razonable documentar la pérdida y el cambio de peso en el momento de la presentación de síntomas y durante el tratamiento de la FEC.
Mientras que el monitoreo de las proteínas séricas era común en los años 80 y 90, ahora se acepta que dichas medidas carecen de sensibilidad y especificidad en la elaboración del diagnóstico de la desnutrición. La disminución de las concentraciones plasmáticas de albúmina, transferrina, proteína transportadora de retinol y prealbúmina pueden ser una consecuencia de la inflamación y la infección relacionadas con la FEC. Aun sin ser un parámetro nutricional adecuado, la disminución de la concentración de proteínas séricas puede tener significación pronóstica. En un estudio retrospectivo durante un período de 10 años (19), el aumento de la concentración de albúmina sérica posterior al uso de NP se asoció a un gasto por la fístula significativamente menor y a mejoría de la tasa de cierre espontáneo. La probabilidad de cierre espontáneo de la fístula fue 18,1 veces mayor cuando la albúmina sérica mejoró que cuando no lo hizo (16). En un estudio prospectivo de manejo de las FEC con terapia nutricional enteral y parenteral, la concentración de albúmina sérica disminuyó durante el tratamiento de las FEC pero volvió a niveles preoperatorios después del cierre de la fístula (18). En contraste, en una gran cohorte de 277 pacientes, la albúmina sérica no fue un factor predictivo independiente de los resultados clínicos (21), hallazgo confirmado en una observación retrospectiva de 79 pacientes con FEC (22). Sin embargo, la mayor concentración de transferrina sérica predijo el cierre espontáneo y las bajas concentraciones de transferrina, proteína transportadora de retinol y prealbúmina fueron predictores de mortalidad (22). Los pacientes que recibieron NP con aumento en las concentraciones de albúmina sérica y gasto de la FEC < 500 ml/d presentaron cierre espontáneo en el 93,3 % de los casos en comparación con el 70 % de fallas del cierre entre los pacientes con concentraciones bajas de albúmina sérica y gasto por la fístula ≥ 500 ml/d (22).
PREGUNTA 2: EN PACIENTES ADULTOS CON FEC, ¿CUÁL ES LA RUTA RECOMENDADA PARA LA TERAPIA NUTRICIONAL (DIETA VÍA ORAL, NE O NP)?
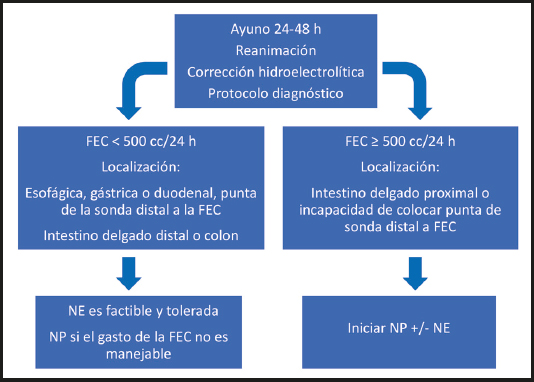
Recomendación: sugerimos que, después de haber logrado la estabilización del balance de líquidos y electrólitos, la dieta oral o la NE pueden ser factibles y toleradas en los pacientes con fístulas enterocutáneas de bajo gasto (< 500 ml/d, lo que sugiere que no existe obstrucción distal). Sin embargo, los pacientes con FEC de alto gasto (> 500 ml/d) pueden requerir NP para cubrir los requerimientos de líquidos, electrólitos y nutrimentos que permitan el cierre espontáneo o quirúrgico de la FEC.
Calidad de la evidencia: muy baja.
Razonamiento: la capacidad de administrar una NE temprana en el periodo postoperatorio puede reducir la posibilidad de desarrollar FEC en los pacientes con abdomen abierto (23). Sin embargo, el número de estudios que evalúan el resultado asociado al uso de NP o NE una vez que se ha formado una FEC es limitado (Tabla suplementaria S2). Dos pequeños estudios retrospectivos y observacionales (uno usando controles históricos) reportan resultados conflictivos en términos de tasa de cierre espontáneo de las fístulas, además de tener poca potencia estadística para la mortalidad (17,24). Un tercer estudio reporta un cierre quirúrgico de la fístula más temprano y menos complicaciones en pacientes que recibieron NE dentro de los primeros 14 días a partir de su admisión al hospital, en comparación con quienes recibieron NE después de 14 o más días (25). No se encontró ningún ensayo aleatorio controlado que comparara la NE con la NP tras la formación de una FEC.
Cuando se produce una fístula, el objetivo inmediato es lograr el equilibrio hidroelectrolítico, así como establecer la ubicación de la fístula, cuantificar el gasto y descartar una obstrucción distal. La evaluación detallada de las características de la fístula (localización exacta, longitud) puede no ser factible en ese momento ya que el trayecto fistuloso aún no ha madurado. En ausencia de obstrucción distal, los pacientes con FEC de bajo gasto (< 500 ml/d) pueden tolerar la dieta oral. Si la ingesta oral se asocia con un aumento significativo del gasto de la FEC o no se tolera por otras razones, la NE es factible y se tolera bien cuando el acceso enteral puede hacerse distal a la fístula (Fig. 2). La tolerancia a la NE y la capacidad de cubrir los requerimientos deben evaluarse regularmente. Si la meta nutricional no puede alcanzarse únicamente con la NE, la terapia nutricional mixta (NE y NP) puede estar indicada. Algunos pacientes requerirán NP si el gasto de la FEC es alto (> 500 ml/d), existe obstrucción intestinal, o el gasto de la FEC compromete significativamente el cuidado de las heridas y de la piel, o dificulta la capacidad de mantener el equilibrio de líquidos y electrólitos cuando se utiliza la NE.
PREGUNTA 3: EN PACIENTES ADULTOS CON FEC, ¿QUÉ APORTES DE PROTEÍNA Y ENERGÍA PROPORCIONAN MEJORES RESULTADOS CLÍNICOS?
Recomendación: basándonos en el consenso de expertos, sugerimos la provisión de 1,5-2,0 g/kg/d de proteína; el aporte energético deberá ser el apropiado a los requerimientos con base en el resultado de la evaluación nutricional. Puede ser necesario un mayor aporte de proteína (hasta 2,5 g/kg/d) en los pacientes con fístula enteroatmosférica y/o fístula de alto gasto.
Calidad de la evidencia: se basa únicamente en el consenso debido a que no hay evidencia reciente disponible.
Razonamiento: no se encontró ninguna evidencia definitiva que evalúe el resultado clínico con relación al aporte específico de energía o proteína. La falta de estudios en los que se mida el gasto energético o el balance nitrogenado en pacientes con FEC es sorprendente. La mayoría de los artículos de revisión se refieren a un estudio observacional retrospectivo de 1964 en el que se trataron 56 casos de pacientes con FEC entre 1953 y 1963 (26). Los pacientes que fueron capaces de consumir entre 1600 y 2000 kcal/d presentaron menor mortalidad (12 % vs. 55 %) y mayor tasa de cierre espontáneo de la fístula (89 % vs. 37 %) que los que consumieron < 1000 kcal/día. Sin embargo, el estudio se realizó antes de que el uso de la NE o la NP se hubiera generalizado y refleja solo qué pacientes eran capaces de consumir tal cantidad de calorías por dieta oral. Probablemente, esta situación generó un sesgo hacia peores resultados en los pacientes gravemente enfermos, que eran menos propensos a tolerar la dieta oral.
Estudios observacionales realizados entre 1990 y 2016 reportan metas de energía de entre 25 y 30 kcal/kg/d, y metas de proteína de 1,5 g/kg/d, pero no informan de la ingesta real ni de su relación con resultados clínicos importantes (Tabla suplementaria S3) (16,17,25,27,28). Tres artículos de revisión recientes recomiendan una dosis de proteína de 1,5 g/kg/d y el aporte energético suficiente para satisfacer el gasto energético basal (GEB) en los pacientes con FEC de bajo gasto, así como aumentar la dosis de proteína a 1,5-2,5 g/kg/d y el aporte de calorías hasta 1,5-2 veces el GEB en los pacientes con FEC de alto gasto (29-31). Ninguno de los artículos de revisión disponibles refieren la dosificación de energía y proteína administrada a pacientes obesos con FEC, aunque esto representa un porcentaje significativo de la población.
Nuestra recomendación se basa en los paradigmas de la práctica general del apoyo nutricional, que incorporan la evaluación del nivel de desnutrición con niveles adecuados de aporte de energía y proteína. El manejo cuidadoso de los líquidos, los electrólitos y las vitaminas es también un aspecto importante de la atención de estos pacientes. En el paciente obeso con FEC, concordamos con las recomendaciones de las guías de nutrición para adultos en cuidados críticos de la ASPEN y la Sociedad de Medicina de Cuidados Críticos (SCCM) para determinar los requerimientos calóricos y protéicos (32). En cuanto al aporte energético, se recomienda la provisión de 11 a 14 kcal/kg/d de peso real si el IMC es de 30 a 50 kg/m2 y de 22 a 25 kcal/kg/día de peso ideal si el IMC > 50 kg/m2. Para el aporte de proteínas se recomienda la provisión de 2 g/kg/día de peso ideal para pacientes con IMC de 30 a 40 kg/m2 y 2,5 g/kg/d de peso ideal si el IMC > 40 kg/m2 (32).
PREGUNTA 4: EN LOS PACIENTES ADULTOS CON FEC, ¿EL USO DE LA FISTULOCLISIS SE ASOCIA A MEJORES RESULTADOS QUE EL CUIDADO ESTÁNDAR?
Recomendación: sugerimos:
– Utilizar lafistuloclisis para la terapia nutricional en los pacientes con capacidad de absorción intestinal distal al sitio de infusión intacta y cuando no se espere que dicho sitio de la FEC utilizado para la infusión vaya a cerrarse espontáneamente.
– Utilizar fórmulas poliméricas inicialmente y cambiar a una semi-elemental (oligomérica) si se presenta intolerancia.
Calidad de la evidencia: muy baja.
Razonamiento: se define la fistuloclisis como la infusión de una fórmula de NE a través del estoma distal de una FEC con o sin la reinfusión del gasto obtenido del orificio fistuloso proximal. Esta técnica solo debe iniciarse después de haber confirmado la integridad y permeabilidad del intestino delgado más allá del orificio fistuloso más distal y en las FEC en las que no se espera un cierre espontáneo. Se puede colocar un acceso enteral en el orificio fistuloso distal con una sonda o catéter, y la fórmula de NE y/o el quimo se infunden a través del orificio. La idea central es usar el intestino tanto para alimentar al paciente como para estimular y nutrir directamente la mucosa intestinal, así como reducir al mínimo el uso de la NP. La tolerancia se evalúa identificando si el aumento del gasto de la FEC es manejable en términos de captura de efluentes, mantenimiento del estado de hidratación y capacidad de administrar una nutrición adecuada y suficiente. Debido a que las fórmulas semi-elementales (oligoméricas) están parcialmente digeridas, con su uso puede lograrse un mayor aporte de nutrientes.
Dos pequeños estudios observacionales, retrospectivos reunieron nuestros criterios de inclusión, pero no divulgan resultados que permitan el cálculo de un efecto (Tabla suplementaria S4). El primer estudio reporta el uso de la fistuloclisis con una fórmula enteral (sin reinfundir el gasto de la fístula) en 12 pacientes con fístulas yeyuno-cutáneas o ileo-cutáneas postoperatorias y un gasto promedio de la fístula proximal de 1360 (rango, 690-3190 ml/d (33). Utilizaron una sonda de gastrostomía con balón que se insertó distalmente y se avanzó 5-10 cm bajo control radiológico. Además de la atención médica estándar, que incluyó la administración de NP, se inició la administración de una fórmula polimérica estándar a razón de 30 ml/h, aumentándola en 20 ml por hora cada día hasta que se alcanzó la meta. Se cambió la fórmula a semi-elemental si se presentaba intolerancia. La NP se suspendió cuando la NE alcanzó una velocidad de infusión de 90 ml/h. Al compararlo con la NP exclusiva, el uso de la fistuloclisis se asoció con un menor costo. La fistuloclisis sustituyó con éxito a la NP en 11 de los 12 pacientes, con solo 1 caso fallido. En 6 pacientes, la fistuloclisis se asoció con un aumento del gasto de la fístula proximal de entre 40 y 330 ml/d, y en 4 pacientes el gasto disminuyó entre 290-1540 ml/d. Nueve de los 11 pacientes se sometieron con éxito a cirugía reconstructiva en una mediana de 155 (rango, 19-422) días después de haber iniciado la fistuloclisis.
El segundo estudio incluyó 95 pacientes con FEC de alto gasto, con intestino restante mayor de 100 cm y función intestinal recuperada (34). El uso de la fistuloclisis en 35 pacientes, incluyendo una fórmula enteral y la reinfusión del gasto de la fístula proximal, se comparó con una fórmula enteral sin reinfusión del gasto de la fístula en los 60 pacientes restantes (34). Definieron la fistuloclisis como la reinfusión del gasto recolectado de la fístula proximal a la fístula distal a través de una sonda de alimentación, mientras que la fórmula enteral fue infundida simultáneamente a través de la misma sonda u otra sonda nasoyeyunal. Todos los pacientes recibieron NP durante el estudio. Como en el estudio anterior, una sonda de gastrostomía con balón se insertó en el orificio fistuloso distal. En el grupo de la fistuloclisis, el gasto del estoma proximal se recolectó en una bolsa estéril y se reinfundió en el extremo distal de la fístula. Se utilizó una fórmula polimérica que se cambió a una fórmula semi-elemental en caso de intolerancia. Parámetros bioquímicos tales como las pruebas de función hepática y los niveles de proteína C-reactiva mejoraron significativamente en los pacientes con fistuloclisis. Además, los costos, la estancia y la mortalidad hospitalarios fueron significativamente más bajos y la sobrevida a 1 año fue significativamente mayor en el grupo de la fistuloclisis.
PREGUNTA 5: EN PACIENTES ADULTOS CON FEC, ¿LAS FÓRMULAS INMUNOMODULADORAS SE ASOCIAN A MEJORES RESULTADOS QUE LAS FÓRMULAS ESTÁNDAR?
Recomendación: no podemos recomendar fórmulas inmunomoduladoras multicomponente para mejorar los resultados del tratamiento de las FEC debido a la falta de evidencia. Sugerimos que la administración de glutamina por vía oral, agregada a la NP, puede mejorar la mortalidad y la tasa de cierre de las fístulas.
Calidad de la evidencia: muy baja.
Razonamiento: los nutrimentos inmunomoduladores se han utilizado y recomendado para varias afecciones cuyas complicaciones, entre ellas la fuga de la anastomosis, comprenden el desarrollo de una FEC, incluyendo el traumatismo abdominal y la cirugía abdominal electiva. Sin embargo, en el contexto del tratamiento de la FEC, solo 1 estudio informó del uso de glutamina oral agregada al manejo con NP. Ningún nutriente inmunomodulador, como la arginina, los ácidos grasos ω-3 o los nucleótidos, se ha evaluado en el manejo de las FEC. La glutamina es un aminoácido condicionalmente esencial y que sirve de sustrato para enterocitos y linfocitos. La suplementación con glutamina puede mejorar la producción de IgA secretora en la mucosa intestinal. Hipotéticamente, la glutamina puede contribuir al cierre de la fístula por mejorar el trofismo de la mucosa intestinal y la respuesta inmunológica. Sin embargo, la eliminación de glutamina es limitada en los pacientes con sepsis o insuficiencia renal o hepática, con riesgo potencial de toxicidad.
Un estudio retrospectivo y observacional incluyó 28 pacientes adultos con fístula enterocutánea de intestino delgado de alto gasto, sin evidencia de sepsis, ni de insuficiencia renal o hepática; de ellos, 9 pacientes recibieron glutamina oral (0,3 g/kg/d) además de NP, y los otros 19 pacientes (2 años antes) recibieron solo NP (Tabla suplementaria S5) (16). El grupo con NP más glutamina oral presentó menor mortalidad y menor tiempo de estancia hospitalaria en comparación con el grupo al que solo se administró NP. El análisis univariado identificó la desnutrición (por VGS), la albúmina sérica baja y el uso de glutamina oral como factores pronósticos asociados a la mortalidad y el cierre de la fístula. El análisis de regresión logística multivariado demostró una mayor tasa de cierres de fístula en los pacientes que recibieron glutamina oral, con una razón de momios (OR) de 13,2 (intervalo de confianza [IC] del 95 %, 1,1-160,5; p = 0,04), y en los pacientes no desnutridos (OR, 15,4; IC 95 %: 1,1-215,5; p = 0,04).
PREGUNTA 6: EN LOS PACIENTES ADULTOS CON FEC, ¿EL USO DE SOMATOSTATINA O SUS ANÁLOGOS PROPORCIONA MEJORES RESULTADOS QUE EL TRATAMIENTO MÉDICO ESTÁNDAR?
Recomendación: recomendamos el uso de análogos de la somatostatina en los pacientes adultos con FEC de alto gasto (> 500 ml/d) como método para reducir el gasto de efluentes y mejorar la tasa de cierre espontáneo.
Calidad de la evidencia: moderada.
Razonamiento: la somatostatina y sus análogos se han utilizado para tratar fístulas gastrointestinales (GI) y pancreáticas debido a su capacidad de inhibir la liberación y los efectos secretores de una gran variedad de hormonas GI, así como de aumentar la absorción de agua y electrólitos, prolongando el tiempo de tránsito intestinal (35). El efecto general que se pretende es reducir el volumen de las secreciones GI como método para reducir el gasto de la fístula y promover de tal modo su cierre espontáneo. Seis ensayos aleatorios controlados (EAC) y 5 estudios observacionales cumplieron con nuestros criterios de inclusión para evaluar el uso de la somatostatina o sus análogos (octreótida, lanreótida) en pacientes adultos con FEC. El grupo de tratamiento recibió por lo general una infusión continua de 250 mcg/h de somatostatina o 100 mcg de octreótida por vía subcutánea 3 veces al día durante 10-20 días, o lanreótida 30 mg intramuscular cada 10 días. No se encontraron estudios que utilizaran la octreótida de depósito (acción prolongada) o la octreótida añadida a la mezcla de NP. Se proporcionó el tratamiento médico estándar de la FEC a todos los pacientes (grupos experimental y de control), que a menudo incorporan la NP, pero la vía y los detalles del aporte nutricional no se describieron sistemáticamente.
Hemos confiado en los datos reportados por los EAC sobre el uso de la somatostatina o sus análogos para el tratamiento de FEC (Tabla suplementaria S6) (27,36-40). De estos ensayos comparables, que fueron descritos originalmente como aleatorios, solo 3 de 6 fueron cegados con respecto al tratamiento y solo 2 de ellos utilizaron un análisis por intención de tratar. La calidad de la evidencia se redujo de alta a moderada con base en el riesgo de sesgo. Realizamos un metaanálisis de 3 EAC que cumplieron con nuestros criterios de inclusión, el cual mostró una reducción significativa del gasto de la fístula con el uso de la somatostatina o sus análogos, al compararlos con los controles (diferencia ponderada promedio [Weighted Mean Difference - WMD], 21,13 %; IC 95 %, 6,51-35,75; p = 0,005) (Fig. 3). Realizamos también un metaanálisis de 6 EAC que cumplieron con nuestros criterios de inclusión, el cual mostró una mayor probabilidad de cierre espontáneo (no quirúrgico) de la fístula al agregar somatostatina o sus análogos frente a la atención médica estándar (razón de momios [OR], 2,82, IC 95 %, 1,77-4,51; p < 0,0001) (Fig. 4). Un último metaanálisis de 4 EAC que cumplieron con nuestros criterios de inclusión mostró una reducción del tiempo para lograr el cierre de la fístula a favor de los análogos de la somatostatina, con una diferencia ponderada promedio = −6,45 días (IC 95 %, −9,67 a −3,23) (Fig. 5). El tiempo de estancia hospitalaria, los costos y las tasas de complicaciones no se informaron sistemáticamente en estos ensayos, por lo que no pudieron incluirse en nuestros metaanálisis.
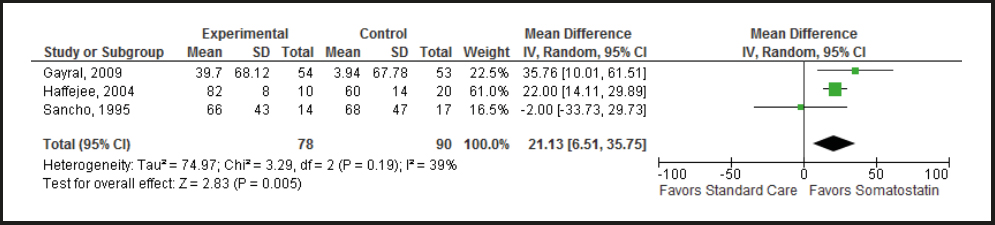
Figura 3. Reducción del gasto de las fístulas enterocutáneas en ensayos aleatorios controlados que comparan la somatostatina o análogos de la somatostatina con el cuidado estándar (IV: varianza inversa).
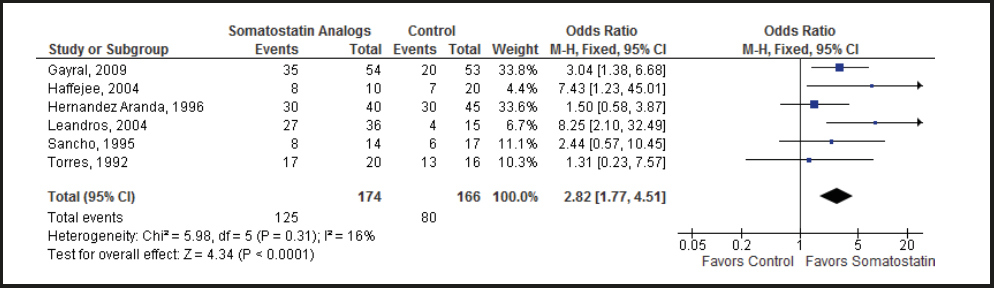
Figura 4. Tasa de cierre espontáneo de las fístulas enterocutáneas en los ensayos aleatorios controlados que comparan la somatostatina o análogos de la somatostatina con el cuidado estándar (M-H: método de Mantel-Haenszel).
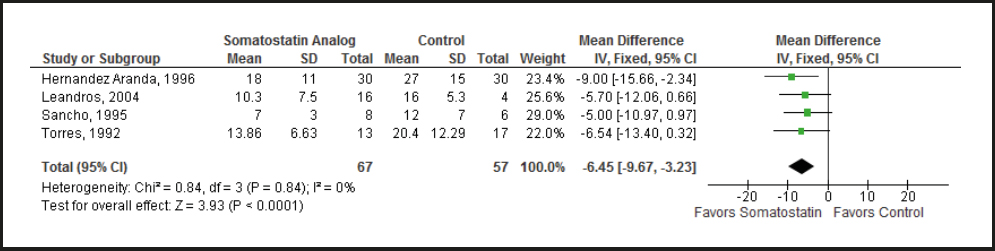
Figura 5. Tiempo para el cierre espontáneo de las fistulas enterocutáneas en los ensayos aleatorios controlados que comparan la somatostatina o análogos de la somatostatina además de la nutrición parenteral frente a la nutrición parenteral sola (IV: varianza inversa).
Aunque el uso de análogos de somatostatina se ha tolerado generalmente bien, su efecto fisiológico sobre las hormonas gastrointestinales puede incluir un aumento del riesgo de estasis biliar, colelitiasis, disfunción hepática, hipoglucemia e hiperglucemia. También se han reportado trastornos gastrointestinales como diarrea, náuseas y malestar abdominal (35). Se recomienda vigilar las cifras de glucosa, y sus variaciones deben tratarse. La vía subcutánea de administración se ha asociado a dolor en el sitio de inyección; así mismo, la frecuencia de la dosis, cada 8 horas, puede resultar difícil para los pacientes con manejo domiciliario. Por último, el costo económico significativo y los desafíos para su reembolso constituyen una barrera más para el uso de los análogos de la somatostatina. Se sugiere un enfoque selectivo para determinar el uso apropiado de los análogos de la somatostatina en los pacientes con FEC. Los pacientes con FEC de gasto alto (> 500 ml/d) tienen más probabilidades de beneficiarse de sus efectos, debido al impacto de una reducción del 20 % del gasto de la fístula en comparación con los pacientes con fístulas de bajo gasto. Puede realizarse una prueba con el fin de evaluar la eficacia de los análogos de la somatostatina para el cierre de la fístula; la duración adecuada de esta prueba parece ser de entre 10 y 20 días según los EAC disponibles, aunque algunos reportan menos días para lograr una reducción del volumen de gasto de la fístula. El uso de la somatostatina ha demostrado mejorar la tasa de cierre espontáneo (no quirúrgico) de la fístula y también se anticipa que la reducción del volumen de gasto por la fístula podría mejorar la capacidad de lograr el equilibrio hidroelectrolítico, facilitar el manejo de las bolsas de ostomía y, en general, hacer más fácil el manejo domiciliario de los pacientes con FEC.
PREGUNTA 7: EN LOS PACIENTES ADULTOS CON FEC, ¿CUÁNDO ESTÁ INDICADA LA TERAPIA DE NUTRICIÓN PARENTERAL DOMICILIARIA (NPD)?
Recomendación: basándonos en el consenso de expertos sugerimos considerar la nutrición parenteral domiciliaria (NPD) cuando el paciente esté médicamente estable y el gasto de la fístula sea manejable, así como en los pacientes con fístulas de alto gasto (> 500 ml/d) cuya reparación quirúrgica aún no se recomiende.
Calidad de la evidencia: basada únicamente en el consenso, debido a que no hay evidencia reciente disponible.
Razonamiento: los pacientes con FEC de alto gasto comienzan a menudo con NP durante la hospitalización, como parte de una estrategia para estabilizar el equilibrio hídrico y nutricional, permitiendo la maduración del trayecto fistuloso. Una vez estables, los pacientes con gasto por la fístula manejable y una adecuada protección de la piel, pueden ser considerados para su egreso a un ambiente domiciliario ya que necesitarán de un período de tiempo prolongado para mejorar sus condiciones antes de un procedimiento quirúrgico definitivo. Los pacientes con fístulas de bajo gasto (< 500 mL/d) pueden tolerar dieta por vía oral o Nutrición Enteral sin exacerbar el gasto de la fístula, como se señaló en la pregunta 2. A finales de la década de 1970 comenzaron a aparecer reportes de caso sobre el uso de NPD en pacientes con FEC. (41) (Tabla Suplementaria S7). Una serie de casos más reciente describe una estancia hospitalaria promedio de 20 días antes del alta del hospital, seguida de un período de 75 días (promedio) con NPD en 15 pacientes, 5 de los cuales tenían FEC.(42) En dicha serie, los pacientes expresaron su preferencia por la NPD sobre la NP en el hospital, con menos estrés familiar y mayor oportunidad de disfrutar de un entorno familiar. En una serie de casos más grande en el Reino Unido, se administró NPD a 143 pacientes con FEC durante un promedio de 5 semanas (rango, 1-94 semanas).(43) La base de datos del Registro Nacional de Pacientes con Cuidados Nutricionales Sustain,(44) menciona que la indicación para NPD fue FEC en el 19 % de los pacientes adultos incluidos. Esta tasa es similar (10 %-36 %) a las tasas reportadas por otros registros internacionales de NPD (45-48). Aunque estos estudios no mencionan resultados clínicos en una manera similar o comparan la NPD con otras formas de terapia nutricional (que permitieran hacer un análisis de resultados), si hacen evidente que la NPD es factible, siempre que existan servicios que provean NPD.
ÁREAS DE INVESTIGACIÓN FUTURA
La evidencia respecto al manejo nutricional óptimo en pacientes adultos con FEC es limitada. Solo 1 de 7 recomendaciones creadas para esta guía clínica se basa en ensayos aleatorios controlados. La naturaleza polifacética de la condición y la heterogeneidad de la población generan desafíos para diseñar estudios. Es difícil lograr estudios con adecuado poder estadístico y requieren de colaboración multicéntrica. Gran parte de nuestra práctica actual se basa en estudios clínicos realizados hace más de 20 años, previos a la epidemia de obesidad y de las indicaciones más conservadoras respecto a requerimientos energéticos, al control agresivo de la glucosa y a los protocolos para minimizar infecciones de accesos venosos centrales y complicaciones. Es claro que la investigación adicional dirigida a optimizar el manejo nutricional de pacientes con FEC está garantizada.
Es necesario realizar investigación específica que permita establecer los requerimientos de proteína y energía en pacientes con FEC, incluyendo la forma de facilitar la pérdida de peso controlada en pacientes obesos. Las siguientes, son preguntas adicionales que también deben ser contestadas:
– ¿Cómo influye la anatomía y la ubicación de la FEC en los requerimientos nutricionales y en la ruta óptima para administrar la terapia nutricional?
– ¿Qué estrategias son efectivas para optimizar el uso de nutrición enteral, así como el uso de fistuloclisis?
– ¿Qué aporte de energía y proteína es el más efectivo en términos de tratamiento de la FEC? ¿Dichos requerimientos varían en pacientes desnutridos o en obesos?
– ¿Qué pacientes se benefician del reposo intestinal como método para controlar el gasto por la fístula y permitir su cierre?
– ¿Es compatible y efectiva la somatostatina cuando se administra como componente de la mezcla de NP?
– ¿Es efectiva la administración de nutrimentos inmuno-moduladores en el manejo de fístulas entero-cutáneas?